ESPRESSIONE E PURIFICAZIONE DI UNA PROTEINA DI FUSIONE











- Slides: 27

ESPRESSIONE E PURIFICAZIONE DI UNA PROTEINA DI FUSIONE

PRODUZIONE DI PROTEINE PER MEZZO DELL’ INGEGNERIA GENETICA Applicazioni delle proteine ricombinanti -PROTEINE DI INTERESSE TERAPEUTICO (anticorpi, insulina, ormone crescita). -PROTEINE DI INTERESSE COMMERCIALE (enzimi). -PROTEINE DA UTILIZZARE COME ANTIGENI PER LA PRODUZIONE DI ANTICORPI POLICLONALI E MONOCLONALI. -REAGENTI PER LA RICERCA DI BASE E APPLICATA.

Sistemi di espressione Procariotici (E. Coli) Eucariotici: Saccharomyces Cerevisiae (lievito) Cellule di insetto (Baculovirus) Cellule di mammifero in coltura (CHO etc. ) Animali transgenici Piante transgeniche

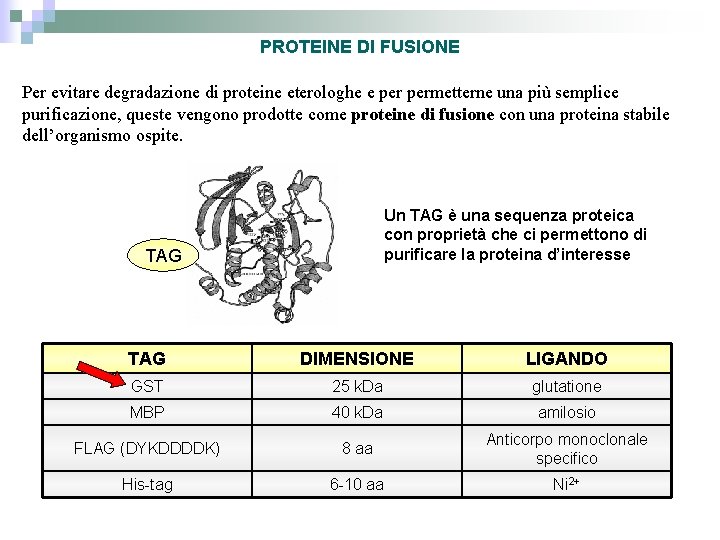
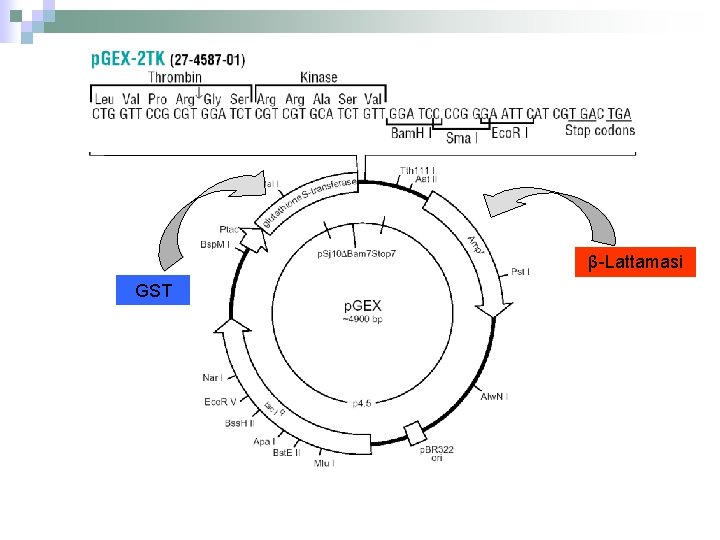
PROTEINE DI FUSIONE Per evitare degradazione di proteine eterologhe e permetterne una più semplice purificazione, queste vengono prodotte come proteine di fusione con una proteina stabile dell’organismo ospite. Un TAG è una sequenza proteica con proprietà che ci permettono di purificare la proteina d’interesse TAG DIMENSIONE LIGANDO GST 25 k. Da glutatione MBP 40 k. Da amilosio FLAG (DYKDDDDK) 8 aa Anticorpo monoclonale specifico His-tag 6 -10 aa Ni 2+

β-Lattamasi GST

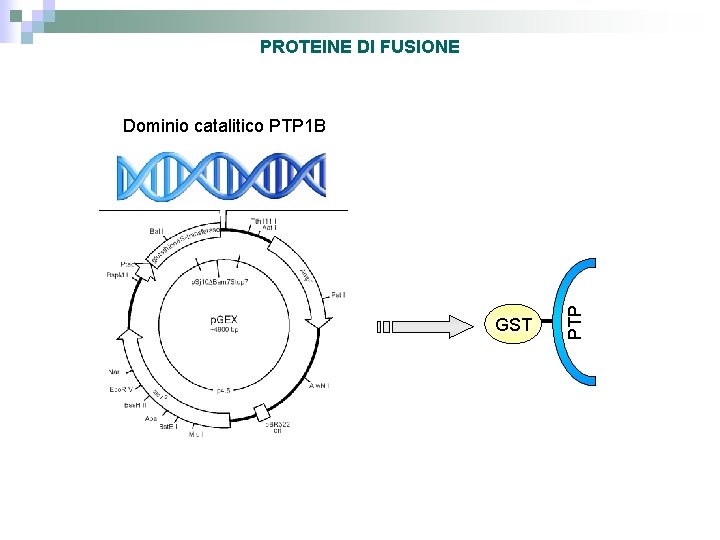
PROTEINE DI FUSIONE GST PTP Dominio catalitico PTP 1 B

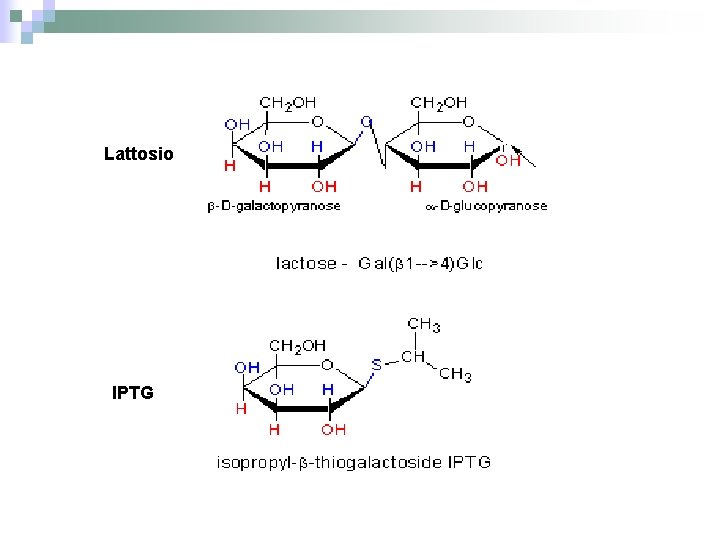
NELLA PRODUZIONE DI PROTEINE ETEROLOGHE IN BATTERI VENGONO UTILIZZATI SPESSO PROMOTORI FORTI E REGOLABILI Forti – Alta affinità per l’RNA polimerasi – Legame forte – trascritto ad alta frequenza – Legame debole- RNA Pol si stacca, no trasc. Regolabile – L’espressione può essere controllata dal ricercatore, tramite induttori e repressori UNA PRODUZIONE CONTINUA DELLA PROTEINA PROVOCA: -inibizione funzioni cellula -perdita energia -perdita plasmide


Lattosio IPTG

ESPRESSIONE E PURIFICAZIONE DI UNA PROTEINA DI FUSIONE 1. TRASFORMAZIONE DEL VETTORE D’ESPRESSIONE (CODIFICANTE PER LA PROTEINA DI FUSIONE) IN OSPITE. 2. AMPLIFICAZIONE DEL CEPPO BATTERICO TRASFORMATO. 3. INDUZIONE DELL’ESPRESSIONE DELLA PROTEINA DI FUSIONE. 4. PURIFICAZIONE DELLA PROTEINA DI FUSIONE.

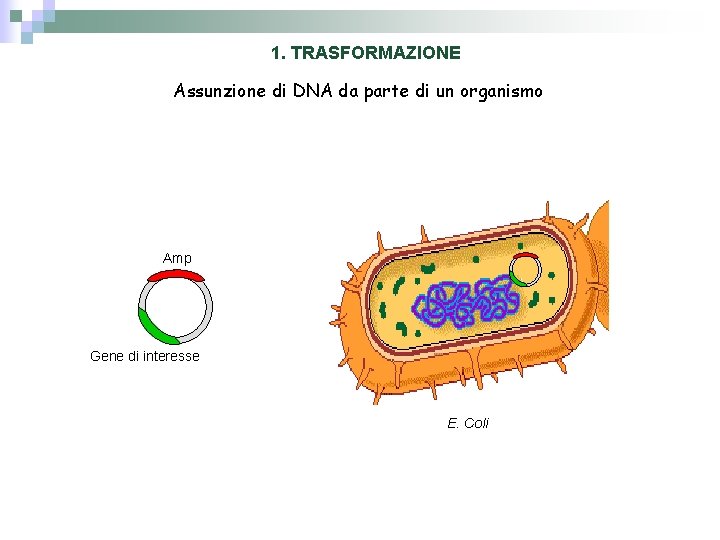
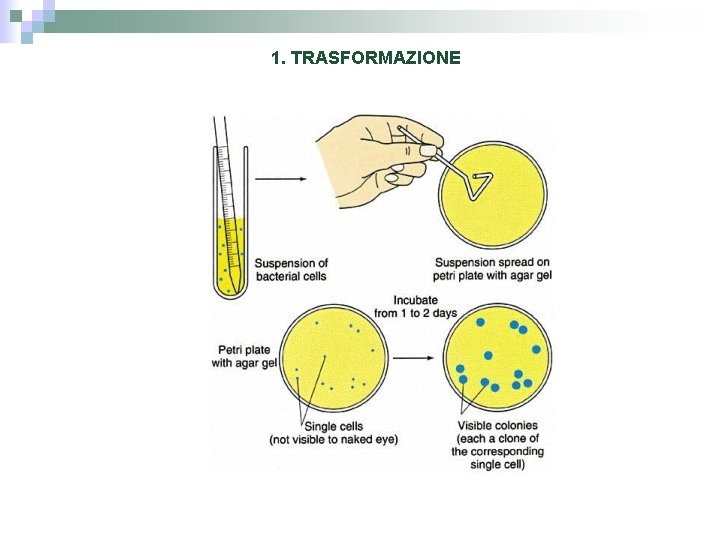
1. TRASFORMAZIONE Assunzione di DNA da parte di un organismo Amp Gene di interesse E. Coli

1. TRASFORMAZIONE

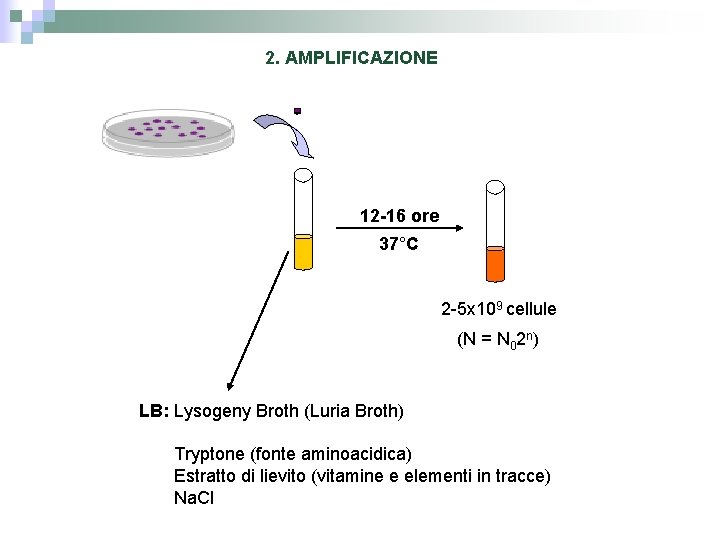
2. AMPLIFICAZIONE 12 -16 ore 37°C 2 -5 x 109 cellule (N = N 02 n) LB: Lysogeny Broth (Luria Broth) Tryptone (fonte aminoacidica) Estratto di lievito (vitamine e elementi in tracce) Na. Cl

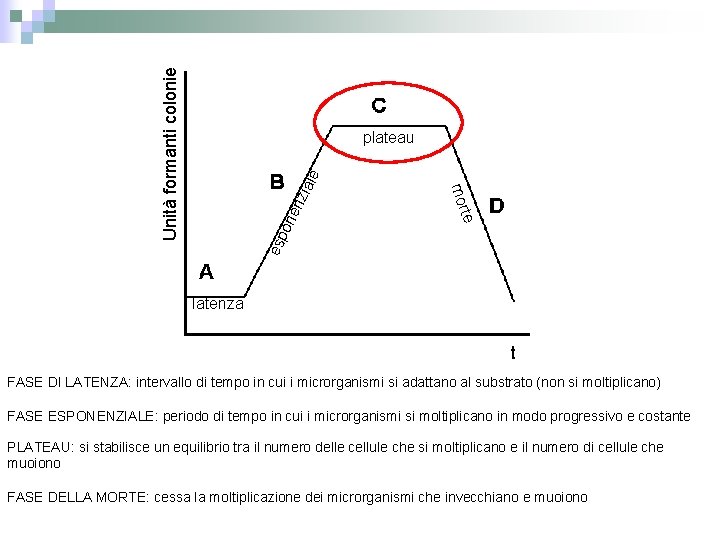
Unità formanti colonie en on esp te mor zia le plateau latenza t FASE DI LATENZA: intervallo di tempo in cui i microrganismi si adattano al substrato (non si moltiplicano) FASE ESPONENZIALE: periodo di tempo in cui i microrganismi si moltiplicano in modo progressivo e costante PLATEAU: si stabilisce un equilibrio tra il numero delle cellule che si moltiplicano e il numero di cellule che muoiono FASE DELLA MORTE: cessa la moltiplicazione dei microrganismi che invecchiano e muoiono

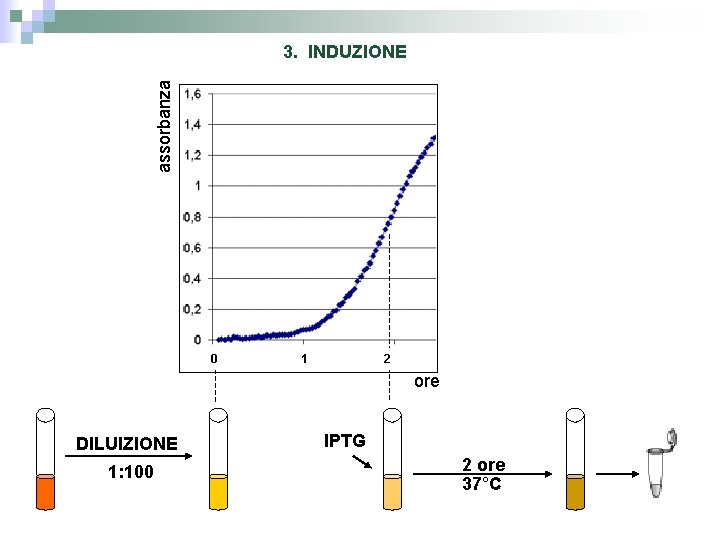
assorbanza 3. INDUZIONE 0 1 2 ore DILUIZIONE 1: 100 IPTG 2 ore 37°C

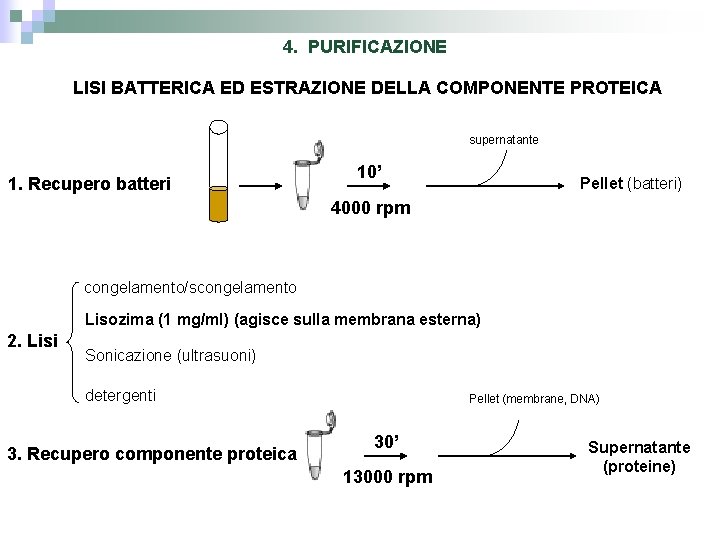
4. PURIFICAZIONE LISI BATTERICA ED ESTRAZIONE DELLA COMPONENTE PROTEICA supernatante 1. Recupero batteri 10’ Pellet (batteri) 4000 rpm congelamento/scongelamento Lisozima (1 mg/ml) (agisce sulla membrana esterna) 2. Lisi Sonicazione (ultrasuoni) detergenti 3. Recupero componente proteica Pellet (membrane, DNA) 30’ 13000 rpm Supernatante (proteine)

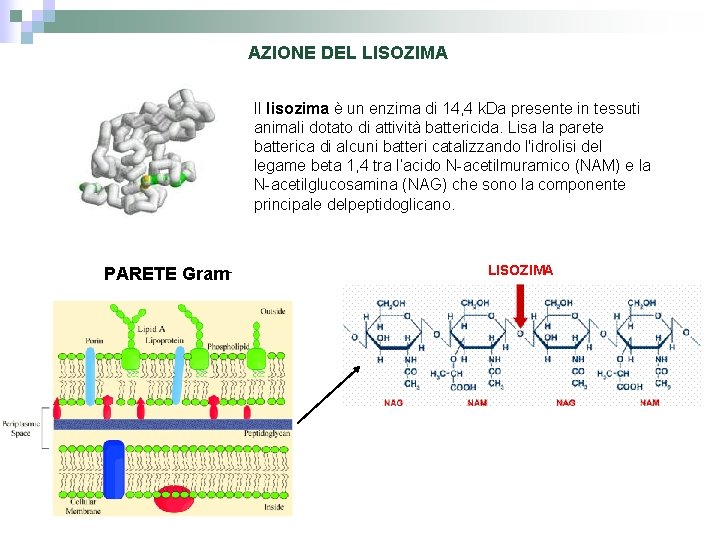
AZIONE DEL LISOZIMA Il lisozima è un enzima di 14, 4 k. Da presente in tessuti animali dotato di attività battericida. Lisa la parete batterica di alcuni batteri catalizzando l'idrolisi del legame beta 1, 4 tra l’acido N-acetilmuramico (NAM) e la N-acetilglucosamina (NAG) che sono la componente principale delpeptidoglicano. PARETE Gram- LISOZIMA

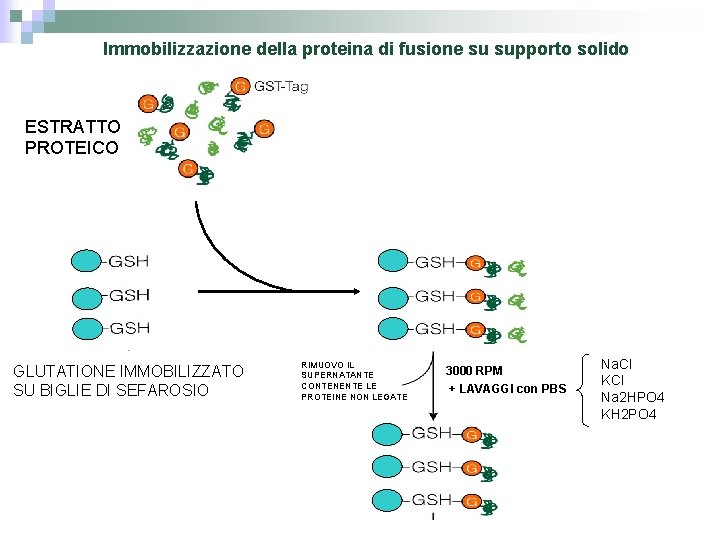
Immobilizzazione della proteina di fusione su supporto solido ESTRATTO PROTEICO GLUTATIONE IMMOBILIZZATO SU BIGLIE DI SEFAROSIO RIMUOVO IL SUPERNATANTE CONTENENTE LE PROTEINE NON LEGATE 3000 RPM + LAVAGGI con PBS Na. Cl KCl Na 2 HPO 4 KH 2 PO 4

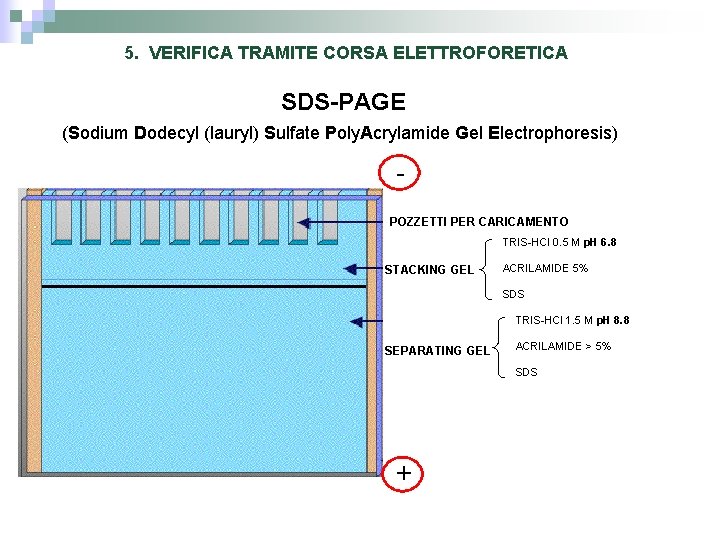
5. VERIFICA TRAMITE CORSA ELETTROFORETICA SDS-PAGE (Sodium Dodecyl (lauryl) Sulfate Poly. Acrylamide Gel Electrophoresis) POZZETTI PER CARICAMENTO TRIS-HCl 0. 5 M p. H 6. 8 STACKING GEL ACRILAMIDE 5% SDS TRIS-HCl 1. 5 M p. H 8. 8 SEPARATING GEL ACRILAMIDE > 5% SDS +

stacking gel: è la parte superiore del gel e la sua funzione è quella di concentrare il campione proteico caricato negli appositi pozzetti, in modo che tutti i campioni comincino la loro migrazione dallo stesso punto di partenza. running gel: è la parte inferiore e la sua funzione è quella di separare le proteine dei vari campioni sulla base del loro peso molecolare. È composto dagli stessi ingredienti dello stacking gel, ma in quantità diverse. In particolare è la concentrazione di acrilammide a variare, a seconda della porosità desiderata: concentrazioni maggiori portano a pori di dimensioni minori, dunque capaci di separare le proteine con una risoluzione maggiore.

COME PREPARARE IL CAMPIONE PER LA CORSA loading buffer 95° C + 13000 rpm • L’ELEVATA TEMPERATURA ROMPE IL LEGAME TRA GST E BIGLIE DI SEFAROSIO • L’SDS DENATURA LA PROTEINA E ROMPE LE INTERAZIONI • IL BETA-MERCAPTOETANOLO RIDUCE GLI EVENTUALI PONTI DISOLFURO + CENTRIFUGANDO POSSIAMO ISOLARE IL SUPERNATANTE CONTENENTE LA PROTEINA Loading buffer 50 m. M Tris-HCl p. H 6. 8 2% SDS 10% Glycerol 1% b-Mercaptoethanol 12. 5 m. M EDTA 0. 02 % Bromophenol Blue

RUOLO DELL’SDS NELLA CORSA LE CARICHE E LA FORMA DI UNA PROTEINA NATIVA INFLUISCONO SULLA CORSA PROTEINA NATIVA L’SDS LEGA LE PROTEINE IN UN RAPPORTO DI UN ANIONE OGNI 2 aa PERDITA DELLE STRUTTURE SECONDARIA E TERZIARIA ACQUISIZIONE DI UNA CARICA NETTA NEGATIVA RAPPORTO CARICA/MASSA SIMILE PER TUTTE LE PROTEINE NEL CAMPIONE Il trattamento con SDS elimina le differenze di forma, quindi la lunghezza della catena polipeptidica, che riflette la massa, e’ l’unico determinante della velocita’ di migrazione. La separazione avviene quindi per differenza fra pesi molecolari visto che il rapporto massa carica per ogni proteina denaturata con SDS rimane costante.

IL GEL VA IMMERSO IN UNA SOLUZIONE DI CORSA CONTENENTE GLICINA 25 m. M Tris HCl p. H 8. 3 192 m. M Glicina 0. 1% SDS

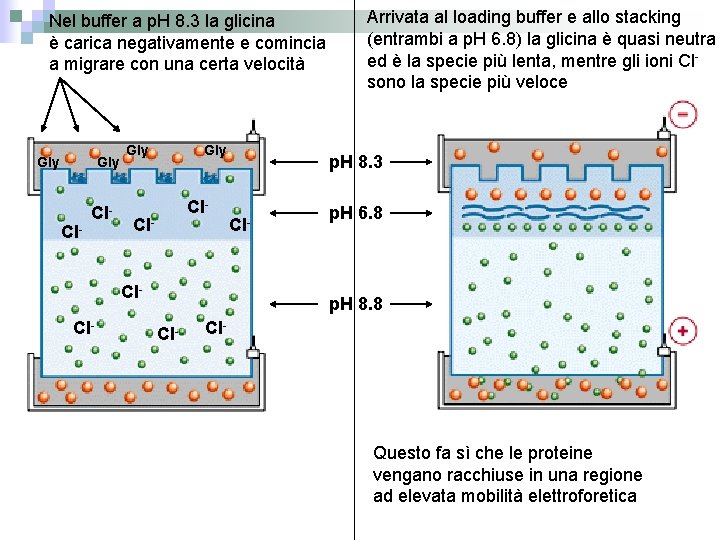
Nel buffer a p. H 8. 3 la glicina è carica negativamente e comincia a migrare con una certa velocità Gly Gly Cl- Cl- Cl. Cl- Arrivata al loading buffer e allo stacking (entrambi a p. H 6. 8) la glicina è quasi neutra ed è la specie più lenta, mentre gli ioni Cl- sono la specie più veloce p. H 8. 3 Cl- p. H 6. 8 p. H 8. 8 Cl- Questo fa sì che le proteine vengano racchiuse in una regione ad elevata mobilità elettroforetica

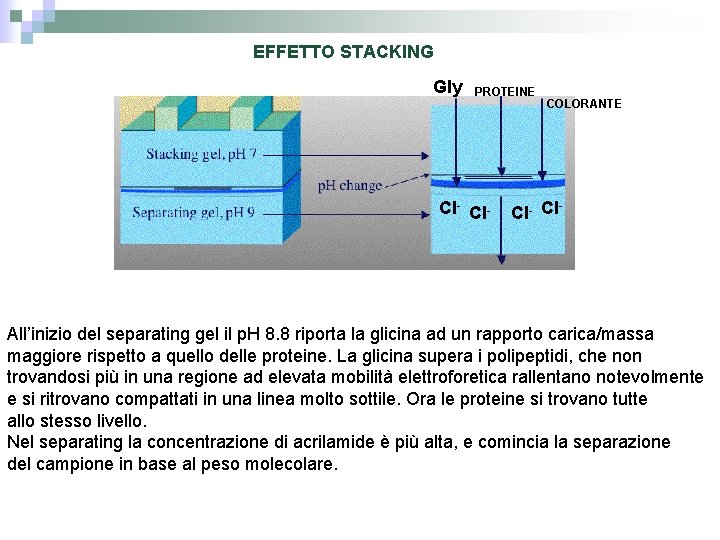
EFFETTO STACKING Gly PROTEINE Cl- COLORANTE Cl- Cl All’inizio del separating gel il p. H 8. 8 riporta la glicina ad un rapporto carica/massa maggiore rispetto a quello delle proteine. La glicina supera i polipeptidi, che non trovandosi più in una regione ad elevata mobilità elettroforetica rallentano notevolmente e si ritrovano compattati in una linea molto sottile. Ora le proteine si trovano tutte allo stesso livello. Nel separating la concentrazione di acrilamide è più alta, e comincia la separazione del campione in base al peso molecolare.

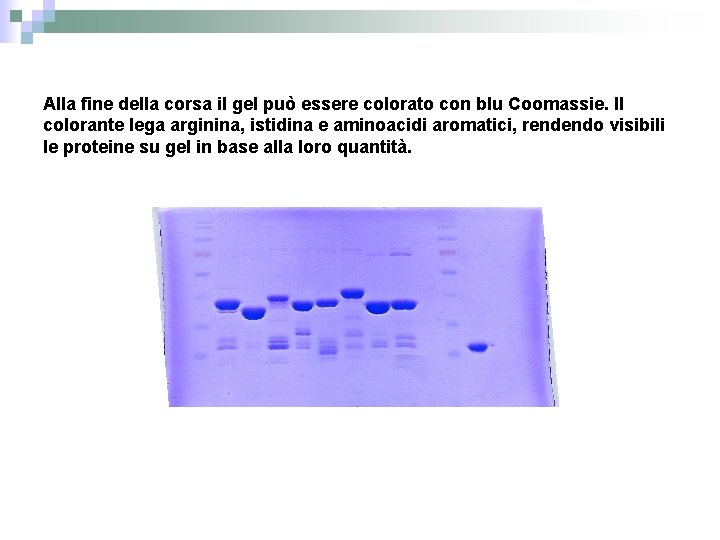
Alla fine della corsa il gel può essere colorato con blu Coomassie. Il colorante lega arginina, istidina e aminoacidi aromatici, rendendo visibili le proteine su gel in base alla loro quantità.

APPLICAZIONI 1. SI PUO’ SFRUTTARE IL SUPPORTO SOLIDO PER ESPERIMENTI DI PULL DOWN 2. SI PUO’ ELUIRE LA PROTEINA LEGATA DALLA RESINA DI SEFAROSIO E UTILIZZARLA PER SAGGI ENZIMATICI 3. SI PUO’ SFRUTTARE IL PRINCIPIO DEL TAG PER ESPERIMENTI DI DOPPIO IBRIDO
 Zymoliase
Zymoliase Interacciones proteina proteina
Interacciones proteina proteina Tecniche di purificazione
Tecniche di purificazione Apparecchio di thiele
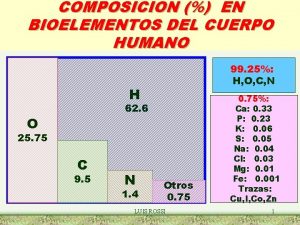
Apparecchio di thiele Bioelemento opcional de una proteina
Bioelemento opcional de una proteina Vettore di espressione
Vettore di espressione Schema riassuntivo monomi e polinomi
Schema riassuntivo monomi e polinomi Vettore di espressione
Vettore di espressione Espressione genica
Espressione genica Semplificazione equazioni
Semplificazione equazioni Espressione genica zanichelli
Espressione genica zanichelli Espressione algebrica impossibile
Espressione algebrica impossibile Regolazione genica eucarioti
Regolazione genica eucarioti Vettore di espressione
Vettore di espressione Espressione letterale
Espressione letterale A liuba che parte zanichelli
A liuba che parte zanichelli Analisi dimensionale
Analisi dimensionale Esempi scritture contabili fusione inversa
Esempi scritture contabili fusione inversa Aspetti fiscali fusione
Aspetti fiscali fusione Modello censuario tipo mappale con fusione di particelle
Modello censuario tipo mappale con fusione di particelle Passaggio di stato
Passaggio di stato Murex finanza cos'è
Murex finanza cos'è Difetto di massa
Difetto di massa Fusione nucleare
Fusione nucleare Fusione nucleare schema
Fusione nucleare schema Sue
Sue Fusione nucleare
Fusione nucleare Fusione fredda rossi
Fusione fredda rossi