Tecniche di purificazione Per effettuare la maggior parte





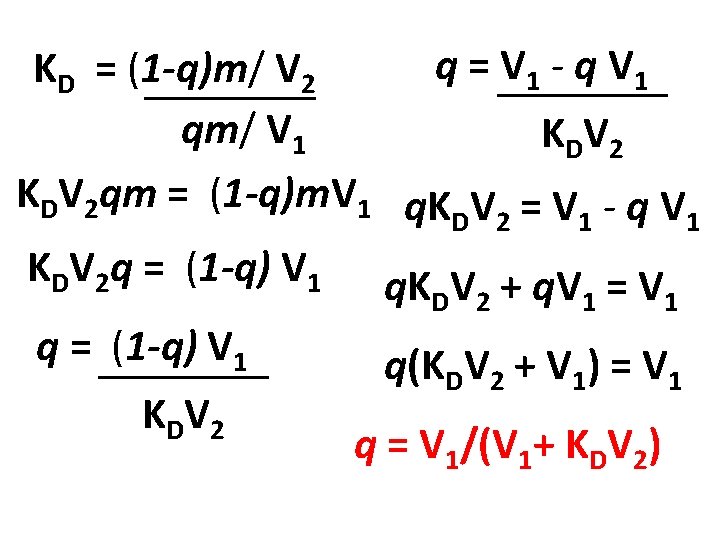
















- Slides: 27

Tecniche di purificazione

Per effettuare la maggior parte delle analisi chimiche è necessario che l’analita venga separato parzialmente o completamente dai composti interferenti. Estrazione con solvente Trasferimento di un soluto da una fase liquida ad un’altra (estrazione da una soluzione acquosa ad un solvente organico)


2 1 S Supponiamo di avere un soluto S sia ripartito tra le fasi 1 e 2. Coefficiente di ripartizione KD = [S]2/[S]1

Solvente 1 (V 1) contiene m moli di S e viene estratto con solvente 2 (V 2). Definiamo q la frazione di S che rimane nella fase 1 una volta raggiunto l’equilibrio. La concentrazione molare di S nella fase 1 sarà qm/ V 1. La concentrazione molare di S nella fase 2 sarà (1 -q)m/ V 2 KD = [S]2/[S]1 = (1 -q)m/ V 2 qm/ V 1 q = V 1/(V 1+ KDV 2)
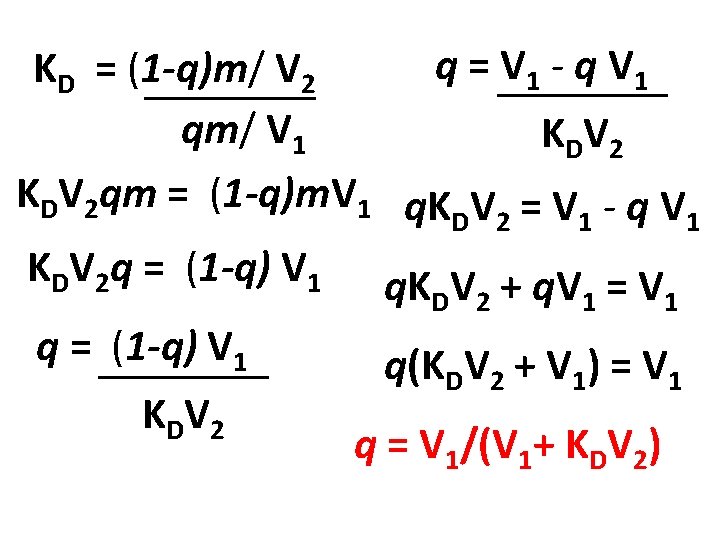
q = V 1 - q V 1 KD = (1 -q)m/ V 2 qm/ V 1 K DV 2 KDV 2 qm = (1 -q)m. V 1 q. K V = V - q V D 2 1 1 KDV 2 q = (1 -q) V 1 q. K V + q. V = V q = (1 -q) V 1 K DV 2 D 2 1 1 q(KDV 2 + V 1) = V 1 q = V 1/(V 1+ KDV 2)

La frazione rimanente dopo 2 estrazioni sarà: q x q = (V 1/V 1+ KDV 2 2 ) La frazione rimanente dopo n estrazioni sarà: qn = (V 1/V 1+ KDV 2)n

Una soluzione acquosa contiene 4 g del soluto A in 200 ml di acqua. Si hanno a disposizione 150 m. L di diclorometano. Verificare che la quantità di soluto che rimane in soluzione acquosa dopo una sola estrazione con tutto il solvente organico è maggiore della quantità che rimane dopo tre estrazioni consecutive utilizzando in ciascuna 50 m. L di diclorometano. Kdiclorometano/acqua = 3

Una mole di un composto A è presente in 100 m. L di una soluzione acquosa. Calcolare il volume di cloroformio necessario affinchè con una sola estrazione venga recuperato il 99% del composto A (KD = 24. 75). Quale sarebbe la percentuale di composto recuperato se si eseguissero due estrazioni multiple con metà del volume calcolato.

q = (0. 1/(0. 1+ (24. 75 x 0. 2))2 = 3. 92 x 10 -4 Frazione estratta = 100 - 0, 0392 = 99, 96



Purificazione di composti oeganici solidi La purificazione di composti organici è importante perché i composti organici solidi preparati in laboratorio possono contenere impurezze I metodi più comuni per la purificazione dei composti organici sono: Cristallizzazione Sublimazione Distillazione Cromatografia

Cristallizazione E’ il processo di formazione dei cristalli Cristallizzazione per raffreddamento di una soluzione calda concentrata • In questo metodo la sostanza impura viene disciolta in acqua o in solvente organico • La soluzione viene filtrata per eliminare le impurità non disciolte • Il filtrato viene riscaldato • La soluzione calda viene raffreddata in modo che i cristalli possano separarsi dalla soluzione • I cristalli precipitati vengono rimossi per filtrazione.


Ricristallizazione Metodo utilizzato per purificare un composto allo stato solido Una piccola quantità di solvente viene aggiunta alla beuta che contiene il solido da purificare. Si riscalda la soluzione e poi si raffredda. Il solido purificato precipita mentre le impurezze rimangono disciolte in soluzione.


Spettrofotometria Utilizzo della luce nella misure delle concentrazioni chimiche

Proprietà della luce Le onde luminose consistono in campi elettrici e magnetici perpendicolari tra loro. Lunghezza d’onda (λ) = distanza tra due massimi Frequenza (ν) = numero di oscillazioni in un secondo λ λν = c c = velocità della luce (2. 997 x 108 m/s)

Proprietà della luce Dualismo onda-materia: possiamo considerare la luce in termini di onda o di particelle dette fotoni. Ciascun fotone trasporta energia E = hν h = costante di Plank (6. 626 x 10 -34 J·s) E = hν = hc/λ Energia è inversamente proporzionale alla lunghezza d’onda

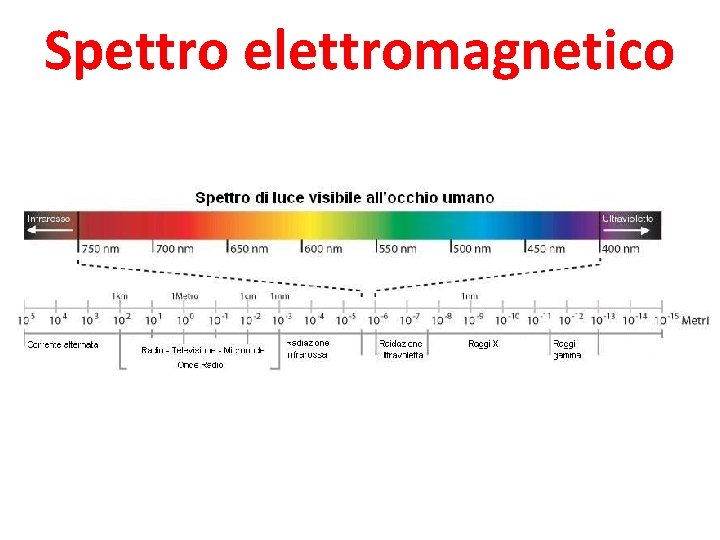
Spettro elettromagnetico

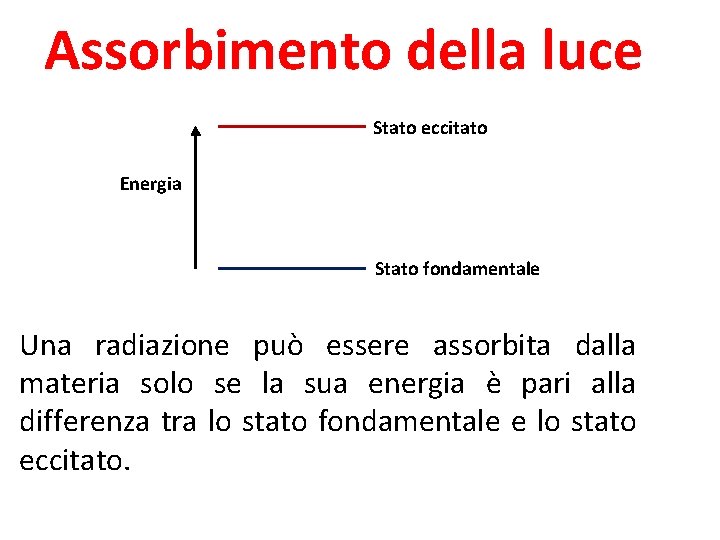
Assorbimento della luce Stato eccitato Energia Stato fondamentale Una radiazione può essere assorbita dalla materia solo se la sua energia è pari alla differenza tra lo stato fondamentale e lo stato eccitato.

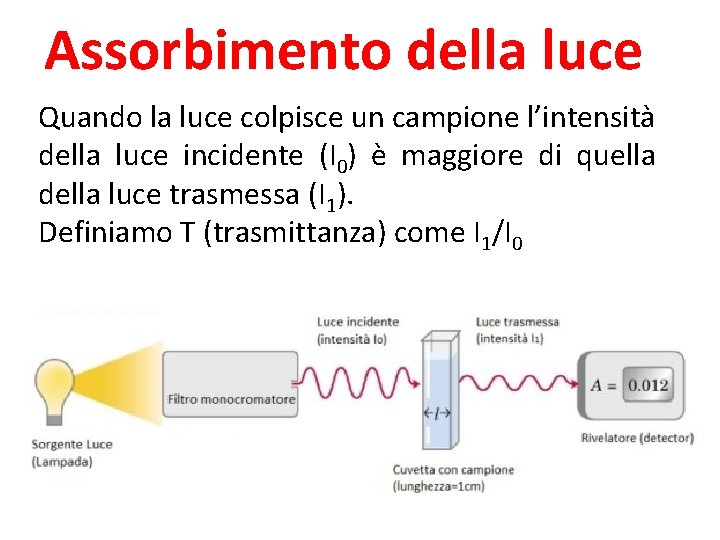
Assorbimento della luce Quando la luce colpisce un campione l’intensità della luce incidente (I 0) è maggiore di quella della luce trasmessa (I 1). Definiamo T (trasmittanza) come I 1/I 0

Assorbimento della luce T = I 1/I 0 A = Log (I 0/I 1) = -Log T A = assorbanza del campione A = εl. C Legge di Lambert-Beer ε = coefficiente di estinzione molare o assorbività molare l = cammino ottico (cm) C = concentrazione(M)

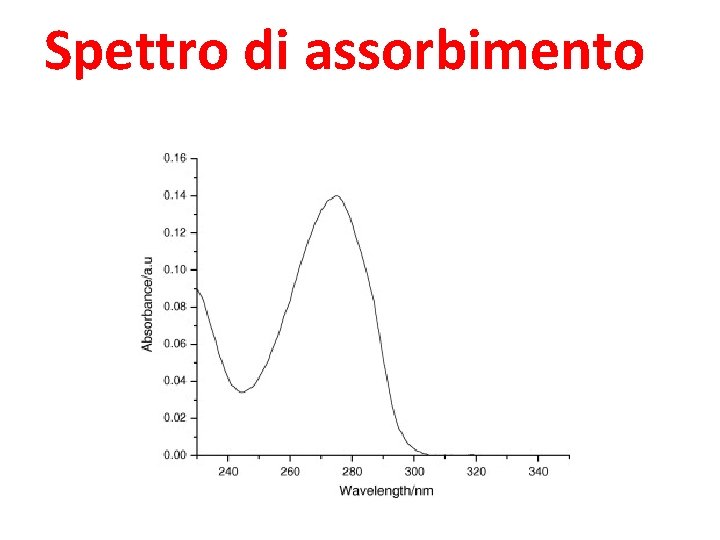
Spettro di assorbimento

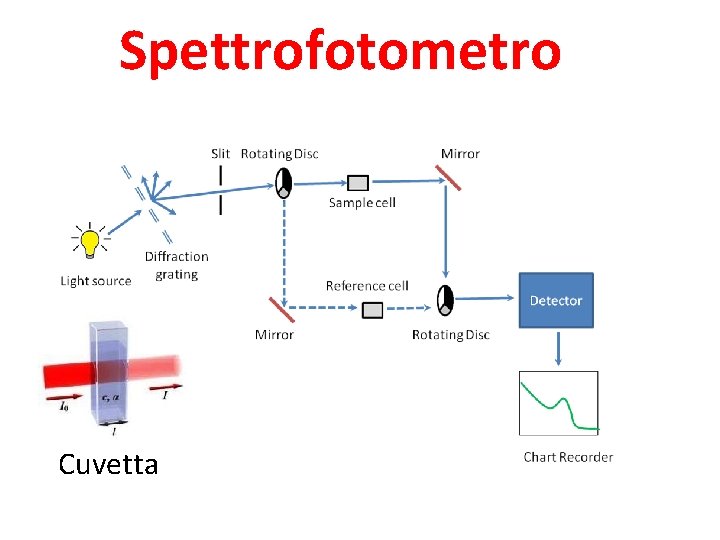
Spettrofotometro Cuvetta

Una sostanza mostra il massimo di assorbanza a 275 nm. Sapendo che ε 275 = 8400 M-1 cm-1 e lo spessore della soluzione attraversato dalla radiazione è di 1 cm calcolare la concentrazione di una soluzione di tale sostanza se A 275 = 0. 70
 Apparecchio di thiele
Apparecchio di thiele Tecniche di purificazione
Tecniche di purificazione Xxvi canto inferno testo
Xxvi canto inferno testo Este parte aquele parte
Este parte aquele parte Cuándo empleamos los números decimales
Cuándo empleamos los números decimales As partes da missa
As partes da missa Te invitamos hacer parte
Te invitamos hacer parte Pubblicità con personificazione
Pubblicità con personificazione Tecniche di catalogazione
Tecniche di catalogazione Comunicazione organizzativa interna
Comunicazione organizzativa interna Teorie e tecniche della televisione
Teorie e tecniche della televisione Spazio simbolico narrativa
Spazio simbolico narrativa Tecniche di rappresentazione dello spazio
Tecniche di rappresentazione dello spazio Tecniche analitiche di laboratorio
Tecniche analitiche di laboratorio Ringraziamenti tesi
Ringraziamenti tesi Giovanni verga seconda rivoluzione industriale
Giovanni verga seconda rivoluzione industriale Italo svevo pensiero
Italo svevo pensiero Shaping e chaining esempio
Shaping e chaining esempio Metodi e tecniche del servizio sociale slide
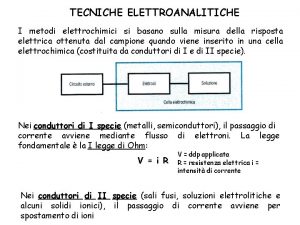
Metodi e tecniche del servizio sociale slide Metodi elettrochimici
Metodi elettrochimici Tecniche di rappresentazione dello spazio
Tecniche di rappresentazione dello spazio Laboratorio linguaggi e tecniche comunicative non verbali
Laboratorio linguaggi e tecniche comunicative non verbali Canali della comunicazione
Canali della comunicazione Tecniche di separazione chimica
Tecniche di separazione chimica Il testo narrativo schema
Il testo narrativo schema Istituto superiore di tecniche investigative
Istituto superiore di tecniche investigative Tecniche di rappresentazione dello spazio
Tecniche di rappresentazione dello spazio Lo schema narrativo
Lo schema narrativo