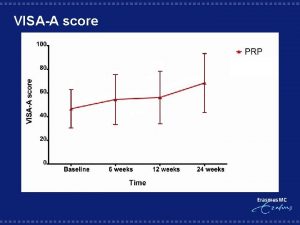
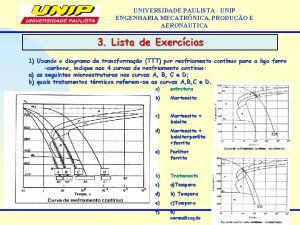
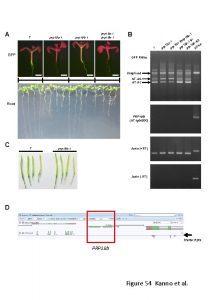
ENGENHARIA AERONUTICA PRP 28 Transferncia de Calor e

































- Slides: 50

ENGENHARIA AERONÁUTICA PRP 28 – Transferência de Calor e Termodinâmica Aplicada Semana 2 CONSIDERAÇÕES DA TERMODIN MICA –

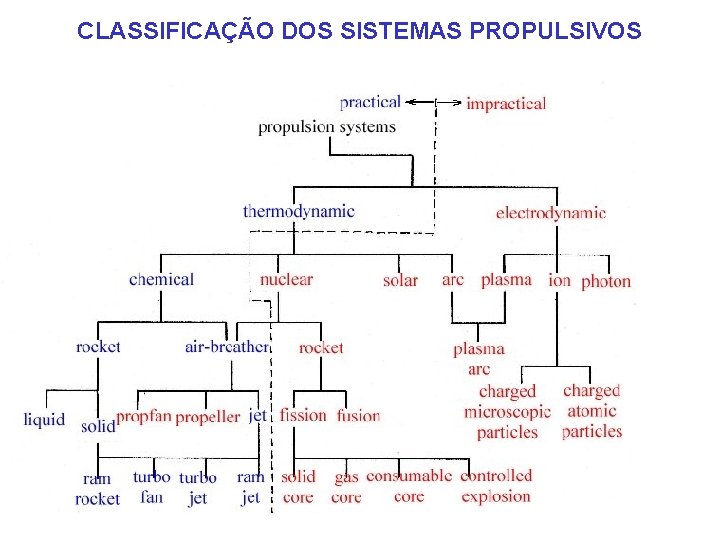
CLASSIFICAÇÃO DOS SISTEMAS PROPULSIVOS

PONTOS BÁSICOS – MÁQUINAS TÉRMICAS • Todas as aeronaves combustível hidrocarbonetos são MÁQUINAS TÉRMICAS • Aplica-se no estudo – Mecânica de Fluidos • Relata as variações na pressão, temperatura e velocidade do ar – Termodinâmica (Análise de Ciclo) • Energia térmica → Energia Mecânica (uso da termodinâmica) • Estudo das variações de estado termodinâmico do fluido de trabalho ao atravessar a máquina térmica • Geometria NÃO importa, processos são importantes

Termodinâmica Química • Cálculo do estado final baseado em alguma informação do estado inicial – assumindo equilíbrio termodinâmico • Propriedades do estado final – por exemplo--– temperatura (temperatura de chama adiabática) • conservação de energia – 1 a lei da TD – composição de equilíbrio • conservação da massa • entropia - 2 a lei da TD

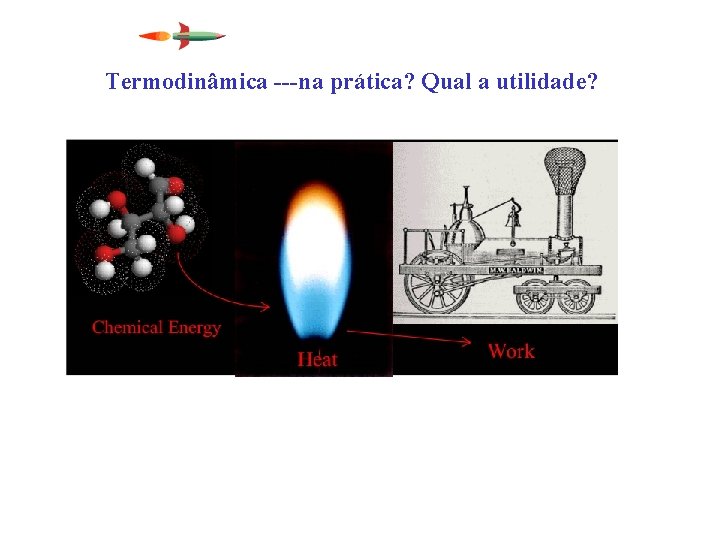
Termodinâmica ---na prática? Qual a utilidade?

Termodinâmica - responde • Primeira Lei – qual a máxima energia (conversão)? • Segunda Lei – quanto posso aproveitar desta energia e em qual direção o processo caminhará? O processo ocorrerá espontaneamente?

Revisão de termodinâmica (1) • Neste curso --revisão – 1 a Lei da Termodinâmica (conservação de energia) - “you can’t win”) – 2 a Lei da Termodinâmica - “you can’t break even”) – Equação de estado (usualmente lei de gás ideal) – – Conservação de massa – Conservação de momentum

VAMOS FALAR SOBRE ENERGIA? ? 1 a Lei da Termodinâmica (conservação de energia)

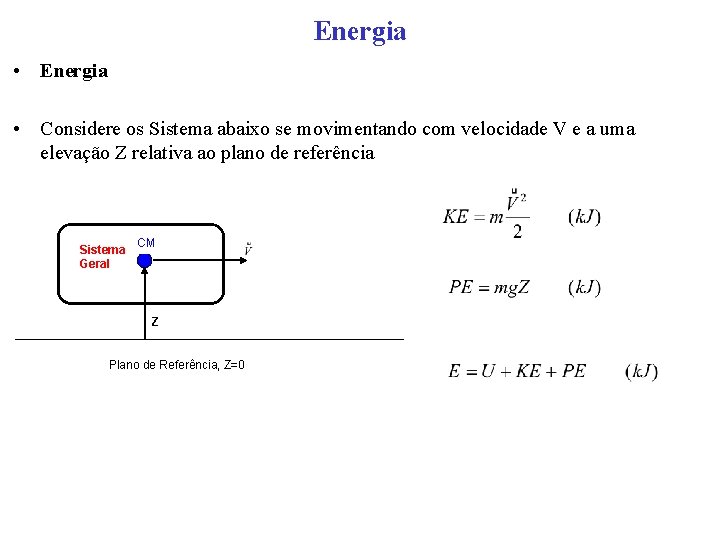
Energia • Considere os Sistema abaixo se movimentando com velocidade V e a uma elevação Z relativa ao plano de referência Sistema Geral CM Z Plano de Referência, Z=0

Energia • A energia total E de um sistema (aberto ou fechado) é a soma de todas as formas de energias que podem existir no interior do sistema tais como térmica, mecânica, cinética, potencial, magnética, química e nuclear. A energia total do sistema é normalmente pensada como a soma da energia interna, energia cinética e energia potencial. A energia interna U é a energia associada a estrutura molecular do sistema e o grau de atividade molecular. A energia cinética KE existe como resultado do movimento do sistema relativo a uma referência externa. Quando o sistema se move a uma velocidade v a energia cinética é expressa como: • A energia que o sistema possui como resultado de sua elevação em um campo gravitacional em relação a uma referência externa é chamada energia potencial PE e é expressa como:

Energia • A energia total de um sistema (aberto ou fechado) é expressa como: • E em relação a massa: Onde e = E/m é a energia específica estocada e u = U/m é a energia interna específica. A variação da energia estocada em Sistema é dada por:

A tempo, vejamos unidades •

Energia • Muitos sistemas fechados permanecem estacionários durante o processo e assim, não experimentam nenhuma variação em suas energias cinética e potencial. A variação na energia estocada é identica a variação da energia interna para sistemas estacionários: • Se KE = PE = 0, • Mas a energia está estocada…como transferir? ? Quem faz o link?

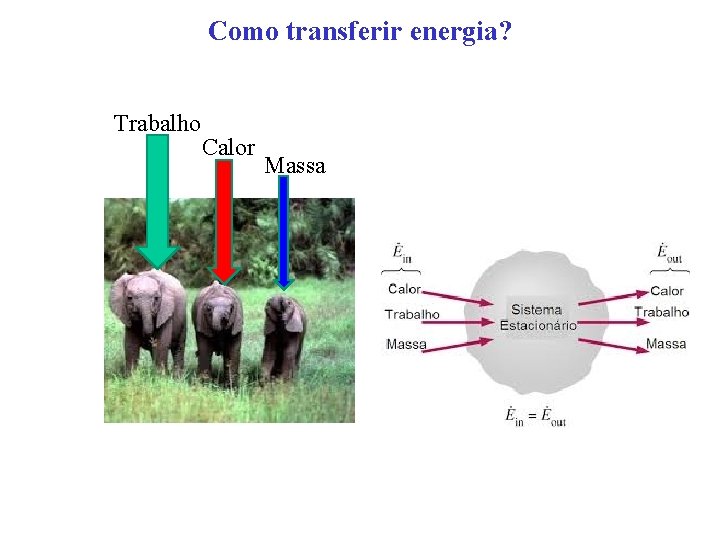
Como transferir energia? Trabalho Calor Massa

Como transferir energia? 1. Transferência de Calor, Q: Calor é energia transferida causada pela diferença de temperatura entre o sistema e as vizinhanças. Q é zero em sistemas adiabáticos. 2. Trabalho, W: Trabalho é a energia transferida para a fronteira do sistema que pode ser visualizada pelo levantamento de um peso. 3. Fluxo mássico, m: Massa flui para o sistema, a energia do sistema aumenta. Massa deixa o sistema energia do sistema diminui. Se não entra ou sai massa, a energia transferida pela massa é nula. Assim em um sistema fechado a transferência de energia pela massa é zero.

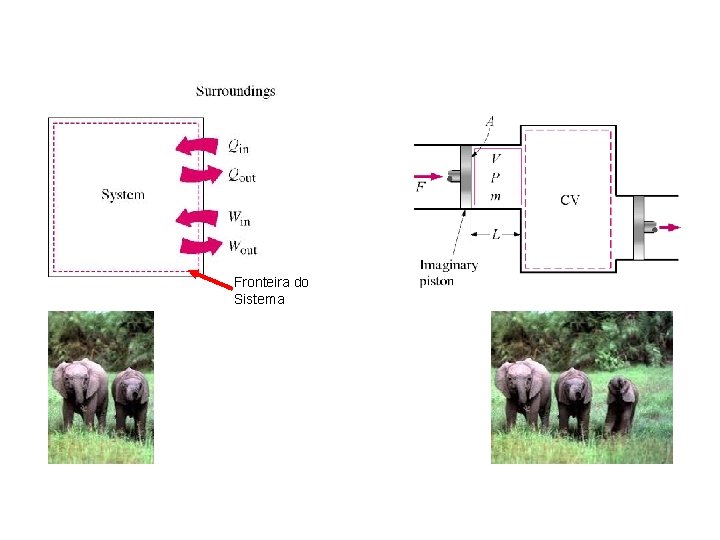
Fronteira do Sistema

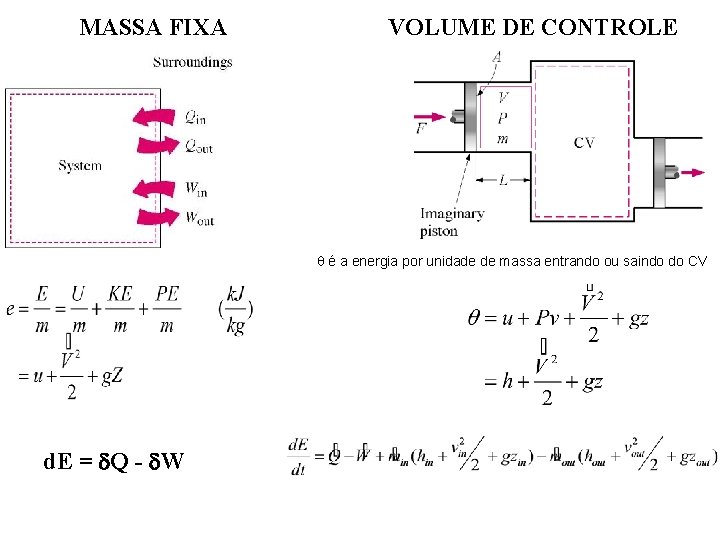
1 a Lei da Termodinâmica para massa fixa Fronteira do Sistema

Revisão de termodinâmica (2) • 1 a Lei da Termodinâmica para um sistema termodinâmico*, i. e. uma massa fixa de matéria (mas geralmente variando o volume) d. E = Q - W E = energia contida na massa - uma propriedade da massa Q = calor transferido para a massa W = trabalho transferido para ou a partir da massa (veja abaixo) d vs. = quantidade independente da trajetória vs. quantidade dependente da trajetória – Sistema útil para massa fixa, e. g. gas em um pistão-cilindro – Cada termo tem unidade de Joules – Trabalho transferido** positivo se sai do Sistema (+ W), no caso de trabalho que entra no Sistema, (- W), – Calor e trabalho NÃO são propriedades da massa, eles são transferidores de energia para/da massa; a massa não contém calor ou trabalho mas contém energia (E) *Van Wylen – define sistema termodinâmico como uma quantidade de matéria de massa e identidade fixas. Aqui também utiliza-se o termo massa fixa ** Definição clássica

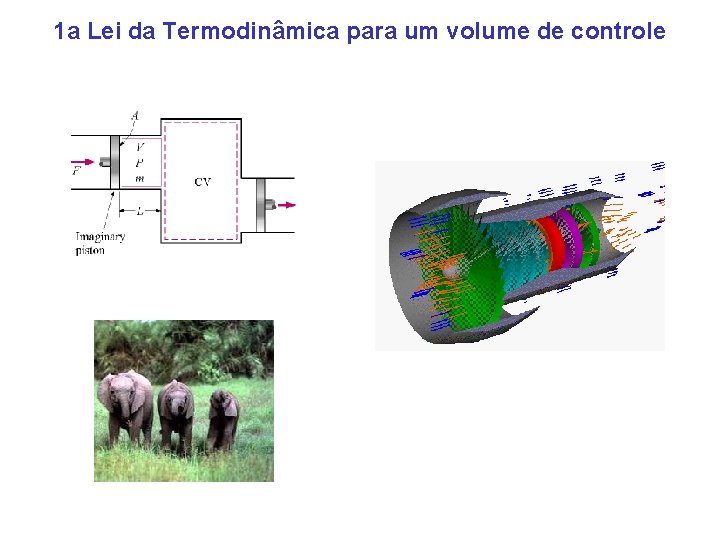
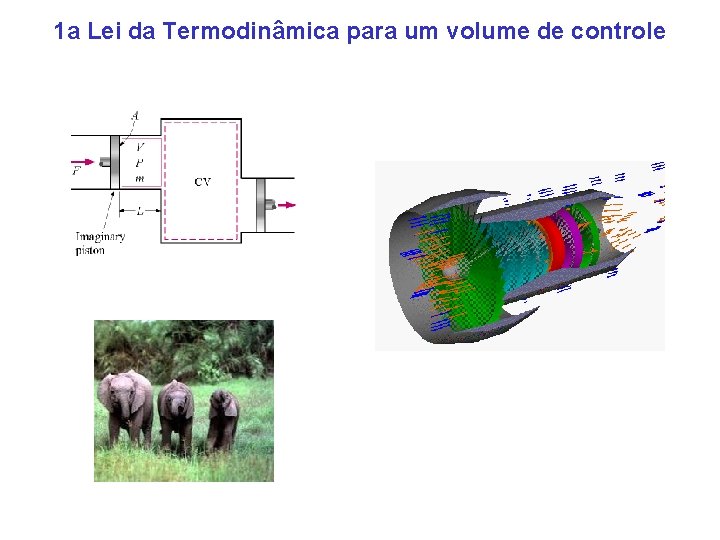
1 a Lei da Termodinâmica para um volume de controle

1 a Lei da Termodinâmica para um volume de controle

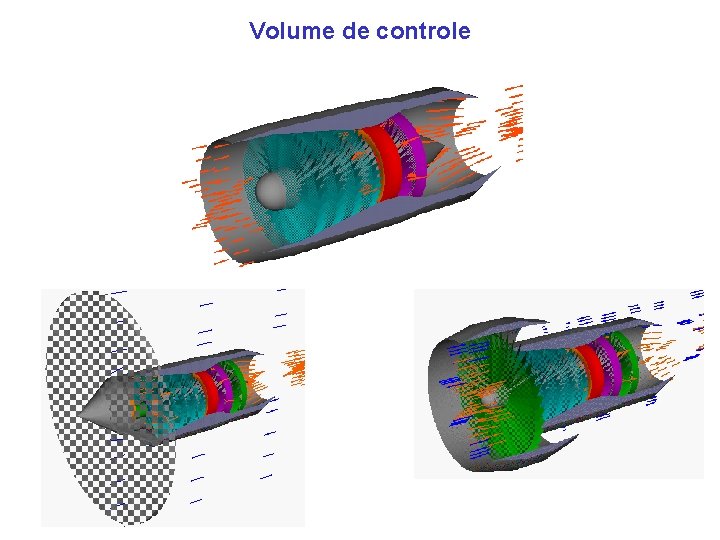
Volume de controle

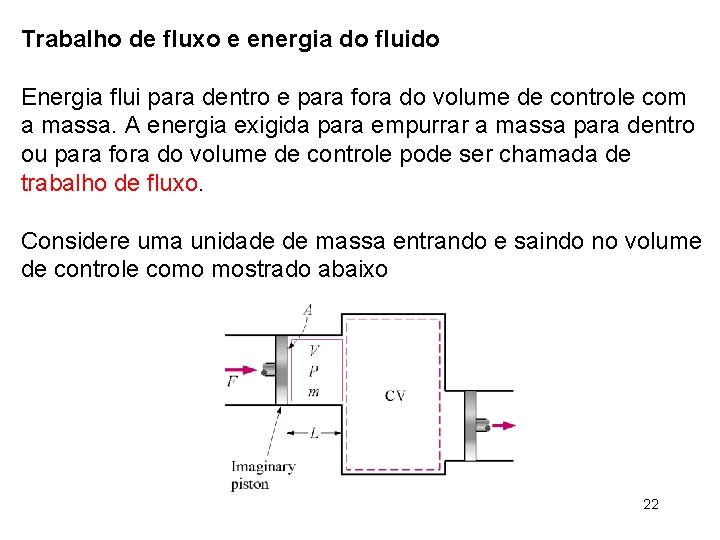
Trabalho de fluxo e energia do fluido Energia flui para dentro e para fora do volume de controle com a massa. A energia exigida para empurrar a massa para dentro ou para fora do volume de controle pode ser chamada de trabalho de fluxo. Considere uma unidade de massa entrando e saindo no volume de controle como mostrado abaixo 22

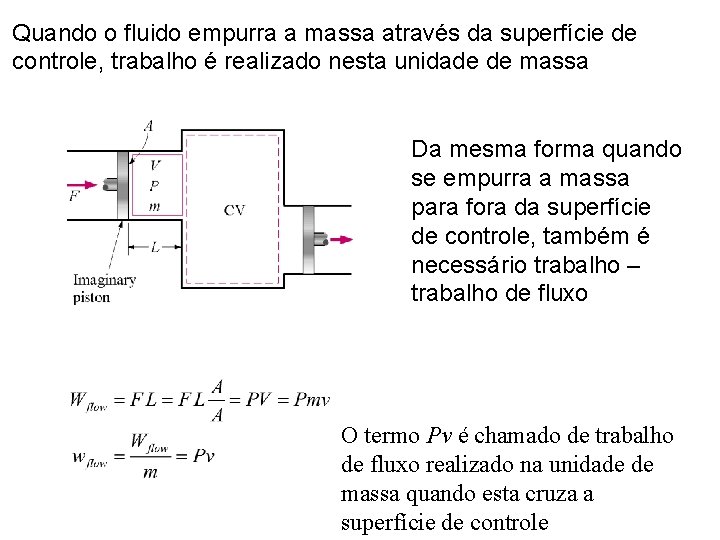
Quando o fluido empurra a massa através da superfície de controle, trabalho é realizado nesta unidade de massa Da mesma forma quando se empurra a massa para fora da superfície de controle, também é necessário trabalho – trabalho de fluxo O termo Pv é chamado de trabalho de fluxo realizado na unidade de massa quando esta cruza a superfície de controle

Energia total do fluido escoando A energia total carregada por unidade de massa quando esta cruza a superfície de controle é a soma da energia interna, trabalho de fluxo, energia potencial e energia cinética. Aqui usamos a definição de entalpia, h = u + Pv.

Energia transportada pela massa Quantidade de energia transportada através da superfície de controle: Taxa de energia através da superfície de controle:

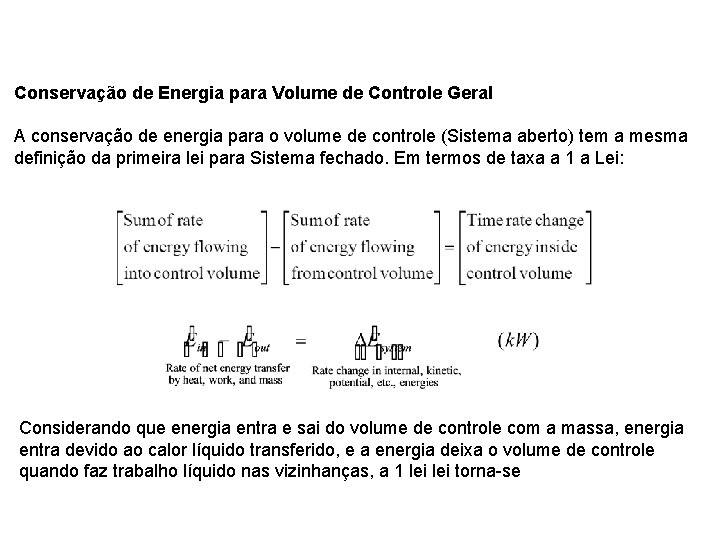
Conservação de Energia para Volume de Controle Geral A conservação de energia para o volume de controle (Sistema aberto) tem a mesma definição da primeira lei para Sistema fechado. Em termos de taxa a 1 a Lei: Considerando que energia entra e sai do volume de controle com a massa, energia entra devido ao calor líquido transferido, e a energia deixa o volume de controle quando faz trabalho líquido nas vizinhanças, a 1 lei torna-se

onde é a energia por unidade de massa entrando ou saindo do CV. A energia por unidade de massa, , fluindo através da superfície de controle que define o volume de controle é composta de 4 termos: a energia interna, a energia cinética, a energia potencial e o trabalho de fluxo. A energia total carregada por unidade de massa quando esta cruza a superfície de controle é Onde a taxa de variação de energia com o tempo do volume de controle é

Ou seja – 1 a lei para CV • 1 a Lei da Termodinâmica para um volume de controle, um volume fixo no espaço que pode ter massa entrando e saindo (oposto a sistema, no qual a massa é fixa mas possivelmente variando o volume): – – – – E = energia no volume de controle = U + KE + PE como antes Qdot, Wdot = taxas de calor & trabalho entrando e saindo (Watts) Subescrito “in” refere-se a condições de entrada da massa, “out” refere-se as condições na saida (s) de massa mdot = fluxo mássico de entrada ou saída do volume de controle h u + Pv = entalpia Note que h, u & v estão minúsculos, i. e. por unidade de massa; h = H/M, u = U/M, V = v/M, etc. ; upper case means total for all the mass (not per unit mass) v = velocidade, assim v 2/2 é o termo de KE g = aceleração da gravidade, z = elevação na entrada ou saida, assim gz é o termo de PE • Volume de controle é útil para análise de dispositivos de volume fixo • Comum escrita como a equação de taxa (como acima)

Revisão de termo – 1 a lei para CV • Note que a forma da 1 a lei para Volume de Controle (CV) parecida com a forma para o Massa Fixa com a adição do termo mdot*(h+V 2/2+gz) que representa o fluxo de energia que entra/sai do CV que é carregado pela massa que entra/sai do CV • A única diferença entre CV e Sistema que não é obvia é a substituição de u (energia interna) por h = u + Pv • De onde vem este termo extra Pv? Vem do fluxo de trabalho necessário para empurrar a massa para dentro do CV ou da parte que recuperamos quando a massa deixa o CV

MASSA FIXA VOLUME DE CONTROLE é a energia por unidade de massa entrando ou saindo do CV d. E = Q - W

Revisão de termo - steady flow – fluxo permanente • Se o sistema é permanente então por definição – d[ ]/dt = 0 para todas [propriedades], i. e. ECV, MCV, h, v, z – Todos os fluxos, i. e. Qdot, Wdot, mdot são constantes (não necessariamente zero) – Soma da massa in = soma de toda massa out (ou mdotin = mdotout para entrada-simples, saída simples, (se não tivermos esta condição então a massa do sistema, a qual é uma propriedade do sistema, não seria constante) – Neste caso (steady-state, steady flow) a 1 a Lei para um CV fica

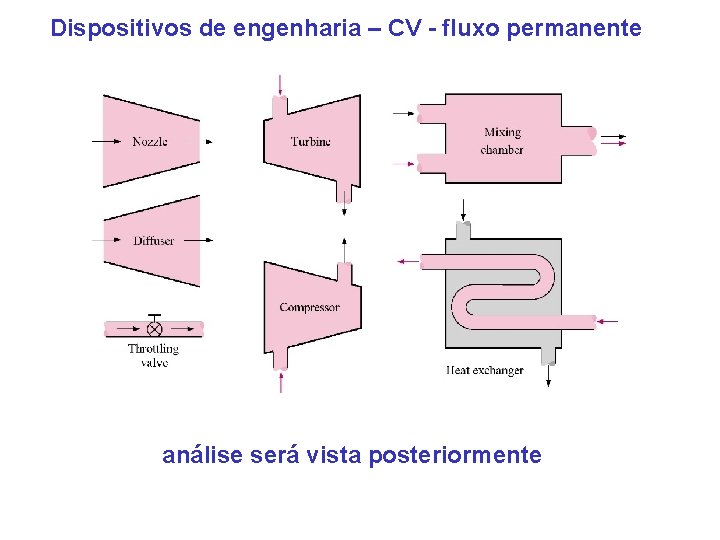
Dispositivos de engenharia – CV - fluxo permanente análise será vista posteriormente

VAMOS FALAR SOBRE ENTROPIA? ? 2 a Lei da Termodinâmica

‘‘Vejam lá, Q é tão desorganizado. . . que tem uma lei só para ele**’’ Transferência de calor é transferência de energia desorganizada em escala microscópica (molecular) COM transferência de entropia associado A 2 Lei da TD ---CALOR TRABALHO **Entropia pode variar devido (1) transferência de calor (2) irreversibilidades (3) massa

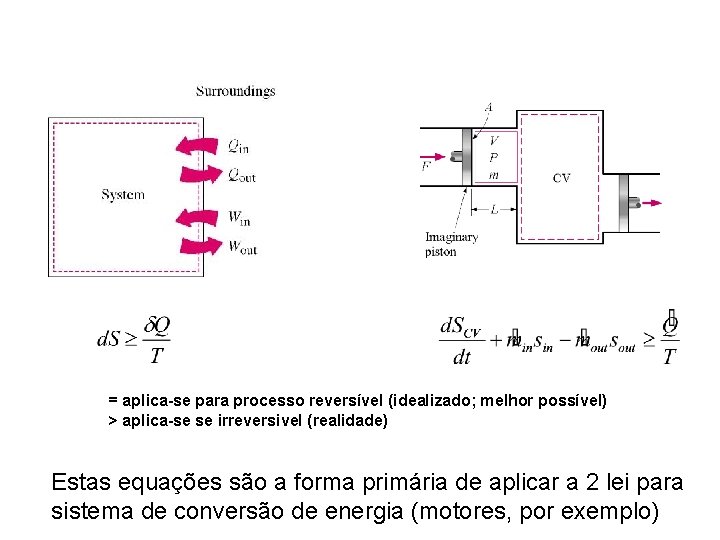
Revisão de termo – 2 a lei • • A 2 a Lei da Termodinâmica declara A entropia (S) de um sistema isolado sempre aumenta ou permanece igual Por combinar – – 2 a lei 1 a lei State postulate – para um sistema de composição química fixa, 2 propriedades independentes especificam o estado do sistema O princípio da entropia como uma propriedade do sistema é adiditivo “pode ser mostrado” que Tds = du + Pdv Tds = dh - vd. P Estas são as chamadas equações de Gibbs, que relacionam a entropia com outras propriedades termodinâmicas (e. g. u, P, v, h, T)

= aplica-se para processo reversível (idealizado; melhor possível) > aplica-se se irreversivel (realidade) Estas equações são a forma primária de aplicar a 2 lei para sistema de conversão de energia (motores, por exemplo)

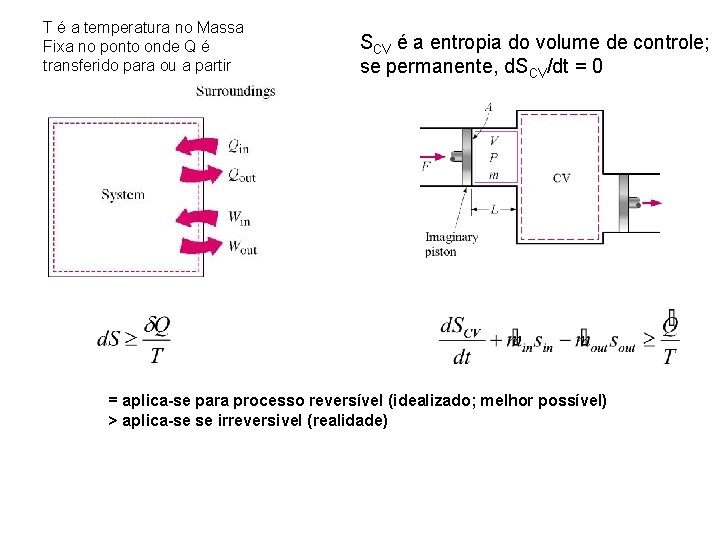
T é a temperatura no Massa Fixa no ponto onde Q é transferido para ou a partir SCV é a entropia do volume de controle; se permanente, d. SCV/dt = 0 = aplica-se para processo reversível (idealizado; melhor possível) > aplica-se se irreversivel (realidade)

Revisão de termo – 2 a lei • Trabalho não aparece em nenhum lugar na 2 lei – Por quê? • Porque NÃO existe transferência de entropia associada com transferência de trabalho, enquanto que EXISTE transferência de entropia associada com a massa e transferência de calor

Entropia versus Trabalho & Calor Transferência de trabalho é transferência de energia organizada o qual pode ocorrer tanto em escala microscópica quanto macroscópica e NÃO tem transferência de entropia associada a ela Transferência de calor é transferência de energia desorganizada em escala microscópica (molecular) COM transferência de entropia associado

Revisão de termo – relações isentrópicas • • Da 2 a Lei, d. S ≥ Q/T Se um processo é reversível d. S = Q/T, e se adicionalmente o processo é adiabático Q = 0 assim d. S = 0 ou S 2 - S 1 = 0 (processo isentrópico) então as relações para S 2 - S 1 podem ser escritas Processo Isentrópico é nosso modelo favorito para compressão e expansão em motores Mas lembre-se que estas relações são válidas somente para – – – Gas ideal Calores específicos constantes (CP, CV) (note que para gas ideal CP = Cv + R e R é uma constante, se CP é constante então Cv também é e vice-versa) Processo reversível adiabático (assim isentrópico) (Ainda muito útil apesar destas restrições…)

Revisão de termo - equações de estado • Somente será considerado 2 equações de estado neste curso – – Gás ideal - P = RT (P = pressão, = 1/v = densidade, T = temperatura (absoluta), R = constante do gás = /Mmix, = constante universal (8. 314 J/mole-K), Mmix = peso molecular da mistura gasosa) Fluido incompressível - = constant • Definição de calores específicos (qualquer substância) • Para gases ideais - h = h(T) e u = u(T) somente (h e u dependem somente da temperatura, não da pressão, volume, etc. ), assim para gases ideais • De dh = CPd. T, du = Cvd. T, as equações de Gibbs e P = RT pode-se demonstrar que (novamente somente para gas ideal)

• TERMODIN MICA BASEADA NA FRUSTAÇÃO

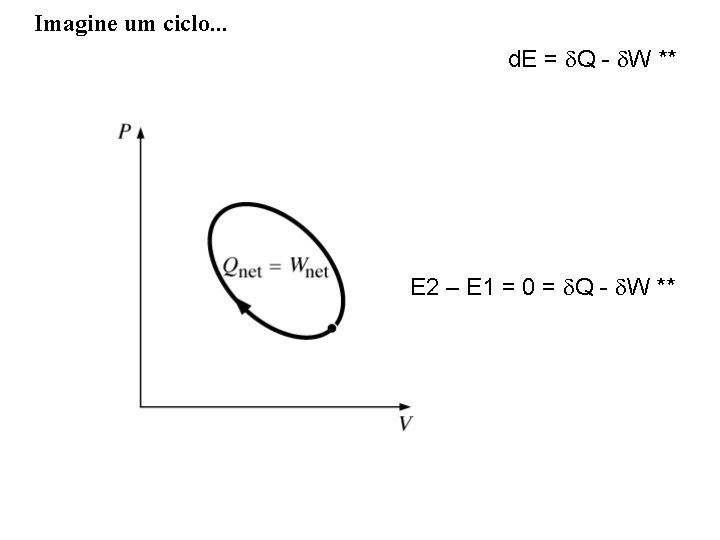
Imagine um ciclo. . . d. E = Q - W ** E 2 – E 1 = 0 = Q - W **

Você NUNCAAAAA GANHA no máximo EMPATA d. E = Q - W ** No máximo Q = W considere ciclo E 2 = E 1 Q W **considere massa fixa Princípio da conservação de energia – 1 a Lei da Termodinâmica

Observe que • A conversão de todo o Calor em Trabalho, VIOLA a Primeira Lei? d. E = Q - W NÃO, a 1ª Lei permite. Mas na prática existe alguma chance? A observação de que na prática é impossível esta conversão é a base da 2ª Lei

SEGUNDA LEI DA TERMODIN MICA A segunda lei define entropia, S, por: Onde dqreversível é o incremento de calor recebido em um processo reversível entre dois estados. A segunda lei também diz que para qualquer processo a soma das variações de entropia para o sistema mais as vizinhanças é igual ou maior que zero Igualdade somente existe em processo reversível (ideal)

2 a LEI DA TERMODIN MICA EMPATA quando chega no ZERO

3 a LEI DA TERMODIN MICA: 3 st LAW Impossível reduzir qualquer sistema à temperatura do zero absoluto mediante um número finito de operações. De acordo com esse princípio, também conhecido como teorema de Nernst, a entropia de todos os corpos tende a zero quando a temperatura tende ao zero absoluto. VC NUNCA chega no ZERO

• The 1 st law: ´´you cannot win´´ "You can't win. " Yes, this means your profit can't be greater than zero. You go to your friend's house to play poker, and when you go home that night, you can't end up with more money (energy) than you started with. • The 2 nd law: ´´you cannot break even´´ To "break even" means to go home after gambling with the same amount of money you had originally. Saying you can't break even means that you can't have zero profit. Entropy will increase, so the amount of energy available to do mechanical work must decrease. • The 3 rd law: you cannot get out of the game (what game? )

Exemplo 1 - Balanço de Energia • Se você já recebeu um tapa, provavelmente se lembra da sensação de ardência (queimação). Imagine se você tem a infelicidade de levar um tapa no rosto de uma pessoa raivosa; e que este cause um aumento de temperatura de 1, 8°C. Assuma que a massa da mão do seu agressor (a) seja de 1, 2 kg e que aproximadamente 0, 150 kg do tecido da sua face foi ferido. Estime a velocidade da mão exatamente antes do ataque. Considere o calor específico da sua pele igual a 3, 8 k. J/ kg °C. Análise profissional - não emocional Sistema ? Envolve massa entrando ou saindo? Energia cinética – sobe ou cai? Energia interna – sobe ou cai?
 Aeronutica
Aeronutica Aeronutica
Aeronutica Junta aeronautica civil
Junta aeronautica civil Temperatura y calor diferencia
Temperatura y calor diferencia Prp food safety
Prp food safety Prp network architecture
Prp network architecture Prp learning hub
Prp learning hub Prp coventry
Prp coventry Trio prp
Trio prp Negative feedback loop geography
Negative feedback loop geography Freeze-dried plasma
Freeze-dried plasma Manuel prp hazırlama
Manuel prp hazırlama Prp hair treatment islamabad
Prp hair treatment islamabad Pd5 inhibitörleri
Pd5 inhibitörleri Prp procurement
Prp procurement Injectie prp
Injectie prp Ssfa unicef
Ssfa unicef Engenharia de tráfego
Engenharia de tráfego Vidros termorrefletores
Vidros termorrefletores Unip engenharia mecatronica
Unip engenharia mecatronica Surgimento da engenharia moderna
Surgimento da engenharia moderna Engenharia de software
Engenharia de software Sistema auxiliares
Sistema auxiliares Engenharia software
Engenharia software Engenharia
Engenharia Ponto de fulgor combustão e ignição
Ponto de fulgor combustão e ignição Fluxo
Fluxo Friburgo
Friburgo Unip
Unip Engenharia elétrica unip
Engenharia elétrica unip Engenharia industrial madeireira ufpr
Engenharia industrial madeireira ufpr Engenharia
Engenharia Escola engenharia
Escola engenharia Modelo engenharia
Modelo engenharia Engenharia química unip
Engenharia química unip Engenharia de produção universo
Engenharia de produção universo Engenharia
Engenharia Qumica
Qumica Escola engenharia
Escola engenharia Densidade relativa
Densidade relativa Engenharia urbana ufrj
Engenharia urbana ufrj Engenharia reversa de software exe
Engenharia reversa de software exe Ufjf
Ufjf Escola de engenharia de lorena
Escola de engenharia de lorena Engenharia software
Engenharia software Unip engenharia quimica
Unip engenharia quimica Univag.com.br
Univag.com.br Modelo engenharia
Modelo engenharia Al-mg
Al-mg Engenharia de software
Engenharia de software Mba engenharia de software
Mba engenharia de software