UNIVERSIDADE PAULISTA UNIP ENGENHARIA QUIMICA BASICA Prof Dr

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA QUIMICA BASICA Prof. Dr. Fernando Cruz Barbieri S. J. dos Campos - Dutra

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA Funções Inorgânica Ácidos Bases Sais Óxidos Prof. Dr. Fernando Cruz Barbieri S. J. dos Campos - Dutra

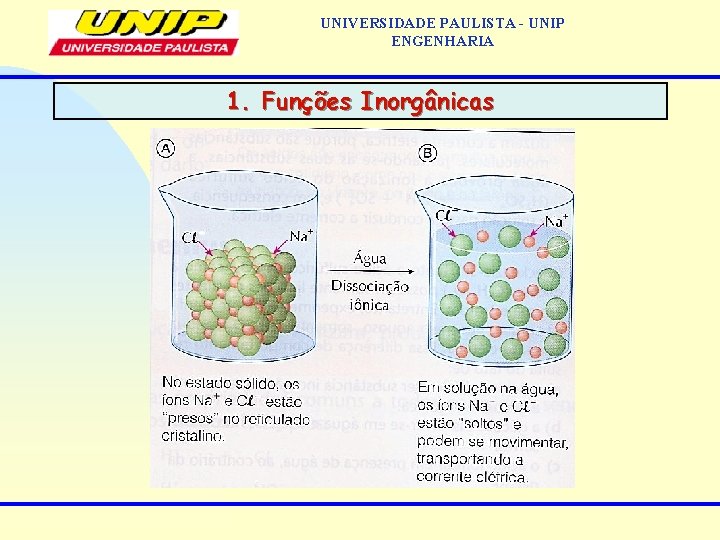
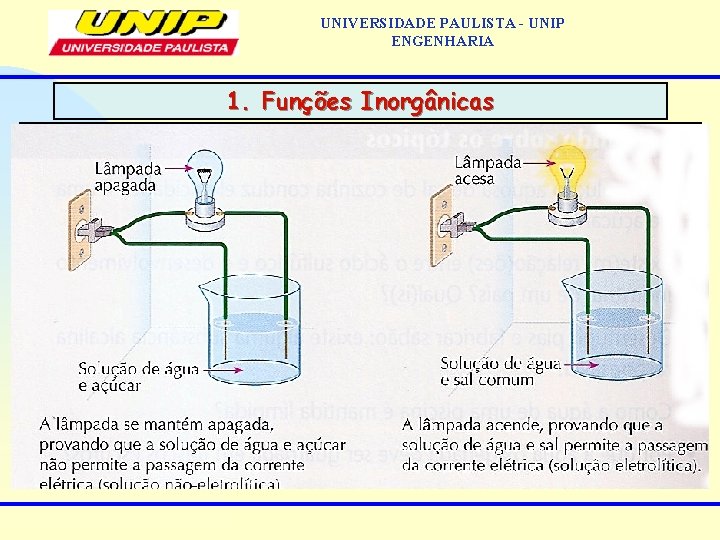
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA • 1. Funções Inorgânicas É um conjunto de substâncias com propriedades químicas semelhantes, denominadas propriedades funcionais; • Eletrólitos: são substâncias que, quando dissolvidas em água, conduzem a corrente elétrica; • Não eletrólitos: não conduzem a corrente elétrica; • O químico Arrhenius, em 1889, sugeriu em sua teoria que os eletrólitos, em solução, se dissociariam em duas partes (íons): uma positiva e outra negativa. Isso explicaria a condução de corrente elétrica por estas soluções; • Na realidade, nos compostos iônicos, os íons já se encontram presentes. A água, neste caso, somente separa (dissociação) os íons já existentes;
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 1. Funções Inorgânicas
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 1. Funções Inorgânicas

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA • Nos 1. Funções Inorgânicas compostos covalentes que são eletrólitos, a água cria condições para que os íons sejam formados e separados. Este processo recebe o nome de ionização: ionização HCl = H+ + Cldissociação Na+Cl- = Na+ + Cl- • Seguindo critério baseado na dissociação/ionização, Arrhenius propôs a Teoria da Dissociação Eletrolítica, onde divide as substâncias em grupos com características químicas distintas: ácidos bases sais óxidos
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA Funções Inorgânica Ácidos

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 2. Definição de ácidos • Segundo Arrhenius, ácidos são substâncias que, quando em solução aquosa, se dissociam, originando exclusivamente H+ como íons positivos. 2. 1 Classificação de ácidos • Presença ou não de oxigênio Oxiácidos: presença de oxigênio na molécula. Exemplos: H 2 SO 4 , HNO 3 Hidrácidos: oxigênio não presente na molécula. Exemplos: HCl, HCN

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 2. 1 Classificação de ácidos • Número de elementos químicos que formam a molécula Ácido binário: formado por dois elementos químicos diferentes. HCl, H 2 S, HI Ácido ternário: formado por três elementos químicos diferentes. H 2 SO 4, HCN, H 4 P 2 O 7 (pirofosfórico/0 Ácidos quaternário: formado por quatro elementos químicos diferentes. HNCO, HSCN (ricinoléico, tiociânico)

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 2. 1 Classificação de ácidos • Número de hidrogênio ionizáveis Monoácidos: presença de 1 H ionizável. HCl = H+ + Cl. Diácidos: presença de 2 H ionizáveis. H 2 SO 4 = 2 H+ + SO 42 Triácidos: presença de 3 H ionizáveis. H 3 PO 4 = 3 H+ + PO 43 Tetrácidos: presença de 4 H ionizáveis. H 4 P 2 O 4 = 4 H+ + P 2 O 44 -
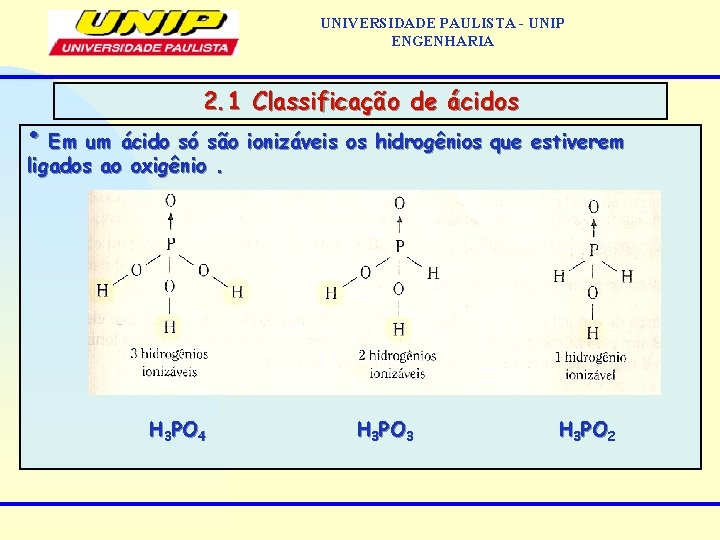
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 2. 1 Classificação de ácidos • Em um ácido só são ionizáveis os hidrogênios que estiverem ligados ao oxigênio. H 3 PO 4 H 3 PO 3 H 3 PO 2

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA • Volatilidade 2. 1 Classificação de ácidos Voláteis: são gasosos ou líquidos e com baixo ponto de ebulição: HNO 3 , HCl e H 2 S Fixos: muito pouco voláteis, somente H 2 SO 4 e H 3 PO 4

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 2. 1 Classificação de ácidos • Grau de ionização • Representado pela letra grega alfa ( ), o grau de ionização é a relação entre a quantidade de moléculas dissociadas e o total de moléculas dissolvidas. Quanto maior o valor de alfa, mais alta a tendência do ácido a se dissociar: alfa (%) = (nº moléculas ionizadas / nº moléculas dissolvidas) x 100 ácidos fortes (alfa maior que 50%): HI, HBr, HCl, HNO 3, H 2 SO 4. ácidos médios (alfa entre 5 e 50%): H 2 SO 3, H 3 PO 4, HF. ácidos fracos (alfa menor que 5%): H 2 S, H 3 BO 3, HCN. ácidos orgânicos.
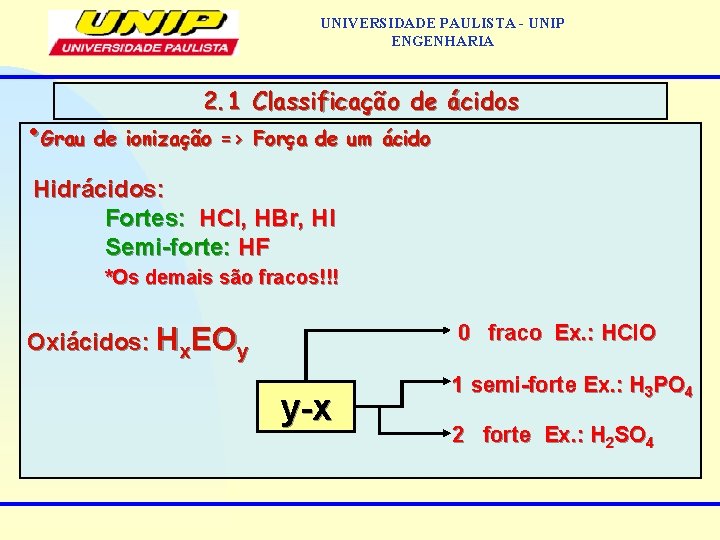
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 2. 1 Classificação de ácidos • Grau de ionização => Força de um ácido Hidrácidos: Fortes: HCl, HBr, HI Semi-forte: HF *Os demais são fracos!!! 0 fraco Ex. : HCl. O Oxiácidos: Hx. EOy y-x 1 semi-forte Ex. : H 3 PO 4 2 forte Ex. : H 2 SO 4
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 2. 1 Classificação de ácidos

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 2. 2 Formulações sobre os ácidos Juntam-se tantos H+ quantos forem necessários para neutralizar a carga do ânion. Para um ânion com carga x-, e utiliza-se x hidrogênio para formular o ácido. Hx Ax. Exemplos: NO 31 - HNO 3 SO 42 - H 2 SO 4 PO 43 - H 3 PO 4 x H A y
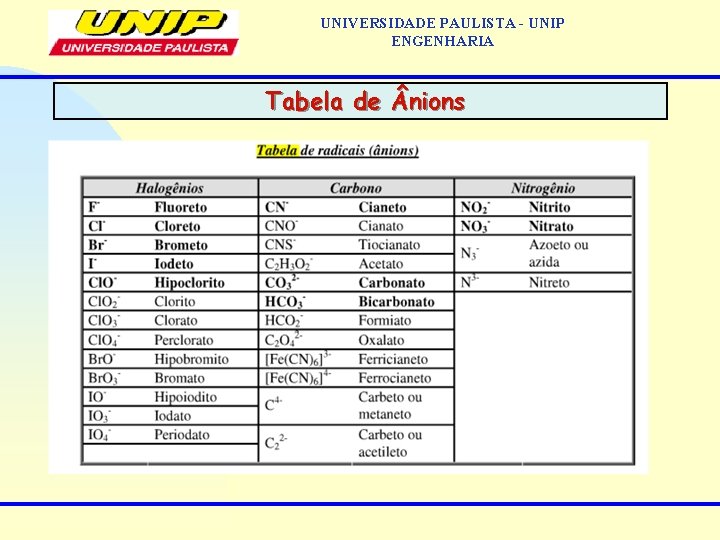
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA Tabela de nions
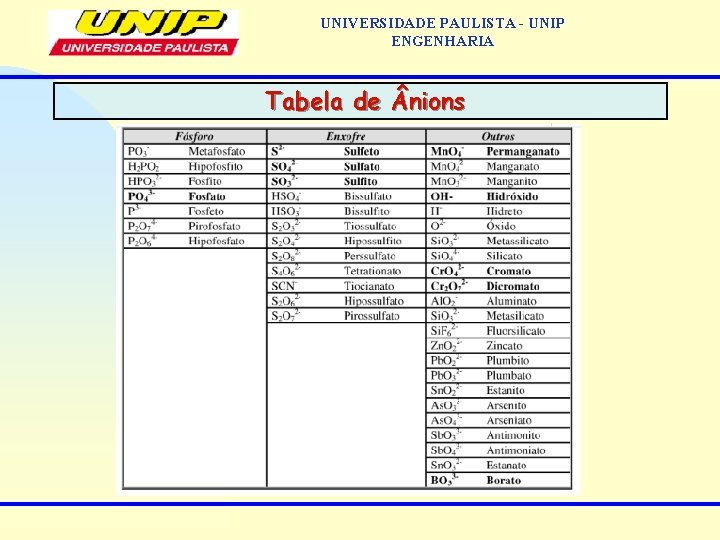
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA Tabela de nions

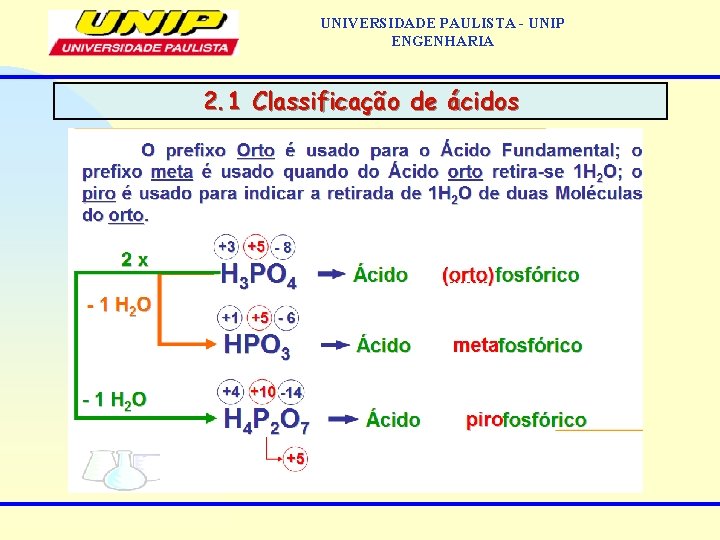
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA • 2. 3 Nomenclatura dos ácidos Hidrácidos: o nome é feito com a terminação ídrico Ácido nome do anion ídrico Ex: HCl: ácido clorídrico; HI: ácido iodídrico • Oxiácidos: quando apresenta apenas a formação de um oxiáxido e sua terminação é ico Ácido nome do anion ico Ex: H 2 CO 3: ácido carbônico; H 3 BO 3: ácido bórico Quando apresenta a formação de 2 oxiácidos e sua terminação é ico Ácido nome do anion Ex: HNO 3: ácido nítrico; HNO 2: ácido nitroso ico oso maior nox menor nox
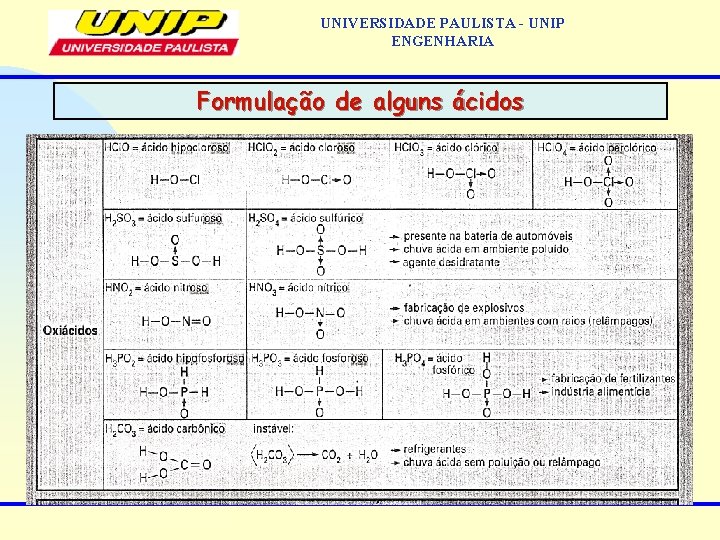
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA Formulação de alguns ácidos

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA Funções Inorgânica Bases

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 3. Definição de bases • Segundo Arrhenius, bases são substâncias que, quando em solução aquosa, se dissociam, originando como único íon negativo OH -. • Número de OH 3. 1 Classificação das bases - presente na fórmula monobase: 1 OH-, Na. OH, KOH dibase: 2 OH- , Ba(OH)2, Fe(OH)2 tribase: 3 OH- , Cr(OH)3, Al(OH)3 tetrabase: 4 OH- , Pb(OH)4, Sn(OH)4
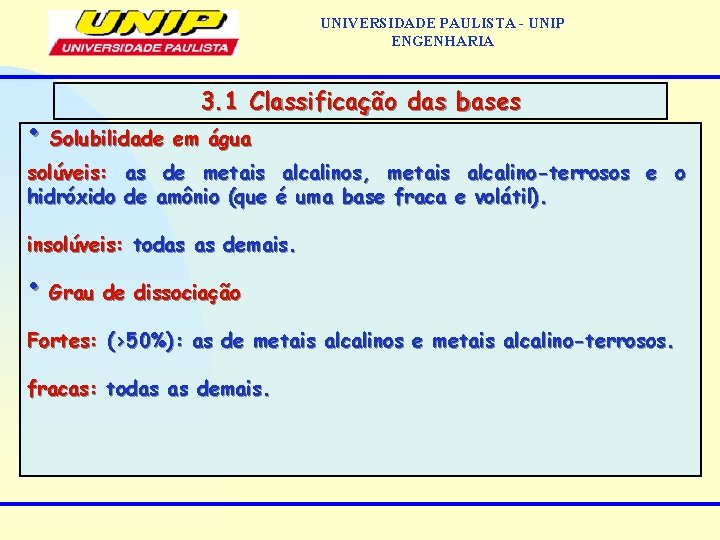
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 3. 1 Classificação das bases • Solubilidade em água solúveis: as de metais alcalinos, metais alcalino-terrosos e o hidróxido de amônio (que é uma base fraca e volátil). insolúveis: todas as demais. • Grau de dissociação Fortes: (>50%): as de metais alcalinos e metais alcalino-terrosos. fracas: todas as demais.
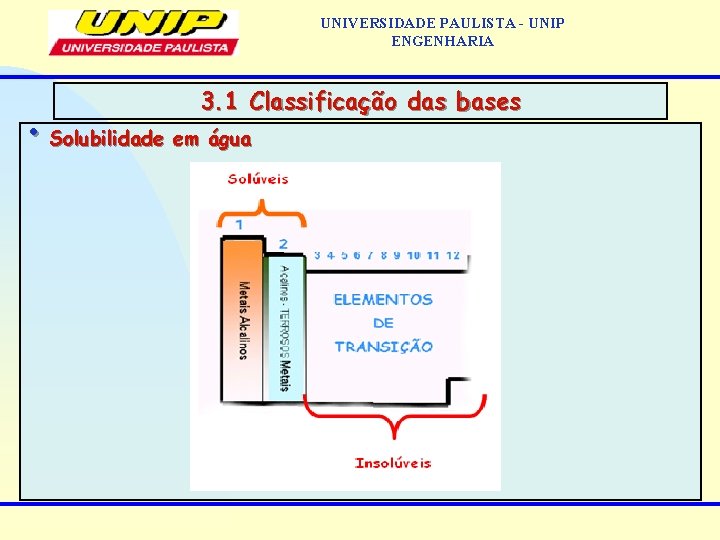
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 3. 1 Classificação das bases • Solubilidade em água
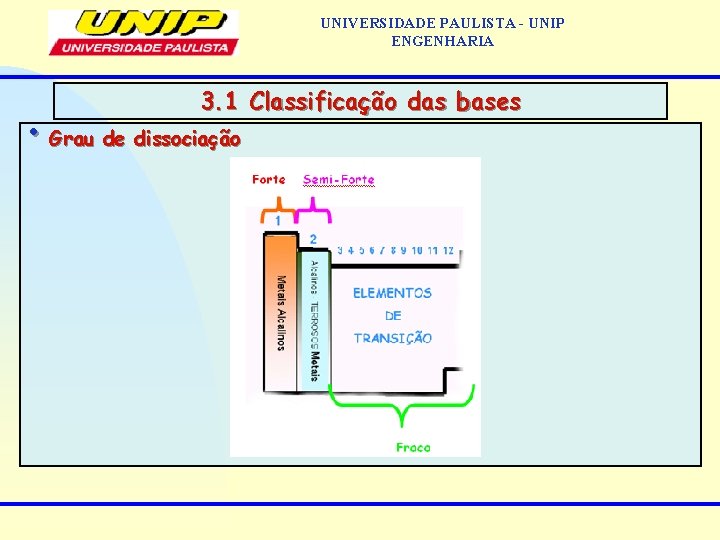
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 3. 1 Classificação das bases • Grau de dissociação
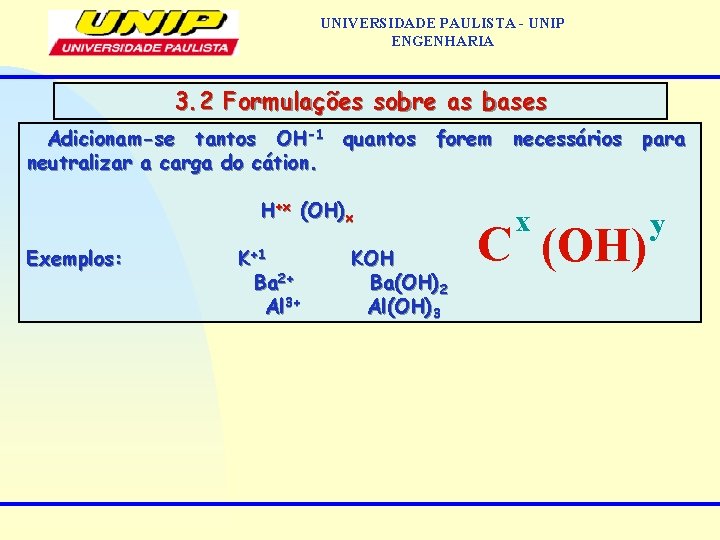
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 3. 2 Formulações sobre as bases Adicionam-se tantos OH-1 quantos forem necessários para neutralizar a carga do cátion. H+x (OH)x Exemplos: K+1 KOH Ba 2+ Ba(OH)2 Al 3+ Al(OH)3 x C (OH) y

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 3. 3 Nomenclatura das bases a) Quando o elemento forma apenas uma base Hidróxido de nome do elemento Ex: Na. OH: hidróxido de sódio; b) Quando o elemento forma duas bases Hidróxido de nome do elemento ico maior nox oso menor nox Ex: Fe(OH)3: hidróxido férrico; ou hidróxido de ferro III Fe(OH)2: hidróxido ferroso; ou hidróxido de ferro II

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA Tabela de Cátions

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA Funções Inorgânica Sais

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 4. Definição de sais • Segundo Arrhenius, sais são substâncias que, quando em solução aquosa, liberam: pelo menos um íon positvo diferente do H+ e pelo menos um íon negativo diferente do OH-: Ca. Cl 2 = Ca 2+ + 2 Cl 1 Na 2 SO 4= 2 Na 1+ + SO 42 Como os sais são provenientes de reações de neutralização entre ácidos e bases, o ânion se origina do ácido e o cátion da base. ÁCIDO + BASE = SAL + ÁGUA
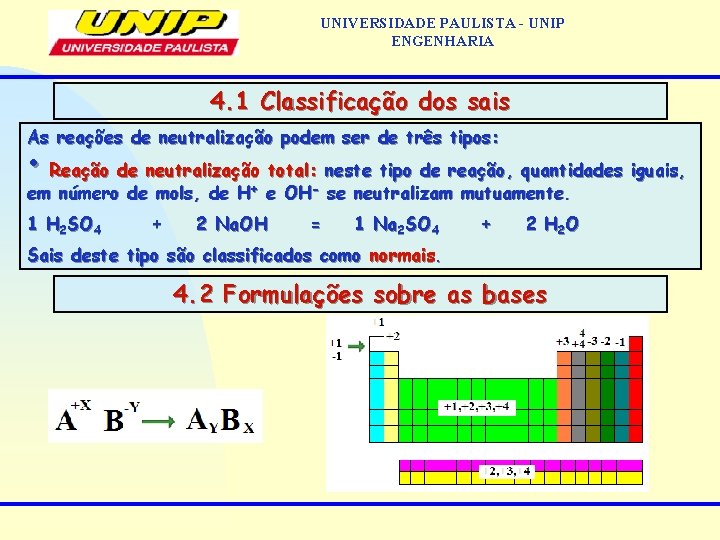
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 4. 1 Classificação dos sais As reações de neutralização podem ser de três tipos: • Reação de neutralização total: neste tipo de reação, quantidades iguais, em número de mols, de H+ e OH- se neutralizam mutuamente. 1 H 2 SO 4 + 2 Na. OH = 1 Na 2 SO 4 + 2 H 2 O Sais deste tipo são classificados como normais. 4. 2 Formulações sobre as bases

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 4. 1 Classificação dos sais As reações de neutralização podem ser de três tipos: • Reação de neutralização total: neste tipo de reação, quantidades iguais, em número de mols, de H+ e OH- se neutralizam mutuamente. 1 H 2 SO 4 + 2 Na. OH = 1 Na 2 SO 4 + 2 H 2 O Sais deste tipo são classificados como normais. • Reação de neutralização parcial do ácido: 1 mol de H SO reagindo com 1 mol de Na. OH. Como o H 2 SO 4 possui 2 H+ em sua molécula, o sal produto o será ácido 2 4 1 H 2 SO 4 + 1 Na. OH = Na. HSO 4 + H 2 O Sais deste tipo são classificados como ácidos. • Reação de neutralização parcial da base: 1 mol de Ba(OH) reagindo com 1 mol de HCl. Como o Ba(OH)2 possui 2 OH 1 - em seu íon-fórmula, o sal produto será básico. 1 Ba(OH)2 + 1 HCl = 1 Ba(OH)Cl + 1 H 2 O 2 Sais deste tipo são classificados como básicos.

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 4. 2 Nomenclatura dos sais a) Sal normal ------------- de ---------- nome do ânion nome do cátion Segue-se a mesma regra das terminações usada nos ácidos. No caso de sais que na sua constituição possuam cátion que possam ter nóx diferentes, deve-se utilizar algarismos romanos para identificação. Fe(NO 3)2 nitrato de ferro II Fe(NO 3)3 nitrato de ferro III No caso de o cátion possuir somente dois nóx possíveis, pode-se também optar por utilizar os sulfixos oso e ico, respectivamente para o menor e maior nox. Fe(NO 3)2 nitrato ferroso Fe(NO 3)3 nitrato férrico

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 4. 2 Nomenclatura dos sais b) Sal ácido ------ + prefixo (mono, di, tri. . . ) ácido de ------- nome do ânion nome do cátion Segue-se a mesma regra das terminações usada nos ácidos. Ex: NH 4 H SO 4 = Sulfato monoácido de amônio Na H 2 PO 4 = Fosfato diácido de sódio c) Sal básico ------ + prefixo (mono, di, tri. . . ) básico de ------- nome do ânion nome do cátion Segue-se a mesma regra das terminações usada nos ácidos. Ex: Mg OH Cl = Cloreto monobásico de magnésio Ca OH 2 Cl = Cloreto dibásico de cálcio

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 4. 2 Nomenclatura dos sais d) Sal hidratado Nome do sal + prefixo para indicar o grau de hidratação + hidratado Ex: Ca. Cl 2. 2 H 2 O = Cloreto de cálcio dihidratado Na 2 B 4 O 7. 2 H 2 O = tetraborato de sódio decahidratado (bórax)
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA Funções Inorgânica Óxidos

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 5. Definição de óxidos • Óxido é todo composto binário, onde o oxigênio é o elemento mais eletronegativo; • Os óxidos podem ser iônicos ou moleculares; • Os óxidos iônicos são aqueles resultantes da união do oxigênio com um metal; • Os óxidos moleculares são aqueles resultantes da união do oxigênio com um não metal; • Os compostos binários de flúor e oxigênio, OF 2 e O 2 F 2, por exemplo, não são considerados óxidos, porque o flúor é mais eletronegativo que o oxigênio

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 5. 1 Nomenclatura dos óxidos a) Iônicos óxido de ______ nome do elemento + (carga do cátion em romanos) A carga do cátion em algarismos romanos é dispensável se o mesmo apresentar nóx fixo. Na 2 O óxido de sódio Cu 2 O óxido de cobre I Cu. O óxido de cobre II b) Moleculares Prefixos indicam as quantidades de átomos de oxigênio e não-metal contidos na fórmula. (mono ou di ou tri. . . ) óxido de (mono ou di ou tri. . . ) + nome do elemento O prefixo mono é somente opcional quando indicar a quantidade de átomos do não metal. CO monóxido de carbono; CO 2 dióxido de carbono N 2 O monóxido de dinitrogênio; N 2 O 5 pentóxido de dinitrogênio

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA • • 5. 2 Classificação dos óxidos Óxidos básicos: apresentam caráter iônico, em que o metal irá apresentar carga +1, +2, +3. Resultantes da união do oxigênio com metais alcalinos e alcalinoterrosos. Reagem com água, originando base. Na 2 O + H 2 O = Ba. O + H 2 O = 2 Na. OH Ba(OH)2 Reagem com ácido, originando sal e água: Na 2 O + 2 HCl = 2 Na. Cl + H 2 O Ba. O + 2 HNO 3 = Ba(NO 3)2 + H 2 O

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA • • 5. 2 Classificação dos óxidos Óxidos ácidos: Apresentam caráter covalente, geralmente são formados por ametais. Originam-se da desidratação de ácidos. Por este motivo, possuem uma nomenclatura opcional especial que especifica o ácido de origem. H 2 CO 3 menos 1 H 2 O = CO 2 anidrido carbônico H 2 SO 4 menos 1 H 2 O = SO 3 anidrido sulfúrico Reagem com água, originando ácido. CO 2 + H 2 O = H 2 CO 3 SO 3 + H 2 O = H 2 SO 4 Reagem com base, originando sal e água. SO 3 + 2 Na. OH = Na 2 SO 4 + H 2 O
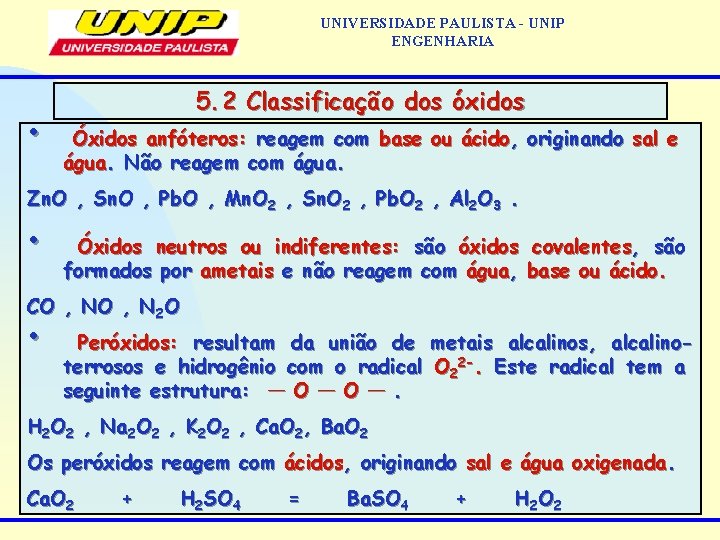
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA • 5. 2 Classificação dos óxidos Óxidos anfóteros: reagem com base ou ácido, originando sal e água. Não reagem com água. Zn. O , Sn. O , Pb. O , Mn. O 2 , Sn. O 2 , Pb. O 2 , Al 2 O 3. • Óxidos neutros ou indiferentes: são óxidos covalentes, são formados por ametais e não reagem com água, base ou ácido. CO , N 2 O • Peróxidos: resultam da união de metais alcalinos, alcalinoterrosos e hidrogênio com o radical O 22 -. Este radical tem a seguinte estrutura: ¯¯ O ¯¯. H 2 O 2 , Na 2 O 2 , K 2 O 2 , Ca. O 2, Ba. O 2 Os peróxidos reagem com ácidos, originando sal e água oxigenada. Ca. O 2 + H 2 SO 4 = Ba. SO 4 + H 2 O 2
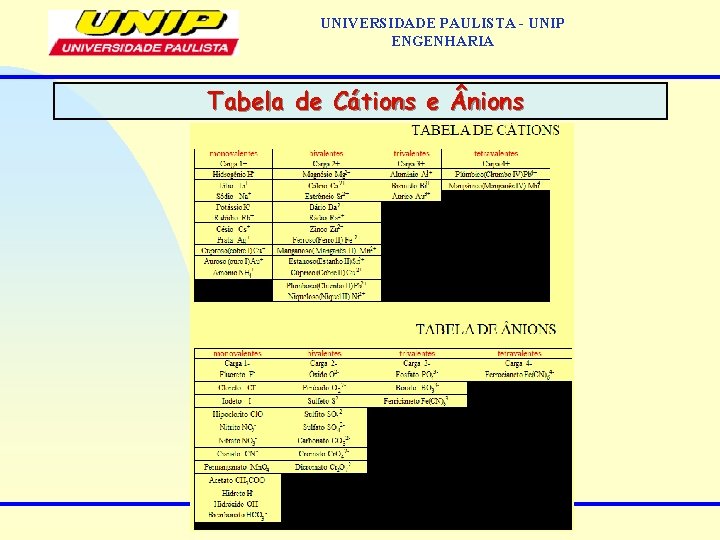
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA Tabela de Cátions e nions

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA Equações Químicas Equação quimica Oxirredução NOX Prof. Dr. Fernando Cruz Barbieri S. J. dos Campos - Dutra

Equações Químicas

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA Equações químicas 1 Equação química: A equação química é a forma de se descrever uma reação química que envolve os reagentes e produtos. Representação de uma Equação Química: Reagentes → Produtos 1 H 2 + ½ O 2 → 1 H 2 O 1. 1 Formulas: indicam quais são as substancias da reação química (H 2, O 2, H 2 O). 1. 2 Coeficientes: indica a proporção de moléculas que participam na reação (2, 1, 2).

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 1. Equações químicas Ca. O + H 2 O Ca(OH)2
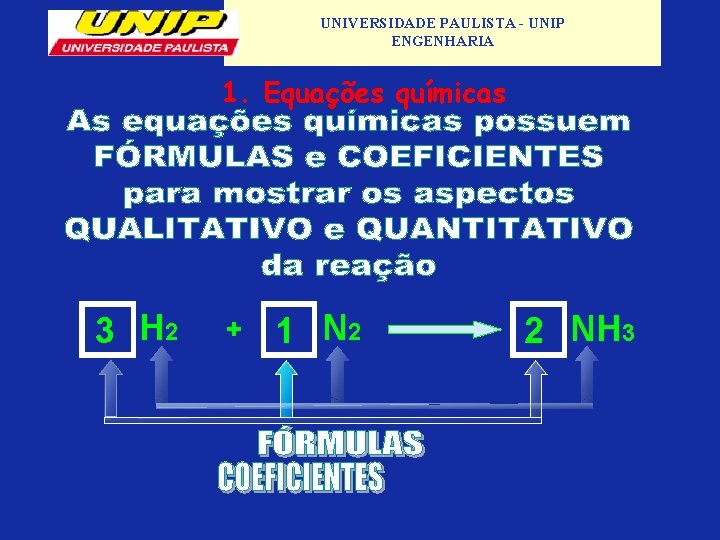
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 1. Equações químicas 3 H 2 + 1 N 2 2 NH 3
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 1. Equações químicas 3 H 2 1 N 2 + + 2 NH 3

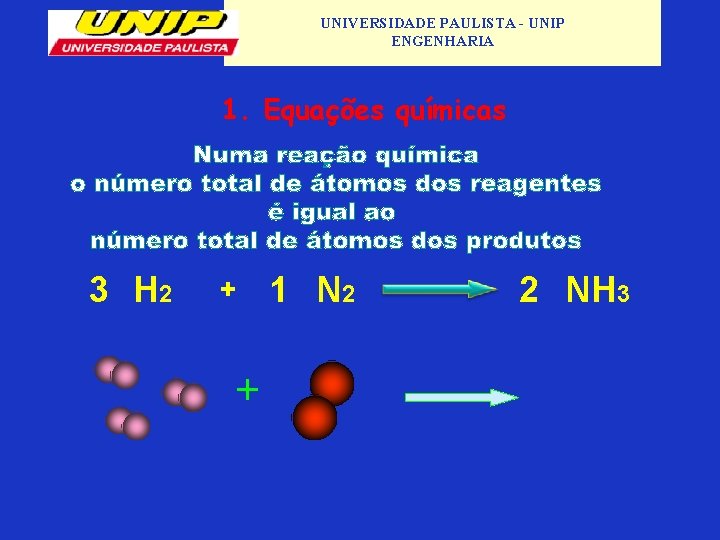
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 1. Equações químicas • Símbolos e números são utilizados para descrever os nomes e as proporções das diferentes substâncias que entram nessas reações; • Os reagentes são mostrados no lado esquerdo da equação e os produtos no lado direito; • Não é criada e nem destruída matéria em uma reação, os átomos somente são reorganizados de forma diferente, por isso, uma equação química deve ser balanceada: o número de átomos da esquerda precisa ser igual o número de átomos da direita; Exemplo de uma Equação Química não equilibrada: H 2 + Cl 2 → HCl • Repare que a equação acima está desbalanceada, pois temos nos reagentes (H 2 e Cl 2) dois átomos de cada elemento, e no produto (HCl) somente uma molécula. Exemplo de uma Equação Química equilibrada: H 2 + Cl 2 → 2 HCl

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 1. Equações químicas • Pode-se saber praticamente tudo sobre uma reação química através de sua equação, ela pode oferecer, por exemplo, as seguintes informações através de símbolos tais como: Quando a reação é reversível: ↔ Presença de luz: λ Catalisadores ou aquecimento: ∆ Formação de um precipitado: ↓ • A Equação Química pode ainda demonstrar o estado físico do átomo participante da reação, através das letras respectivas entre parênteses: Gás (g) Vapor (v) Líquido (l) Sólido (s) Cristal (c) A presença de átomos, íons ou moléculas em solução aquosa é representada pela abreviatura: (aq)

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 1. Equações químicas Análise ou decomposição Uma única substância produz duas ou mais substância 2 H 20 (g) 2 H 2 (g) + O 2 (g) + (NH 4)2 Cr 2 O 7(s) N 2(g) + Cr 2 O 3(s) + 4 H 2 O(v)

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 1. Equações químicas Síntese ou adição Várias substância produzem uma única 3 H 2 1 N 2 + + 2 NH 3

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 1. Equações químicas Simples troca ou substituição Uma substância simples desloca parte da substância composta + Fe(s) + 2 HCl + (aq) H 2 (g) + Fe. Cl 2 (aq)
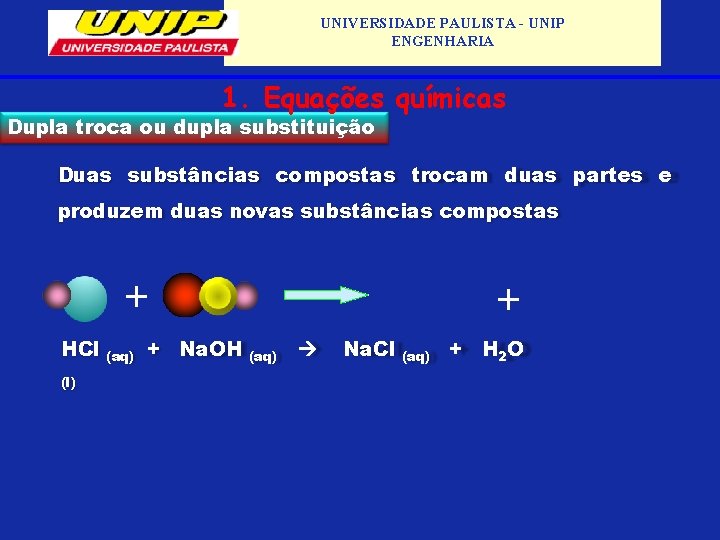
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA 1. Equações químicas Dupla troca ou dupla substituição Duas substâncias compostas trocam duas partes e produzem duas novas substâncias compostas + HCl (l) (aq) + Na. OH + (aq) Na. Cl (aq) + H 2 O

Oxidação NOX

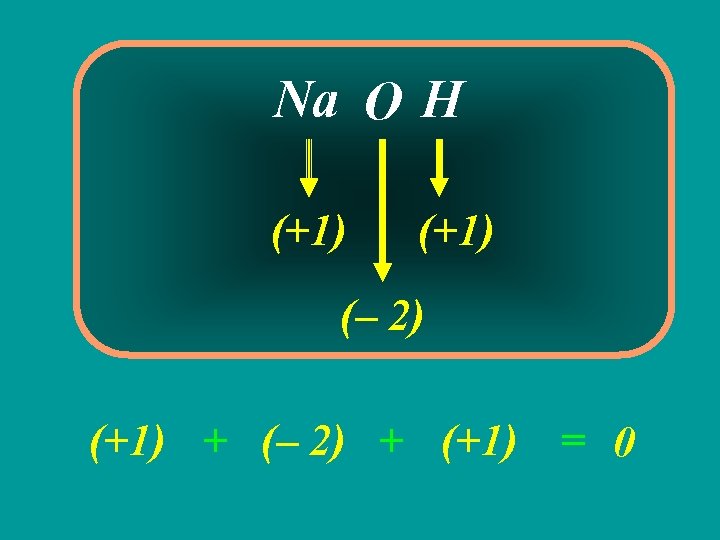
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA Reações de Oxirredução 2. Reação de Oxirredução Reação de oxirredução ou redox - Reação com transferência de elétrons de um reagente para outro, ou reação com variação de nox de pelo menos um elemento. Oxidação - Perda de elétrons ou aumento de nóx; Redução - Ganho de elétrons ou diminuição de nóx; 2. 1 Número de Oxidação (Nox) Chamamos de número de oxidação ou nóx a carga assumida por um átomo quando a ligação que o une a um outro é quebrada. Existem três casos a serem analisados com relação ao nóx de um elemento: composto iônico, covalente e substância simples;

UNIVERSIDADE PAULISTA - UNIP FARMÁCIA Número de Oxidação (Nox) • Num composto iônico, ou nóx é a própria carga do íon, pois quando a ligação se rompe, já ocorreu a transferência do elétron do átomo menos para o mais eletronegativo; • Na formação do Na. Cl, o Na passa de 11 para 10 elétrons e o Cl passa de 17 para 18 elétrons. O Na fica com carência de 1 elétron e assume a carga 1+, o Cl fica com excesso de um elétrons e assume a carga 1. Então, os nox do Na e do Cl, neste composto, serão respectivamente 1+ e 1 -;

UNIVERSIDADE PAULISTA - UNIP FARMÁCIA Número de Oxidação (Nox) • Num composto covalente assume-se que a mesma se quebra e que o par de elétrons fica com o átomo mais eletronegativo; • Na molécula de HCl, o átomo mais eletronegativo é o Cl e o menos é o H. O Cl adiciona um elétron à sua eletrosfera, enquanto o H perde um. Então, os nóx do Cl e do H serão, respectivamente, 1 - e 1+; • Em uma substância simples, os nóx de todos os átomos componentes é igual a zero, pois não é possível a existência de diferenças de eletronegatividade. Exemplos: S 8, H 2, O 2, P 4, Cgraf, Cdiam.
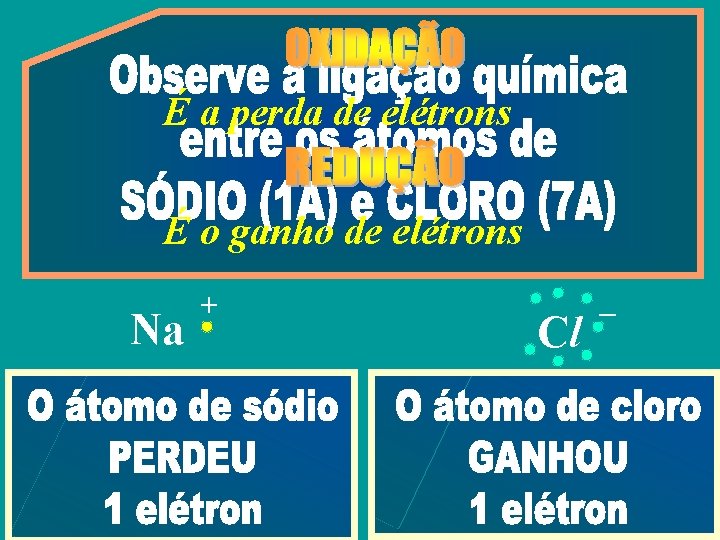
É a perda de elétrons É o ganho de elétrons Na + Cl –

É o número que mede Nox = + 1 Nox = – 1 a carga real ou aparente de uma espécie química Na + Cl –
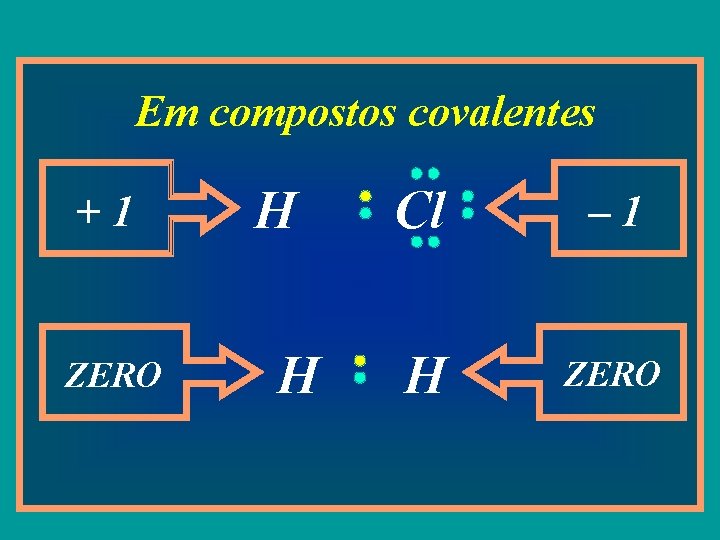
Em compostos covalentes +1 ZERO H H Cl – 1 H ZERO

É a perda de elétrons ou aumento do Nox É o ganho de elétrons ou diminuição do Nox

1ª REGRA Todo átomo em uma substância simples possui Nox igual a ZERO He H P 42 Nox = 0

2ª REGRA Alguns átomos em uma substância composta possui Nox CONSTANTE
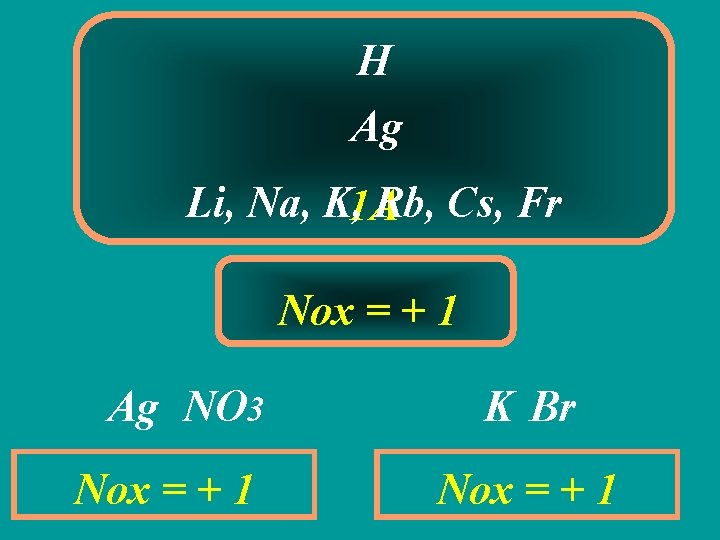
H Ag Li, Na, K, 1 A Rb, Cs, Fr Nox = + 1 Ag NO 3 Nox = + 1 K Br Nox = + 1
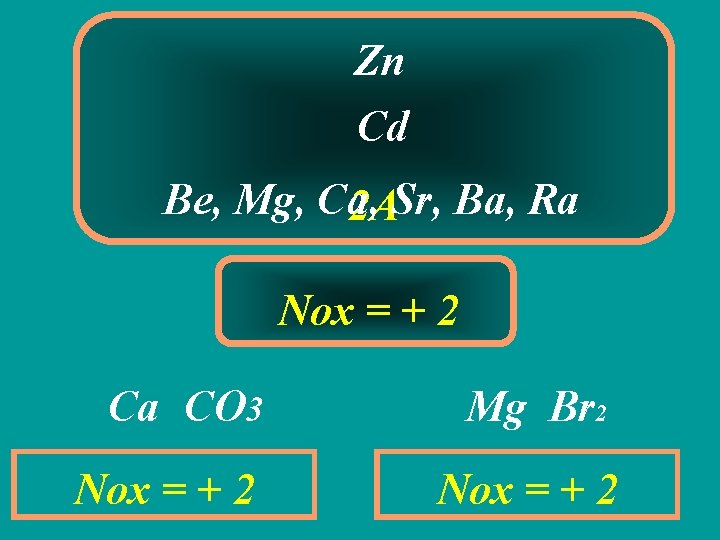
Zn Cd Be, Mg, Ca, 2 ASr, Ba, Ra Nox = + 2 Ca CO 3 Mg Br 2 Nox = + 2

Al Nox = + 3 Al 2 O 3 Al Br 3 Nox = + 3

calcogênios (O, S, Se, Te, Po) quando for o mais eletronegativo (no final da fórmula) Nox = – 2 Al 2 O 3 Nox = – 2 H 2 S Nox = – 2

Halogênios (F, Cl, Br, I, At) quando for o mais eletronegativo (no final da fórmula) Nox = – 1 Al Cl 3 Nox = – 1 HF Nox = – 1

3ª REGRA A soma algébrica do Nox de todos os átomos em uma substância composta É igual a ZERO

Ba 2 As 2 O 7 (+2) x (– 2) 2. (+2) + 2. x + 7. (– 2) = 0 4 + 2. x – 14 = 0 10 2. x = 10 14 – 4 x = 2 = +5



4ª REGRA A soma algébrica do Nox de todos os átomos em um íon é igual à CARGA DO ÍON
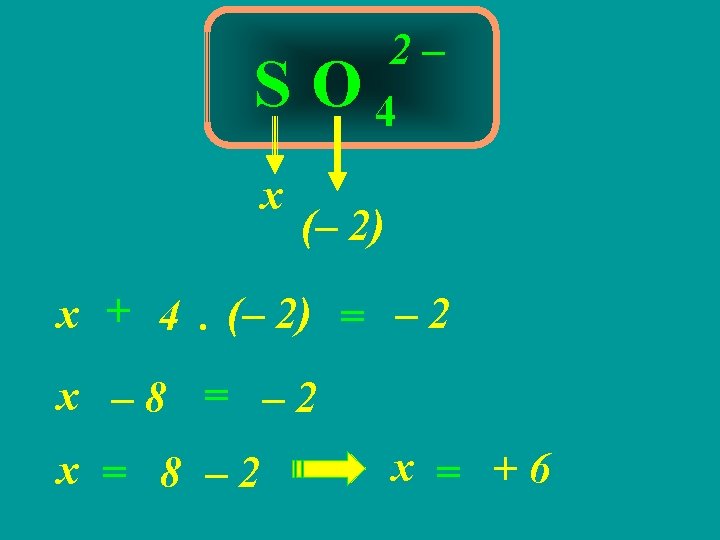
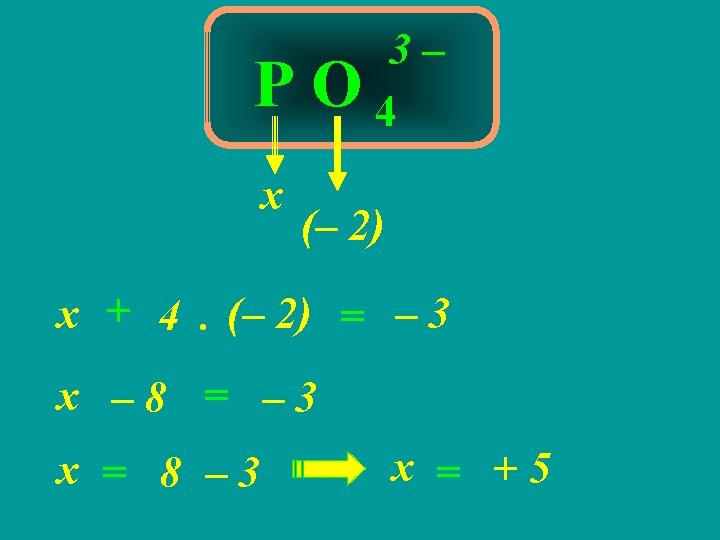
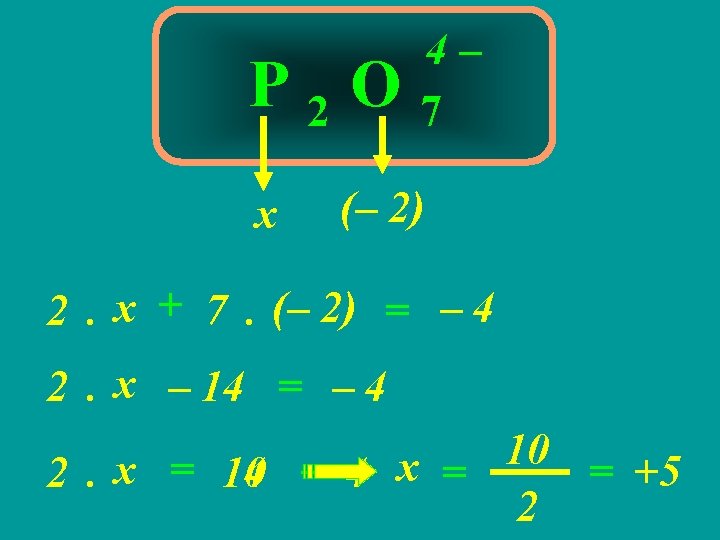

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA Balanceamento por tentativa Prof. Dr. Fernando Cruz Barbieri S. J. dos Campos - Dutra

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA

BALANCEAMENTO DE EQUAÇÕES QUÍMICAS MÉTODO DAS TENTATIVAS 4 Al + ____ 3 O 2 ___ 2 Al 2 O 3 ___ a) Raciocinar, inicialmente, com os elementos que apareçam em uma única substância em cada membro da equação. Al e O b) Se vários elementos satisfazem a condição anterior, escolha de preferência aquele possua maiores índices. O 2 e 3 c) Escolhido o elemento, inverter seus índices do 1º para o 2º membro da equação, e vice-versa, usando-os como coeficientes. d) Com esses dois coeficientes, acerte os demais; continue somente com os elementos que já possuem coeficientes em um dos membros

1 Al 2(CO 3)3 ____ 1 Al 2 O 3 + ____ 3 CO 2 a) Raciocinar, inicialmente, com os elementos que apareçam em uma única substância em cada membro da equação. Al e C b) Se vários elementos satisfazem a condição anterior, escolha de preferência aquele possua maiores índices. C 3 e 1 c) Escolhido o elemento, inverter seus índices do 1º para o 2º membro da equação, e vice-versa, usando-os como coeficientes. d) Com esses dois coeficientes, acerte os demais; continue somente com os elementos que já possuem coeficientes em um dos membros

01) Ao efetuarmos o balanceamento da equação da reação 1 H 2 S + 4 Br 2 + 4 H 2 O 1 H 2 SO 4 + 8 HBr podemos observar que a soma de seus menores coeficientes é: a) 10. b) 12. c) 14. d) 15. e) 18. 1 + 4 + 1 + 8 = 18

02) Acertando os coeficientes estequiométricos da reação abaixo com os menores números inteiros possíveis, teremos como soma de todos os coeficientes: 2 KMn. O 4 + 16 1 8 HCl a) 25. b) 30. c) 35. d) 40. e) 42. 2 1 KCl + 12 Mn. Cl 2 + 8 4 H 2 O + 5/2 5 Cl 2 2 + 16 + 2 + 8 + 5 = 35

03) Os coeficientes estequiométricos do ácido e da base, respectivamente, na reação abaixo balanceada com os menores valores inteiros possíveis são: 4 Al(OH)3 + 3 H 4 Si. O 4 1 Al 4(Si. O 4)3 + 12 H 2 O base a) 4 e 3. ácido b) 3 e 4. H 4 Si. O 4 Al(OH)3 3 4 c) 1 e 12. d) 12 e 1. e) 3 e 1.

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA Quantidade e medida Mol Prof. Dr. Fernando Cruz Barbieri S. J. dos Campos - Dutra

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA Mol Como é possível contar as partículas de matéria (Átomos, moléculas, íons. . . )? Se são muito pequenas, para agrupá-las é necessário definir uma “porção” que contenha um número muito grande de partículas. A GRANDEZA que agrupa um número definido de partículas é a QUANTIDADE DE MATÉRIA (n), cuja unidade é o mol. A quantidade de matéria representa o número de mol de uma amostra de substância. Qual o “tamanho” (quantidade) de 1 mol? 1 mol é igual a 6, 02 x 1023 partículas = 602 000 000 partículas

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA Mol (quantidade de matéria): origina-se do latim monte e pilha; • Por definição é quantidade de matéria de um sistema que contém tantas entidades elementares (partículas = átomos, moléculas, íons, elétrons entre outras partículas) quantos átomos existentes em um elemento químico. Como é possível medir o mol? Não existe nenhum instrumento que faça medidas em número de mol! Assim, foi necessário relacionar QUANTIDADE DE MATÉRIA (número de mol – n) com MASSA (em gramas – g), originando o conceito de MASSA MOLAR.

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA Mol EXEMPLO: APRESENTE a quantidade das seguintes medidas: 12 laranjas a) 1 dúzia de laranjas = ____ 20 b) 2 dezenas de pares de tênis = _____ pares de tênis = 40 _____ pés de tênis 50 centímetros = ____ 500 milímetros c) 0, 5 metro = _______ d) Então, 1 mol de estrelas = _________________ 602 000 000 estrelas TODAS ESSAS RELAÇÕES REPRESENTAM PROPORCIONALIDADE!

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA Mol • Por definição é quantidade de matéria de um sistema que contém tantas entidades elementares (partículas = átomos, moléculas, íons, elétrons entre outras partículas) quantos átomos existentes em um elemento químico. Onde m é a massa em gramas e M. M é a massa molar em g/mol. Ex: 3, 45 g de Na n = 3, 45 g / 23 [g/mol] = 0, 15 mols 4, 90 g d H 2 SO 4 n = 4, 90 g / 2+32+64 [g/mol] = 0, 05 mols

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA Mol Numero de Avogrado: é o numero de átomos (ou moléculas) existentes em um átomo-grama (ou molécula-grama) de qualquer elemento químico. Ligando então, o conceito de mol ao numero de Avogrado, podemos dizer: 1 mol 6, 02 x 1023 partículas; 1 mol de de moléculas 6, 02 x 1023 moléculas 1 molécula-grama; átomos 6, 02 x 1023 átomos 1 átomo-grama íons 6, 02 x 1023 íons 1 íons-grama; elétrons 6, 02 x 1023 elétrons 1 elétrons-grama. Átomo-grama: é massa em gramas de um elemento químico cujo valor numérico coincide com sua massa atômica. Molécula-grama: é a massa em grama de uma substancia química cujo valor numérico também coincide com sua massa molecular.
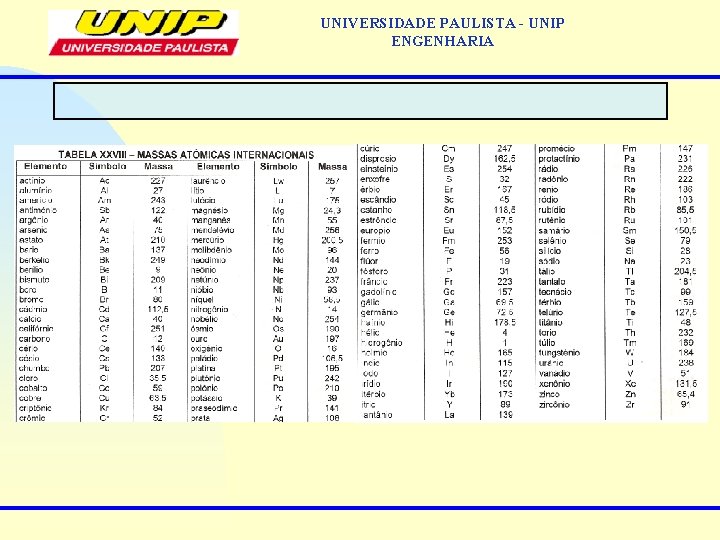
UNIVERSIDADE PAULISTA - UNIP ENGENHARIA

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA Calculo Estequiometrico Prof. Dr. Fernando Cruz Barbieri S. J. dos Campos - Dutra

UNIVERSIDADE PAULISTA - UNIP FARMÁCIA E BIOQUÍMICA Cálculo Estequiométrico 1 Definição: É calculo das quantidades de reagentes e/ou produtos das reações químicas feitos com base nas LEIS DAS REAÇÕES e executado, em geral, com o auxilio das equações químicas correspondentes. • Essas leis baseadas são: (lei da conservação da massa, Leis proporções fixas, Leis das proporções múltiplas). 2 Regra fundamental: • Escrever a equação química mencionada no problema; • Acertar os coeficientes dessa equação (lembre-se de que os coeficientes indicam a proporção em números de mols existentes entre os participantes da reação (balanceamento); • Estabelecer uma regra de três entre o dado e a pergunta do problema, obedecendo aos coeficientes da equação, que poderá ser escrita em massa, volume e ainda em números de mols.

UNIVERSIDADE PAULISTA - UNIP FARMÁCIA E BIOQUÍMICA
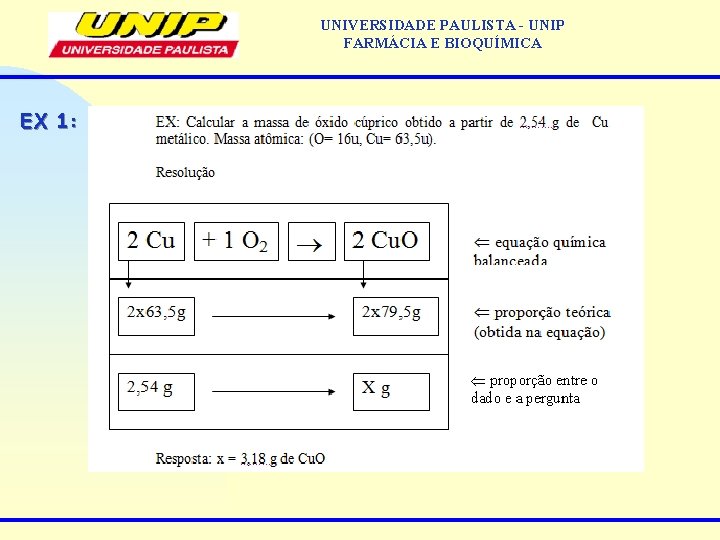
UNIVERSIDADE PAULISTA - UNIP FARMÁCIA E BIOQUÍMICA EX 1:
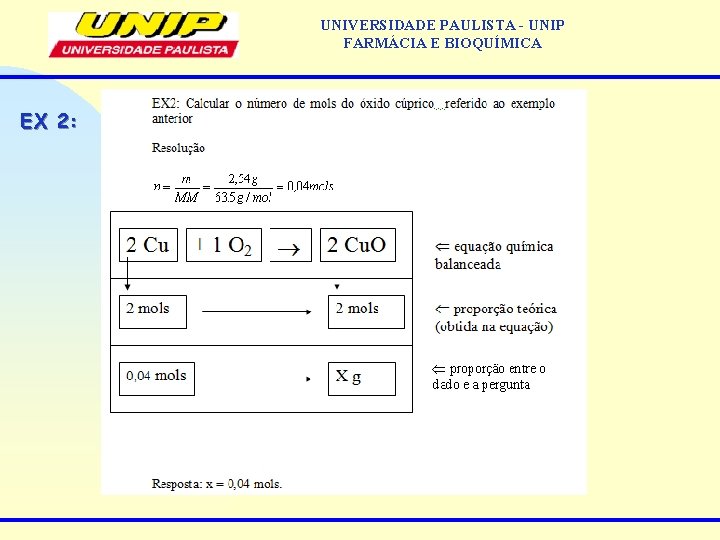
UNIVERSIDADE PAULISTA - UNIP FARMÁCIA E BIOQUÍMICA EX 2:

UNIVERSIDADE PAULISTA - UNIP FARMÁCIA E BIOQUÍMICA EX 3:
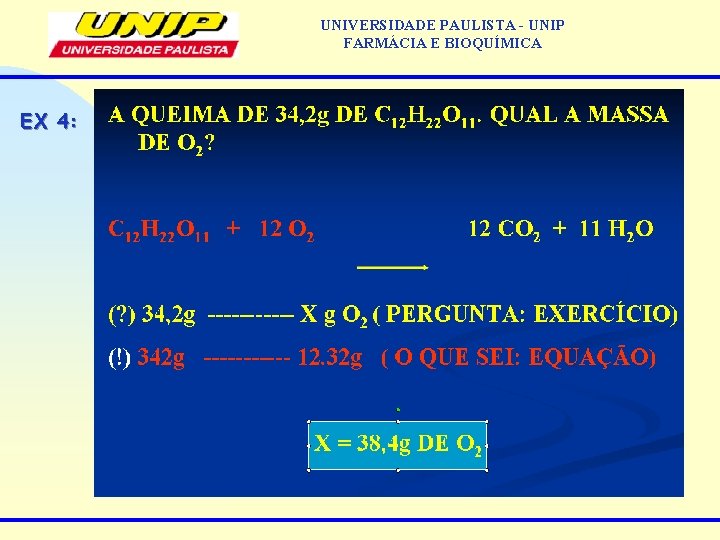
UNIVERSIDADE PAULISTA - UNIP FARMÁCIA E BIOQUÍMICA EX 4:

UNIVERSIDADE PAULISTA - UNIP FARMÁCIA E BIOQUÍMICA EX 5:

UNIVERSIDADE PAULISTA - UNIP FARMÁCIA E BIOQUÍMICA

UNIVERSIDADE PAULISTA - UNIP ENGENHARIA Provas Bimestrais P 2
- Slides: 102