DISOLUCIONES Unidad 3 2 Contenidos 1 1 Sistemas



























- Slides: 30

DISOLUCIONES Unidad 3

2 Contenidos (1) 1. - Sistemas materiales. 2. - Disoluciones. Clasificación. 3. - Concentración de una disolución 3. 1. En g/l (repaso). 3. 2. % en masa (repaso). 3. 3. % en masa/volumen. 3. 4. Molaridad. 3. 5. Fracción molar

3 Contenidos (2) 4. - Preparación de una disolución. 5. - Fenómeno de la disolución. 6. - Solubilidad. 7. - Propiedades coligativas de las disoluciones (cualitativamente).

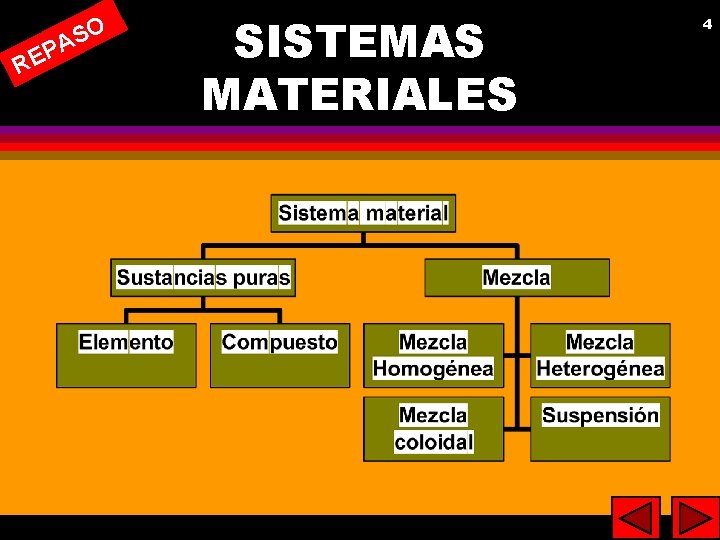
PA E R SO SISTEMAS MATERIALES 4

5 DISOLUCIÓN (Concepto) l l l Es una mezcla homogénea de dos o mas sustancias químicas tal que el tamaño molecular de la partículas sea inferior a 10 --9 m. Se llama mezcla coloidal cuando el tamaño de partícula va de 10 -9 m a 2 · 10 -7 m. Se llama suspensión cuando el tamaño de las partículas es del orden de 2 · 10 -7 m.

Componentes de una disolución l l Soluto (se encuentra en menor proporción). Disolvente (se encuentra en mayor proporción y es el medio de dispersión). 6

7 Clasificación de disoluciones l l Según el número de componentes. Según estado físico de soluto y disolvente. Según la proporción de los componentes. Según el carácter molecular de los componentes.

Según el número de componentes. l l l Binarias Ternarias. . 8

Según estado físico de soluto y disolvente. l Soluto • • • Gas Líquido Sólido Disolvente Ejemplo Gas Gas Líquido Sólido Aire Niebla Humo CO 2 en agua Petróleo Azúcar-agua H 2 -platino Hg - cobre Aleacciones 9

Según la proporción de los componentes. l Diluidas • (poca cantidad de soluto) l Concentradas • (bastante cantidad de soluto) l Saturadas • (no admiten mayor concentración de soluto) 10 10

11 11 Según el carácter molecular de los componentes. l Conductoras • Los solutos están ionizados (electrolitos) tales como disoluciones de ácidos, bases o sales, l No conductoras • El soluto no está ionizado

Concentración (formas de expresarla) l l l l gramos/litro Tanto por ciento en masavolumen. Molaridad. Normalidad (ya no se usa). Fracción molar. Molalidad. 12 12

SO PA E R l l Concentración en gramos/litro. Expresa la masa en gramos de soluto por cada litro de disolución. msoluto (g) conc. (g/l) = ———— Vdisolución (L) 13 13

SO PA E R l l Tanto por ciento en masa. Expresa la masa en gramos de soluto por cada 100 g de disolución. msoluto % masa = ————— · 100 msoluto + mdisolvente 14 14

Tanto por ciento en masa-volumen. l l Expresa la masa en gramos de soluto por cada 100 cm 3 de disolución. msoluto % masa/volumen = ——————— Vdisolución (dl) 15 15

Molaridad (M ). l l l Expresa el número de moles de soluto por cada litro de disolución. n msoluto Mo = ——————— V (l) Msoluto ·V (l) siendo V (l) el volumen de la disolución expresado en litros 16 16

Ejercicio: ¿ Cuál es la molaridad de la disolución obtenida al disolver 12 g de Na. Cl en agua destilada hasta obtener 250 ml de disolución? Expresado en moles, los 12 g de Na. Cl son: m 12 g n = = 0, 2 moles Na. Cl M 58, 44 g/mol La molaridad de la disolución es, pues: 0, 2 moles M = = 0, 8 M 0, 250 L 17 17

18 18 Relación entre M con % en masa y densidad de disolución Sabemos que: ms 100 ms % = —— · 100 = ———— mdn Vdn · ddn Despejando Vdn: 100 ms Vdn = ———— % · ddn Sustituyendo en la fórmula de la molaridad: ms ms · % · ddn Mo = —————— = ———— Ms · Vdn Ms · 100 ms 100 Ms

Ejercicio: ¿Cuál será la molaridad de una disolución de NH 3 al 15 % en masa y de densidad 920 kg/m 3? 920 kg/m 3 equivale a 920 g/L % · ddn 15 · 920 g · L-1 Mo = —————————-1 = 8, 11 M 100 Ms 100 · 17 g · mol 19 19

20 20 Riqueza ( ) l l l Las sustancias que se usan en el laboratorio suelen contener impurezas. Para preparar una disolución se necesita saber qué cantidad de soluto puro se añade. msustancia (pura) = —————— · 100 msustancia (comercial) De donde 100 msust. (comercial) = msust. (pura) · ——

Ejemplo: 21 21 ¿Como prepararías 100 ml de una disolución 0’ 15 M de Na. OH en agua a partir de Na. OH comercial del 95 % de riqueza? m = Molaridad · M(Na. OH) · V m = 0’ 15 mol/l · 40 g/mol · 0’ 1 l = = 0’ 60 g de Na. OH puro m. Na. OH 100 (comercial) = m. Na. OH (pura) · —— = 95 100 = 0’ 60 g · —— = 0’ 63 g Na. OH comercial 95

Ejercicio: Prepara 250 cm 3 de una disolución 22 22 de HCl 2 M, sabiendo que el frasco de HCl tiene las siguientes indicaciones: d=1’ 18 g/cm 3; riqueza = 35 % l l l m = Molaridad · M(HCl) · V m = 2 mol/l · 36’ 5 g/mol · 0’ 25 l = = 18’ 3 g de HCl puro que equivalen a 100 18’ 3 g ·—— = 52’ 3 g de HCl comercial 35 m 52’ 3 g V = ————— = 44’ 3 cm 3 d 1’ 18 g/cm 3

23 23 Fracción molar ( ) l l Expresa el cociente entre el nº de moles de un soluto en relación con el nº de moles total (soluto más disolvente). nsoluto = ————— nsoluto + ndisolvente Igualmente ndisolvente = ————— nsoluto + ndisolvente

24 24 Fracción molar ( ) (cont. ). l l nsoluto + ndisolvente soluto + disolvente = ————— = 1 nsoluto + ndisolvente Si hubiera más de un soluto siempre ocurrirá que la suma de todas las fracciones molares de todas las especies en disolución dará como resultado “ 1”.

Ejemplo: Calcular la fracción molar de CH 4 y 25 25 de C 2 H 6 en una mezcla de 4 g de CH 4 y 6 g de C 2 H 6 y comprobar que la suma de ambas es la unidad. 4 g 6 g n (CH 4) =———— = 0, 25 mol; n (C 2 H 6) =————= 0, 20 mol 16 g/mol 30 g/mol n (CH 4) 0, 25 mol (CH 4) = ————————— = 0, 56 n (CH 4) + n (C 2 H 6) 0, 25 mol + 0, 20 mol n (C 2 H 6) 0, 20 mol (C 2 H 6) = ————————— = 0, 44 n (CH 4) + n (C 2 H 6) 0, 25 mol + 0, 20 mol (CH 4) + (C 2 H 6) = 0, 56 + 0, 44 = 1

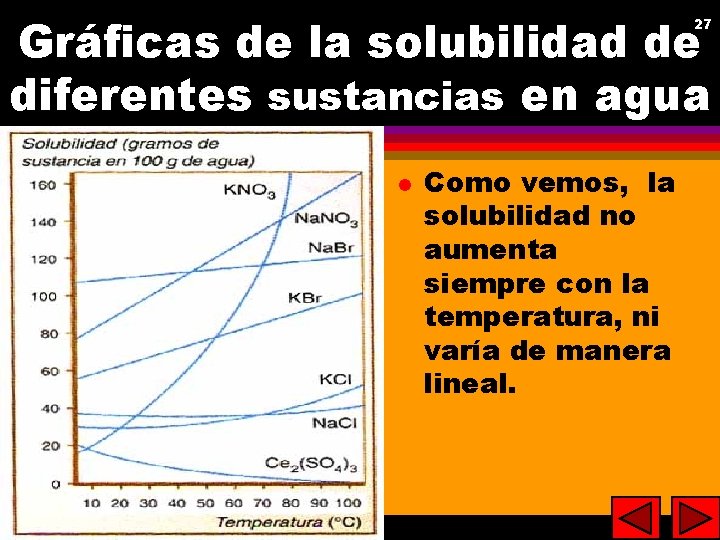
26 26 Solubilidad l l Es la máxima cantidad de soluto que se puede disolver en una determinada cantidad de disolvente (normalmente suelen tomarse 100 g). La solubilidad varía con la temperatura (curvas de solubilidad).

Gráficas de la solubilidad de diferentes sustancias en agua 27 27 l Como vemos, la solubilidad no aumenta siempre con la temperatura, ni varía de manera lineal.

28 28 Propiedades coligativas l l Las disoluciones tienen diferentes propiedades que los disolventes puros. Es lógico pensar que cuánto más concentradas estén las disoluciones mayor diferirán las propiedades de éstas de los disolventes puros.

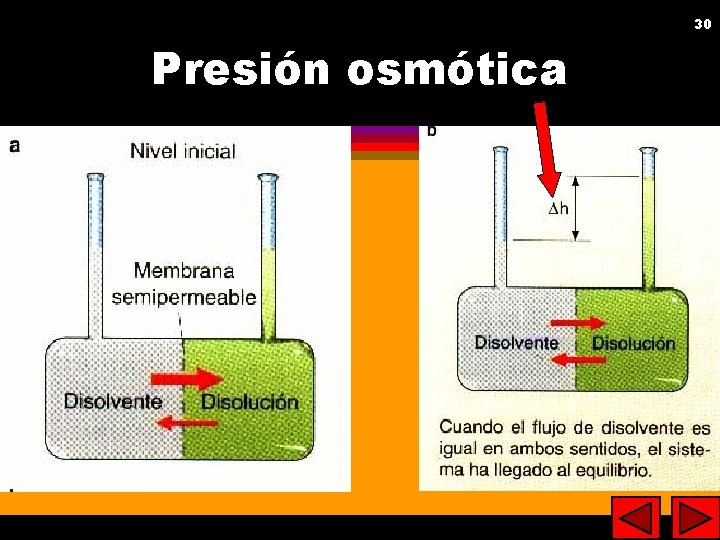
29 29 Propiedades coligativas l l Disminución de la presión de vapor. Aumento de temperatura de ebullición. Disminución de la temperatura de fusión. Presión osmótica (presión hidrostática necesaria para detener el flujo de disolvente puro a través de una membrana semipermeable).

30 30 Presión osmótica
 Unidades decenas centenas
Unidades decenas centenas Porcentaje de masa en volumen
Porcentaje de masa en volumen Solucion
Solucion Clasificacion de las disoluciones
Clasificacion de las disoluciones Disoluciones
Disoluciones Disoluciones ejemplos
Disoluciones ejemplos Disoluciones
Disoluciones Las mezclas son uniones
Las mezclas son uniones Tabla comparativa de disoluciones coloides y suspensiones
Tabla comparativa de disoluciones coloides y suspensiones Homogéneas
Homogéneas Disoluciones ejemplos
Disoluciones ejemplos Unidad 4 sistemas de ecuaciones diferenciales lineales
Unidad 4 sistemas de ecuaciones diferenciales lineales Propiedades del texto
Propiedades del texto Propositos de conocimiento del medio segundo grado
Propositos de conocimiento del medio segundo grado Contenidos factuales ejemplos
Contenidos factuales ejemplos Repaso de contenidos
Repaso de contenidos Introduccion de un trabajo
Introduccion de un trabajo Contenidos procedimentales y actitudinales
Contenidos procedimentales y actitudinales Contenidos
Contenidos Contenidos desarrollados
Contenidos desarrollados Integración y reelaboración de contenidos digitales
Integración y reelaboración de contenidos digitales Contenidos interdisciplinares
Contenidos interdisciplinares Contenidos procedimentales
Contenidos procedimentales Actitudinal ejemplos
Actitudinal ejemplos Secuenciación de contenidos
Secuenciación de contenidos Unidad educativa paccha
Unidad educativa paccha Ciencias naturales unidad 1
Ciencias naturales unidad 1 Que tipo de texto es la unidad
Que tipo de texto es la unidad Potencia promedio
Potencia promedio La unidad de carga eléctrica es:
La unidad de carga eléctrica es: Avancemos 3 unidad 1 leccion 1
Avancemos 3 unidad 1 leccion 1