DISOLUCIONES Unidad 3 2 Contenidos 1 1 Sistemas



























- Slides: 30

DISOLUCIONES Unidad 3

2 Contenidos (1) 1. - Sistemas materiales. 2. - Disoluciones. Clasificación. 3. - Concentración de una disolución 3. 1. 3. 2. En g/l (repaso). % en masa (repaso). 3. 3. % en masa/volumen. 3. 4. 3. 5. Molaridad. Fracción molar 2

3 3 Contenidos (2) 4. 5. 6. 7. - Preparación de una disolución. Fenómeno de la disolución. Solubilidad. Propiedades coligativas de las disoluciones (cualitativamente).

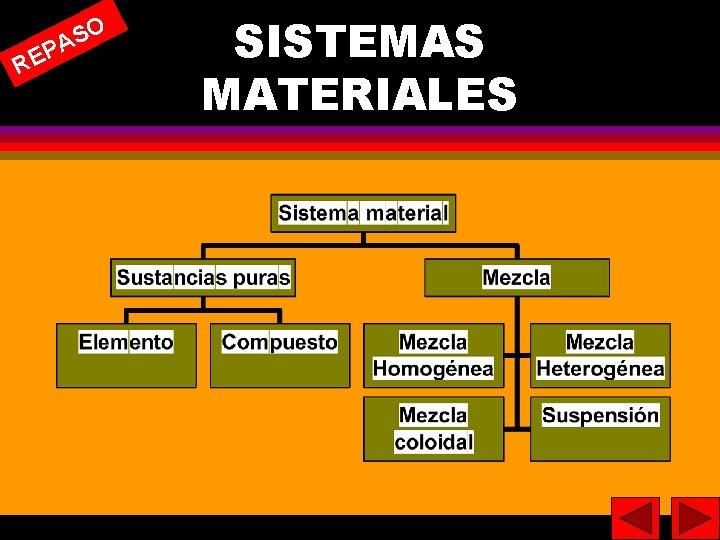
PA E R SO SISTEMAS MATERIALES 4 4

5 5 DISOLUCIÓN (Concepto) Es una mezcla homogénea de dos o mas sustancias químicas tal que el tamaño molecular de la partículas sea inferior a 10 --9 m. Se llama mezcla coloidal cuando el tamaño de partícula va de 10 -9 m a 2 · 10 -7 m. Se llama suspensión cuando el tamaño de las partículas es del orden de 2 · 10 -7 m.

6 Componentes de una disolución Soluto (se encuentra en menor proporción). Disolvente (se encuentra en mayor proporción y es el medio de dispersión). 6

7 7 Clasificación de disoluciones Según el número de componentes. Según estado físico de soluto y disolvente. Según la proporción de los componentes. Según el carácter molecular de los componentes.

8 Según el número de componentes. Binarias Ternarias. . 8

Según estado físico de soluto y disolvente. 9 Soluto • • • Gas Líquido Sólido Disolvente Ejemplo Gas Gas Líquido Sólido Aire Niebla Humo CO 2 en agua Petróleo Azúcar-agua H 2 -platino Hg - cobre Aleacciones 9

10 Según la proporción de los componentes. Diluidas • (poca cantidad de soluto) Concentradas • (bastante cantidad de soluto) Saturadas • (no admiten mayor concentración de soluto) 10

11 11 Según el carácter molecular de los componentes. Conductoras • Los solutos están ionizados (electrolitos) tales como disoluciones de ácidos, bases o sales, No conductoras • El soluto no está ionizado

12 Concentración (formas de expresarla) gramos/litro Tanto por ciento en masavolumen. Molaridad. Normalidad (ya no se usa). Fracción molar. Molalidad. 12

SO PA E R Concentración en gramos/litro. 13 Expresa la masa en gramos de soluto por cada litro de disolución. msoluto (g) conc. (g/L) = ———— Vdisolución (L) 13

SO PA E R Tanto por ciento en masa. 14 Expresa la masa en gramos de soluto por cada 100 g de disolución. msoluto % masa = ————— · 100 msoluto + mdisolvente 14

15 Tanto por ciento en masa-volumen. Expresa la masa en gramos de soluto por cada 100 cm 3 de disolución. msoluto % masa/volumen = —————— Vdisolución (d. L) 15

16 Molaridad (M ). Expresa el número de moles de soluto por cada litro de disolución. n msoluto Molar = ——————— V (L) Msoluto ·V (L) siendo V (L) el volumen de la disolución expresado en litros 16

Ejercicio: ¿ Cuál es la molaridad 17 de la disolución obtenida al disolver 12 g de Na. Cl en agua destilada hasta obtener 250 m. L de disolución? Expresado en moles, los 12 g de Na. Cl son: m 12 g n = = 0, 2 moles Na. Cl M 58, 44 g/mol La molaridad de la disolución es, pues: 0, 2 moles M = = 0, 8 M 0, 250 L 17

18 18 Relación entre M con % en masa y densidad de disolución Sabemos que: ms 100 ms % = —— · 100 = ———— mdisoln Vdisoln · ddisoln Despejando Vdisoln: 100 ms Vdn = ———— % · ddisoln Sustituyendo en la fórmula de la molaridad: ms ms· % · ddisoln Mo = —————— = ———— Ms · Vdn Ms · 100 ms 100 Ms

Ejercicio: 19 ¿Cuál será la molaridad de una disolución de NH 3 al 15 % en masa y de densidad 920 kg/m 3? 920 kg/m 3 equivale a 920 g/L % · ddn 15 · 920 g · L-1 M = ————————— = 8, 11 M -1 100 Ms 100 · 17 g · mol 19

20 20 Riqueza ( ) Las sustancias que se usan en el laboratorio suelen contener impurezas. Para preparar una disolución se necesita saber qué cantidad de soluto puro se añade. msustancia (pura) = —————— · 100 msustancia (comercial) De donde 100 msust. (comercial) = msust. (pura) · ——

Ejemplo: 21 de 21 ¿Como prepararías 100 ml una disolución 0’ 15 M de Na. OH en agua a partir de Na. OH comercial del 95 % de riqueza? m = Molaridad · M(Na. OH) · V m = 0’ 15 mol/l · 40 g/mol · 0’ 1 L = = 0’ 60 g de Na. OH puro m. Na. OH 100 (comercial) = m. Na. OH (pura) · —— = 95 100 = 0’ 60 g · —— = 0’ 63 g Na. OH comercial 95

22 22 Ejercicio: Prepara 250 cm 3 de una disolución de HCl 2 M, sabiendo que el frasco de HCl tiene las siguientes indicaciones: d=1’ 18 g/cm 3; riqueza = 35 % m = Molaridad · M(HCl) · V m = 2 mol/L · 36’ 5 g/mol · 0’ 25 L = = 18’ 3 g de HCl puro que equivalen a 100 18’ 3 g ·—— = 52’ 3 g de HCl comercial 35 m 52’ 3 g V = ————— = 44’ 3 cm 3 d 1’ 18 g/cm 3

23 Fracción molar ( ) Expresa el cociente entre el nº de moles de un soluto en relación con el nº de moles total (soluto más disolvente). nsoluto = ————— nsoluto + ndisolvente Igualmente ndisolvente = ————— nsoluto + ndisolvente 23

24 Fracción molar ( ) (cont. ). nsoluto + ndisolvente soluto + disolvente = ————— = 1 nsoluto + ndisolvente Si hubiera más de un soluto siempre ocurrirá que la suma de todas las fracciones molares de todas las especies en disolución dará como resultado “ 1”. 24

25 CH 4 y 25 Ejemplo: Calcular la fracción molar de de C 2 H 6 en una mezcla de 4 g de CH 4 y 6 g de C 2 H 6 y comprobar que la suma de ambas es la unidad. 4 g 6 g n (CH 4) =———— = 0, 25 mol; n (C 2 H 6) =————= 0, 20 mol 16 g/mol 30 g/mol n (CH 4) 0, 25 mol (CH 4) = ————————— = 0, 56 n (CH 4) + n (C 2 H 6) 0, 25 mol + 0, 20 mol n (C 2 H 6) 0, 20 mol (C 2 H 6) = ————————— = 0, 44 n (CH 4) + n (C 2 H 6) 0, 25 mol + 0, 20 mol (CH 4) + (C 2 H 6) = 0, 56 + 0, 44 = 1

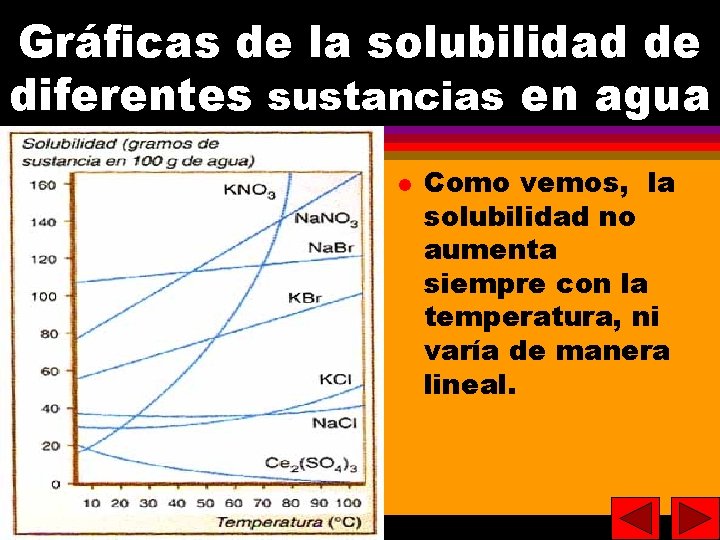
26 Solubilidad Es la máxima cantidad de soluto que se puede disolver en una determinada cantidad de disolvente (normalmente suelen tomarse 100 g). La solubilidad varía con la temperatura (curvas de solubilidad). 26

27 Gráficas de la solubilidad de diferentes sustancias en agua Como vemos, la solubilidad no aumenta siempre con la temperatura, ni varía de manera lineal. 27

28 Propiedades coligativas Las disoluciones tienen diferentes propiedades que los disolventes puros. Es lógico pensar que cuánto más concentradas estén las disoluciones mayor diferirán las propiedades de éstas de los disolventes puros. 28

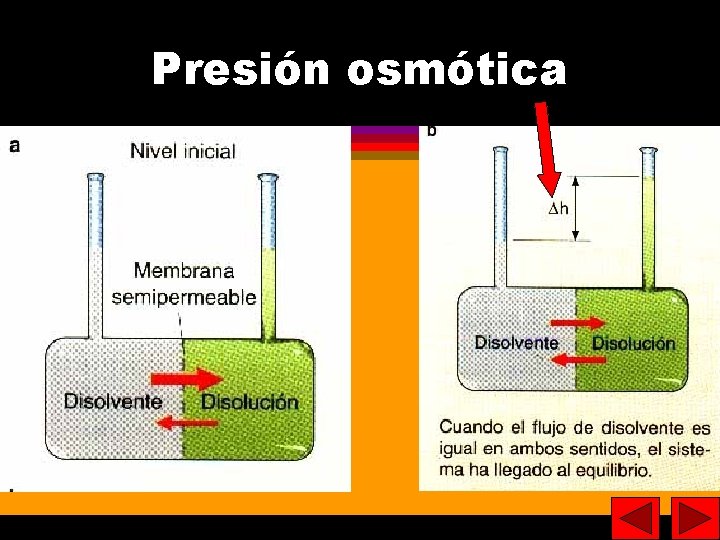
29 29 Propiedades coligativas Disminución de la presión de vapor. Aumento de temperatura de ebullición. Disminución de la temperatura de fusión. Presión osmótica (presión hidrostática necesaria para detener el flujo de disolvente puro a través de una membrana semipermeable).

30 Presión osmótica 30
 Unidades decenas centenas
Unidades decenas centenas De gas a sólido
De gas a sólido Disoluciones ejemplos
Disoluciones ejemplos Solubilidad quimica
Solubilidad quimica Tabla de soluciones coloides y suspensiones
Tabla de soluciones coloides y suspensiones Clasificacion de las disoluciones
Clasificacion de las disoluciones Disolucin
Disolucin Tipos de disoluciones
Tipos de disoluciones Disoluciones
Disoluciones Ate disoluciones coloides y suspensiones
Ate disoluciones coloides y suspensiones Ejemplo de suspensiones
Ejemplo de suspensiones Unidad 4 sistemas de ecuaciones diferenciales lineales
Unidad 4 sistemas de ecuaciones diferenciales lineales Contenidos procedimentales y actitudinales
Contenidos procedimentales y actitudinales Contenidos desarrollados
Contenidos desarrollados Ejemplos de contenidos factuales
Ejemplos de contenidos factuales Integración y reelaboración de contenidos digitales
Integración y reelaboración de contenidos digitales Contenidos interdisciplinares
Contenidos interdisciplinares Saber hacer saber conocer y saber ser
Saber hacer saber conocer y saber ser Aprendizaje contenidos
Aprendizaje contenidos Secuenciación de contenidos
Secuenciación de contenidos Esquema de texto informativo
Esquema de texto informativo Ejercicios de conocimiento del medio segundo grado
Ejercicios de conocimiento del medio segundo grado Objetivos de repaso
Objetivos de repaso Contenidos procedimentales
Contenidos procedimentales Introduccion de un trabajo
Introduccion de un trabajo Unidad de medida de lluvia
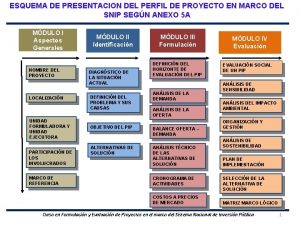
Unidad de medida de lluvia Ejemplo de un esquema de presentación
Ejemplo de un esquema de presentación Unidad del paciente
Unidad del paciente Decena de mil
Decena de mil Unidad fraccionaria ejemplos
Unidad fraccionaria ejemplos Sensaciones de la vista
Sensaciones de la vista