Conceptos y parmetros de enlace Valencia La capacidad


















































![FORMACIÓN DEL TETRACIANO CINCATO [Ni (CN)4] 2 - FORMACIÓN DEL TETRACIANO CINCATO [Ni (CN)4] 2 -](https://slidetodoc.com/presentation_image_h/9bcce0aafb60e7eb1c99a7dc372c7d5e/image-69.jpg)

- Slides: 70

Conceptos y parámetros de enlace

Valencia La capacidad de un elemento para combinarse con otro. Número de átomos de hidrógeno que se pueden combinar con un átomo de un elemento dado.

Por ejemplo, el nitrógeno presenta 5 valencias: N 2 O (I) NO (II) N 2 O 3 (III) NO 2 (IV), N 2 O 5 (V), El magnesio solamente una valencia: Mg. H 2(II)

Número de Oxidación Número de electrones involucrados en un enlace Para calcularlo se asigna el signo positivo a los átomos que presentan bajas electronegatividades y negativo a los más electronegativos

El número de oxidación se calcula multiplicando el número de átomos por el número de electrones que pierde o gana. En el caso de oxianiones, el elemento central se calcula considerando la suma algebraica del catión y del oxígeno y la diferencia que se requiere para que la carga total de la molécula o fórmula sea cero

Cálculo de los estados de oxidación de los componentes atómicos del KMn. O 4 K = + 1 * 1 = +1 O = - 2 * 4 = -8 - 8 + 1 + Mn = 0 Mn = + 7

Carga Formal (Electrones de valencia) 1/2(electrones compartidos) – (electrones no enlazados)

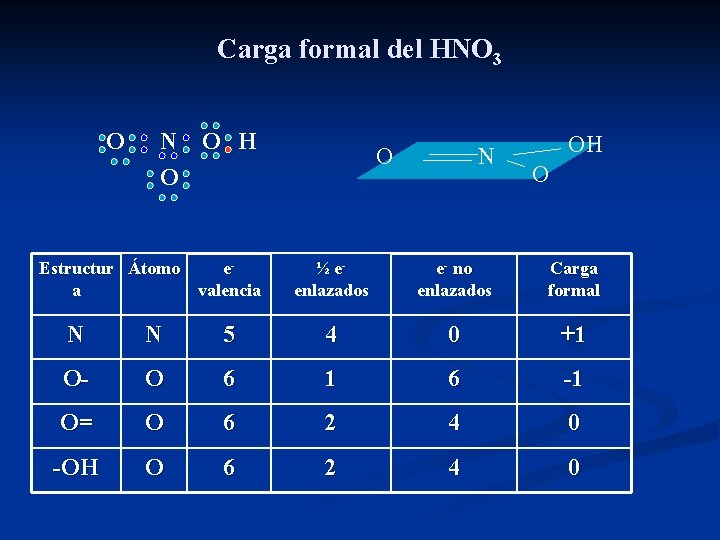
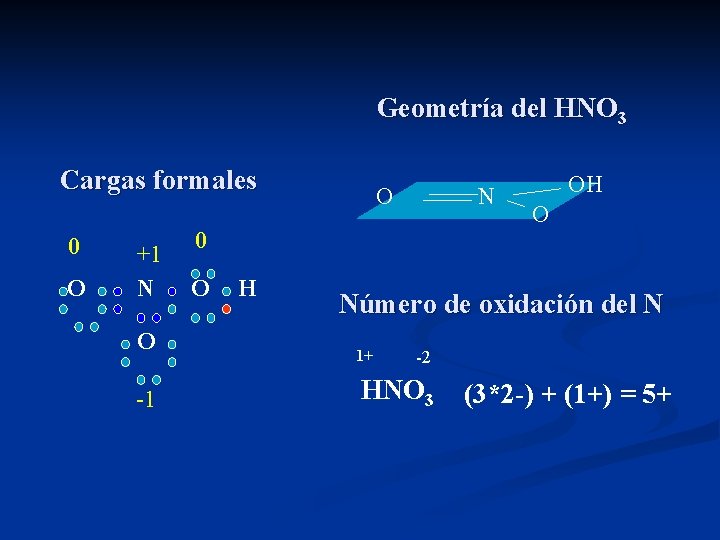
Carga formal del HNO 3 O N O H O O Estructur Átomo ea valencia N OH O ½ eenlazados e- no enlazados Carga formal N N 5 4 0 +1 O- O 6 1 6 -1 O= O 6 2 4 0 -OH O 6 2 4 0

Geometría del HNO 3 Cargas formales 0 O +1 N O -1 O N OH O 0 O H Número de oxidación del N 1+ -2 HNO 3 (3*2 -) + (1+) = 5+

Energía de enlace. Para una molécula diatómica, la energía de disociación es el cambio de entalpía de la reacción en la cual la molécula gaseosa se separa en átomos gaseosos H H 2(g) = H. + H. D(H-H) =

Energía de enlace En moléculas más complejas se obtienen diferentes energías dependiendo del ambiente molecular (vecinos), pero la variación no es muy grande CH 4 (g)= C(g) + 4 H(g) H = 1, 662 KJ/mol C-H = 1, 662/4=416 k. J/mol CH 4(g) = CH 3(G) + H(g) 430. 9 k. J/mol CH 3 -CH 3(g) = CH 3 -CH 2. + H. (g) 401. 7 k. J/mol (CH 3)-CH = (CH 3)- C(g) + H. (g) 376. 6 k. J/mol

Energía de enlace El dato de energía de enlace que se reportan para un enlace corresponden a energía de enlaces promedio C-H 413 k. J/mol

Longitud del enlace En las moléculas los átomos están siempre vibrando uno con respecto al otra, de modo, que no hay una sola distancia fija. Sin embargo hay una distancia promedio bien definida entre los núcleos Se mide experimentalmente por métodos espectroscópicos

Ángulos de enlace Es el ángulo interno de la intersección entre las dos líneas trazadas a través del núcleo de un átomo central, desde los núcleos de los átomos enlazados. El ángulo de enlace queda determinado, principalmente por: a) el número de electrones de valencia, b) la geometría de la molécula y c) los pares libres

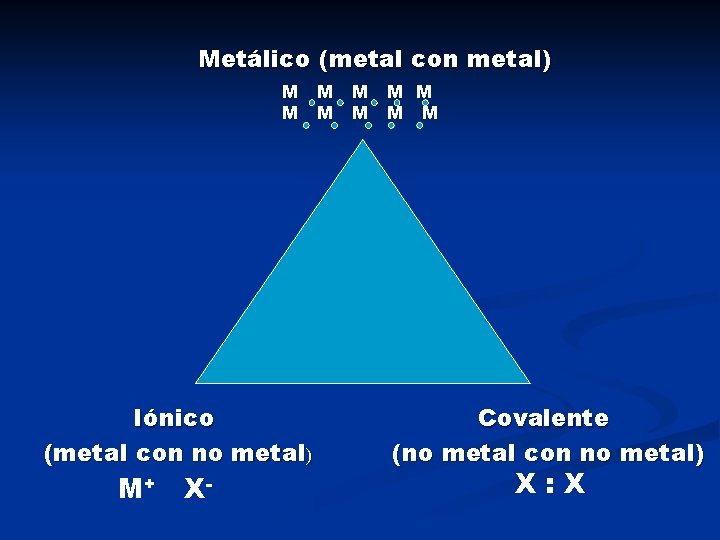
Tipos de enlaces químicos n Metálico n Iónico n Covalente

Metálico (metal con metal) M M M M M Iónico (metal con no metal) M+ X - Covalente (no metal con no metal) X: X

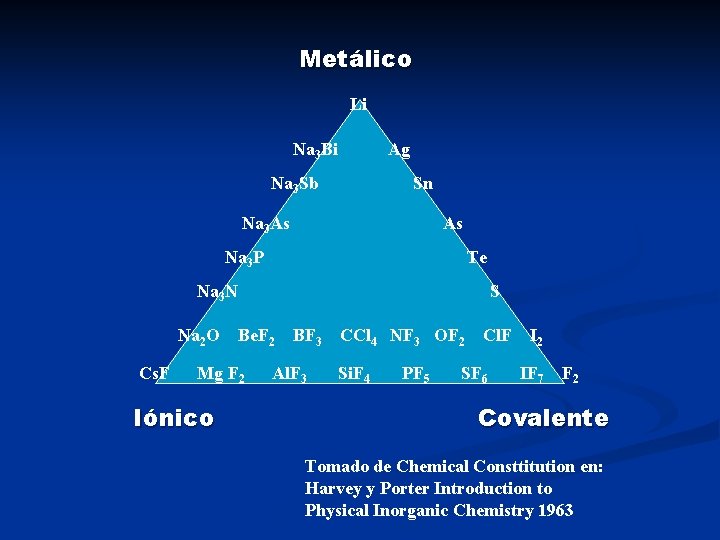
Metálico Li Na 3 Bi Ag Na 3 Sb Sn Na 3 As As Na 3 P Te Na 3 N Na 2 O Cs. F Be. F 2 Mg F 2 Iónico S BF 3 Al. F 3 CCl 4 NF 3 OF 2 Si. F 4 PF 5 Cl. F SF 6 I 2 IF 7 F 2 Covalente Tomado de Chemical Consttitution en: Harvey y Porter Introduction to Physical Inorganic Chemistry 1963

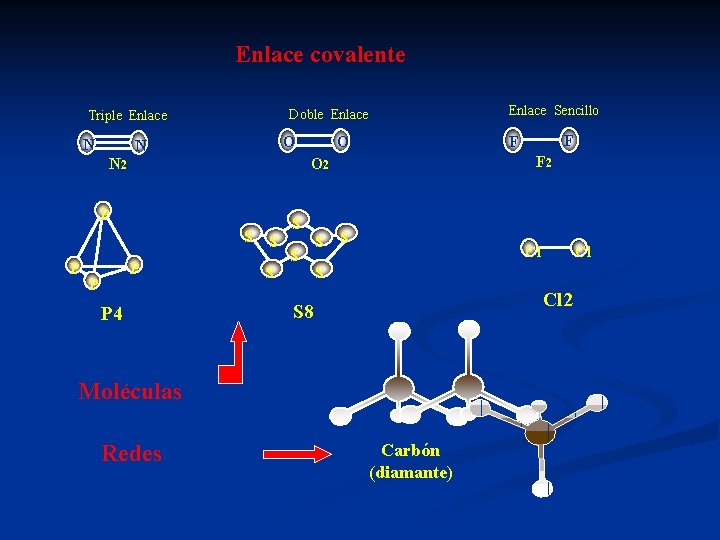
Enlace covalente N O N P S S P P P 4 S S F 2 S Cl Cl S Cl 2 S 8 Moléculas Redes F F O O 2 N 2 P Enlace Sencillo Doble Enlace Triple Enlace Carbón (diamante)

Reglas simples para la formación de un enlace covalente 1. El enlace iónico debe ser desfavorable (altas energías de ionización y afinidades electrónicas) 2. Los orbitales atómicos deben sobreponerse (estar en la misma región espacial) La simetría de los orbitales es importante 3. Generalmente se forman enlaces con dos electrones como consecuencia del principio de exclusión de Pauli (dos electrones deben tener los espines desapareados si ocupan la misma región). Esta regla tiene muchas excepciones

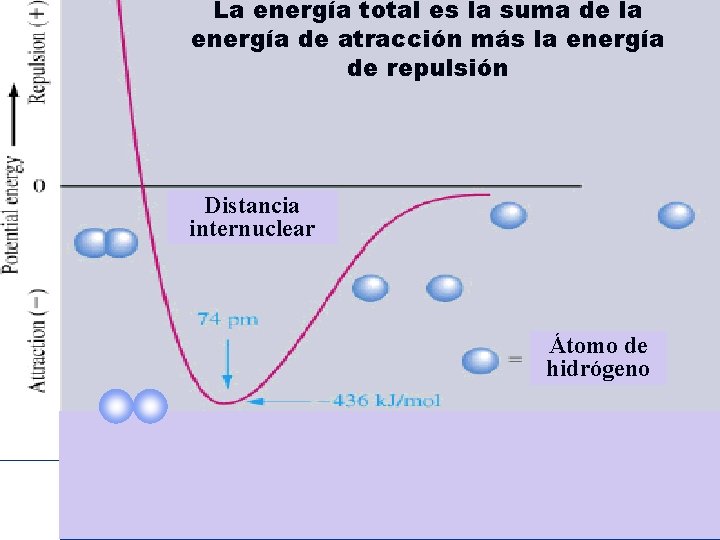
La energía total es la suma de la energía de atracción más la energía de repulsión Distancia internuclear Átomo de hidrógeno

Modelo de Lewis y Langmuir desarrollaron una teoría de enlace con base en ecompartidos. Plantearon reglas empíricas simples como la regla del octeto y las estructuras de Lewis

El enlace se forma cuando los átomos se unen compartiendo e- de la capa de valencia H 1 s 1 Li [He] 2 s 1 Be [He] 2 s 2 B [He] 2 s 2 2 p 1 C [He]2 s 2 2 p 2 F [He]2 s 2 2 p 5 Ne [He]2 s 2 2 p 6 H: H F F

Modelo de Lewis Los electrones de valencia de cada átomo se representan por medio de puntos, cruces o círculos. Cada par de electrones compartidos pueden representarse con una línea y si hay dobles o triples enlaces se representan con dos o tres líneas

Los electrones se disponen en la estructura de Lewis por pares: : 9 de 17


Reglas del octeto Establece que al formarse un enlace químico los átomos adquieren, piérden o comparten electones, de tal manera que la cara más externa de valencia contenga 8 electrones

Reglas del octeto Hay muchas excepciones ppues hay compuestos con más de 8 electrones de valencia. En este caso, se dice que la capa “d” de valencia se ha expandido (uso de orbitales d y f)

Reglas del octeto 1. Para la mayoría de las moléculas hay un máximo de 8 electrones de valencia 2. Cuando un átomo tiene orbitales d, la valencia se expande. 3. Las repulsiones entre electrones deben ser minimizadas. 4. La molécula debe alcanzar su mínimo de energía.

Generalmente la distancia diminuye y la energía aumenta (como valor absoluto) a medida que aumenta el número de pares de electrones compartidos


Estructuras de Lewis 1. - Suma algebráica del número de ede valencia de cada elemento Si la carga es (-) sumar electrones Si la carga es (+) restar electrones CO 32 N 2 O (1*4)C + (3*6)O + (2)carga = 24 e(2*5)N + (6*1)O = 16 e-

Escriba los símbolos de los átomos, con sus electrones de valencia 2. - Coloque los pares de e- de modo de completar el octeto 3. -

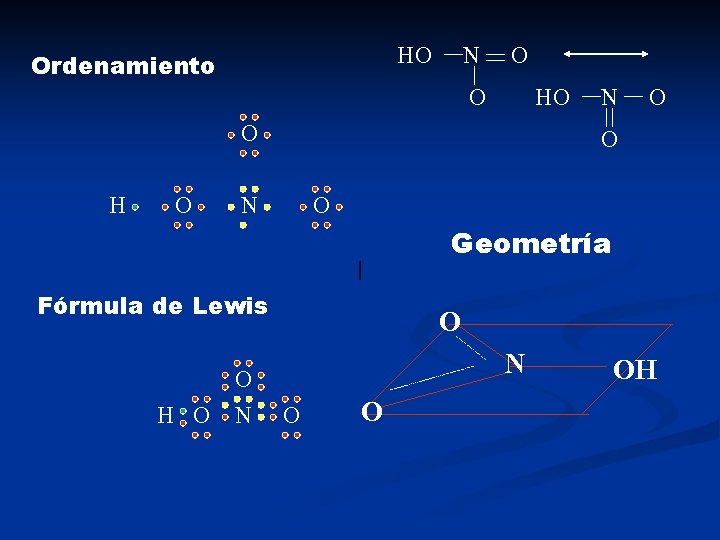
HO Ordenamiento N O O H O N O Geometría Fórmula de Lewis H O O N O O OH

Compuestos con número impar de electrones Estos compuestos formados con átomos que contribuyen con un número impar de electrones de valencia no obedecen la regla del octeto y son paramagnéticos 12 de 17

Compuestos con número impar de electrones Las estructuras se escriben formando tantos pares de electrones como sea posible y se dejan los electrones extras sin enlazar

11 de 17

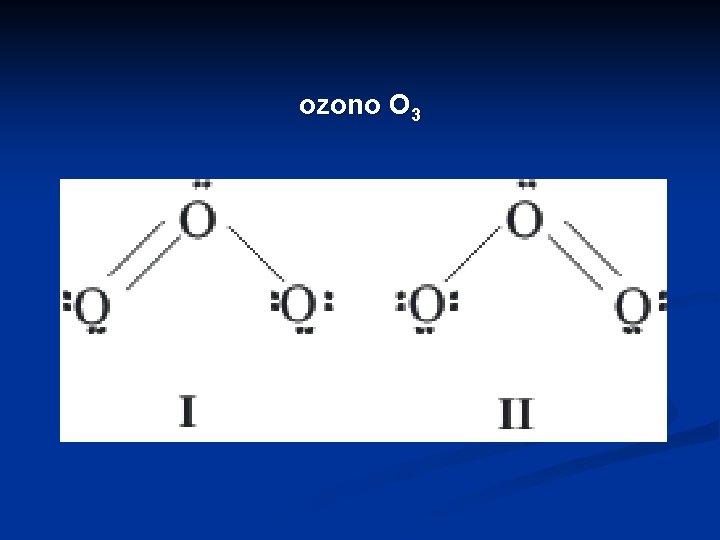
Resonancia Hay sustancias que no se describen con el modelo de Lewis y se requiere utilizar el concepto de resonancia Por ejemplo, el ozono O 3 O = O

ozono O 3

Ninguna de las dos estructuras representa correctamente la geometría de dicha molécula. Cada una considera un enlace simple y uno doble, lo cual implica que hay una distancia de enlace menor que la del otro. Sin embargo experimentalmente ambas distancias con idénticas (128 pm). Este valor es intermedio entre un enlace oxígeno simple (148 pm) y uno doble (121 pm)

Resonancia A cada estructura se le llama estructura contribuyente o canónicas y tiene la misma posibilidad de existir La energía se le llama energía de resonancia - O C - O O O C C O - -O - O

Teoría de enlace valencia Esta teoría deriva directamente del trabajo de Lewis. Heitler y London en 1927 propusieron un tratamiento cuántico para la molécula de H 2. Este desarrollo se conoce como Teoría del Enlace Valencia. Pauling y Slater modificaron esta teoría lo cual llevó a obtener una imagen exacta del aspecto geométrico de la molécula.

No es posible resolver la ecuación de Schrödinger exactamente, por lo que se deben hacer algunas aproximaciones para obtener las funciones de onda de los orbitales moleculares

Teoría de enlace valencia Se supone que 2 átomos de hidrógeno aislados, que pueden describirse con sus funciones de onda YA y YB para orbitales 1 s se unen y la función de onda de la molécula se puede describir como: Y = YA(1) YB(2) Donde A y B designa a los átomos y los números a los electrones Curva a

Teoría de enlace valencia Los resultados mejoran si se considera que los electrones se pueden intercambiar (energía de intercambio): Ycov = YA(1) YB(2) + YA(2) YB(1) Curva b

Y mejora aun más, si se considera la posibilidad de una contribución iónica : Y = Ycov + l Y H+H- + l. Y H-H+ Donde l es menor a 1 H-H H+ + H - Covalente H- + H + iónico Curva “d”

Covalente iónico YH 2 = YA(1) * YB(2) + YA(2) * YB(1) + l YA(1) * YA(2)+ l YB(1) * YB(2) YH 2 = Ycov + l Yiónica Energía = 388 k. J/mol Distancia = 74. 9


Sintetizando la teoría de Heitler y London Si se suponen 2 átomos de H, se pueden describir con las funciones de onda YA y YB 1. Cuando interaccionan YH 2 = YA(1) * YB(2) La energía de enlace de H 2 calculada con la función de onda anterior es de 24 k. J/mol (la energía real es de 458 k. J/mol) con una distancia de 74 pm (dreal = 90 pm)

Para mejorar los resultados se considera que los electrones se pueden intercambiar libremente YH 2 = YA(1) * YB(2) + YA(2) * YB(1) Con esta nueva función de onda la energía de enlace calculada es de 303 k. J/mol, una mejora sustancial respecto al cálculo anterior.

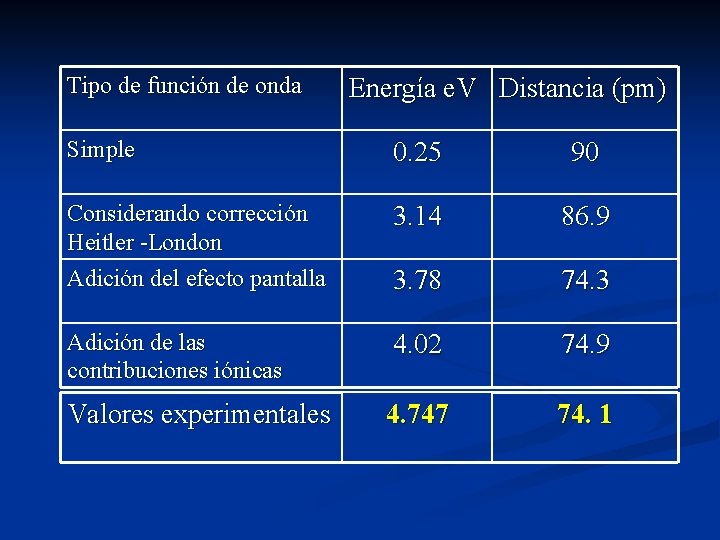
Tipo de función de onda Energía e. V Distancia (pm) Simple 0. 25 90 Considerando corrección Heitler -London Adición del efecto pantalla 3. 14 86. 9 3. 78 74. 3 Adición de las contribuciones iónicas 4. 02 74. 9 Valores experimentales 4. 747 74. 1

Teoría de enlace valencia Linus Pauling y Slater formularon una importante ampliación de la teoría de enlace valencia que permite predecir cuál enlace sea el más fuerte y determinar la dirección de la unión Las suposiciones son: 1. El enlace más fuerte se forma entre los orbitales de dos átomos que se superponen en el mayor grado posible. 2. La dirección del enlace que se forma será aquella en la que los orbitales estén concentrados

Sintetizando la teoría de Heitler y London Si se suponen 2 átomos de H, se pueden describir con las funciones de onda YA y YB 1. Cuando interaccionan YH 2 = YA(1) * YB(2) La energía de enlace de H 2 calculada con la función de onda anterior es de 24 k. J/mol (la energía real es de 458 k. J/mol) con una distancia de 90 pm (dreal = 74 pm) Para tratar de corregir el error se introduce nuevas funicones de onda en la que se considera que los electrones se pueden intercambiar libremente YH 2 = YA(1) * YB(2) + YA(2) * YB(1) Con esta nueva función de onda la energía de enlace calculada es de 303 k. J/mol, una mejora sustancial respecto al cálculo anterior.

Si ahora se considera el carácter iónico, nuevamente se mejora el cálculo, obteniendo energías más proximas a las medidas experimentalmente. H–H H+ HH- H+ Covalente iónico YH 2 = YA(1) * YB(2) + YA(2) * YB(1) + l YA(1) * YA(2)+ l YB(1) * YB(2) YH 2 = Ycov + l Yiónica Energía = 388 k. J/mol Distancia = 74. 9

Linus Pauling y Slater formularon una importante amplicación de la teoría de enlace valencia. Las suposiciones son: 1. 2. El enlace más fuerte se formará entre los orbitales de dos átomos que se superponen en el mayor grado posible. La dirección del enlace que se forma será aquella en la que los orbitales estén concentrados Estas suposiciones permiten predecir cuál enlace seá el más fuerte y determinar la dirección de la unión

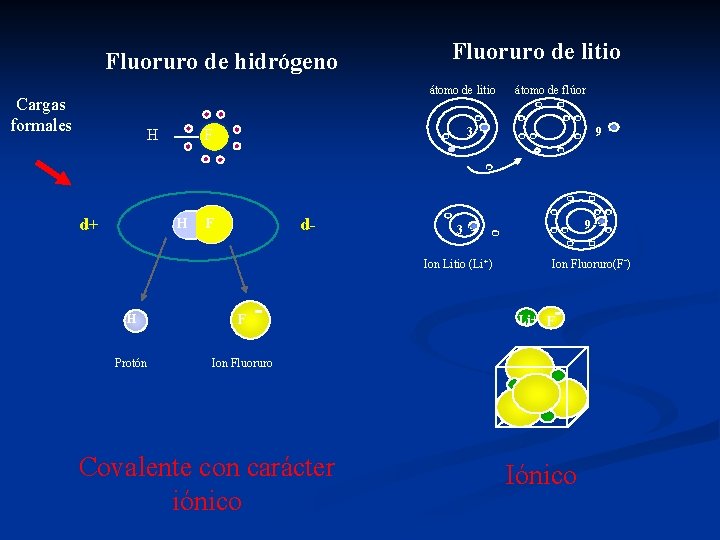
El compartir electrones es la base de la teoría de enlace covalente. Sin embargo, no siempre la distribución de la carga es uniforme, ya que en moléculas heteronucleares el elemento con mayor electronegatividad atrae más a los electrones, creando cargas formales (Ander y Sonnessa 1965 p. 128)

Fluoruro de litio Fluoruro de hidrógeno átomo de litio Cargas formales H d+ - F H d- F 3+ F Protón Ion Fluoruro Covalente con carácter iónico - 9+ - 3+ Ion Litio (Li+) H átomo de flúor 9+ Ion Fluoruro(F-) Li+ F Iónico

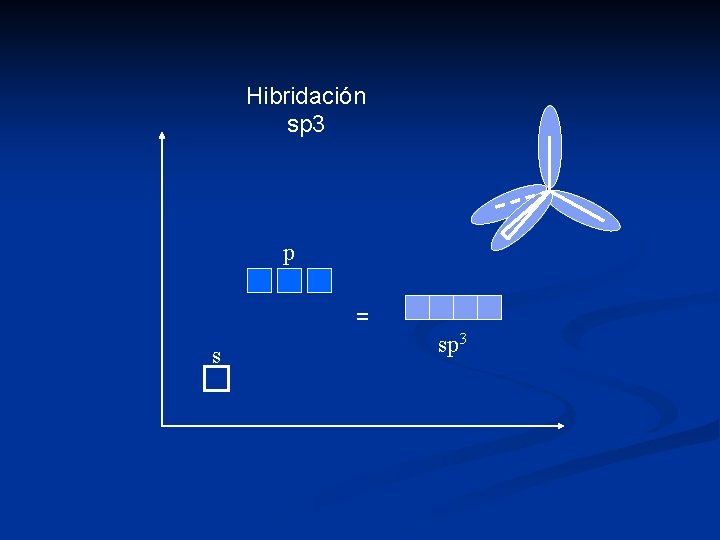
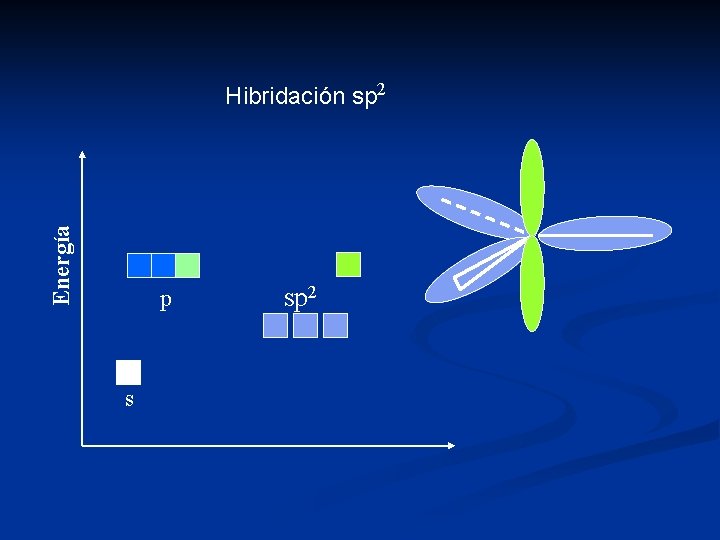
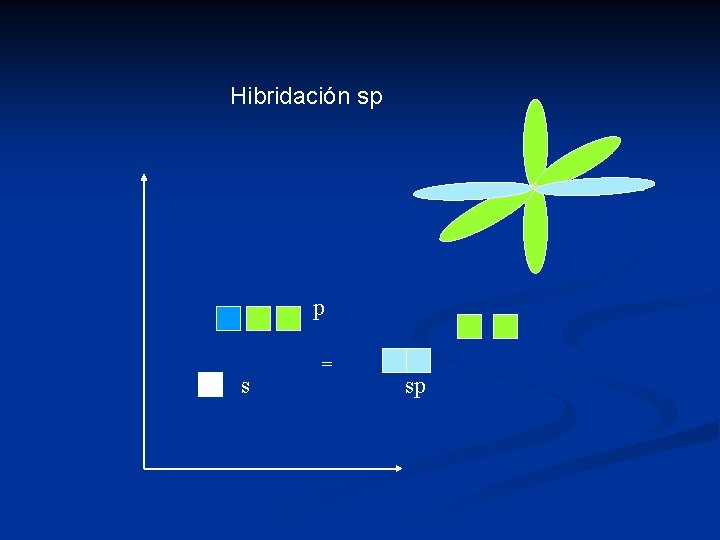
Hibridación Consiste en la combinación lineal de orbitales atómicos puros. s + p = sp (2 orbitales) lineal s + 2 p = sp 2 (3 orbitales) trigonal s + 3 p = sp 3 (4 orbitales) tetraédrico dsp 2 = planar cuadrado dsp 3 = trigonal bipiramidal o piramidal cuadrado d 2 sp 3 = octaédrico

Hibridación sp 3 p = s sp 3

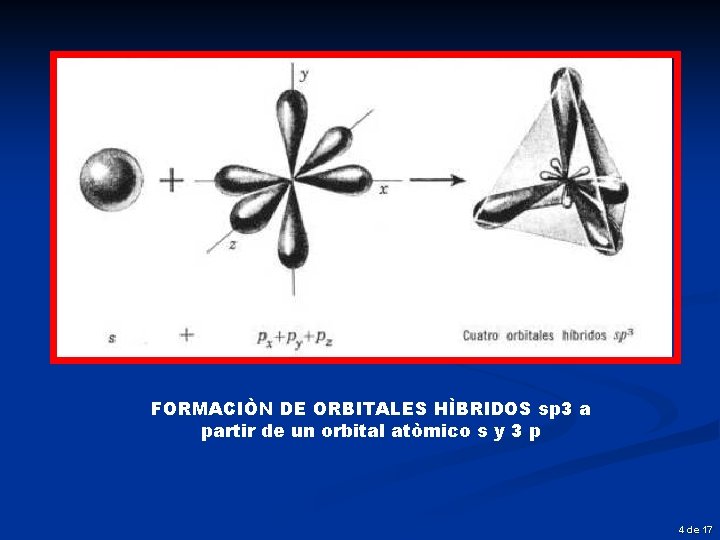
FORMACIÒN DE ORBITALES HÌBRIDOS sp 3 a partir de un orbital atòmico s y 3 p 4 de 17

Energía Hibridación sp 2 p s sp 2

6 de 17

Hibridación sp p s = sp

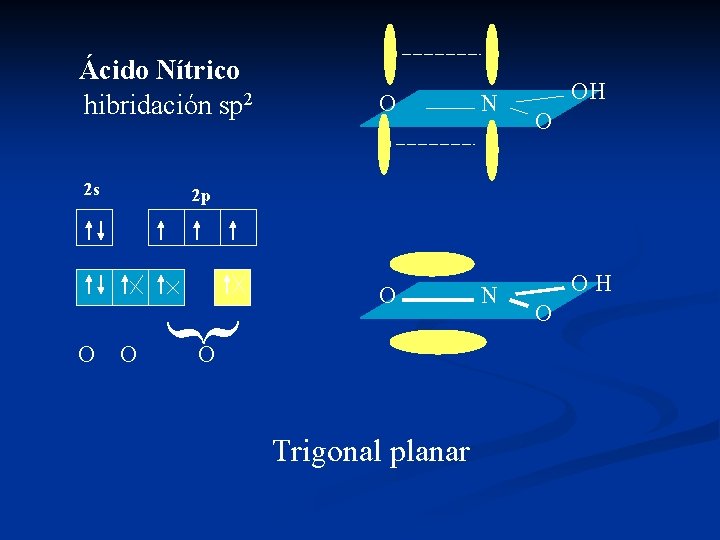
Ácido Nítrico hibridación sp 2 2 s N OH O 2 p O { O O O Trigonal planar OH O

Cuando dos orbitales no son compatibles espacialmente; cuando las funciones de onda del electrón no pueden sumarse ni restarse, no se forma un enlace Orbitales de no-enlace

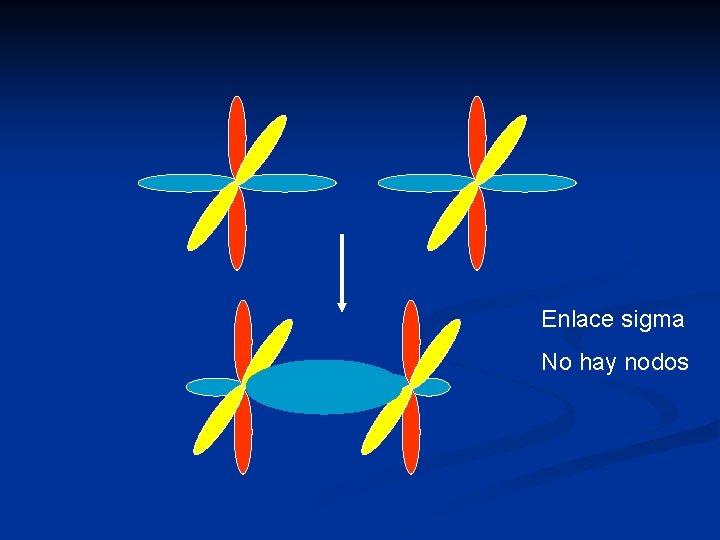
Enlace sigma No hay nodos

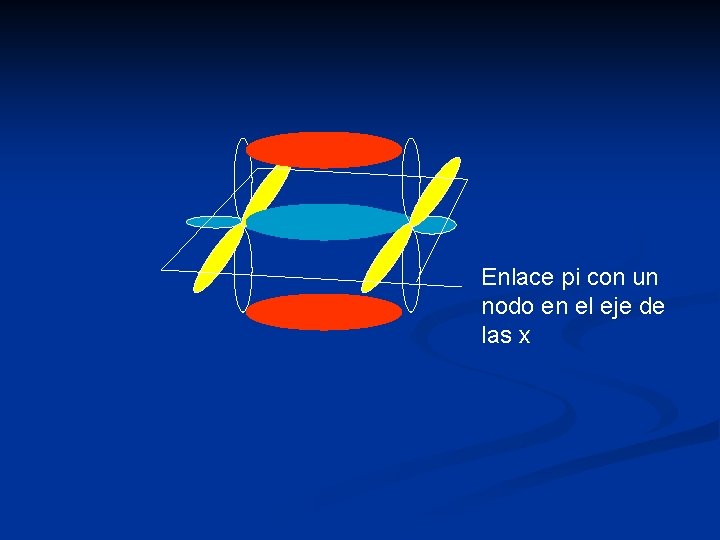
Enlace pi con un nodo en el eje de las x

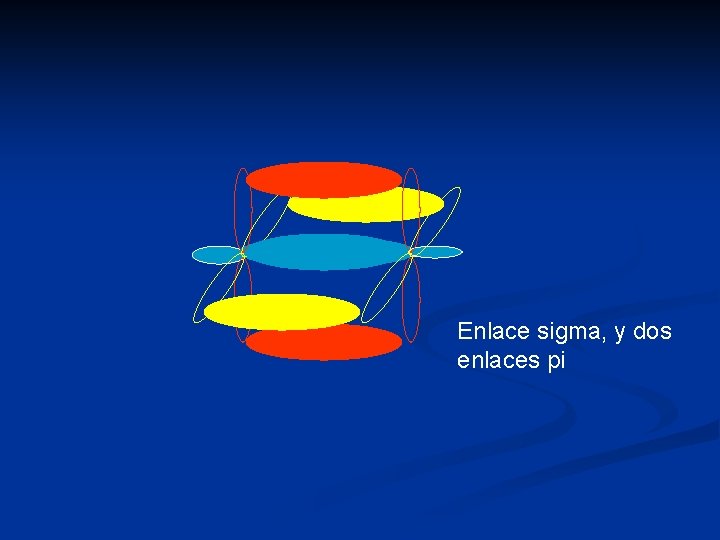
Enlace sigma, y dos enlaces pi

Formación del NF 3 14 de 17
![FORMACIÓN DEL TETRACIANO CINCATO Ni CN4 2 FORMACIÓN DEL TETRACIANO CINCATO [Ni (CN)4] 2 -](https://slidetodoc.com/presentation_image_h/9bcce0aafb60e7eb1c99a7dc372c7d5e/image-69.jpg)
FORMACIÓN DEL TETRACIANO CINCATO [Ni (CN)4] 2 -

 Volúmenes pulmonares
Volúmenes pulmonares Tipo de hibridacion
Tipo de hibridacion Parmetros
Parmetros 1 sigma y 1 pi
1 sigma y 1 pi Estudio a nivel de perfil
Estudio a nivel de perfil Capacidad organizacional
Capacidad organizacional Capacidad de crear significantes
Capacidad de crear significantes Capabilidad
Capabilidad Musculos del aparato respiratorio
Musculos del aparato respiratorio Mi corazon no es ambicioso ni mis ojos altaneros
Mi corazon no es ambicioso ni mis ojos altaneros Capacidad de conviccion
Capacidad de conviccion Antivalor de colaboración
Antivalor de colaboración Capacidad
Capacidad Capacidad de redefinición
Capacidad de redefinición Trabajo de aplicación práctica aiep
Trabajo de aplicación práctica aiep Como se calcula el volumen de un prisma hexagonal
Como se calcula el volumen de un prisma hexagonal Capacidad de ept
Capacidad de ept Filos de protozoarios
Filos de protozoarios Capacidad de manufactura
Capacidad de manufactura Capacidad de un cuerpo
Capacidad de un cuerpo Es la capacidad que tiene un cuerpo
Es la capacidad que tiene un cuerpo Capacidad del canal
Capacidad del canal Hl l dl cl ml
Hl l dl cl ml Capacidad de la materia para fragmentarse
Capacidad de la materia para fragmentarse Introduccion de estudio de mercado
Introduccion de estudio de mercado Mapa conceptual sistema de unidades
Mapa conceptual sistema de unidades Fase autonoma
Fase autonoma Capacidad descriptiva explicativa y predictiva
Capacidad descriptiva explicativa y predictiva Antivalor de la gratitud
Antivalor de la gratitud Importancia de la capacidad empresarial
Importancia de la capacidad empresarial Equipo de transporte horizontal
Equipo de transporte horizontal Capacidad calorifica
Capacidad calorifica En que se mide la capacidad
En que se mide la capacidad Capacidad requerida
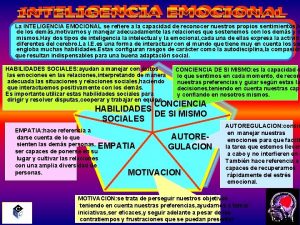
Capacidad requerida Capacidad de reconocer nuestros propios sentimientos
Capacidad de reconocer nuestros propios sentimientos Fizyme
Fizyme Capacidad descriptiva explicativa y predictiva
Capacidad descriptiva explicativa y predictiva Capacidad
Capacidad Cantidad de calor
Cantidad de calor Calor específico
Calor específico Cross promenade ejercicios
Cross promenade ejercicios Composición de la harina de trigo
Composición de la harina de trigo Australopithecus bahrelghazali capacidad craneal
Australopithecus bahrelghazali capacidad craneal Capacidad distintiva de los grafemas
Capacidad distintiva de los grafemas Australopithecus resumen
Australopithecus resumen Capacidad laboral
Capacidad laboral Nociones gramaticales basicas
Nociones gramaticales basicas Capacidad requerida
Capacidad requerida Capacidad de automotivacion
Capacidad de automotivacion Ley de newton
Ley de newton Capacidad de canal
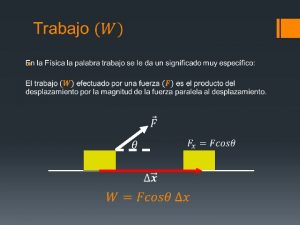
Capacidad de canal Es la capacidad de efectuar un trabajo
Es la capacidad de efectuar un trabajo Planeación de requerimientos de capacidad crp.
Planeación de requerimientos de capacidad crp. Capacidad laboral
Capacidad laboral Capacidad tecnologica y cientifica
Capacidad tecnologica y cientifica Producción sincronizada
Producción sincronizada Esquema de calorimetria
Esquema de calorimetria Não metais
Não metais Que es un paramilitar
Que es un paramilitar Juan luis jaramillo valencia
Juan luis jaramillo valencia Comentario plano urbano valencia
Comentario plano urbano valencia Capas de valencia de los elementos
Capas de valencia de los elementos Mesomeria
Mesomeria Banda de valencia e condução
Banda de valencia e condução Electrones de valencia ejemplos
Electrones de valencia ejemplos Intenčný typ
Intenčný typ Comentario plano urbano valencia
Comentario plano urbano valencia Eletrons de valencia
Eletrons de valencia Estaño electrones de valencia
Estaño electrones de valencia Inditex
Inditex Agresividad valencia
Agresividad valencia