Chng 7 ST V MT S KIM LOI





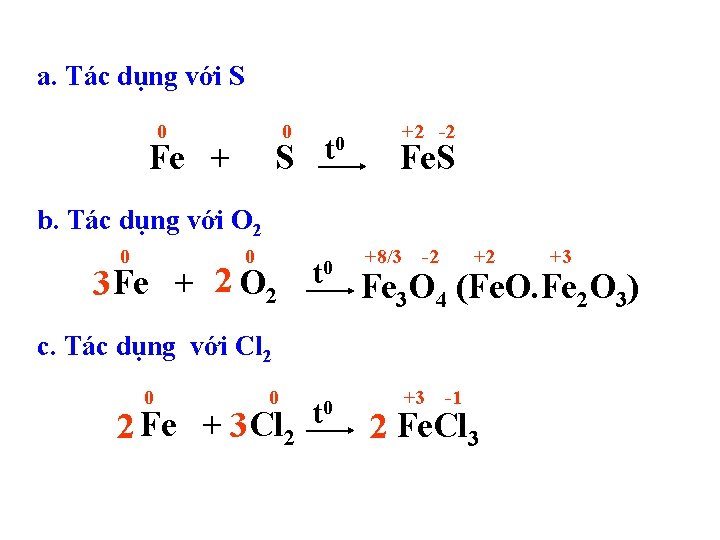












- Slides: 21


Chương 7 SẮT VÀ MỘT SỐ KIM LOẠI QUAN TRỌNG Bài 31. SẮT

CẤU TRÚC BÀI GIẢNG 2 I. to add Title VỊ TRÍClick - CẤU HÌNH ELECTRON II. TÍNH CHẤT VẬT LÍ III. TÍNH CHẤTClick add Title HÓAto HỌC IV. Click. TỰ to add Title 2 TRẠNG THÁI NHIÊN


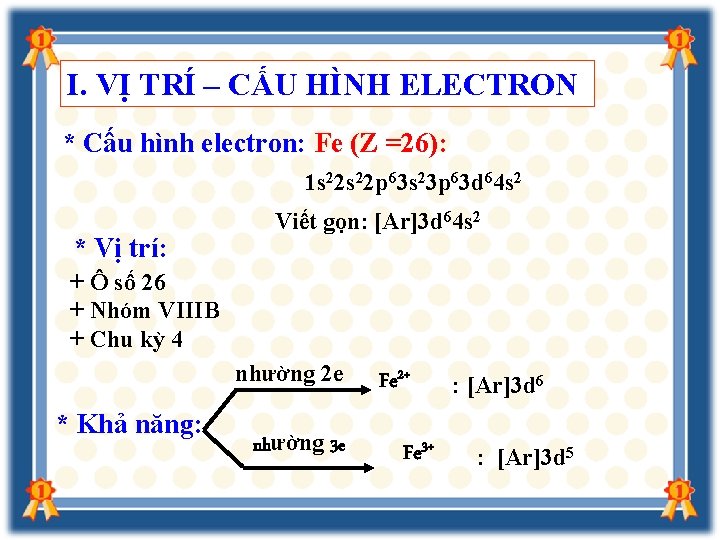
I. VỊ TRÍ – CẤU HÌNH ELECTRON * Cấu hình electron: Fe (Z =26): 1 s 22 p 63 s 23 p 63 d 64 s 2 * Vị trí: Viết gọn: [Ar]3 d 64 s 2 + Ô số 26 + Nhóm VIIIB + Chu kỳ 4 nhường 2 e * Khả năng: nhường 3 e Fe 2+ Fe 3+ : [Ar]3 d 6 : [Ar]3 d 5

II. TÍNH CHẤT VẬT LÍ * Màu trắng hơi xám, dẻo. * Khối lượng riêng là 7, 9 g/cm 3 (kim loại nặng). * Nhiệt độ nóng chảy là 15400 C. * Có tính dẫn nhiệt, dẫn điện tốt ( yếu hơn Ag, Cu, Al ). * Có tính nhiễm từ.

III. TÍNH CHẤT HÓA HỌC K+ Na+ Mg 2+ A l 3+ Zn 2+ Fe 2+ Ni 2+ Sn 2+ Pb 2+ H+ Cu 2+ Ag+Au 3+ K Na Mg Al Zn Fe Ni Sn Pb H Cu Ag Au - Sắt có tính khử trung bình Fe 2+ + 2 e Fe 3+ + 3 e Trong hợp chất, Fe có số oxi hóa +2 hoặc +3 1. Tác dụng với phi kim: Ở t 0 cao, Fe bị phi kim oxi hóa thành Fe 2+, Fe 3+ (tùy vào chất oxi hóa tác dụng với Fe)
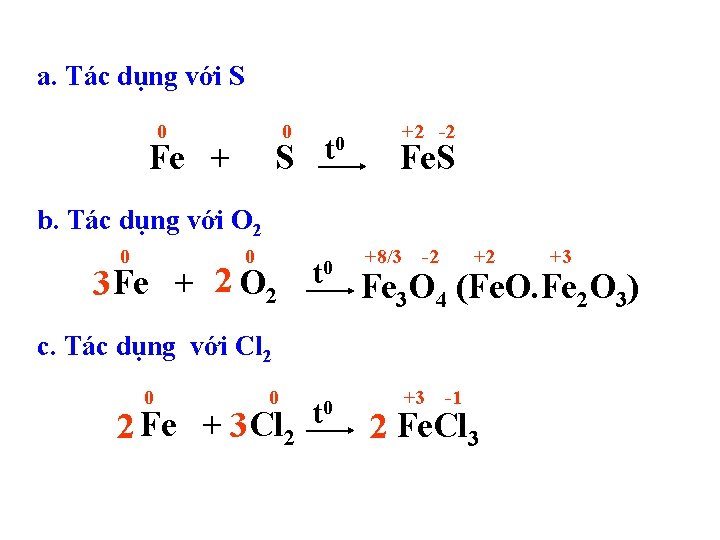
a. Tác dụng với S 0 0 Fe + S t 0 +2 -2 Fe. S b. Tác dụng với O 2 0 0 3 Fe + 2 O 2 t 0 +8/3 -2 +2 Fe 3 O 4 (Fe. O. Fe 2 O 3) c. Tác dụng với Cl 2 0 0 2 Fe + 3 Cl 2 t 0 +3 +3 -1 2 Fe. Cl 3

2. Tác dụng với axit : a. Axit HCl, H 2 SO 4 loãng muối Fe 2+ + H 2 Fe + 2 HCl Fe. Cl 2 + H 2 Fe + H 2 SO 4 loãng Fe. SO 4 + H 2 b. Axit HNO 3, H 2 SO 4 đặc (dư) muối Fe 3+ + sản phẩm khử + H 2 O Chú ý: Fe không tác dụng với HNO 3 đặc nguội, H 2 SO 4 đặc nguội

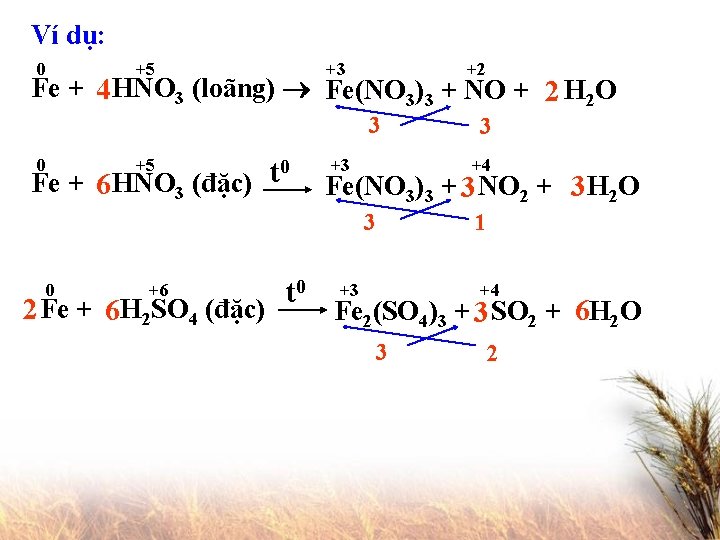
Ví dụ: 0 +5 +3 +2 Fe + 4 HNO 3 (loãng) Fe(NO 3)3 + NO + 2 H 2 O 3 0 +5 0 t Fe + 6 HNO 3 (đặc) +3 +4 Fe(NO 3)3 + 3 NO 2 + 3 H 2 O 3 0 +6 2 Fe + 6 H 2 SO 4 (đặc) t 0 3 1 +3 +4 Fe 2(SO 4)3 + 3 SO 2 + 6 H 2 O 3 2

3. Tác dụng với dung dịch muối (đứng sau Fe) * VD Fe + Cu. SO 4 → Fe. SO 4 + Cu↓ Fe + Al 2(SO 4)3 →

IV. TRẠNG THÁI TỰ NHIÊN v Trong vỏ Trái đất, sắt đứng thứ hai trong các kim loại (sau nhôm) v Trong tự nhiên, sắt tồn tại chủ yếu ở dạng hợp chất. Có trong các quặng: - Quặng manhetit (Fe 3 O 4) - Quặng hematit đỏ (Fe 2 O 3) - Quặng hematit nâu (Fe 2 O 3. n. H 2 O) - Quặng xiđerit (Fe. CO 3) - Quặng pirit (Fe. S 2) v Sắt có trong hemoglobin (Hồng cầu) của máu.

Quặng Manhetit: Fe 3 O 4

Quặng Hematit đỏ: Fe 2 O 3

Quặng Hematit nâu: Fe 2 O 3. n. H 2 O

Quặng Xidetit: Fe. CO 3

Quặng Pirit: Fe. S 2

Sắt là khoáng chất thiết yếu cho cuộc sống, Sắt là thành phần thiết yếu trong cấu tạo Hồng cầu, có nhiệm vụ vận chuyển oxi trong máu. Khi lượng chất. Sắt trong cơ thể thấp sẽ dẫn đến tình trạng thiếu máu.

Câu 1: Cấu hình electron nào sau đây là của ion Fe 2+? A. [Ar] 3 d 64 s 2. B. [Ar] 4 s 23 d 4. C. [Ar] 3 d 5. D. [Ar]3 d 6.

Câu 2: Fe có thể phản ứng được với dung dịch trong dãy nào sau đây? A. HCl, Cu. SO 4, Na. OH. B. HNO 3, KOH, Ag. NO 3. C. HCl, Cu. SO 4, Ag. NO 3. D. HCl, HNO 3, Na. NO 3.

Câu 3: Ion Fe 3+ có cấu hình electron lớp ngoài cùng là Câu 4: Khi ngâm một vật bằng Fe vào dung dịch Cu. SO 4 khi quan sát thì thấy có hiện tượng là A. màu xanh của dung dịch nhạt dần. B. xuất hiện kết tủa màu đỏ bám vào thanh Fe. C. màu xanh của dung dịch nhạt dần và sắt bị gỉ. D. Màu xanh của dung dịch nhạt dần và xuất hiện lớp màu đỏ bám vào thanh Fe.