Alkalick kovy CH3 Anorganick chemie DUM 2 2





















- Slides: 23


Alkalické kovy CH-3 Anorganická chemie, DUM č. 2 2. ročník čtyřletého studia Mgr. Radovan Sloup Gymnázium Sušice Tento materiál byl vytvořen v rámci projektu Gymnázium Sušice – Brána vzdělávání II

Alkalické kovy Li 11 Na 19 K Rb 37 Cs 55 Fr 87 3 lithium sodík draslík rubidium cesium francium

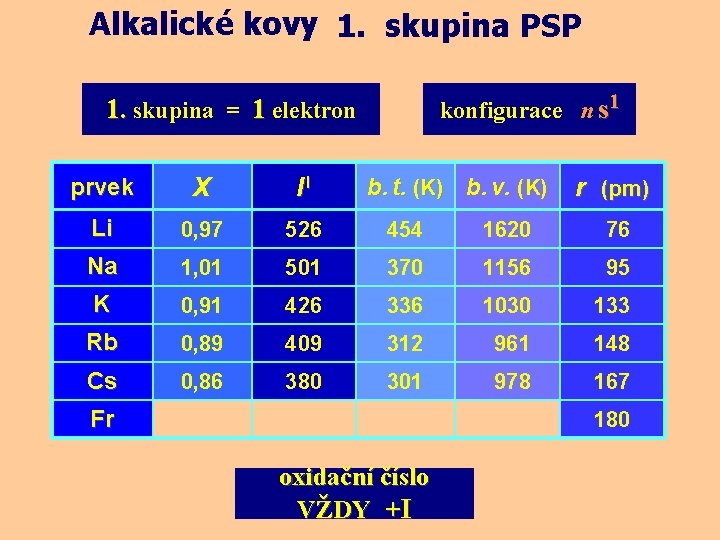
Alkalické kovy 1. skupina PSP konfigurace n s 1 1. skupina = 1 elektron prvek X II Li 0, 97 526 454 1620 76 Na 1, 01 501 370 1156 95 K 0, 91 426 336 1030 133 Rb 0, 89 409 312 961 148 Cs 0, 86 380 301 978 167 b. t. (K) b. v. (K) Fr r (pm) 180 oxidační číslo VŽDY +I

Alkalické kovy alkalické kovy jsou měkké a dají se krájet nožem krájení sodíku: krájení draslíku:

Alkalické kovy a jejich ionty barví plamen lithium sodík draslík

2 Li + 2 H 2 O 2 Li. OH + H 2 reakci lithia s vodou můžete pozorovat na těchto odkazech: http: //www. youtube. com/watch? v=oxh. W 7 Tt. XIAM&feature=related http: //www. youtube. com/watch? v=h. Sly 84 l. Rqj 0&feature=related

2 K + 2 H 2 O 2 KOH + H 2 2 Na + 2 H 2 O 2 Na. OH + H 2

Alkalické kovy 2 Na + 2 H 2 O 2 Na. OH + H 2

Alkalické kovy

2 Na + 2 H 2 O 2 Na. OH + H 2

2 Na + 2 H 2 O 2 Na. OH + H 2

2 Na + 2 H 2 O 2 Na. OH + H 2

2 Na + 2 H 2 O 2 Na. OH + H 2

2 K + 2 H 2 O 2 KOH + H 2

2 K + 2 H 2 O 2 KOH + H 2

2 K + 2 H 2 O 2 KOH + H 2

2 K + 2 H 2 O 2 KOH + H 2

2 Rb + 2 H 2 O 2 Rb. OH + H 2 reakci rubidia s vodou můžete pozorovat na tomto odkazu: http: //www. youtube. com/watch? v=25 a. Ha. Zlgi 5 g reakci rubidia a cesia s vodou můžete pozorovat na tomto odkazu: http: //www. youtube. com/watch? v=hap 9 JWp 5 IZ 8 2 Cs + 2 H 2 O 2 Cs. OH + H 2

2 M + 2 H 2 O 2 MOH + H 2 reakci všech alkalických kovů s vodou můžete pozorovat na tomto odkazu: http: //www. youtube. com/watch? v=QSZ-3 w. Sce. PM&feature=related

Alkalické kovy jak se mění průběh reakce alkalického kovu v závislosti na jeho protonovém čísle? řešení: Li Na 11 K 19 Rb 37 Cs 55 Fr 87 3 lithium sodík draslík rubidium cesium francium Zrychluje se ve směru rostoucího protonového čísla !!!

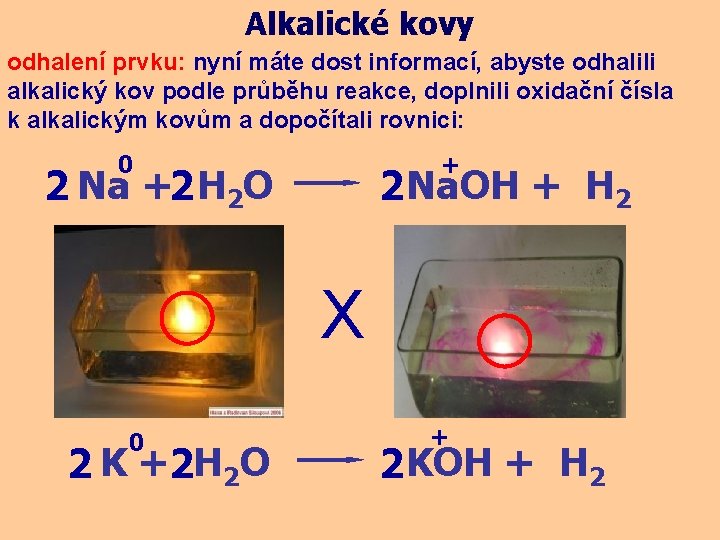
Alkalické kovy odhalení prvku: nyní máte dost informací, abyste odhalili alkalický kov podle průběhu reakce, doplnili oxidační čísla k alkalickým kovům a dopočítali rovnici: 0 + 2 Na +2 H 2 O 2 Na. OH + H 2 X 0 2 K +2 H 2 O + 2 KOH + H 2

ALKALICKÉ KOVY Vytvořeno v rámci projektu Gymnázium Sušice - Brána vzdělávání II Autor: Mgr. Radovan Sloup, Gymnázium Sušice Předmět: Chemie (Anorganická chemie) Třída: sexta osmiletého gymnázia Označení: VY_32_INOVACE_Ch-3_02 Datum vytvoření: 29. září 2012 Anotace a metodické poznámky Prezentace je určena pro shrnutí chemie alkalických kovů v rozsahu SŠ, s důrazem na jejich reakci s vodou. Materiál je vhodné podle možností doplnit reálnými experimenty v různých variantách provedení, podle prezentace. Na úvod prezentace pokud možno proveďte plamenové zkoušky alespoň s ionty sodíku a draslíku. Na závěr ve slidu „odhalení prvku“ si vyberte reakci draslíku nebo sodíku na filtračním papíru s vodou a podle toho nechte doplnit konkrétní reakci. V této fázi zdůrazněte barvu plamene, vznik vodíku a hodnoty oxidačních čísel prvků. Pro odkazy je nutné on-line připojení k internetu. Použité materiály: Honza, J. ; Mareček, A. ; Chemie pro čtyřletá gymnázia (1. díl). Brno: Da. Ta. Print, 1995; ISBN 80 -900066 -6 -3 Greenwood, N. N. ; Earnshaw, A. ; Chemie prvků I. Praha: Informatorium, 1993, ISBN 80 -85427 -38 -9 Fotografie a schémata jsou dílem autora prezentace. Vše je vytvořeno pomocí nástrojů Power Point 2003, Zoner. Photo. Studio 14, Gimp 2. 6. 11 Materiály jsou určeny pro bezplatné používání pro potřeby výuky a vzdělávání na všech typech škol a školských zařízení. Jakékoliv další využití podléhá autorskému zákonu.
 Rumus struktur propil
Rumus struktur propil Ch3-ch2-ch=ch2+hcl
Ch3-ch2-ch=ch2+hcl Dum dum bullet
Dum dum bullet Ch3-ch3-oh
Ch3-ch3-oh Compuestos nitrogenados
Compuestos nitrogenados Reaccion de condensacion
Reaccion de condensacion Naming esters
Naming esters Ch3 ch2 ch2 ch2 ch2 ch2 ch3
Ch3 ch2 ch2 ch2 ch2 ch2 ch3 Numerar
Numerar Nombre iupac
Nombre iupac Ch3-ch=ch-ch3 + h2o
Ch3-ch=ch-ch3 + h2o O ch
O ch Rozličné kovy zpracovávali
Rozličné kovy zpracovávali Sfarbenie plameňa alkalické kovy
Sfarbenie plameňa alkalické kovy Kovy a jejich vlastnosti
Kovy a jejich vlastnosti Biogénne kovy
Biogénne kovy Dům s pečovatelskou službou ostrava mariánské hory
Dům s pečovatelskou službou ostrava mariánské hory Polyfunkční dům definice
Polyfunkční dům definice Dum audes ardua vinces
Dum audes ardua vinces Jussive noun clause
Jussive noun clause Recursos expressivos cesario verde
Recursos expressivos cesario verde Dm ochrana rohu
Dm ochrana rohu Banging the drums like dum diddy day
Banging the drums like dum diddy day Jan neruda trojúhelník
Jan neruda trojúhelník