Kyslk sloueniny CH3 Anorganick chemie DUM 9 2








- Slides: 12


Kyslík, sloučeniny CH-3 Anorganická chemie, DUM č. 9 2. ročník čtyřletého studia Mgr. Radovan Sloup Gymnázium Sušice Tento materiál byl vytvořen v rámci projektu Gymnázium Sušice – Brána vzdělávání II

Osnova: kyslík Vazebné možnosti kyslíku. Voda jako nejběžnější sloučenina kyslíku. Peroxid vodíku a jeho chemické vlastnosti. Oxidy, jejich rozdělení a význam. Kyslíkaté kyseliny. Soli kyslíkatých kyselin. 3

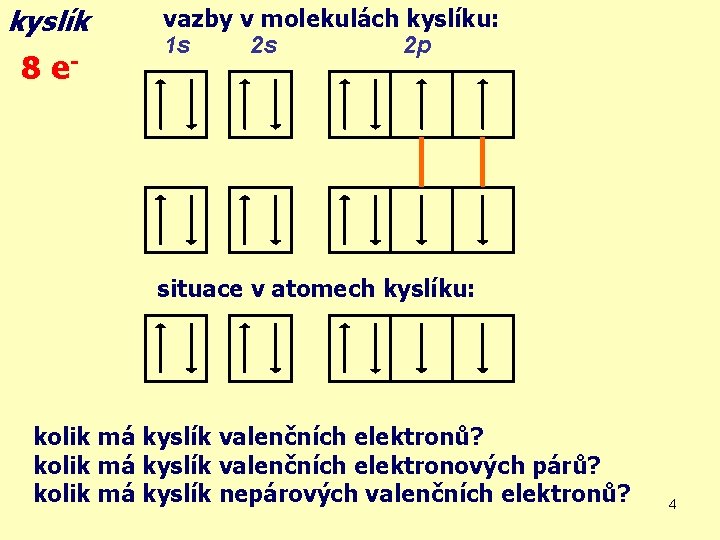
kyslík 8 e- vazby v molekulách kyslíku: 1 s 2 s 2 p situace v atomech kyslíku: kolik má kyslík valenčních elektronů? kolik má kyslík valenčních elektronových párů? kolik má kyslík nepárových valenčních elektronů? 4

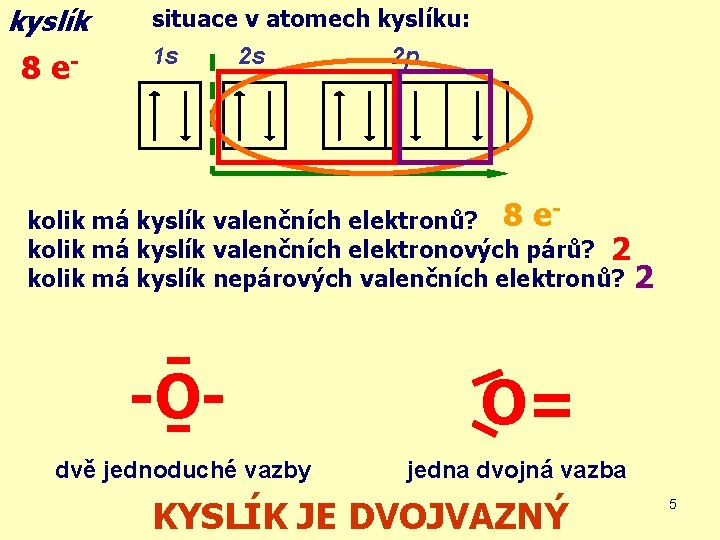
kyslík 8 e- situace v atomech kyslíku: 1 s 2 s 2 p kolik má kyslík valenčních elektronů? 8 e kolik má kyslík valenčních elektronových párů? 2 kolik má kyslík nepárových valenčních elektronů? 2 - -Odvě jednoduché vazby O= jedna dvojná vazba KYSLÍK JE DVOJVAZNÝ 5

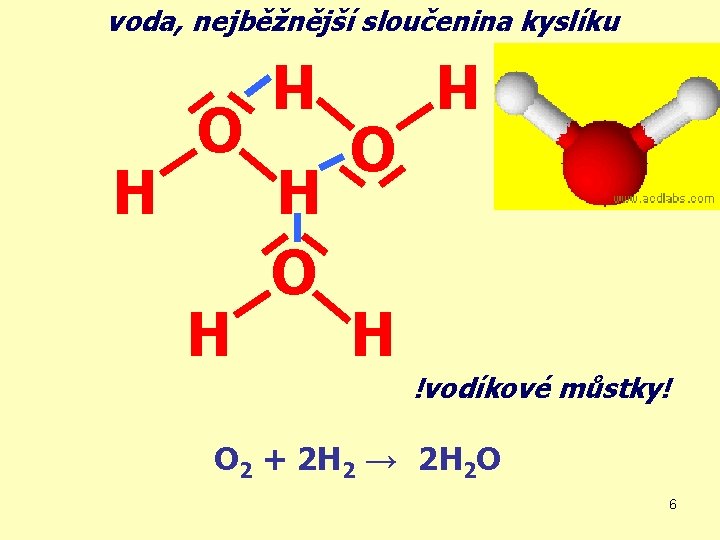
voda, nejběžnější sloučenina kyslíku O H H H O !vodíkové můstky! O 2 + 2 H 2 → 2 H 2 O 6

voda, nejběžnější sloučenina kyslíku 2 H 2 O → OH- + H 3 O+ nejběžnější rozpouštědlo autoprotolýza vody čistá voda neexistuje tři skupenství 7

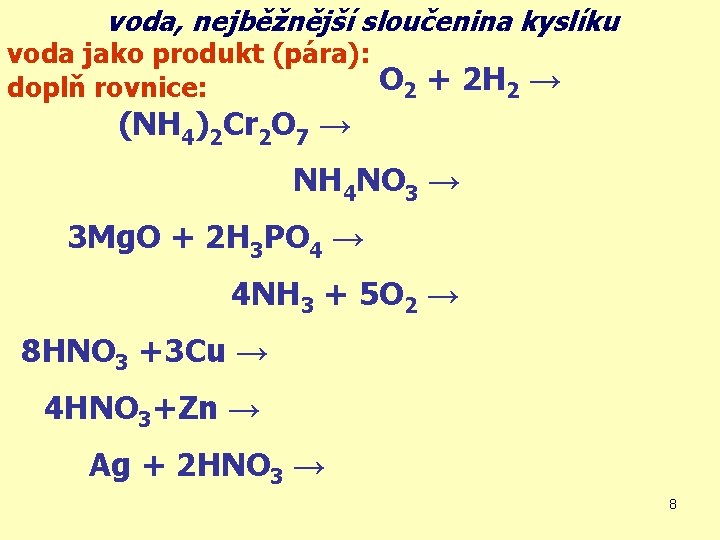
voda, nejběžnější sloučenina kyslíku voda jako produkt (pára): O 2 + 2 H 2 → 2 H 2 O doplň rovnice: (NH 4)2 Cr 2 O 7 → Cr 2 O 3 + N 2 + 4 H 2 O NH 4 NO 3 → N 2 O + 2 H 2 O 3 Mg. O + 2 H 3 PO 4 → Mg 3(PO 4)2 + 3 H 2 O 4 NH 3 + 5 O 2 → 4 NO + 6 H 2 O 8 HNO 3 +3 Cu → 3 Cu(NO 3)2 +2 NO +4 H 2 O 4 HNO 3+Zn → Zn(NO 3)2 +2 NO 2 + 2 H 2 O Ag + 2 HNO 3 → Ag. NO 3 + NO 2 + H 2 O 8

voda, nejběžnější sloučenina kyslíku voda jako reaktant: SO 2 + H 2 O → H 2 SO 3 doplň rovnice: 2 Na + 2 H 2 O → 2 Na. OH + H 2 Na 2 O + H 2 O → 2 Na. OH Ca. O + H 2 O → Ca(OH)2 2 Na. OH + 2 Al + 6 H 2 O → 2 Na[Al(OH)4] + 3 H 2 6 H 2 O + 2 Al → 3 H 2 + 2 Al(OH)3 B 2 O 3 + 3 H 2 O → 2 H 3 BO 3 9

peroxid vodíku, nestabilní sloučenina kyslíku 2 H 2 O 2 → O 2 + H 2 O !netvoří vodíkové můstky! rozpadá se na světle a teple dezinfekční a bělící účinky, žíravina ve formě roztoku (3%, 6%, 30%) redukční účinky (vzniká kyslík): Ag 2 O + H 2 O 2 → 2 Ag + O 2 + H 2 O oxidační účinky (vzniká voda): 10 2 Fe. SO 4 + H 2 O 2 + H 2 SO 4 → Fe 2(SO 4)3+ 2 H 2 O

oxidy, dvouprvkové sloučeniny kyslíku -2 M x Oy kyselinotvorné: jejich reakcí s H 2 O vzniká kyselina CO 2 SO 2 P 4 O 10 B 2 O 3 SO 3 … zásadotvorné: jejich reakcí s H 2 O vzniká zásada Na 2 O Ca. O Mg. O K 2 O … amfoterní: reakcí s zásadou i kyselinou vzniká sůl Zn. O Al 2 O 3 … neutrální: nereagují se zásadou ani s kyselinou NO CO 11

obr 1. (29. 10. 2012), autor: neznámý: http: //commons. wikimedia. org/wiki/File: PSM_V 31_D 740_Carl_Wilhelm_Scheele. jpg