CHEMIE HLINKU CH3 Anorganick chemie DUM 4 sexta















- Slides: 20


CHEMIE HLINÍKU CH-3 Anorganická chemie, DUM č. 4 sexta osmiletého gymnázia Mgr. Radovan Sloup Gymnázium Sušice Tento materiál byl vytvořen v rámci projektu Gymnázium Sušice – Brána vzdělávání II

hliník Osnova: Jaká je značka hliníku a jeho postavení v tabulce? Elektronová konfigurace hliníku. Kdo a kdy hliník poprvé připravil a kdo popsal jeho vlastnosti? Jaké jsou chemické vlastnosti hliníku? K čemu se hliník používá? Analytické stanovení hlinitých iontů. Biochemický význam hliníku …

hliník značka hliníku je odvozena z latinského názvu: ALUMINIUM značka hliníku je:

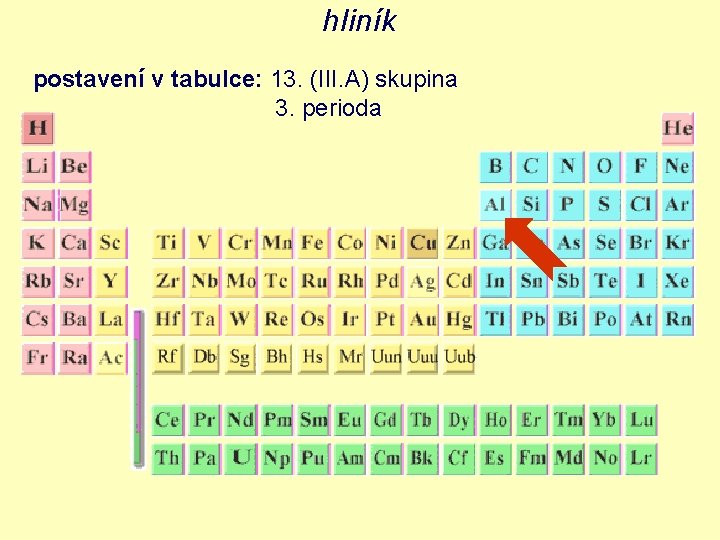
hliník postavení v tabulce: 13. (III. A) skupina 3. perioda

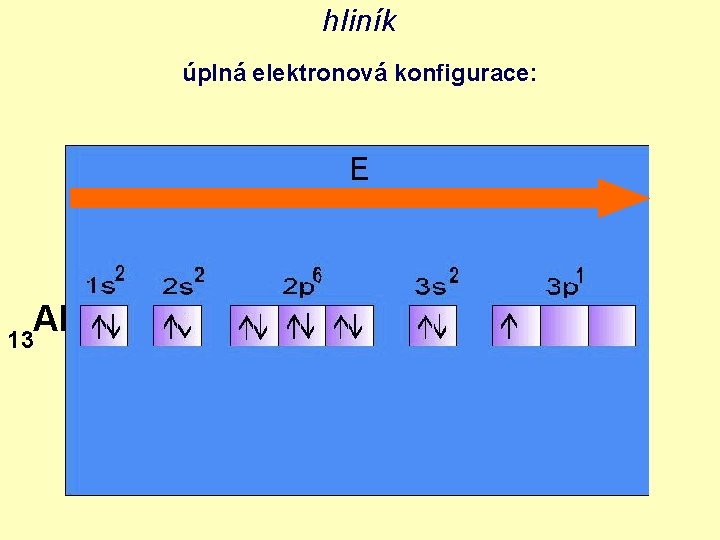
hliník úplná elektronová konfigurace: E Al 13

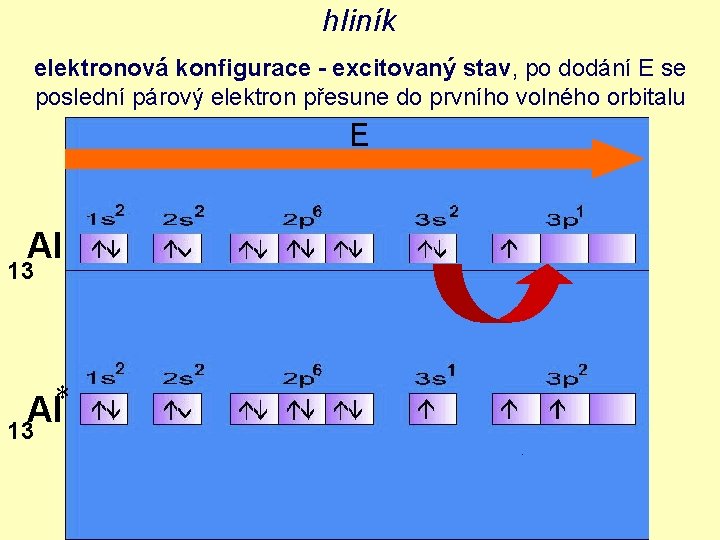
hliník elektronová konfigurace - excitovaný stav, po dodání E se poslední párový elektron přesune do prvního volného orbitalu E Al 13 * Al 13

hliník historie přípravy hliníku: První připravil hliník v roce 1825 Dán Hans Christian Oersted z kamence, chemicky dodekahydrátu síranu hlinito-draselného. Nejdřív připravil chlorid hlinitý tak, že proháněl plynný chlor nad směsí kamence a dřevěného Obr. č. 1 uhlí žhavého do červena. H. Ch. Oersted Poté nechal chlorid hlinitý reagovat s amalgamem draslíku, čímž získal amalgam hliníku, od něhož oddestiloval rtuť a tak připravil hrudku kovu, který leskem a barvou připomínal cín. Byl to hliník znečištěný rtutí. Pokusy o zopakování postupu provedené ve dvacátých letech dvacátého století potvrdily, že se hliník dá takto získat. Vlastnosti hliníku poprvé popsal Friedrich Wöhler r. 1827.

hliník chemické vlastnosti hliníku: doplň: reakce hliníku s O 2 + Al →

hliník chemické vlastnosti hliníku: Co se stane, když vystavíme hliníkové předměty kontaktu se rtutí, nebo její solí? doplň: H 2 O + Al → následná reakce s H 2 O pozn. amalgamace = vznik slitiny se rtutí

hliník chemické vlastnosti hliníku: Co se stane, když vystavíme hliníkové předměty kontaktu se rtutí, nebo její solí? doplň: následná reakce s O 2 + Al →

hliník chemické vlastnosti hliníku: Co se stane, když vystavíme hliníkové předměty kontaktu se rtutí, nebo její solí? doplň: následná reakce s Br 2 + Al →

hliník chemické vlastnosti hliníku: Co se stane, když vystavíme hliníkové předměty kontaktu se rtutí, nebo její solí? doplň: následná reakce s HCl + Al →

hliník chemické vlastnosti hliníku: Co se stane, když vystavíme hliníkové předměty kontaktu se rtutí, nebo její solí? doplň: následná reakce s Na. OH + Al →

hliník chemické vlastnosti hliníku: doplň: S + Al → reakce hliníkového prachu se sírou

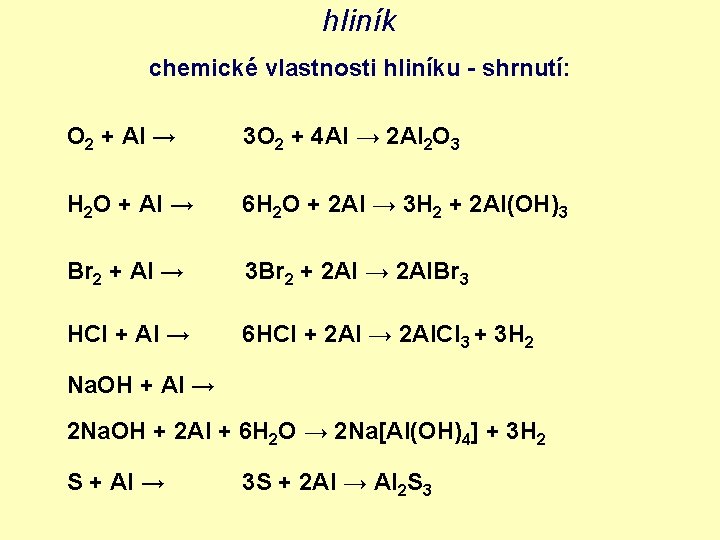
hliník chemické vlastnosti hliníku - shrnutí: O 2 + Al → 3 O 2 + 4 Al → 2 Al 2 O 3 H 2 O + Al → 6 H 2 O + 2 Al → 3 H 2 + 2 Al(OH)3 Br 2 + Al → 3 Br 2 + 2 Al → 2 Al. Br 3 HCl + Al → 6 HCl + 2 Al → 2 Al. Cl 3 + 3 H 2 Na. OH + Al → 2 Na. OH + 2 Al + 6 H 2 O → 2 Na[Al(OH)4] + 3 H 2 S + Al → 3 S + 2 Al → Al 2 S 3

hliník VŠE CO VYPADÁ JAKO HLINÍK, JE SKUTEČNĚ HLINÍK? řada 1000 – Al minimálně 99 % a více řada 3000 – slitina Al + Mn řada 5000 – slitina Al + Mg řada 7000 – slitina Al + Zn řada 2000 – slitina Al + Cu řada 4000 – slitina Al + Si řada 6000 – slitina Al + Mg + Si řada 8000 – slitina Al + různé výhody slitin: - nízká hustota - vysoká pevnost - odolnost proti korozi - odolnost proti kyselinám - vysoká el. a tepelná vodivost - dobrá svařovatelnost - slušná recyklovatelnost = úspory - dobrá odlévatelnost … nevýhody: malá tvrdost malá obrobitelnost nízká leštitelnost měkké sl. elektrochemická koroze

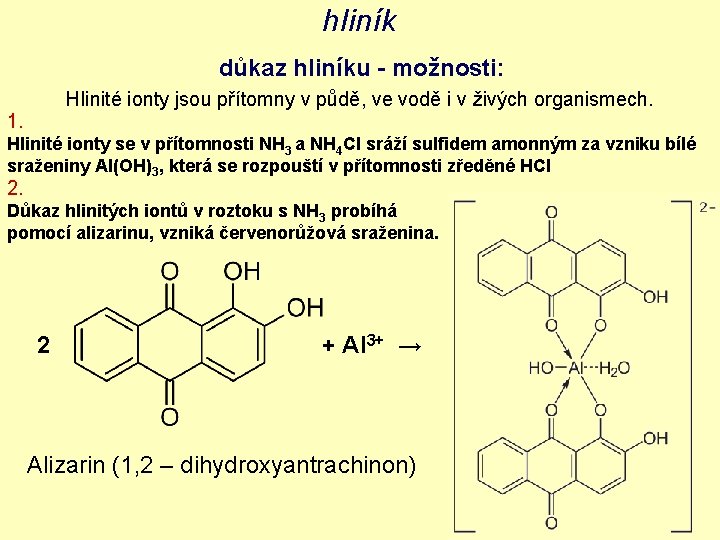
hliník důkaz hliníku - možnosti: Hlinité ionty jsou přítomny v půdě, ve vodě i v živých organismech. 1. Hlinité ionty se v přítomnosti NH 3 a NH 4 Cl sráží sulfidem amonným za vzniku bílé sraženiny Al(OH)3, která se rozpouští v přítomnosti zředěné HCl 2. Důkaz hlinitých iontů v roztoku s NH 3 probíhá pomocí alizarinu, vzniká červenorůžová sraženina. 2 + Al 3+ → Alizarin (1, 2 – dihydroxyantrachinon)

hliník biochemický význam hliníku: - dlouho byl považován za netoxický. - 70. léta 20. století - hliník byl považován za rizikový faktor pro vznik Alzheimerovy demence (v 90. letech 20. st. vyvráceno) - v půdě je přítomný v podobě Al 3+, uvolňuje se ve zvýšené míře při p. H půdy < 5, jeho zvýšená koncentrace je pro rostliny toxická - vitamín C likviduje při kontaktu méně než například měď, železo

CHEMIE HLINÍKU Vytvořeno v rámci projektu Gymnázium Sušice - Brána vzdělávání II Autor: Mgr. Radovan Sloup, Gymnázium Sušice Předmět: Chemie (Anorganická chemie) Třída: sexta osmiletého gymnázia Označení: VY_32_INOVACE_Ch-3_04 Datum vytvoření: srpen 2012 Anotace a metodické poznámky Prezentace je určena pro shrnutí chemie hliníku v rozsahu SŠ, pro zopakování základních reakcí hliníku a pro zhodnocení jeho využití, analýzy a biochemických účinků. Materiál je vhodné podle možností doplnit reálnými experimenty. Pro reálný experiment je možné demonstrovat hoření prskavky (oxidace hliníkového prachu). Použité materiály: Honza, J. ; Mareček, A. ; Chemie pro čtyřletá gymnázia (1. díl). Brno: Da. Ta. Print, 1995; ISBN 80 -900066 -6 -3 Strunecká, A. ; Patočka. J. ; Nové poznatky o toxických účincích fluoru a hliníku. Interní medicína pro praxi 2001/5, s. 205 -208 Greenwood, N. N. ; Earnshaw, A. ; Chemie prvků I. Praha: Informatorium, 1993, ISBN 80 -85427 -38 -9 Obr č. 1 – C. A. Jensen, http: //commons. wikimedia. org/wiki/File: H. _C. _%C 3%98 rsted_(C. _A. _Jensen). jpg Ostatní obrázky a schémata jsou dílem autora prezentace. Vše je vytvořeno pomocí nástrojů Power Point 2003, Chem. Sketch 11. 01, Zoner. Photo. Studio 14, Gimp 2. 6. 11 Materiály jsou určeny pro bezplatné používání pro potřeby výuky a vzdělávání na všech typech škol a školských zařízení. Jakékoliv další využití podléhá autorskému zákonu.
 Tata nama senyawa karbon
Tata nama senyawa karbon Ch3-ch2-ch=ch2+hcl
Ch3-ch2-ch=ch2+hcl Metternich system
Metternich system Solubility of amines
Solubility of amines Ch3-ch3-oh
Ch3-ch3-oh Compuestos nitrogenados
Compuestos nitrogenados Ch3-ch-ch2-ch-ch3
Ch3-ch-ch2-ch-ch3 Esters naming
Esters naming Ch3 ch2 ch2 ch2 ch2 ch2 ch3
Ch3 ch2 ch2 ch2 ch2 ch2 ch3 Hidrocarbonetos
Hidrocarbonetos Alquenos ejemplos
Alquenos ejemplos οξειδωση αλδευδων
οξειδωση αλδευδων Dum spiro spero
Dum spiro spero Dum 14
Dum 14 Krysař hlavní myšlenka
Krysař hlavní myšlenka Noite fechada recursos expressivos
Noite fechada recursos expressivos Iontovy dum
Iontovy dum Polyfunkční dům definice
Polyfunkční dům definice Ceterum ego dum omnia stupeo
Ceterum ego dum omnia stupeo Dům s pečovatelskou službou ostrava mariánské hory
Dům s pečovatelskou službou ostrava mariánské hory Dum audes ardua vinces
Dum audes ardua vinces