Chemie dusku CH3 Anorganick chemie DUM 6 2








- Slides: 13


Chemie dusíku CH-3 Anorganická chemie, DUM č. 6 2. ročník čtyřletého studia Mgr. Radovan Sloup Gymnázium Sušice Tento materiál byl vytvořen v rámci projektu Gymnázium Sušice – Brána vzdělávání II

Osnova: dusík Jaká je značka dusíku a jeho postavení v tabulce? Elektronová konfigurace dusíku. Kdo dusík poprvé připravil a jaké jsou jeho fyzikální vlastnosti? Jak probíhá výroba a příprava dusíku? Jaké jsou chemické vlastnosti dusíku? K čemu se dusík používá? 3

dusík značka dusíku je odvozena z latinského názvu: NITROGENIUM značka dusíku je? Na Ni N No Ne 4

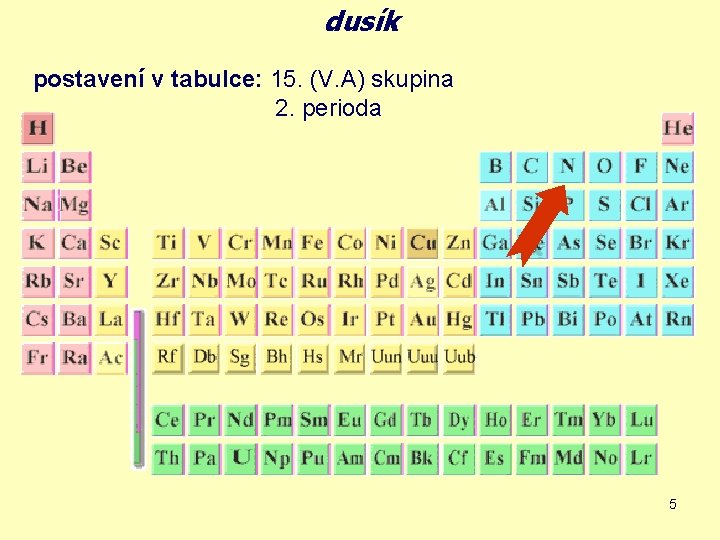
dusík postavení v tabulce: 15. (V. A) skupina 2. perioda 5

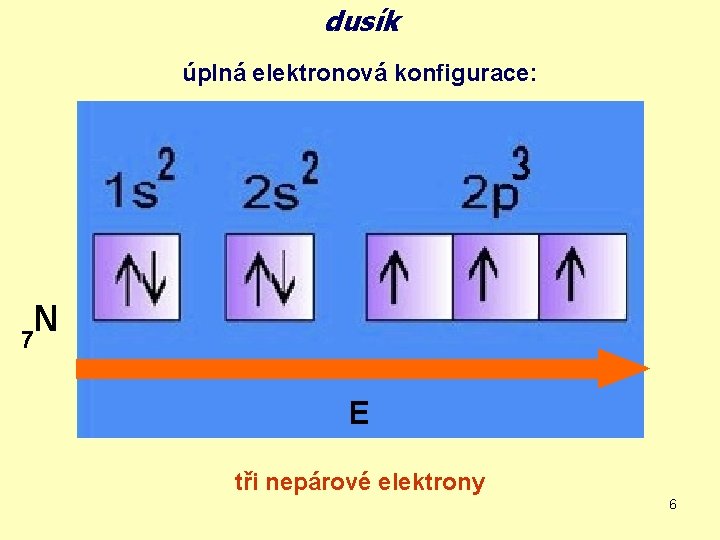
dusík úplná elektronová konfigurace: N 7 E tři nepárové elektrony 6

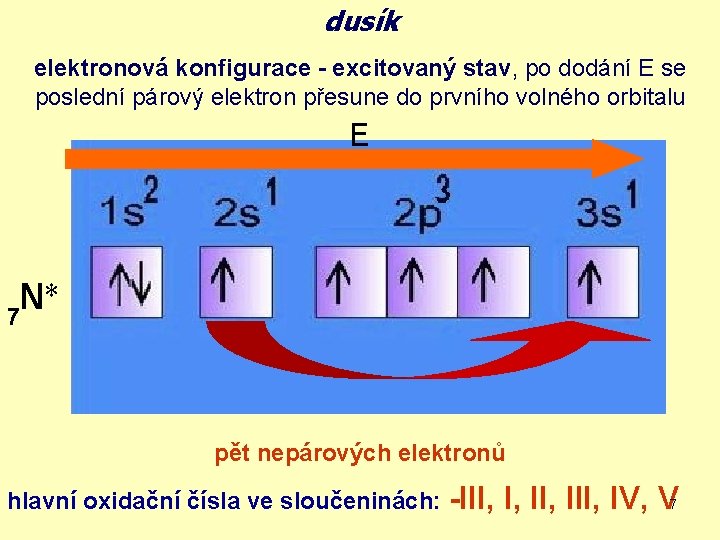
dusík elektronová konfigurace - excitovaný stav, po dodání E se poslední párový elektron přesune do prvního volného orbitalu E * N 7 pět nepárových elektronů hlavní oxidační čísla ve sloučeninách: -III, I, III, IV, V 7

historie přípravy dusíku: obr. 1 Dusík - plyn popsal jako první němec Carl Wilhelm Scheele (obr. ) v roce 1777 a francouz Antoine Lavoisier jej pojmenoval jako azote, což znamená „dusivý plyn“. Další název „nitrogéne“ znamená „ledkotvorný“ a udržel se v latinském označení nitrogenium. Český název dusík vznikl překladem jeho německého názvu Stickstoff a pochází od bratrů Preslových. fyzikální vlastnosti dusíku: Tt = -210 °C, Tv = -195, 7 °C bez zápachu, bez chuti, nejedovatý, nepodporuje hoření, nerozpustný ve vodě, hustota 1, 25 kg/m 3, součást atmosféry 8 tvoří 78 jejích objemových procent v podobě molekul N 2 bezbarvý plyn za norm. podmínek,

dusík příprava dusíku v laboratoři např. : (NH 4)2 Cr 2 O 7 → Cr 2 O 3 + H 2 O + N 2 výroba dusíku: destilace zkapalněného vzduchu - co je to destilace? Metoda oddělování složek homogenní směsi (roztoku) na základě rozdílné teploty varu. dusík: T = -195, 7 °C v kyslík: Tv = -183 °C argon: Tv = -186 °C 9

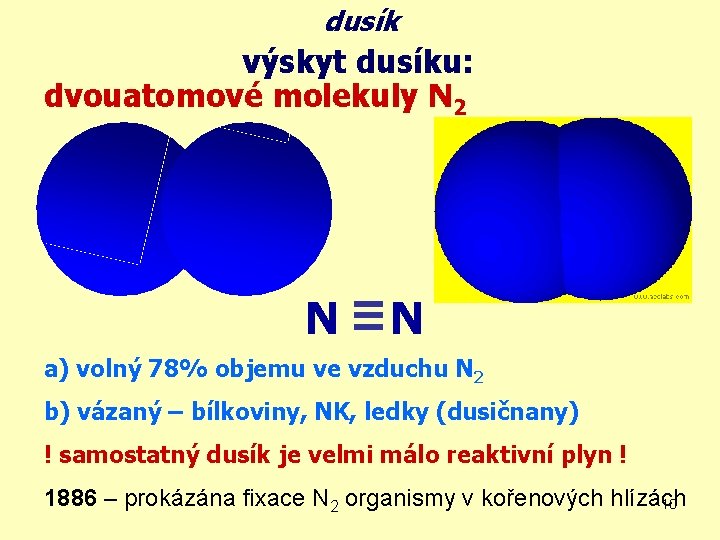
dusík výskyt dusíku: dvouatomové molekuly N 2 N N a) volný 78% objemu ve vzduchu N 2 b) vázaný – bílkoviny, NK, ledky (dusičnany) ! samostatný dusík je velmi málo reaktivní plyn ! 1886 – prokázána fixace N 2 organismy v kořenových hlízách 10

dusík použití dusíku: a)výroba NH 3 amoniaku a kyseliny dusičné N 2 + 3 H 2 → 2 NH 3 4 NH 3 + 5 O 2 → 4 NO + 6 H 2 O 2 NO + O 2 → 2 NO 2 3 NO 2 + H 2 O → 2 HNO 3 + NO b) výroba hnojiv (dusičnany, NPK…) c) inertní atmosféra (při sváření kovů, …) 11 d) kapalný dusík (uchování biomateriálu)

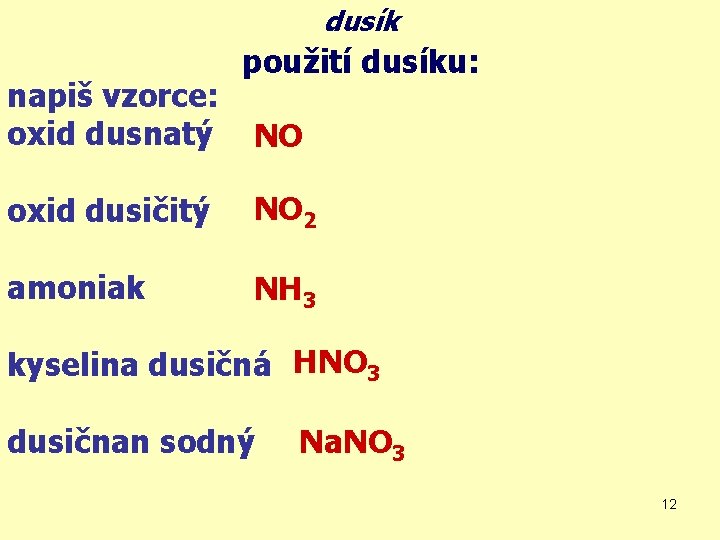
dusík napiš vzorce: oxid dusnatý použití dusíku: NO oxid dusičitý NO 2 amoniak NH 3 kyselina dusičná HNO 3 dusičnan sodný Na. NO 3 12

CHEMIE DUSÍKU Vytvořeno v rámci projektu Gymnázium Sušice - Brána vzdělávání II Autor: Mgr. Radovan Sloup, Gymnázium Sušice Předmět: Chemie (Anorganická chemie) Třída: sexta osmiletého gymnázia Označení: VY_32_INOVACE_Ch-3_06 Datum vytvoření: LISTOPAD 2012 Anotace a metodické poznámky Prezentace je určena pro úvod chemie dusíku v rozsahu SŠ. Pro zopakování základních vlastností dusíku a jeho výskytu. Zmíněna je příprava dusíku, jeho základní použití a reakce v průmyslových výrobách. Během prezentace se objeví několik úkolů k řešení, které je součástí jednotlivých slidů. Materiál je vhodné podle možností doplnit reálnými experimenty. Pro reálný experiment je možné demonstrovat rozklad dichromanu amonného. Vhodné uspořádání je zřejmé z obrázku na slidu číslo 9. Tento experiment je možné provézt také ve zkumavce, kterou zahříváme nad plamenem. Vznikající dusík můžeme dokázat vsunutím hořící špejle, která po chvilce uhasne. Použité materiály: Honza, J. ; Mareček, A. ; Chemie pro čtyřletá gymnázia (1. díl). Brno: Da. Ta. Print, 1995; ISBN 80 -900066 -6 -3 obr 1. (29. 10. 2012), autor: neznámý: http: //commons. wikimedia. org/wiki/File: PSM_V 31_D 740_Carl_Wilhelm_Scheele. jpg Greenwood, N. N. ; Earnshaw, A. ; Chemie prvků I. Praha: Informatorium, 1993, ISBN 80 -85427 -38 -9 Obrázky a schémata jsou dílem autora prezentace. Vše je vytvořeno pomocí nástrojů Power Point 2003, Zoner. Photo. Studio 14, Malování, Gimp 2. 6. 11 Materiály jsou určeny pro bezplatné používání pro potřeby výuky a vzdělávání na všech typech škol a školských zařízení. Jakékoliv další využití podléhá autorskému zákonu.