Chemie kyslku CH3 Anorganick chemie DUM 8 2









- Slides: 13


Chemie kyslíku CH-3 Anorganická chemie, DUM č. 8 2. ročník čtyřletého studia Mgr. Radovan Sloup Gymnázium Sušice Tento materiál byl vytvořen v rámci projektu Gymnázium Sušice – Brána vzdělávání II

Osnova: kyslík Jaká je značka kyslíku a jeho postavení v tabulce? Elektronová konfigurace kyslíku. Kdo kyslík poprvé připravil a jaké jsou jeho fyzikální vlastnosti? Jak probíhá výroba a příprava kyslíku? Jaké jsou chemické vlastnosti kyslíku? K čemu se kyslík používá? Oxidační účinky kyslíku. Biochemický význam kyslíku … 3

kyslík značka kyslíku je odvozena z latinského názvu: OXYGENIUM značka kyslíku je? Ox O Om Og On Ou 4

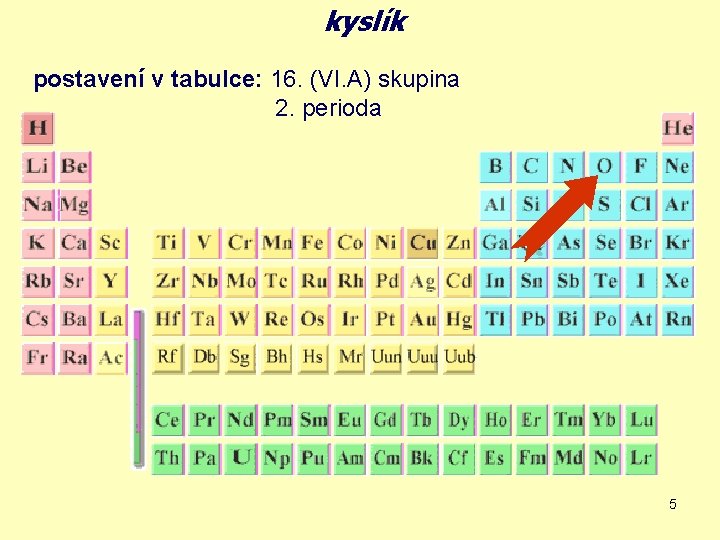
kyslík postavení v tabulce: 16. (VI. A) skupina 2. perioda 5

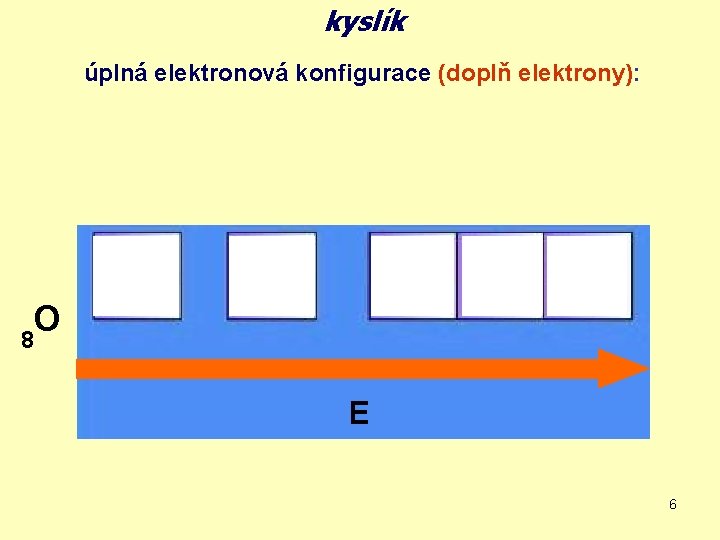
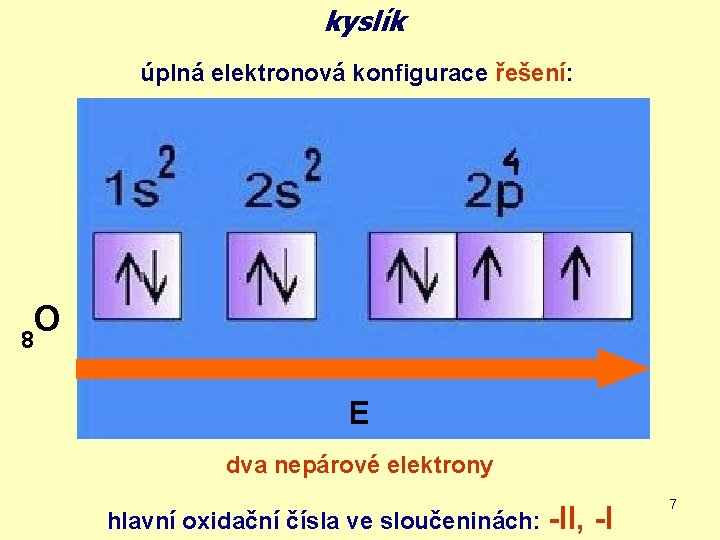
kyslík úplná elektronová konfigurace (doplň elektrony): O 8 E 6

kyslík úplná elektronová konfigurace řešení: O 8 E dva nepárové elektrony hlavní oxidační čísla ve sloučeninách: -II, -I 7

historie přípravy kyslíku: obr. 1 Kyslík popsal jako první němec Carl Wilhelm Scheele v roce 1772 a pojmenoval jej „ohnivý vzduch“. 1779 A. Lavoisier navrhuje název „oxygen“ – neboli „kyselinu tvořící“, udržel se v latinském označení oxygenium. Český název kyslík navrhl Jan Svatopluk Presl. fyzikální vlastnosti kyslíku: Tt ≈ -219 °C, Tv ≈ -183 °C bez zápachu, bez chuti, nejedovatý, podporuje hoření, rozpustný ve vodě, hustota 1, 43 kg/m 3, součást atmosféry, tvoří 21 jejích objemových procent v podobě molekul O 2 (příp. O 3) 8 bezbarvý plyn za norm. podmínek,

kyslík příprava a důkaz kyslíku v laboratoři např. : 2 KMn. O 4 → O 2 + K 2 Mn. O 4 + Mn. O 2 2 KNO 3 → O 2 + 2 KNO 2 2 H 2 O 2 → O 2 + 2 H 2 O výroba kyslíku: destilace zkapalněného vzduchu: Metoda oddělování složek homogenní směsi (roztoku) na základě rozdílné teploty varu. dusík: Tv = -195, 7 °C kyslík: Tv = -183 °C argon: Tv = -186 °C 9

kyslík chemické vlastnosti např. reakce hliníku s O 2 doplň: O 2 + Al → 10

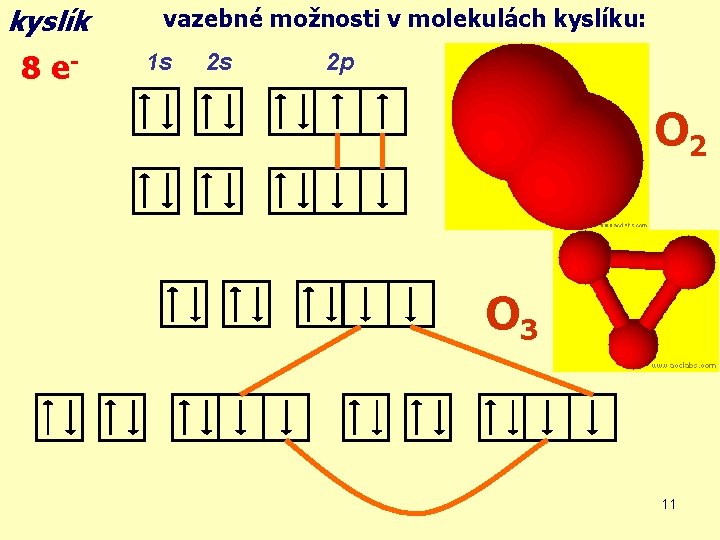
kyslík 8 e- vazebné možnosti v molekulách kyslíku: 1 s 2 s 2 p O 2 O 3 11

kyslík ! výrazné oxidační účinky ! doplň reakce úplných oxidací (hoření): O 2 + Al → 3 O 2 + 4 Al → 2 Al 2 O 3 O 2 + C → CO 2 + Fe → 3 O 2 + 4 Fe → 2 Fe 2 O 3 O 2 + Li → O 2 + 4 Li → 2 Li 2 O O 2 + Na → 2 Na + O 2 → Na 2 O 2 + S → SO 2 12

obr 1. (29. 10. 2012), autor: neznámý: http: //commons. wikimedia. org/wiki/File: PSM_V 31_D 740_Carl_Wilhelm_Scheele. jpg
 2 metil 3 pentanon
2 metil 3 pentanon Reaksi ch3 ch2 cl
Reaksi ch3 ch2 cl Metternich system
Metternich system οξειδωση αλδευδων
οξειδωση αλδευδων Ch3 nh ch ch3 twice
Ch3 nh ch ch3 twice Ch3-ch3-oh
Ch3-ch3-oh N metilpentanamida
N metilpentanamida Reacciones de los halogenuros de alquilo
Reacciones de los halogenuros de alquilo Ester hydrolysis to carboxylic acid
Ester hydrolysis to carboxylic acid Ch3 ch2 ch2 ch2 ch2 ch2 ch3
Ch3 ch2 ch2 ch2 ch2 ch2 ch3 Ch3-ch2-ch3 nome
Ch3-ch2-ch3 nome Alquenos ejemplos
Alquenos ejemplos Banging the drums like dum diddy day
Banging the drums like dum diddy day Neruda fejetony podpis
Neruda fejetony podpis