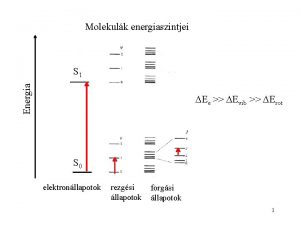
8 A MOLEKULK ELEKTRONSZERKEZETE Molekulk energiaszintjei Energia S






















![Spektrum ábrázolása: Vízszintes tengelyen [nm] (fizikában ν [1/cm]) Függőleges tengelyen intenzitás abszorbancia transzmisszió Leggyakrabban Spektrum ábrázolása: Vízszintes tengelyen [nm] (fizikában ν [1/cm]) Függőleges tengelyen intenzitás abszorbancia transzmisszió Leggyakrabban](https://slidetodoc.com/presentation_image_h2/c3c983f618366921947cd467ff690b49/image-43.jpg)




![Spektrum ábrázolása: Vízszintes tengelyen [nm] Függőleges tengelyen intenzitás IF (önkényes egység) F fluoreszcencia kvantumhatásfok Spektrum ábrázolása: Vízszintes tengelyen [nm] Függőleges tengelyen intenzitás IF (önkényes egység) F fluoreszcencia kvantumhatásfok](https://slidetodoc.com/presentation_image_h2/c3c983f618366921947cd467ff690b49/image-53.jpg)




![Optikai forgatóképesség A királis vegyület oldata a polarizáció síkját elfordítja: a = [M]·c· [M] Optikai forgatóképesség A királis vegyület oldata a polarizáció síkját elfordítja: a = [M]·c· [M]](https://slidetodoc.com/presentation_image_h2/c3c983f618366921947cd467ff690b49/image-64.jpg)
![[M] függ a hullámhossztól Polariméter: néhány hullámhosszon méri [M]-et, legtöbbször a Na D-vonalán ([M]D) [M] függ a hullámhossztól Polariméter: néhány hullámhosszon méri [M]-et, legtöbbször a Na D-vonalán ([M]D)](https://slidetodoc.com/presentation_image_h2/c3c983f618366921947cd467ff690b49/image-65.jpg)



- Slides: 74

8. A MOLEKULÁK ELEKTRONSZERKEZETE

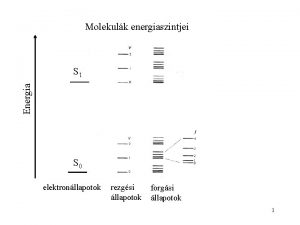
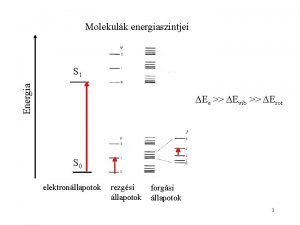
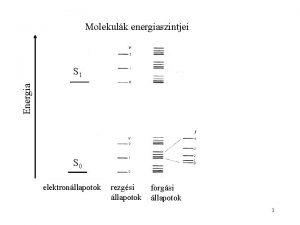
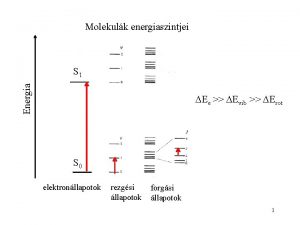
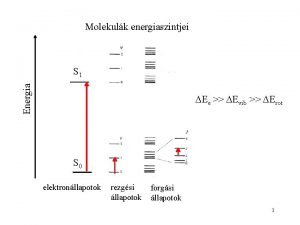
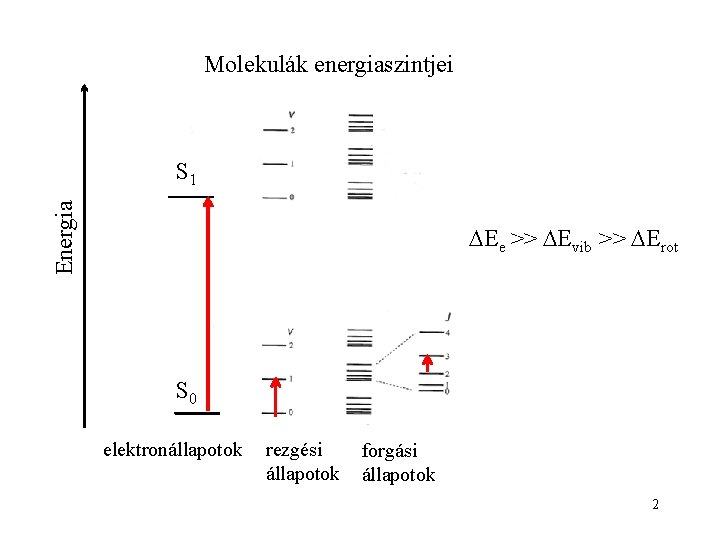
Molekulák energiaszintjei Energia S 1 Ee >> Evib >> Erot S 0 elektronállapotok rezgési állapotok forgási állapotok 2

8. 1. A független részecske modell molekulákra (A molekulapálya-modell) 3

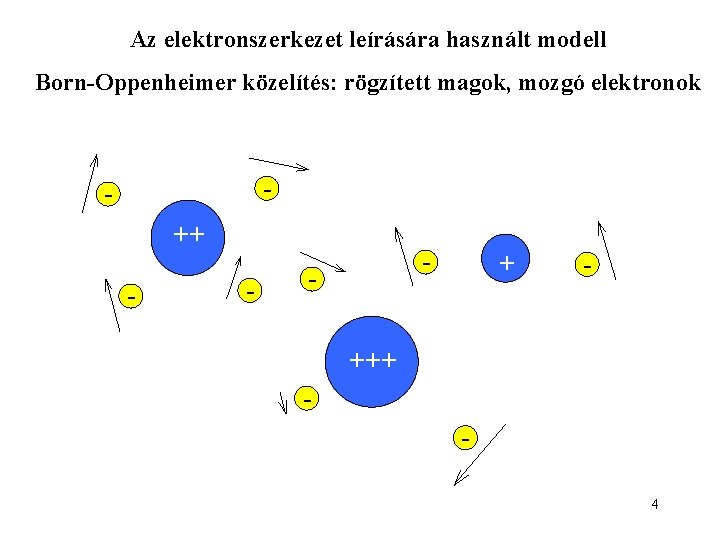
Az elektronszerkezet leírására használt modell Born-Oppenheimer közelítés: rögzített magok, mozgó elektronok - ++ - - + - +++ 4

Schrödinger-egyenlet a modellre: 5

az elektronok mozgási energiájának operátora 6

a magok mozgási energiájának operátora , mivel a magok rögzítve vannak! 7

a mag-elektron vonzás pot. E operátora Zke a k-ik mag töltése ri, k az i-ik elektron és a k-ik mag távolsága 8

az elektron-elektron taszítás pot. E operátora ri, j az i-ik és a j-ik elektron távolsága 9

a mag-mag taszítás pot. E operátora rk, ℓ a k-ik és a ℓ-ik mag távolsága állandó, mivel a magok rögzítve vannak! 10

Ezt a differenciál egyenletet nem lehet analitikusan megoldani, csak közelítő módszerrel (numerikusan). És még akkor is nehéz! 11

A feladat egyszerűbb, ha az egyes elektronok mozgását elválasztjuk: FÜGGETLEN-RÉSZECSKE MODELL (az atomok szerkezeténél már szerepelt, most több mag - több elektron rendszerre, és a számítás algoritmusát is bemutatva) 12

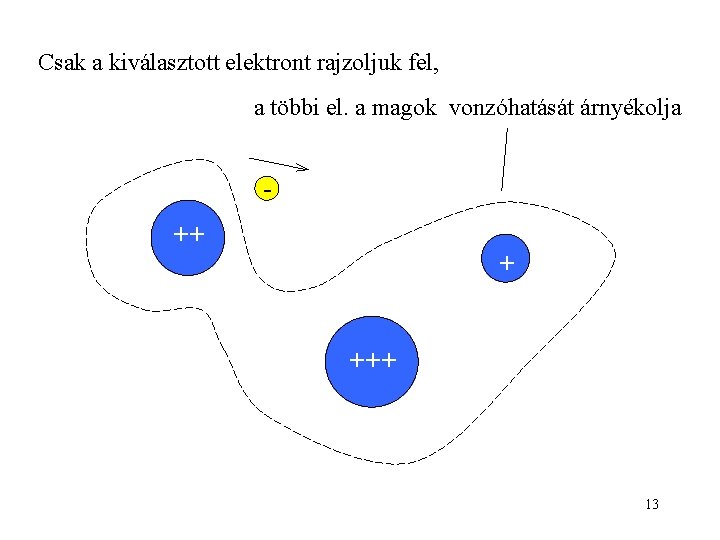
Csak a kiválasztott elektront rajzoljuk fel, a többi el. a magok vonzóhatását árnyékolja ++ + +++ 13

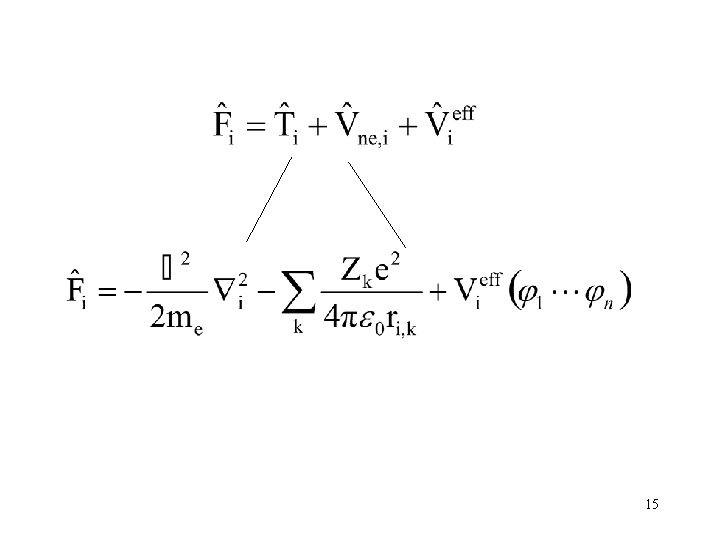
A külön mozgó elektronokra külön Schrödingeregyenletet írhatunk fel. Az i-ik elektronra: Az i-ik elektron a Fock-operátora az i-ik elektron hullámfüggvénye 14

15

A független részecske modellt használva az elektronszerkezetre felírt Shrödinger-egyenletben a Hamilton-operátor 16

A modell előnyei: 1. (számítógéppel) gyorsabb megoldás, 2. szemléletes eredmény: az elektronszerkezet molekulapályákból tevődik össze, amelyeket εi energiájuk φi hullámfüggvényük jellemez MO (molecular orbital) 17

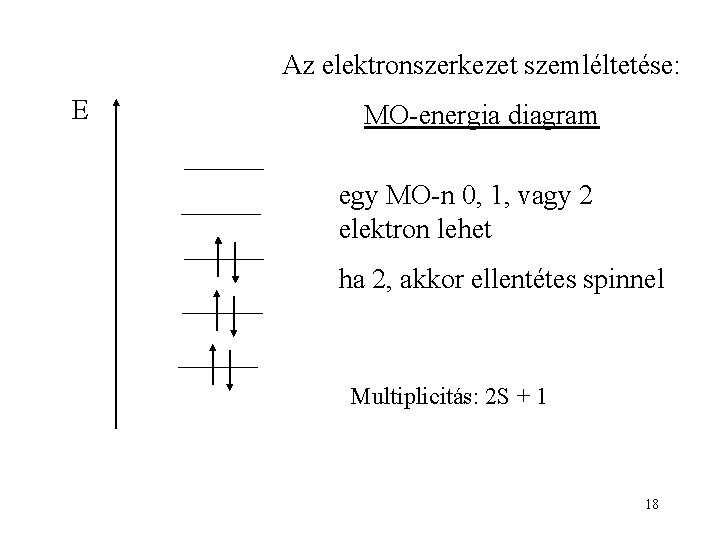
Az elektronszerkezet szemléltetése: E MO-energia diagram egy MO-n 0, 1, vagy 2 elektron lehet ha 2, akkor ellentétes spinnel Multiplicitás: 2 S + 1 18

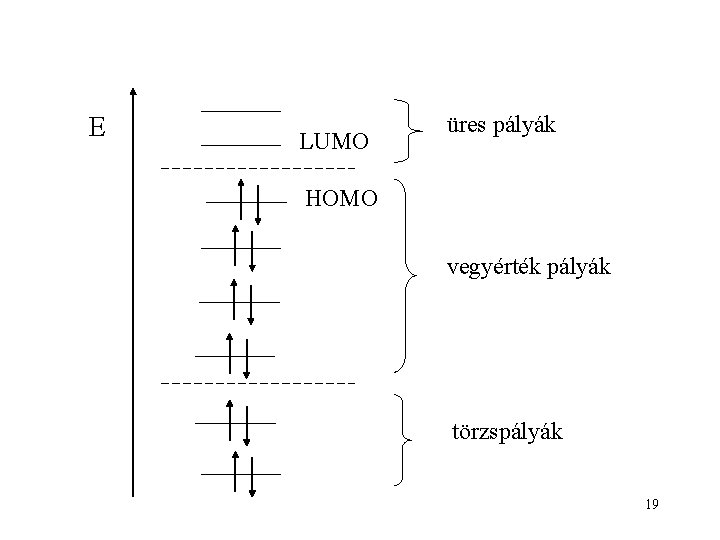
E LUMO üres pályák HOMO vegyérték pályák törzspályák 19

MO-k alakja – a hullámfüggvények ábrázolása Azt a felületet ábrázolják, amelyen belül a MO-n lévő elektron 90 %-os valószínűséggel található. 20

Vegyérték pályák lokális szimmetriája n-pálya: nem-kötő elektronpár -pálya : hengerszimmetrikus a kötés(ek)re -pálya : csomósík a kötés(ek) síkjában 21

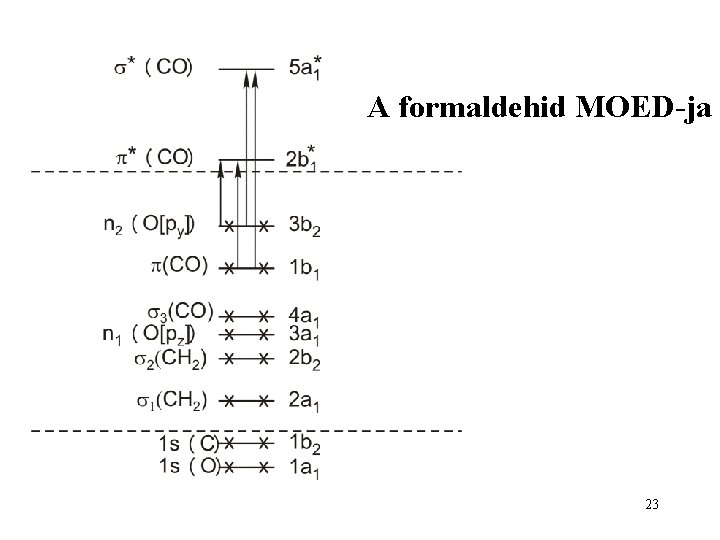
Példa: a formaldehid MO-i 22

A formaldehid MOED-ja 23

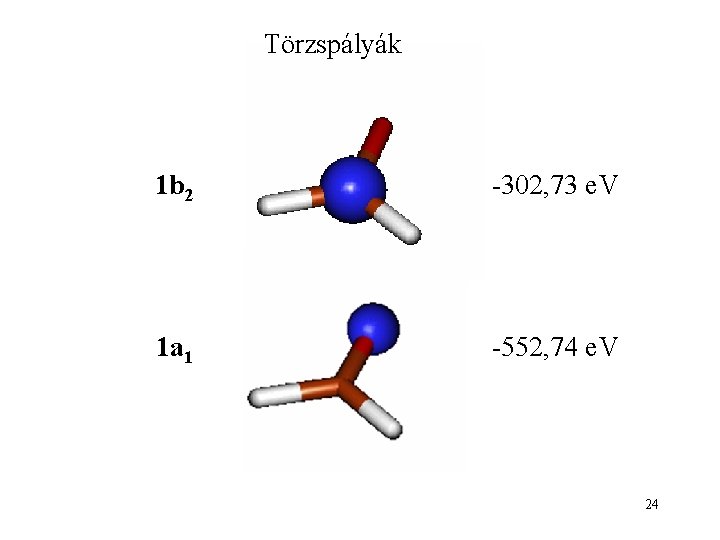
Törzspályák 1 b 2 -302, 73 e. V 1 a 1 -552, 74 e. V 24

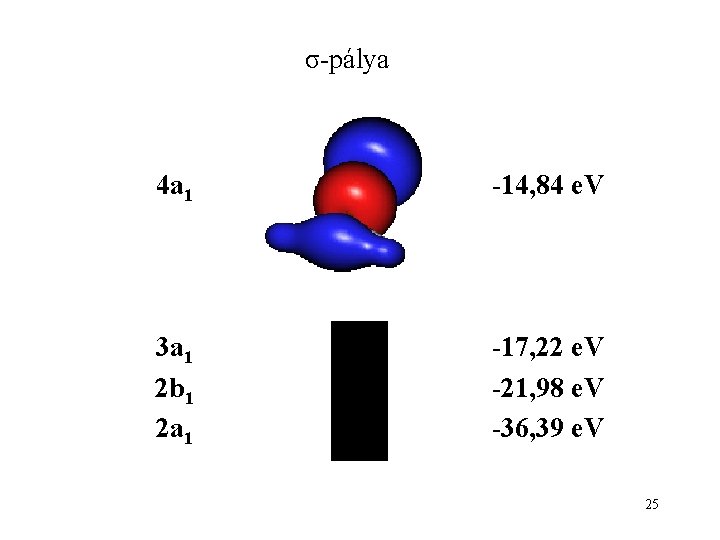
σ-pálya 4 a 1 -14, 84 e. V 3 a 1 2 b 1 2 a 1 -17, 22 e. V -21, 98 e. V -36, 39 e. V 25

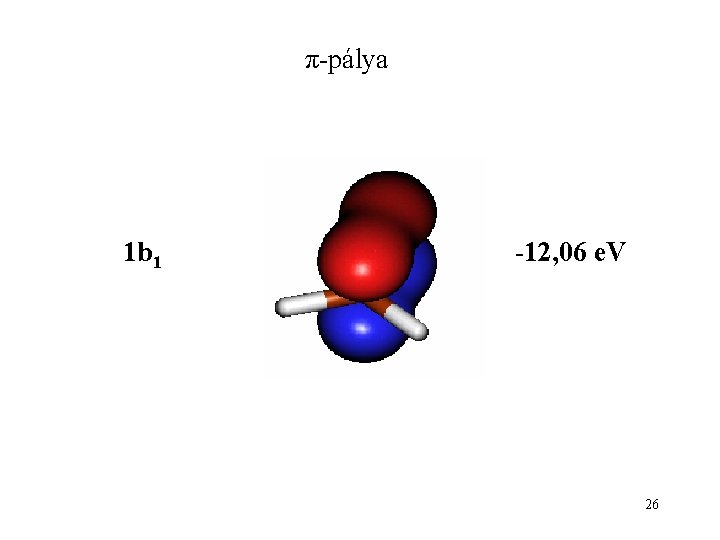
π-pálya 1 b 1 -12, 06 e. V 26

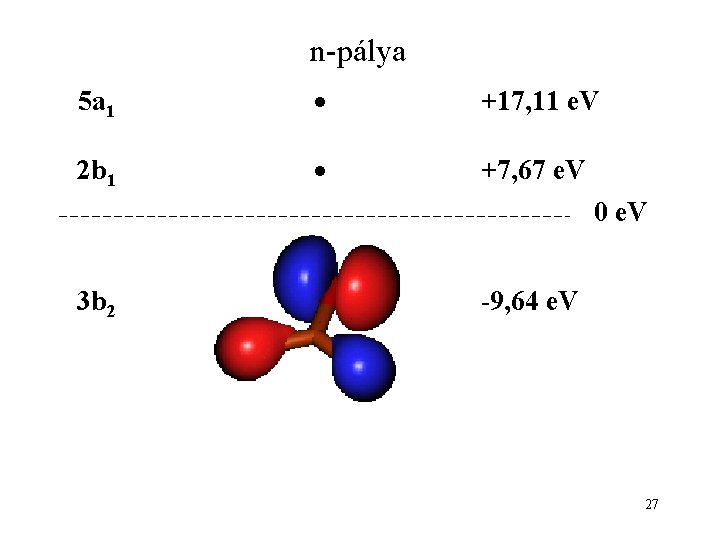
n-pálya 5 a 1 +17, 11 e. V 2 b 1 +7, 67 e. V 0 e. V 3 b 2 -9, 64 e. V 27

Molekulapálya Kémiai kötés Az összes atom részt vesz benne Két atomot köt össze elektrongerjesztés vegyértékrezgés kötéstávolság ionizáció Két különböző fogalom!!! 28

8. 2. Elektrongerjesztések elmélete 29

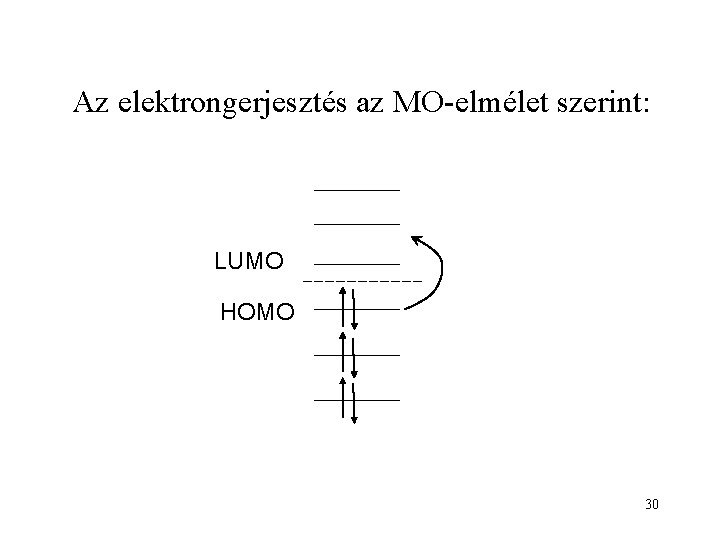
Az elektrongerjesztés az MO-elmélet szerint: LUMO HOMO 30

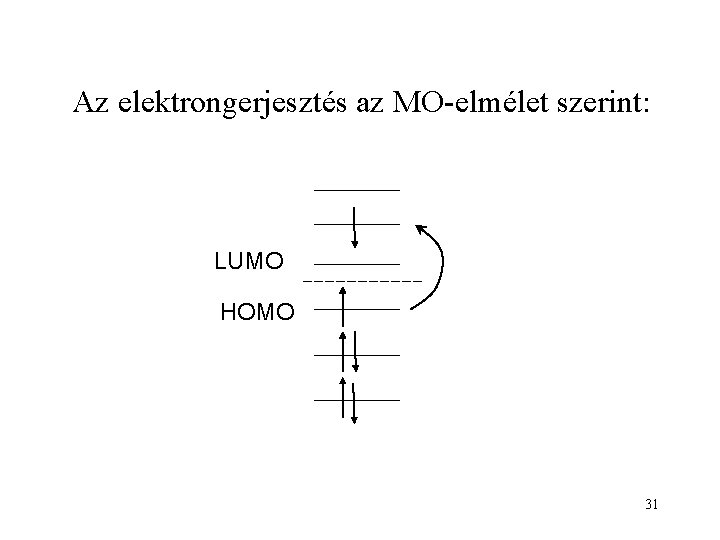
Az elektrongerjesztés az MO-elmélet szerint: LUMO HOMO 31

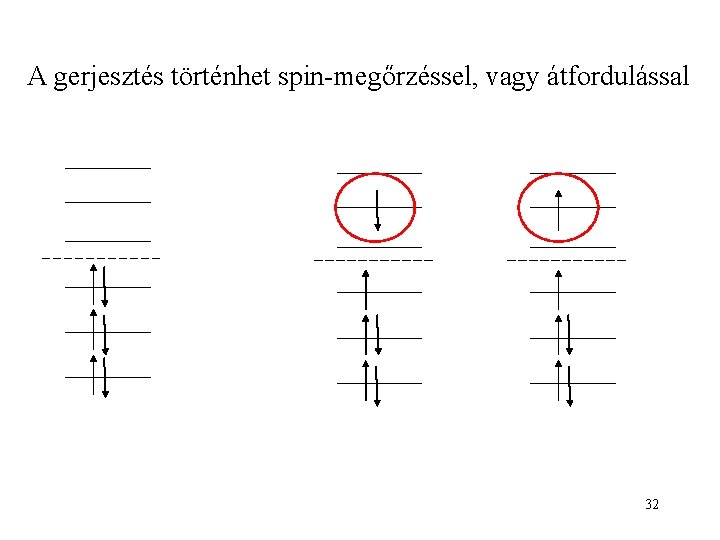
A gerjesztés történhet spin-megőrzéssel, vagy átfordulással 32

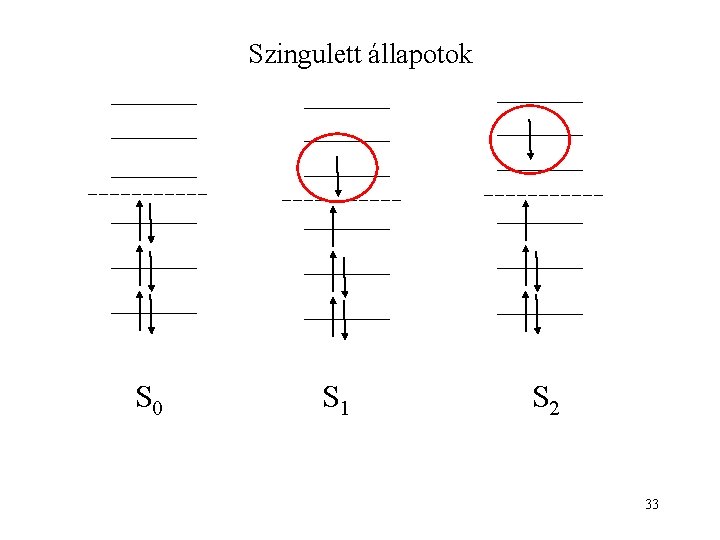
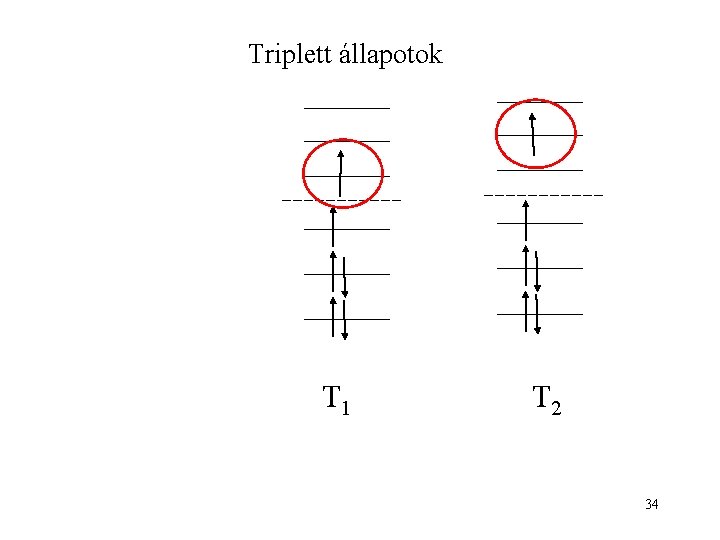
Szingulett állapotok S 0 S 1 S 2 33

Triplett állapotok T 1 T 2 34

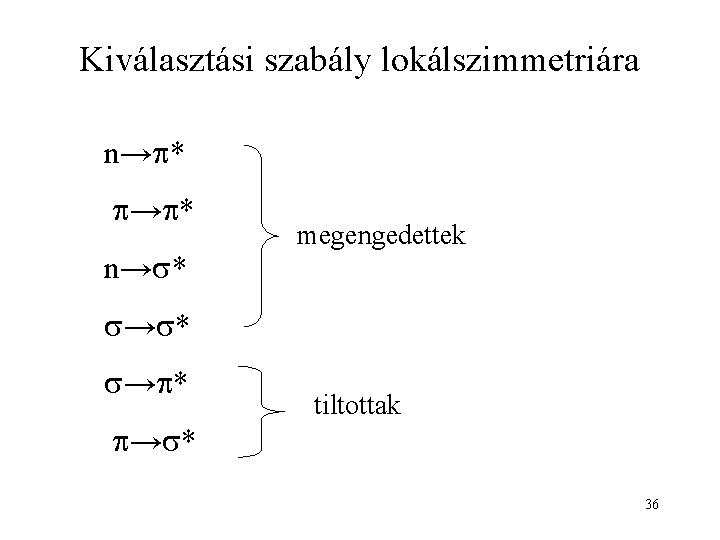
Kiválasztási szabályok szempontjai • Pályák lokálszimmetriája • Spinállapot 35

Kiválasztási szabály lokálszimmetriára n→ * megengedettek → * → * tiltottak 36

Kiválasztási szabály spinállapotra S = 0 37

Elektronállapotok energia-diagramja S 3 S 2 S 1 T 2 T 1 S 0 38

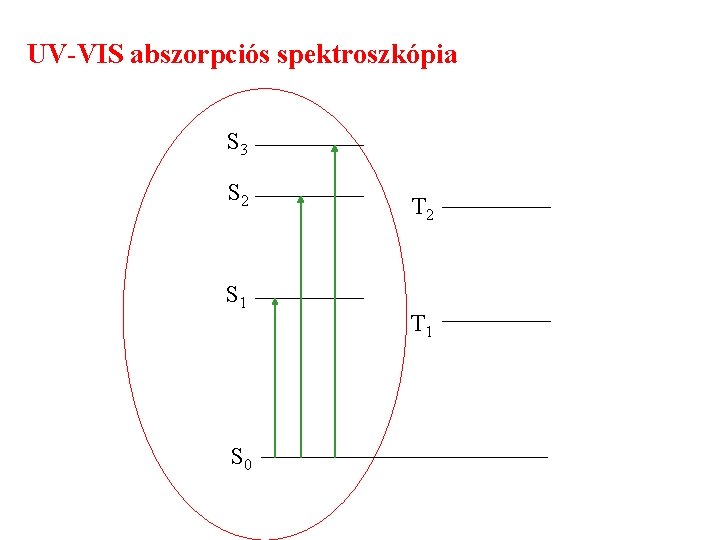
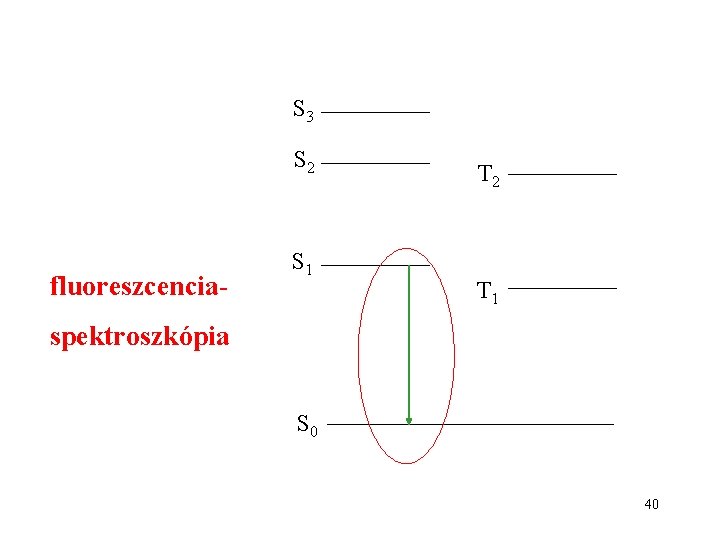
UV-VIS abszorpciós spektroszkópia S 3 S 2 S 1 S 0 T 2 T 1

S 3 S 2 fluoreszcencia- S 1 T 2 T 1 spektroszkópia S 0 40

8. 3. Ultraibolya- és látható abszorpciós spektroszkópia 41

Törzspályákon levő elektronok gerjesztése: röntgensugárzással. Vegyértékpályákon levő MO-król elektronok gerjesztése: UV és látható sugárzással. = 100 -1000 nm Vákuum-ultraibolya tartomány: 100 -170 (200) nm UV-tartomány: 170 (200) - 400 nm Látható tartomány: 400 – 700 (800) nm Közeli IR tartomány: 700 (800) – 2500 nm. 42
![Spektrum ábrázolása Vízszintes tengelyen nm fizikában ν 1cm Függőleges tengelyen intenzitás abszorbancia transzmisszió Leggyakrabban Spektrum ábrázolása: Vízszintes tengelyen [nm] (fizikában ν [1/cm]) Függőleges tengelyen intenzitás abszorbancia transzmisszió Leggyakrabban](https://slidetodoc.com/presentation_image_h2/c3c983f618366921947cd467ff690b49/image-43.jpg)
Spektrum ábrázolása: Vízszintes tengelyen [nm] (fizikában ν [1/cm]) Függőleges tengelyen intenzitás abszorbancia transzmisszió Leggyakrabban oldat mintát vizsgálnak. (Oldószerek: víz, n-hexán, etanol. ) 43

Vizsgálható vegyületek Szerves vegyületek a. ) -kötés és kötetlen elektronpárt is tartalmazó funkciós csoportot tartalmazó molekulák (CO, CN, NO 2 -csoport; n- * átmenet) b. ) laza n-elektronpárt tartalmazó molekulák (Cl, Br, I, Se-tartalmú vegyületek; n- * gerjesztés, 200 nm felett) c. ) konjugált kettőskötéseket tartalmazó molekulák ( -pályák felhasadása miatt - * gerjesztés, 200 nm felett) 44

Szervetlen vegyületek Átmeneti fémek komplexei A fématom degenerált d vagy f pályái a ligandumok hatására felhasadnak. A felhasadt pályák között kicsi az energiakülönbség. Az ilyen elektronátmenet az UV-látható tartományba esik. Elméleti alapok: ligandumtér-elmélet. 45

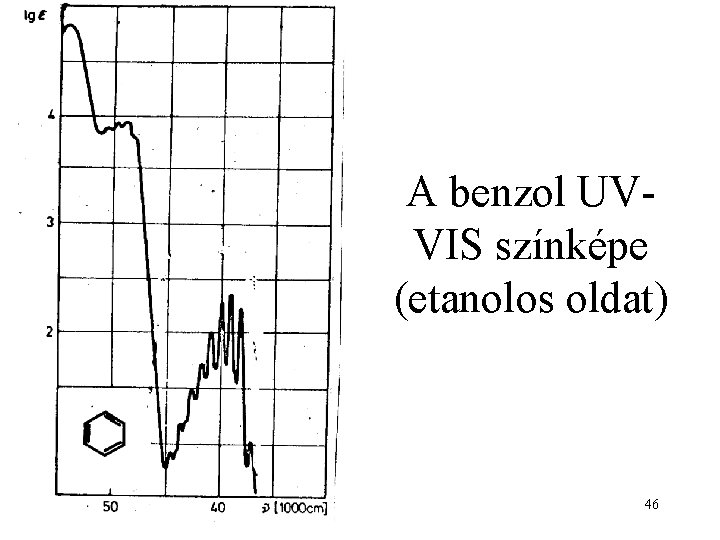
A benzol UVVIS színképe (etanolos oldat) 46

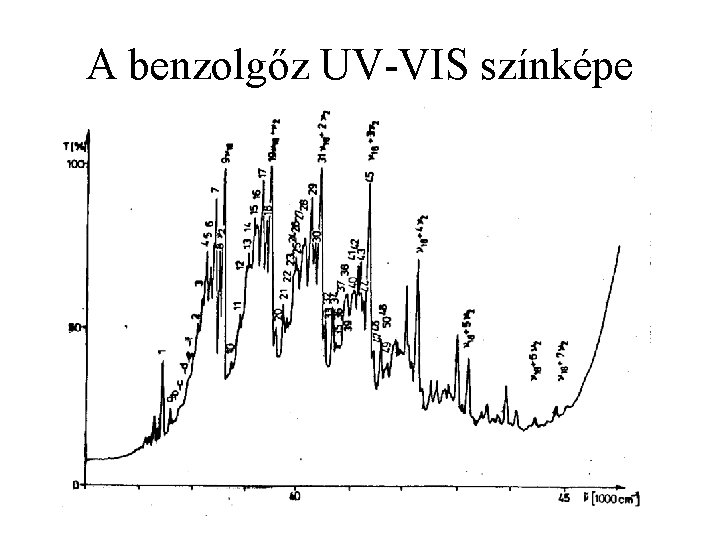
A benzolgőz UV-VIS színképe 47

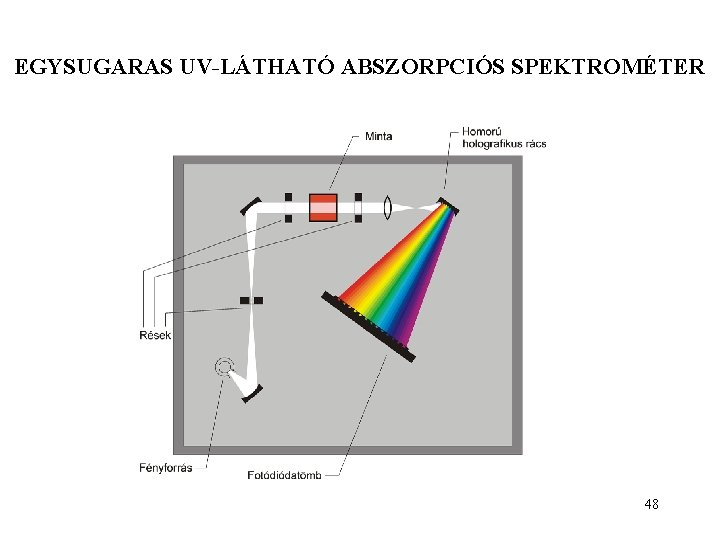
EGYSUGARAS UV-LÁTHATÓ ABSZORPCIÓS SPEKTROMÉTER 48

UV-VIS abszorpciós spektroszkópia alkalmazása: • koncentráció meghatározása oldatban (pontos) • reakciókinetikai vizsgálatok (fotódiódasoros készülék előnyös) • kémiai egyensúlyok vizsgálata 49

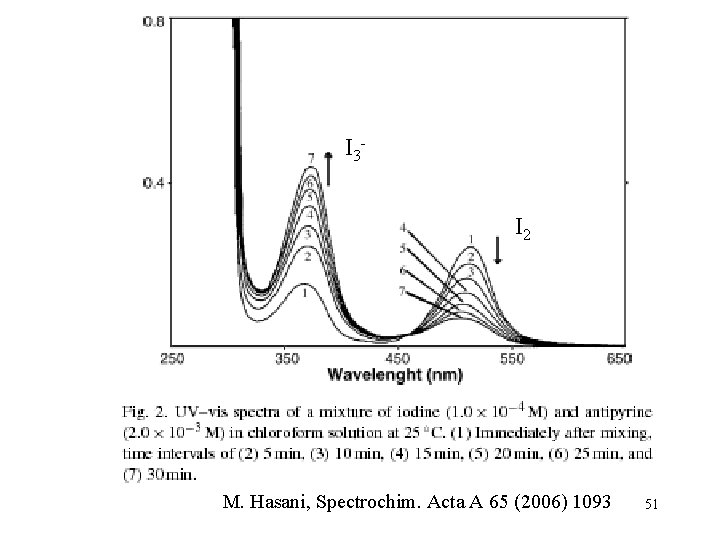
Példa reakciókinetikai alkalmazásra: I 2 redukciója I 3 - ionná antipirinnel oldatban gyulladáscsökkentő gyógyszer 50

I 3 I 2 M. Hasani, Spectrochim. Acta A 65 (2006) 1093 51

8. 4. Fluoreszcencia-spektroszkópia Fluoreszcencia-spektrum: a gerjesztést követő emisszió intenzitását mérjük, az emisszió hullámhossza függvényében. 52
![Spektrum ábrázolása Vízszintes tengelyen nm Függőleges tengelyen intenzitás IF önkényes egység F fluoreszcencia kvantumhatásfok Spektrum ábrázolása: Vízszintes tengelyen [nm] Függőleges tengelyen intenzitás IF (önkényes egység) F fluoreszcencia kvantumhatásfok](https://slidetodoc.com/presentation_image_h2/c3c983f618366921947cd467ff690b49/image-53.jpg)
Spektrum ábrázolása: Vízszintes tengelyen [nm] Függőleges tengelyen intenzitás IF (önkényes egység) F fluoreszcencia kvantumhatásfok Oldószerek: (l. UV-látható abszorpciós spektroszkópia) 53

SPEKTROFLUORIMÉTER 54

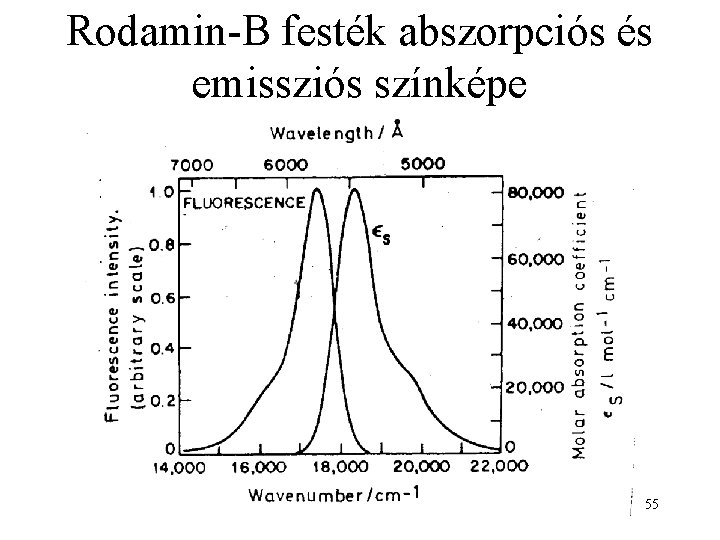
Rodamin-B festék abszorpciós és emissziós színképe 55

A fluoreszcencia-mérés előnye Az érzékenység sokkal nagyobb, mint az abszorpciós mérésnél, mivel - a jelet az I = 0 -hoz (sötétség) képest mérjük, - a vegyületeknek csak kis hányada (aromások, ritka földfémek komplexei) fluoreszkál. 56

Alkalmazások: - kémiai analízis fluoreszcencia-spektrum mérésével (esetleg 10 -10 M-os oldat fluoreszcenciája is mérhető. ) - fluoreszcencia mikroszkóp - orvosi diagnosztika 57

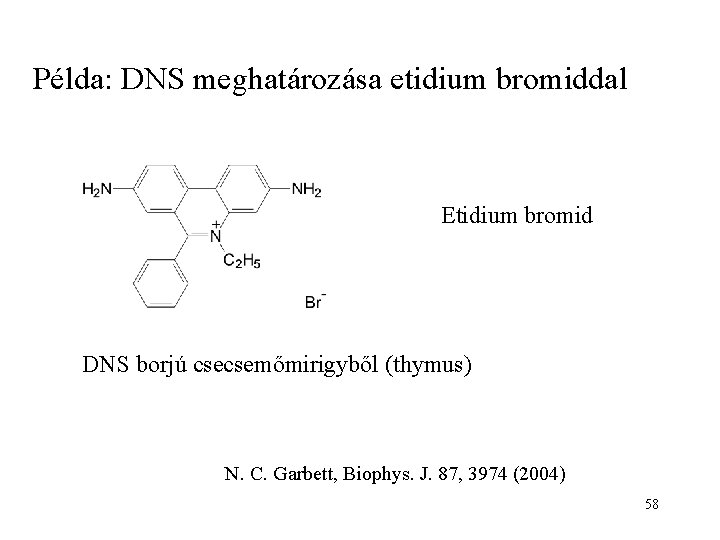
Példa: DNS meghatározása etidium bromiddal Etidium bromid DNS borjú csecsemőmirigyből (thymus) N. C. Garbett, Biophys. J. 87, 3974 (2004) 58

DNS szerkezete Wikipedia - English 59

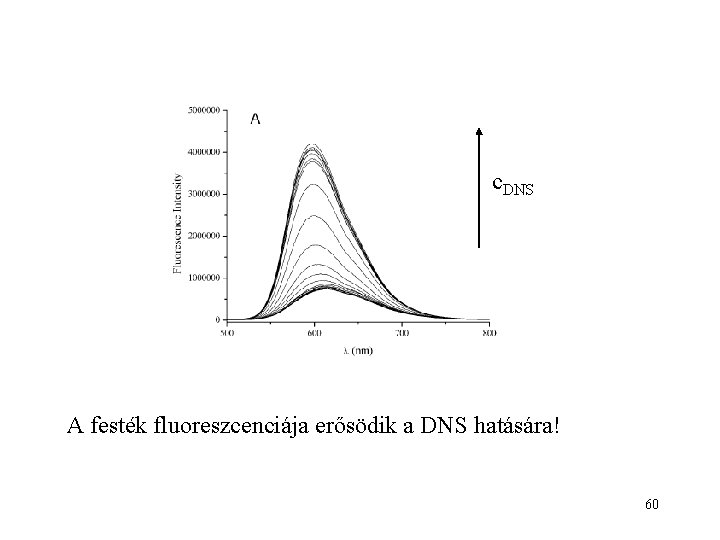
c. DNS A festék fluoreszcenciája erősödik a DNS hatására! 60

2008 kémiai Nobel-díj: zöld fluoreszkáló fehérje (GFP) Roger Tsien, Osamu Shimomura , Martin Chalfie 61

8. 5. Optikai forgatóképesség és cirkuláris dikroizmus Az élő szervezetben sok királis vegyület fordul elő: aminosavak, cukrok, egyes aminok, szteroidok, alkaloidok, terpenoidok Ezek vizsgálhatók kiroptikai módszerekkel: forgatóképesség, ORD, CD 62

síkban polarizált fény 63
![Optikai forgatóképesség A királis vegyület oldata a polarizáció síkját elfordítja a Mc M Optikai forgatóképesség A királis vegyület oldata a polarizáció síkját elfordítja: a = [M]·c· [M]](https://slidetodoc.com/presentation_image_h2/c3c983f618366921947cd467ff690b49/image-64.jpg)
Optikai forgatóképesség A királis vegyület oldata a polarizáció síkját elfordítja: a = [M]·c· [M] moláris forgatóképesség c koncentráció küvettavastagság 64
![M függ a hullámhossztól Polariméter néhány hullámhosszon méri Met legtöbbször a Na Dvonalán MD [M] függ a hullámhossztól Polariméter: néhány hullámhosszon méri [M]-et, legtöbbször a Na D-vonalán ([M]D)](https://slidetodoc.com/presentation_image_h2/c3c983f618366921947cd467ff690b49/image-65.jpg)
[M] függ a hullámhossztól Polariméter: néhány hullámhosszon méri [M]-et, legtöbbször a Na D-vonalán ([M]D) Spektropolariméter: megméri az [M] - spektrumot (Optikai rotációs diszperzió, ORD) 65

(a) balra (a) jobbra cirkulárisan polarizált fény 66

Cirkuláris dikroizmus A jobbra és balra cirkulárisan polarizált fény abszorpciós koefficiense eltér! Ezt a hatást mérjük: Aj = j·c· , ill. Ab = b·c· CD-jel: A = Aj – Ab = ( j - b) ·c· CD-spektrum: A a hullámhossz függvényében 67

Példa: (R)- és (S)-fenil-etil-amin CD színképe 68

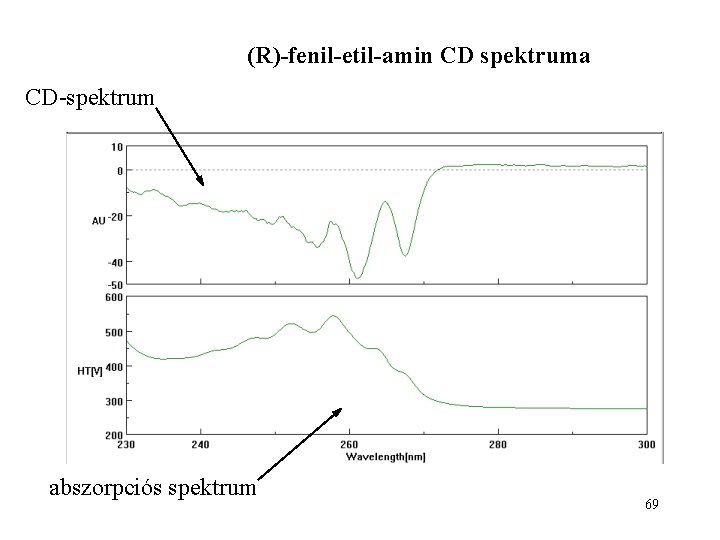
(R)-fenil-etil-amin CD spektruma CD-spektrum abszorpciós spektrum 69

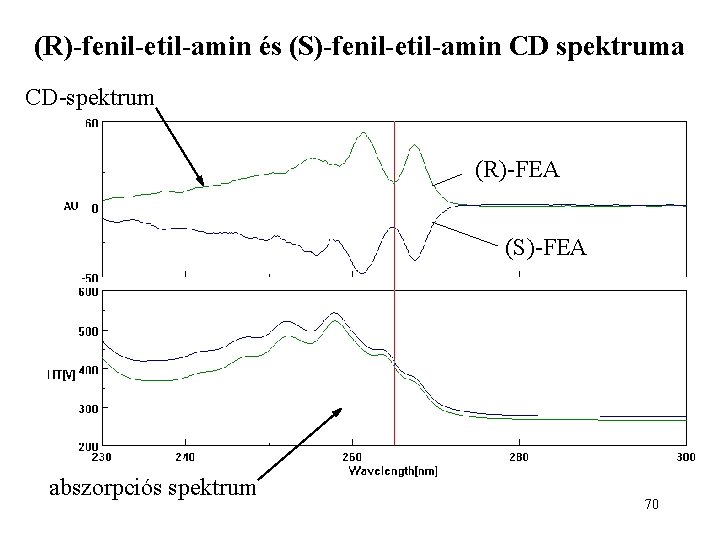
(R)-fenil-etil-amin és (S)-fenil-etil-amin CD spektruma CD-spektrum (R)-FEA (S)-FEA abszorpciós spektrum 70

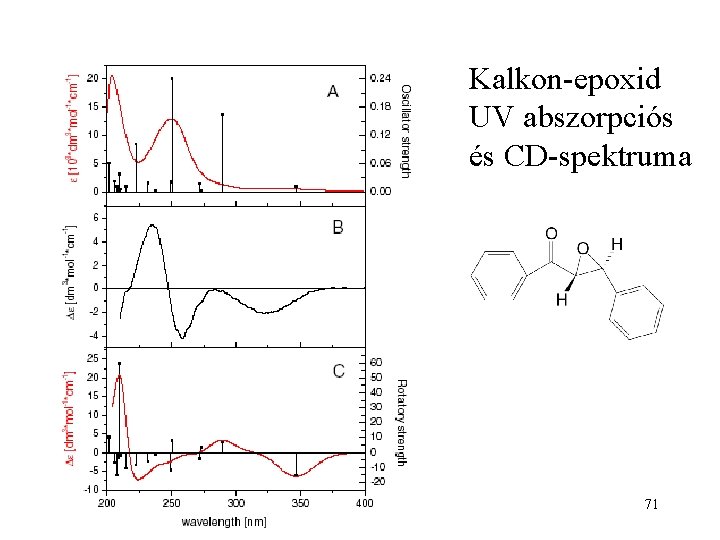
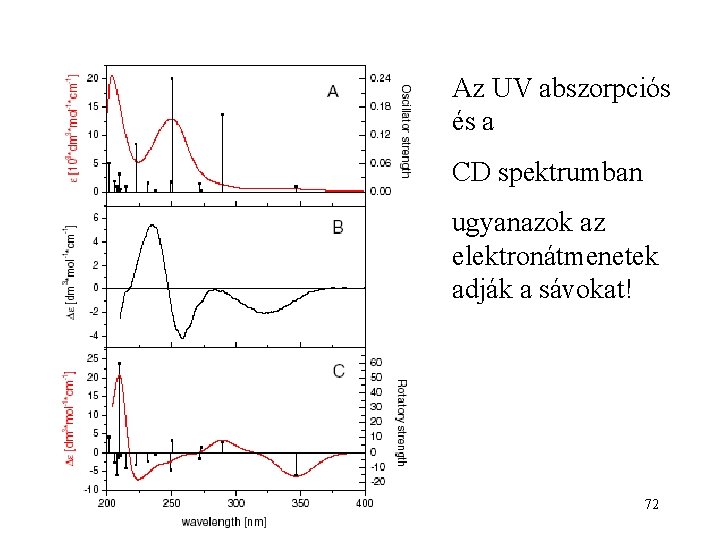
Kalkon-epoxid UV abszorpciós és CD-spektruma 71

Az UV abszorpciós és a CD spektrumban ugyanazok az elektronátmenetek adják a sávokat! 72

A CD spektroszkópia alkalmazásai 1. szerkezetvizsgálat: konfiguráció meghatározása 2. analitika: királis vegyület koncentrációjának mérése 3. biológiai rendszerek elemzése (HPLC + CD spektrométer) 73

Alapkérdések 53. Milyen kvantummechanikai közelítések vezetnek a molekulapályamodellhez? 54. Rajzoljon fel sematikusan egy molekulapálya-energiadiagramot! 55. Milyen alakja van a , ill. az n-molekulapályáknak? 56. Mit nevezünk a molekulák szingulett és triplett állapotainak? 57. Milyen oldószerek használhatók az UV abszorpciós spektroszkópiában? 58. Milyen spinállapotok közötti átmenetből adódik a fluoreszcencia és a foszforeszcencia? 59. Mit nevezünk fluoreszcencia-kvantumhatásfoknak? 60. Mit nevezünk gerjesztési ill. emissziós fluoreszcencia-színképnek? 61. Miből adódik a fluoreszcenciás detektálás nagy érzékenysége? 62. Milyen mennyiségeket tüntetnek fel a CD és az ORD színképek tengelyein? 74
 Neon elektronszerkezete
Neon elektronszerkezete Ag elektronszerkezete
Ag elektronszerkezete Gyakorl
Gyakorl Elektronhéjak
Elektronhéjak Réz elektronszerkezete
Réz elektronszerkezete Magnálium
Magnálium Energia cinetica scuola primaria
Energia cinetica scuola primaria Teorema energiei cinetice
Teorema energiei cinetice Pressao absoluta
Pressao absoluta Formas de energia
Formas de energia Valores de energia
Valores de energia Site:slidetodoc.com
Site:slidetodoc.com Praca wzór
Praca wzór Energia de legatura a nucleului
Energia de legatura a nucleului Calcula la fuerza con que se atraen una libreta de 150g
Calcula la fuerza con que se atraen una libreta de 150g Variatia energiei cinetice
Variatia energiei cinetice Energia classe quinta
Energia classe quinta Teorema da equipartição da energia
Teorema da equipartição da energia Dois carros saem da origem com velocidades
Dois carros saem da origem com velocidades Teoria de bandas
Teoria de bandas Elementos mas electronegativos
Elementos mas electronegativos Ingreso al sistema web res. 1102-404 y res. 785
Ingreso al sistema web res. 1102-404 y res. 785 Decatipus acl 4
Decatipus acl 4 Energia biomasse
Energia biomasse Lipidi energia
Lipidi energia Munka jele
Munka jele Apparecchio che accumula energia elettrostatica
Apparecchio che accumula energia elettrostatica Bmb energia
Bmb energia Energia interna
Energia interna Ejemplo de energia potencial
Ejemplo de energia potencial Trabalho sobre energia
Trabalho sobre energia üorzo
üorzo Perdidas de carga
Perdidas de carga Unidad de la energia cinetica
Unidad de la energia cinetica In the previous lesson i learned that
In the previous lesson i learned that Principio della minima energia
Principio della minima energia Modelo atomico de bohr
Modelo atomico de bohr Relacion entre trabajo y energia
Relacion entre trabajo y energia Teorema energia cinetica
Teorema energia cinetica Variaçao da energia mecanica
Variaçao da energia mecanica Caracteristicas del oxigeno
Caracteristicas del oxigeno Wind power energia
Wind power energia Energia solare powerpoint scuola media
Energia solare powerpoint scuola media Conductividad eléctrica ejemplos
Conductividad eléctrica ejemplos Extracorrente di apertura formula
Extracorrente di apertura formula Y = a(b)^x
Y = a(b)^x Pressione di radiazione zanichelli
Pressione di radiazione zanichelli Equação de margules
Equação de margules Resumen de la energía
Resumen de la energía Las enzimas disminuyen la energia de activacion
Las enzimas disminuyen la energia de activacion é nas quedas que o rio cria energia
é nas quedas que o rio cria energia Energia geotermica in italia
Energia geotermica in italia Energia maremotriu
Energia maremotriu Uso racional de la energia electrica
Uso racional de la energia electrica Piramide de energia
Piramide de energia Energia
Energia Teoria cinetica de los gases
Teoria cinetica de los gases Avantajele și dezavantajele energiei eoliene
Avantajele și dezavantajele energiei eoliene Energia cinetica y potencial formulas
Energia cinetica y potencial formulas Energia potencial eletrica
Energia potencial eletrica Promienie atomowe
Promienie atomowe Partes de un volcán
Partes de un volcán Potenza elettrica definizione
Potenza elettrica definizione Uma bolinha de massa m
Uma bolinha de massa m Mechanikai munka
Mechanikai munka Como funciona la energia nuclear
Como funciona la energia nuclear Energia potravín prezentácia
Energia potravín prezentácia Slidetodoc. com
Slidetodoc. com Energía cinética rotacional ejemplos
Energía cinética rotacional ejemplos Az energiaminimum elve
Az energiaminimum elve Conservação da energia
Conservação da energia Cuantas moleculas de atp se producen en el ciclo de krebs
Cuantas moleculas de atp se producen en el ciclo de krebs Fundacion mater dei
Fundacion mater dei Definizione energia potenziale
Definizione energia potenziale Energia eolica tamaño
Energia eolica tamaño