5 COURS DE THERMODYNAMIQUE Module Phv 221 21122021
























































- Slides: 62

5 COURS DE THERMODYNAMIQUE (Module Phv 221) 21/12/2021 Cours de thermodynamique M. Bouguechal Phv 211 1

5 Chapitre cinq Deuxième principe de la thermodynamique 5. 1 Insuffisances du premier principe. 5. 2 Transformations irréversibles 5. 3 Enoncés historiques du second principe 5. 3. 1 Enoncé de Clausius 5. 3. 2 Enoncé de Kelvin 5. 4 Enoncé mathématique du second principe 5. 4. 1 Transformation réversible 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 2

5 5. 4. 2 Calcul de variation d’entropie réversible 5. 4. 2. 1 Transformation adiabatique 5. 4. 2. 2 Transformation isotherme 5. 4. 2. 3 Transformation isochore 5. 4. 2. 4 Transformation isobare 5. 5 Expressions des coefficients différentiels de l’entropie 5. 6 Expressions de la différentielle de l’entropie 5. 7 Troisième principe de la thermodynamique 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 3

5 5. 1 INSUFFISANCES DU PREMIER PRINCIPE Le premier principe de la thermodynamique qui énonce la conservation de l'énergie permet de faire le bilan de l'énergie des systèmes, sans imposer de conditions sur les types d'échanges possibles. Ce bilan énergétique ne permet pas de prévoir le sens de l’échange ou l’évolution thermodynamiques des systèmes. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 4

5 Par exemple, le premier principe ne permet pas de déterminer le sens d’une réaction chimique ou simplement le sens de l’échange de chaleur entre un corps chaud et un corps froid. On sait que la chaleur passe spontanément du chaud vers le froid et non l’inverse. Le premier principe n’exclut pas le transfert spontané de la chaleur du froid vers le chaud : cette transformation est évidemment impossible naturellement. ? 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 5

5 Il faut donc mettre au point un deuxième principe appelé aussi principe d'évolution, à partir d’expériences thermodynamiques, qui permettra de prévoir l'évolution des systèmes. Le deuxième principe introduit une nouvelle fonction d'état dite entropie S qui décrit le comportement des systèmes. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 6

5 5. 2 TRANSFORMATIONS IRREVERSIBLES Beaucoup de transformations thermodynamiques sont irréversibles: elles ne peuvent évoluer que dans un sens. Deux exemples pour illustrer cela. ü Exemple 1 : Détente de Joule-Gay-Lussac. ü Exemple 2 : Transfert de chaleur entre deux systèmes. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 7

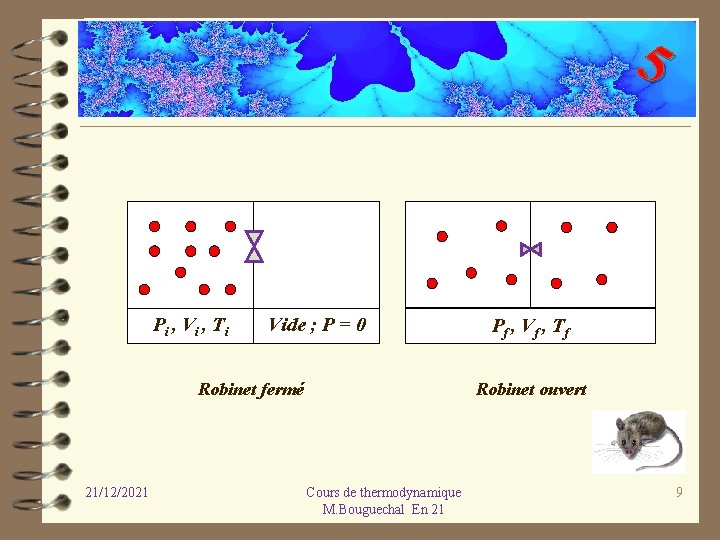
5 ü Exemple 1 : Détente de Joule-Gay-Lussac. On considère deux systèmes, l’un contenant un gaz à une certaine pression P et l’autre un système vide, sans molécules : la pression est alors nulle. Un robinet permet d’ouvrir entre les deux systèmes. On ouvre le robinet, et sous l’effet de la différence de pression, certaines molécules du système passent brusquement de façon irréversible dans le compartiment de gauche. Cette transformation thermodynamique appelée détente est spontanée et irréversible : en aucun cas la transformation inverse ne peut se produire spontanément ou naturellement sans apport d’énergie de l’extérieur. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 8

5 Pi , Vi , Ti Vide ; P = 0 Robinet fermé 21/12/2021 Pf , Vf , Tf Robinet ouvert Cours de thermodynamique M. Bouguechal En 21 9

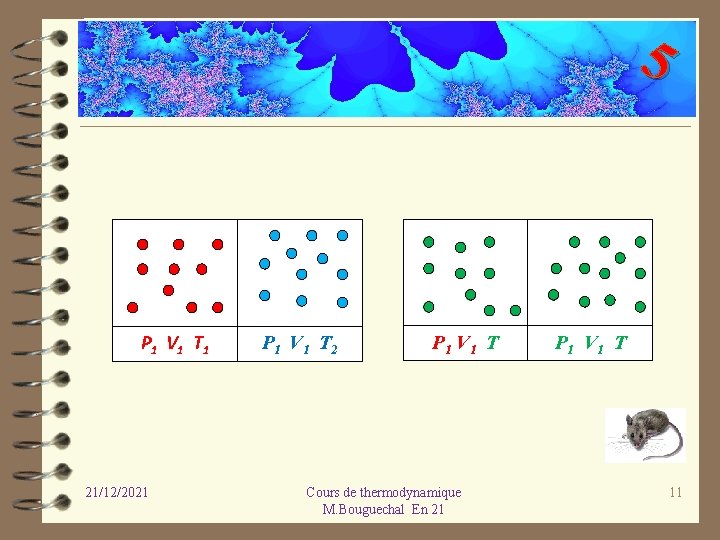
5 ü Exemple 2 : Transfert de chaleur entre deux systèmes. On considère deux systèmes, contenant chacun un gaz de même volume de même pression mais leur température est différente. Les deux systèmes sont en contact par l’intermédiaire d’une paroi à travers laquelle il y a échange d’énergie. Au bout d’un certain temps les deux températures sont égales ; cette transformation est irréversible, la chaleur passe du chaud vers le froid. En aucun cas la chaleur ne peut passer spontanément du froid vers le chaud. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 10

5 P 1 V 1 T 1 21/12/2021 P 1 V 1 T 2 P 1 V 1 T Cours de thermodynamique M. Bouguechal En 21 P 1 V 1 T 11

5 5. 3 Enoncés historiques du second principe 5. 3. 1 Enoncé de Clausius Une quantité de chaleur ne peut jamais être transférée spontanément d'une source froide vers une source chaude Source chaude TC > TF Q : impossible Source froide TF 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 12

5 5. 3. 2 Enoncé de Kelvin Il est impossible de prélever une quantité de chaleur Q d'une source d'énergie et de la transformer intégralement en travail. Source T Q Impossible W Avec une source de chaleur, on ne peut pas réaliser un moteur. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 13

5 5. 4 Enoncé mathématique du second principe Pour tout système fermé, il existe une fonction d’état appelée entropie, entropie représentée par S. L’entropie est une grandeur extensive, elle est égale à la somme de l’entropie échangée avec l’extérieur et de l’entropie créée à l’intérieur du système. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 14

5 On peut donc écrire : Text est la température de l’extérieur. : est l’entropie créée à l’intérieur du système par les irréversibilités du système, c’est une grandeur positive ou nulle, nulle quand il n’ y a pas d’irréversibilité à l’intérieur du système. Ce n’est pas une fonction d’état. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 15

5 L’entropie s’exprime en joule/kelvin : J. K-1 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 16

5 En résumé : 21/12/2021 Signe de Interprétation > 0 Transformation possible = 0 Transformation réversible <0 Transformation impossible dans les conditions envisagées Cours de thermodynamique M. Bouguechal En 21 17

5 Si on fait le bilan de l’entropie lors d’une transformation , on peut alors écrire : La variation de l’entropie lors d’une transformation est égale à l’entropie échangée + l’entropie créée à l’intérieur du système durant la transformation. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 18

5 Sur un cycle : comme alors 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 19

5 5. 4. 1 Transformation réversible Dans le cas d’une transformation réversible on a : On en déduit alors que : Premier principe : D’où : et : 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 20

5 5. 4. 2 Calcul de variation d’entropie réversible et pour un gaz parfait : 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 21

5 Dans le cas d’une transformation réversible d’un gaz parfait, on peut aussi écrire : 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 22

5 5. 4. 2. 1 Transformation adiabatique Dans le cas d’une transformation réversible adiabatique, on on en déduit alors que : et S est donc constante. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 23

5 Une transformation adiabatique réversible est une transformation isentropique c'est-à -dire une transformation au cours de laquelle l’entropie S garde une valeur constante. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 24

5 5. 4. 2. 2 Transformation isotherme d. T = 0 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 25

5 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 26

5 En intégrant entre deux états : initial i et final f ; on obtient : 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 27

5 5. 4. 2. 3 Transformation isochore d. V = 0 En intégrant entre deux états : initial i et final f ; on obtient : 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 28

5 5. 4. 2. 4 Transformation isobare d. P = 0 Si le gaz est parfait alors : à démontrer 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 29

5 5. 5 Expressions des coefficients différentiels de l’entropie Transformation quelconque 21/12/2021 Transformation réversible Cours de thermodynamique M. Bouguechal En 21 30

5 Déterminons les coefficients différentiels de l’entropie : On sait que : U est une fonction d’état, le théorème de Schwartz est vérifié, on peut donc écrire : 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 31

5 1 C’est la première relation de Maxwell. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 32

5 On sait que : d. U est une différentielle totale exacte des variables S et V, on peut donc écrire : 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 33

5 On en déduit alors : et 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 34

5 ü On montre aussi en utilisant le fait que P = P ( S ; V ) : 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 35

5 On en déduit que : 2 C’est la deuxième relation de Maxwell. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 36

5 On peut aussi la démontrer en utilisant la définition de l’enthalpie et en appliquant le théorème de Schwartz car H est une fonction d’état. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 37

5 ü On montre aussi en utilisant le fait que T = T ( S ; V ) : 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 38

5 On en déduit que : 3 C’est la troisième relation de Maxwell. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 39

5 ü On montre aussi en utilisant le fait que T = T ( S ; P ) : 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 40

5 On en déduit que : 4 C’est la quatrième relation de Maxwell. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 41

5 En résumé, on obtient alors les relations suivantes appelées relations de Maxwell Relations de Maxwell Il faut ajouter : et D’une manière pratique, on retrouve ces relations en utilisant le tableau suivant : 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 P T S V 42

5 Autres relations importantes : A v = cste, on a : 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 43

5 On en déduit que : 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 44

5 De la même manière à p = cst : on a A P = cste, on a : 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 45

5 On en déduit que : 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 46

5 5. 6 Expressions de la différentielle de l’entropie S étant une fonction d’état, on peut alors exprimer sa différentielle en fonction des variables P ; V et T et on peut alors déterminer les coefficients calorimétriques Cv, Cp, l, h, λ et μ. d’où 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 et 47

5 d’où 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 et 48

5 d’où 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 et 49

5 Relations de Maxwell et et et Les relations donnant les coefficients calorimétriques sont appelés les relations de Clapeyron. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 50

5 James Clerk Maxwell (1831 à Édimbourg, en Écosse - 1879) est un physicien et mathématicien écossais. Il est principalement connu pour avoir unifié en un seul ensemble d'équations, les équations de Maxwell, l'électricité, le magnétisme et l'induction. Il a notamment démontré que les champs électriques et magnétiques se propagent dans l'espace sous la forme d'une onde et à la vitesse de la lumière. Il a également développé la distribution de Maxwell, une méthode statistique de description de la théorie cinétique des gaz. En 1931, pour le centenaire de la naissance de Maxwell, Einstein lui-même décrivait les travaux de Maxwell comme les « plus profonds et fructueux que la physique ait connu depuis le temps de Newton » . Benoît Paul Émile Clapeyron, né 26 février 1799 à Paris et mort le 28 janvier 1864 dans cette même ville, est un ingénieur et physicien français. il s'intéresse principalement à la thermodynamique alors naissante (Sadi Carnot en 1834). Il laisse son nom à l'équation de Clapeyron (ou de Clausius et Clapeyron) qui donne la chaleur latente de changement d'état des corps purs ainsi qu'à un diagramme thermodynamique (coordonnée (P, V)). Il mène une carrière d'enseignant à l'École nationale des ponts et chaussées à partir de 1844 et il est élu membre l'Académie des sciences en 1858, au fauteuil de Cauchy. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 51

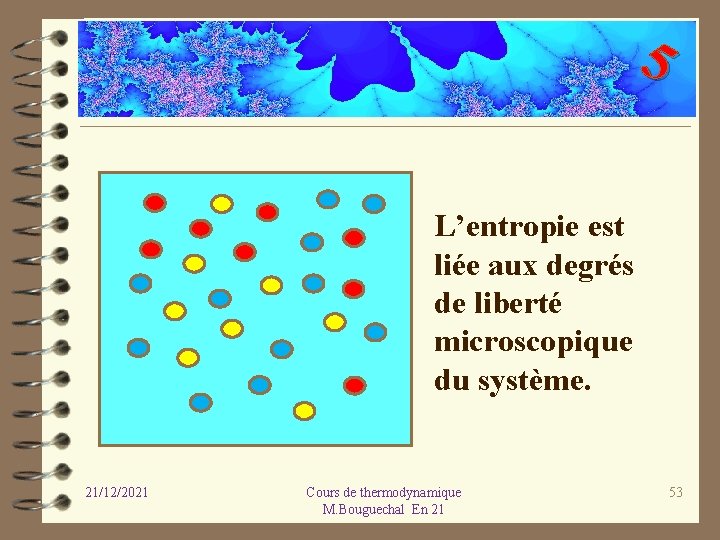
5 5. 7 INTERPRETATION MICROSCOPIQUE DU SECOND PRINCIPE Le deuxième principe de la thermodynamique peut s’interpréter au niveau microscopique c’est à dire au niveau des molécules du système, l’entropie est liée à la notion de “ désordre moléculaire “. L'augmentation d'entropie d’un système isolé lors d’une transformation d’un état initial à un état final correspond à la tendance naturelle du système à augmenter son désordre qui va alors un maximum. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 52

5 L’entropie est liée aux degrés de liberté microscopique du système. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 53

5 L’entropie est une mesure du nombre de degrés de liberté d’un système, sa définition microscopique donnée par Boltzmann : 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 54

5 est l’ensemble de toutes les configurations microscopiques possibles du système ou micro-états, donnant une énergie égale à E. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 55

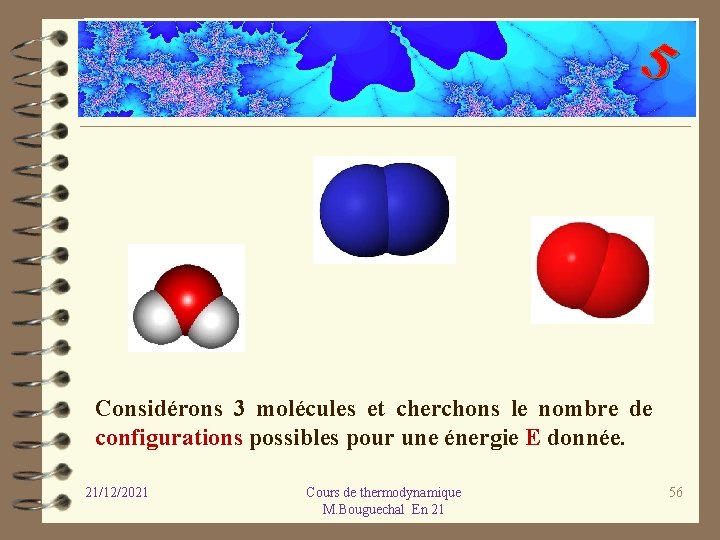
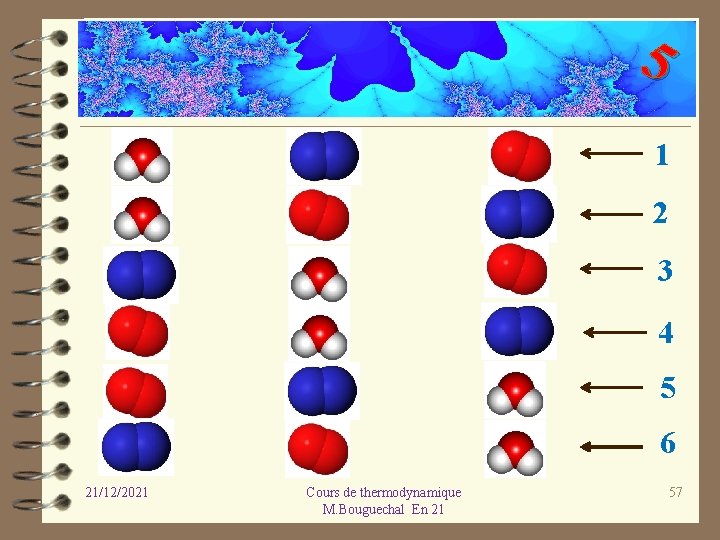
5 Considérons 3 molécules et cherchons le nombre de configurations possibles pour une énergie E donnée. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 56

5 1 2 3 4 5 6 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 57

5 Il y a donc 6 configurations pour l’énergie totale E des molécules 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 58

5 5. 7 Troisième principe de la thermodynamique L’entropie donnée par le second principe est défini à une constante additive près. Le troisième principe défini cette constante. Enoncé du troisième principe : Au zéro absolu ( T = 0 K), l’entropie de tout corps homogène vaut zéro. 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 59

5 ü Donner l’expression des coefficients calorimétriques pour un gaz parfait. ü Calculer le travail lors d’une transformation isentropique 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 60

5 Fin de la leçon 5 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 61

5 21/12/2021 Cours de thermodynamique M. Bouguechal En 21 62