2 COURS DE THERMODYNAMIQUE Module En 21 11222020


















![2 ü Le coefficient de dilatation volumique isobare α [α] = θ-1 dimension de 2 ü Le coefficient de dilatation volumique isobare α [α] = θ-1 dimension de](https://slidetodoc.com/presentation_image_h/871e3dc33d16a24a7d2dd8a40c8b3aee/image-23.jpg)
![2 ü Le coefficient de compression isochore β [β] = θ-1 dimension de β: 2 ü Le coefficient de compression isochore β [β] = θ-1 dimension de β:](https://slidetodoc.com/presentation_image_h/871e3dc33d16a24a7d2dd8a40c8b3aee/image-24.jpg)
























- Slides: 51

2 COURS DE THERMODYNAMIQUE (Module En 21) 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 1

2 Chapitre deux Equations d’état, gaz parfait, gaz réels 2. 1 Equation d’état et représentation 2. 2 Transformations thermodynamiques 2. 3 Coefficients élastiques 2. 4 Equation d’état et gaz parfait 2. 5 Equation d’état et gaz réels 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 2 2

2. 1 Equation d’état et représentation 2 Un même système peut se trouver dans des états différents (exemple : un gaz plus ou moins comprimé par un piston) . Ces états sont alors caractérisés par des paramètres ou des grandeurs : les variables d’état. La température T d’un gaz ou d’un liquide, la pression P qu’un fluide exerce sur les parois du récipient qui le contient, le volume V qu’il occupe dans l’espace , la densité ρ … sont des paramètres thermodynamiques caractérisant l’état du fluide. On distinguera les variables extensives (elles dépendent de la masse et ont donc des propriétés additives, par exemple, V, m, n) des variables intensives (qui ne dépendent pas de la masse et n’ont donc pas de propriétés additives, par exemple, P, T, ) 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 3

2 Un ensemble complet de paramètre thermodynamique est suffisant pour définir l’état du système. Les équations d’état sont les relations qui existent entre ces paramètres. P=f (T, V) Par exemple : Pour un échantillon de gaz parfait contenant n moles, la connaissance de P et V est suffisante pour décrire le système. En effet la température est déduite de l’équation d’état caractéristique des gaz parfaits : PV=n R T = n N Ak. BT pour une mole de gaz N A est le nombre d’Avogadro ( = 6. 02 10 23 entités élémentaires / mole) k. B est la constante de Boltzmann R = Nk. B la constante des gaz parfaits. 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 4

2 Un système se trouve à l’état d’équilibre s’il n’évolue plus, c’est à dire si il n’y a plus de transfert d’énergie entre lui et le milieu extérieur. On est alors en mesure de connaître par exemple la variation infinitésimale de P à partir des variations infinitésimales de T et de V : Formule mathématique pour une fonction à deux variables f(x, y): 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 5

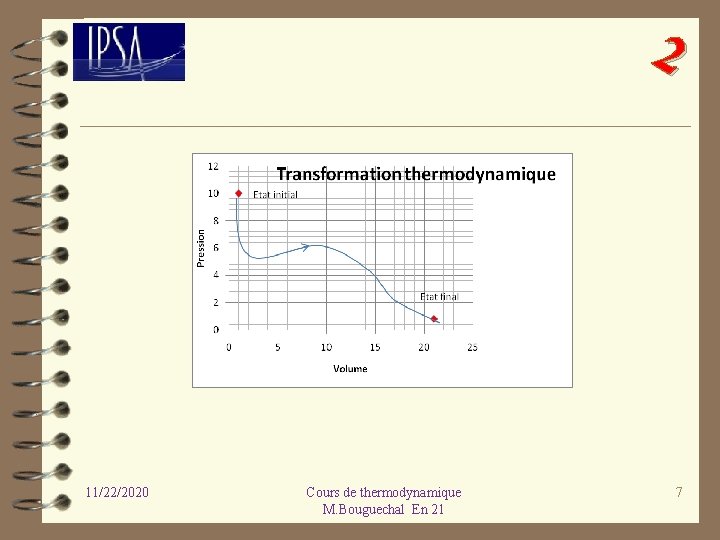
2. 2 Transformations thermodynamiques 2 Un système peut subir des transformations qui l’amène d’un état initial caractérisé par des variables d’état ou coordonnées thermodynamiques ( Pi, Vi, Ti …. ) à un autre état final caractérisé par d’autres variables d’état ou coordonnées thermodynamiques (Pf, Vf, Tf …. ) , il va alors passer d’un état initial vers un état final en passant par des états intermédiaires plus ou moins bien définis. Lors de ce changement d’état ou transformation thermodynamique des échanges d’énergies ont lieu entre le système et le milieu extérieur. Au cours d’une transformation, un système passe par une suite d’états intermédiaires entre l’état initial et l’état final. 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 6

2 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 7

2 Si on est capable de caractériser une suite d’états entre un état initial et un état final, on définit le chemin que suit le système au cours de la transformation. Une même transformation peut être réalisée suivant différents chemins ; 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 8

2 Si ces deux états, initial et final sont infiniment voisins, c’est à dire que les coordonnées thermodynamiques du système ne diffèrent que par une quantité infiniment petite, on dit que la transformation est infinitésimale ou élémentaire. . 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 9

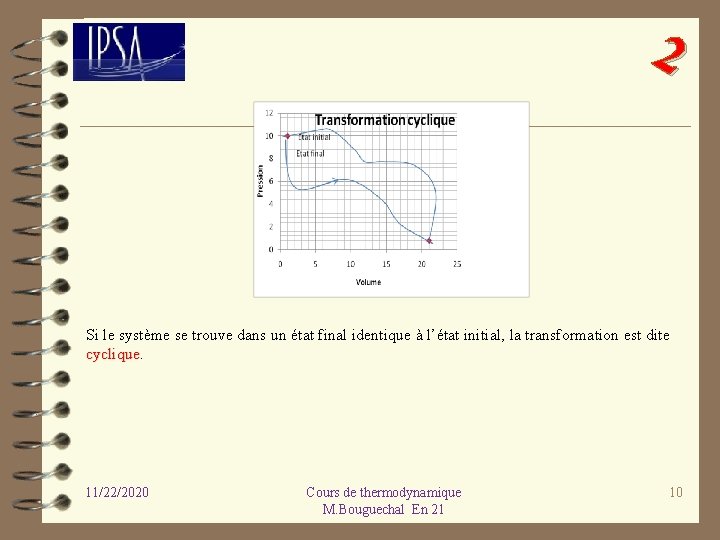
2 Si le système se trouve dans un état final identique à l’état initial, la transformation est dite cyclique 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 10

2 II-2 -1 Transformations quasi-statiques Une transformation quasi-statique est une transformation lente, composée d’une suite continue d’états d’équilibre infiniment voisins, allant de l’état initial à l’état final. L’équilibre mécanique et thermique à chaque instant t de la transformation entre un fluide (de pression P et de température T à l’instant t) et le milieu extérieur (de pression Pe et de température Te à l’instant t) impose : P = Pe au niveau de toute paroi mobile et T = Te au niveau la paroi, c'est-à-dire que la transformation est très lente, pratiquement statique et que l’on peut considérer qu’à chaque instant on a un équilibre entre le système et le milieu extérieur. 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 11

2 II-2 -2 Transformations réversible ou irréversible Les transformations thermodynamiques peuvent être réversibles ou irréversibles. ü Pour être réversible, réversible il faut, condition nécessaire mais non suffisante, que la transformation soit infiniment lente. Elle sera alors formée d’une suite d’états d’équilibre. Toute transformation réversible est quasi-statique. Par contre l’inverse n’est pas vrai. Ces transformations réversibles ne sont pas réelles, mais c’est le cas idéal pour les calculs en thermodynamique. ü Une transformation irréversible se traduit par une brusque rupture d’un état d’équilibre irréversible initial. Il n’est alors pas possible de définir la température T et la pression P du système à chaque instant. On ne connaît précisément que leurs valeurs dans l’état initial et final. 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 12

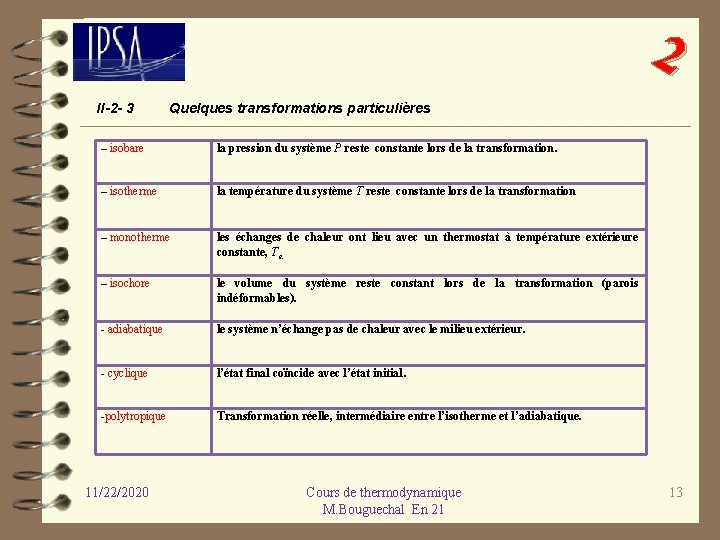
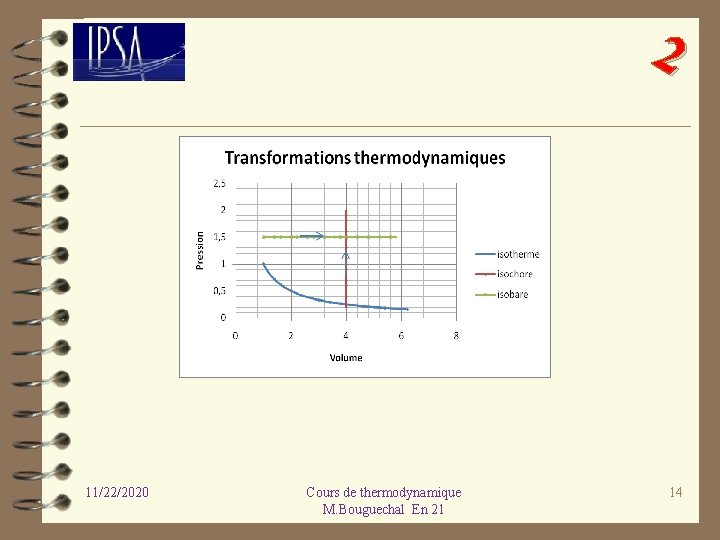
2 II-2 - 3 Quelques transformations particulières – isobare la pression du système P reste constante lors de la transformation. – isotherme la température du système T reste constante lors de la transformation – monotherme les échanges de chaleur ont lieu avec un thermostat à température extérieure constante, Te. – isochore le volume du système reste constant lors de la transformation (parois indéformables). - adiabatique le système n’échange pas de chaleur avec le milieu extérieur. - cyclique l’état final coïncide avec l’état initial. -polytropique Transformation réelle, intermédiaire entre l’isotherme et l’adiabatique. 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 13

2 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 14

2. 3 Coefficients thermoélastiques 2 II. 3. 1 Rappel mathématique Soit du(x, y) une différentielle totale exacte des deux variables x, y ; on a alors : du = M(x, y)dx + N(x, y)dy avec Cette condition est nécessaire pour que du soit une différentielle totale exacte ( d. t. e ) : C'est-à-dire : 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 15

2 Et dans ce cas on pourra écrire : Si on considère une différentielle du(x, y, z) de trois variables ( x, y, z ) ; du du = M(x, y, z)dx dx + N(x, y, z)dy dy +P P(x, y, z)dz dz si du est une d. t. e alors : Et dans ce cas, on pourra écrire : 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 16

2 Si f(x, y, z) = 0, alors df = 0 : On peut d’ailleurs toujours écrire une fonction sous cette forme, exemple PV = n. RT d’où PV - n. RT = 0 ; c'est-à-dire f (P, V, n , T) = 0, on en déduit que : ( 1 ) On remplace le dy de la formule ( 1 ) par son expression de la formule (2) et on obtient : 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 17

2 (4) On développe, on réduit et on obtient : On en déduit alors que chaque coefficient placé devant dx et dy doit être nul et on obtient : 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 18

2 ( 5 ) ( 6 ) A partir de l’équation ( 5 ) ; on obtient : 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 19

2 A partir de l’équation ( 6 ) ; on obtient : D’où : 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 20

2 On peut appliquer cette formule en thermodynamique, les trois variables x, y, z sont P P, V V et T T : pression , volume et température, on obtient alors : 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 21

2 II. 3. 2 Les coefficients thermoélastiques L’équation d’état d’un gaz permet de connaitre les propriétés de ce gaz, mais la détermination d’une équation d’état pour un gaz donné, dans des conditions précises de température et de pression n’est pas toujours facile, pour connaitre les propriétés d’un gaz on définit alors un certain nombre de coefficients appelés coefficients élastiques ou thermoélastiques. 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 22
![2 ü Le coefficient de dilatation volumique isobare α α θ1 dimension de 2 ü Le coefficient de dilatation volumique isobare α [α] = θ-1 dimension de](https://slidetodoc.com/presentation_image_h/871e3dc33d16a24a7d2dd8a40c8b3aee/image-23.jpg)
2 ü Le coefficient de dilatation volumique isobare α [α] = θ-1 dimension de α : inverse d’une température ; unité : Kelvin-1 Ce coefficient représente la variation relative de volume résultant d’une variation de température à pression constante. 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 23
![2 ü Le coefficient de compression isochore β β θ1 dimension de β 2 ü Le coefficient de compression isochore β [β] = θ-1 dimension de β:](https://slidetodoc.com/presentation_image_h/871e3dc33d16a24a7d2dd8a40c8b3aee/image-24.jpg)
2 ü Le coefficient de compression isochore β [β] = θ-1 dimension de β: inverse d’une température ; unité : Kelvin-1 Ce coefficient représente la variation relative de pression résultant d’une variation de température à volume constant. 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 24

2 ü Le coefficient de compressibilité isotherme χT Le coefficient χT est positif. [χT ] a la dimension de l’inverse d’une pression ; unité : Pascal-1 Ce coefficient représente la variation relative de volume résultant d’une variation de pression à température constante. 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 25

2 . . Les coefficients thermoélastiques sont liés par la relation : = Ceci se démontre facilement en utilisant la relation mathématique des trois dérivées partielles en remplaçant x, y, z par P, V et T. 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 26

2. 4 Equation d’état et gaz parfait 2 Le gaz parfait est un gaz idéal : ü il correspond à un gaz dilué c’est à dire un gaz à pression réduite ü c'est un ensemble de N atomes ou molécules identiques sans interaction entre eux et soumis à une agitation perpétuelle et aléatoire (dite agitation moléculaire ou thermique). 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 27

2 Hypothèses du gaz parfait (Théorie cinétique des gaz) ü Les atomes ou molécules du gaz sont assimilés à des masses ponctuelles, leur volume est donc négligeable devant le volume qu’elles occupent. ü Il n’y a pas d’interaction entre les molécules, l’énergie potentielle d’interaction est donc nulle, Epi = 0. ü La pression est due aux nombreux chocs des molécules sur les parois du système. 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 28

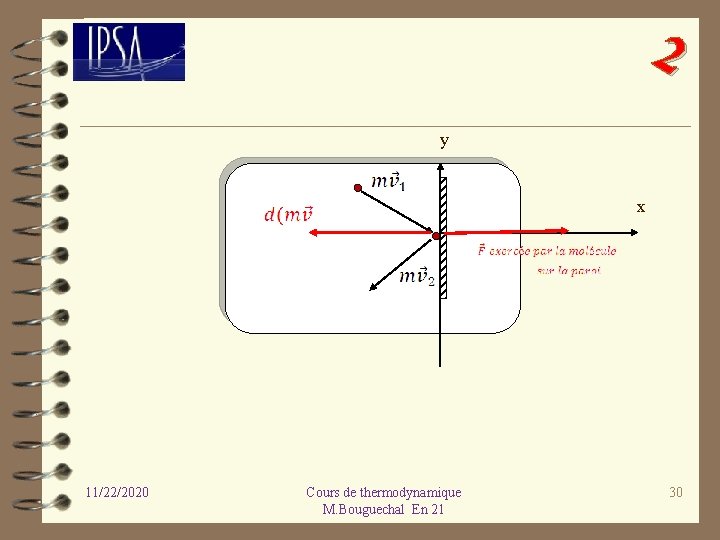
2 Soit N le nombre total de molécules dans le système ; étudions le choc élastique d’une molécule sur la paroi du système. D’après la deuxième loi de Newton, on a : Le choc étant élastique, l’énergie cinétique totale est conservée et donc la norme du vecteur-vitesse est donc conservée. La projection sur l’axe Ox donne : 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 29

2 y x 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 30

2 Connaissant la force exercée par la molécule sur la paroi du système, il est alors possible de déterminer la pression exercée sur la surface ou un élément de surface. 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 31

2 Les molécules frappant la surface S de la paroi pendant l’intervalle de temps Δt sont comprises dans un cylindre de base S et de hauteur vxΔt : or d’après la théorie cinétique des gaz, à l’équilibre seulement la moitié de ces molécules se dirige vers la paroi : Vx Δt Le nombre de molécules frappant la paroi est donc égal à : 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 32

2 = Avec n n 0 le nombre de molécules par unité de volume et donc n n 0 = N/V P = -Or la répartition des vitesses dans l'enceinte est isotrope, on a : 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 33

2 où √ √<v 2> est la vitesse quadratique moyenne des molécules définie par : 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 34

2 D'après la théorie cinétique des gaz, la température absolue T est une grandeur qui caractérise le degré d'agitation thermique des molécules. On en déduit alors : en posant, n = N/NA et R = k. B NA = n. RT C’est l’équation d’état des gaz parfaits. 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 35

2 Comme le nombre de moles est donnée par : n = N/ NA = m/M la loi des gaz parfait peut aussi s'écrire pour une m de gaz parfait : avec, , r = R/M désignant la constante individuelle de chaque gaz. 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 36

2 ü Unités Dans le système international SI ou MKS, les grandeurs de l’équation des gaz parfaits s’expriment dans les unités suivantes : v La pression P en pascal ( Pa ) v Le volume V en m 3 v La température T en Kelvin ( k ) v La constante des gaz parfaits R = 8, 314 en J/(K. mol) La constante de Boltzmann : k k. B = R/ NA = 1, 38. 10 -23 J/K Le nombre d'Avogadro : N NA = 6, 023. 1023 entités/mole 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 37

2 ü Autres lois des gaz parfaits. v Loi de Boyle-Mariotte : o à T = cte : P 1 V 1=P 2 V 2 v Lois de Gay Lussac et Charles : o à V = cte : o à P = cte : 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 38

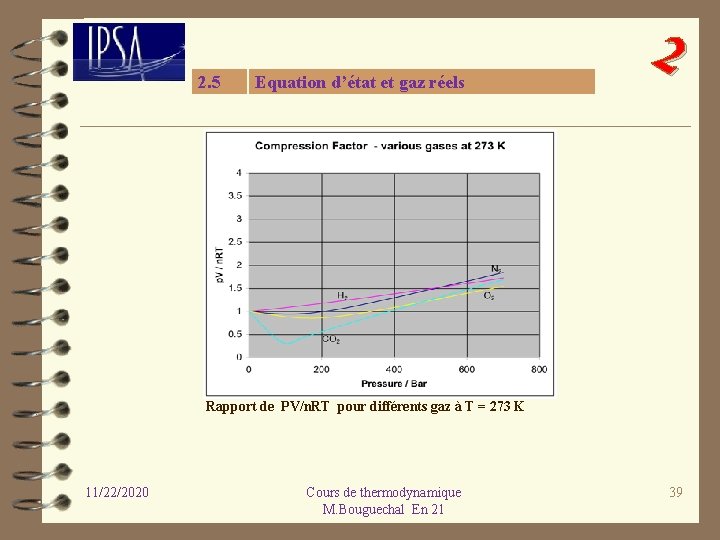
2. 5 Equation d’état et gaz réels 2 Rapport de PV/n. RT pour différents gaz à T = 273 K 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 39

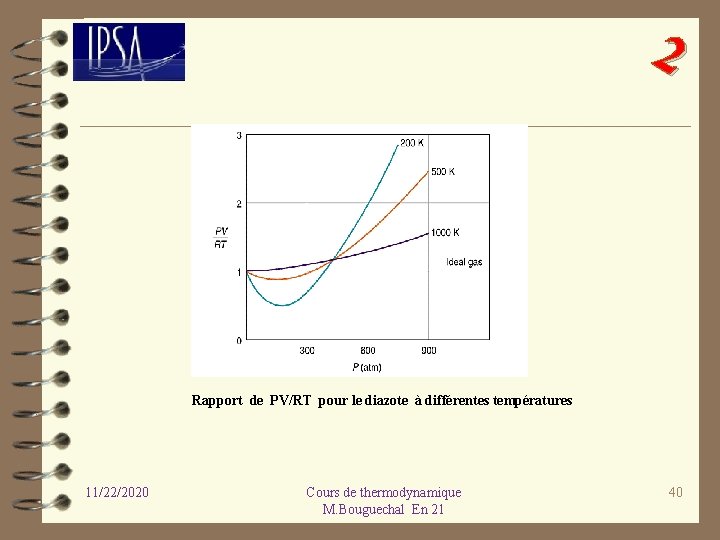
2 Rapport de PV/RT pour le diazote à différentes températures 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 40

2 L’équation d’état du gaz parfait ne peut représenter un gaz que dans un domaine bien déterminé de température et de pression. Les forces d’interaction entre les d’interaction molécules sont alors inexistantes et le volume propre des molécules par rapport au volume occupé est négligeable. Cette différence de comportement par rapport au gaz parfait est observée expérimentalement. Le rapport Z = PV/n. RT, appelé PV/n. RT facteur de compression, pour une température donnée est constant pour un gaz compression parfait et égal à 1. Différents gaz n’obéissent plus à cette loi. On remarque aussi que lorsque la pression tend vers zéro, tous les gaz vérifient l’équation des gaz parfaits. 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 41

2 Diverses équations d’état ont été proposées pour les gaz réels, elles représentent l’état d’un gaz dans un domaine de pression et de température pour un gaz donné. ü Equation d'état du viriel ( Kammerlingh Omnes, 1901 ). Equation d'état du viriel L'équation d'état s’écrit comme un développement en série de Z, soit en fonction de P, ou de V. 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 42

2 ü L'équation de Van der Waals ( 1879 ), Van Der Waals introduit deux L'équation de Van der Waals corrections dans la loi des gaz parfaits: 1. Les molécules ont un volume non-nul et incompressible. 2. Il existe des forces d'attraction entre les molécules. 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 43

2 1. Les molécules ont un volume non-nul et incompressible. Les molécules occupent tout le volume d’après la théorie cinétique des gaz. 11/22/2020 Les molécules occupent le volume du récipient moins le volume occupé par leur propre volume d’après Van der Waals. Vb = Nb appelé covolume est le volume occupé par N molécules de volume propre b. Cours de thermodynamique M. Bouguechal En 21 44

2 2. Il existe des forces d'attraction entre les molécules. ü Une molécule est en interaction avec toutes les molécules qui l'entourent. ü Dans le cas d’une molécule se dirigeant vers la paroi du récipient à une certaine vitesse, elle est entourée de moins molécules et sa vitesse est ralentie et va donc ainsi exercer une pression moindre. La pression est alors donnée pour n moles par P + a n 2/V 2. 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 45

2 L'équation d'état de Van der Waals sous sa forme extensive s’écrit : Ou encore, sous forme intensive : Vm étant le volume molaire Vm = V/n 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 46

2 Il existe aussi d’autres équations d’état : - celle de Berthelot : - ou celle de Diétérici 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 47

2 2 Fin de la leçon 2 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 48

2 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 49

2 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 50

2 11/22/2020 Cours de thermodynamique M. Bouguechal En 21 51