Dpartement de Chimie Module Thermodynamique Chimique Filire SMC













- Slides: 33

Département de Chimie Module Thermodynamique Chimique Filière SMC - S 4 Solution TD Série N° 6 Pr ABDALLAOUI Abdelaziz a. abdallaoui@umi. ac. ma Thermodynamique Chimique - Filière SMC, S 4 1

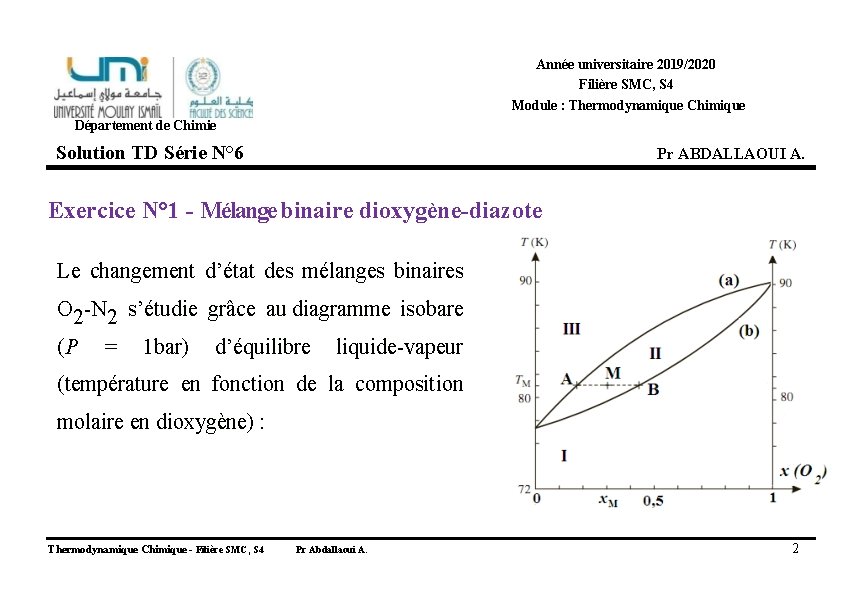
Année universitaire 2019/2020 Filière SMC, S 4 Module : Thermodynamique Chimique Département de Chimie Solution TD Série N° 6 Pr ABDALLAOUI A. Exercice N° 1 - Mélange binaire dioxygène-diazote Le changement d’état des mélanges binaires O 2 -N 2 s’étudie grâce au diagramme isobare (P = 1 bar) d’équilibre liquide-vapeur (température en fonction de la composition molaire en dioxygène) : Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 2

1. Qu'appelle-t-on mélange idéal ? 1. Mélange idéal : a. C’est un mélange où les propriétés des corps purs sont conservées. b. C’est un mélange de deux liquides purs miscibles dont le volume total de la solution est la somme des volumes deux liquides mélangés. Vmél = V 1 + V 2 c. C’est un mélange où sa vapeur est considérée comme un mélange de gaz parfaits. d. C’est un mélange où la pression de vapeur totale de la solution varie linéairement avec les valeurs P°A et P°B en fonction des fract. molaires dans la solution liquide. e. C’est un mélange où ΔHdissol ≈ 0 c-à-d les interactions soluté-solvant sont du même ordre de grandeur que les interactions soluté-soluté et solvant-solvant. Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 3

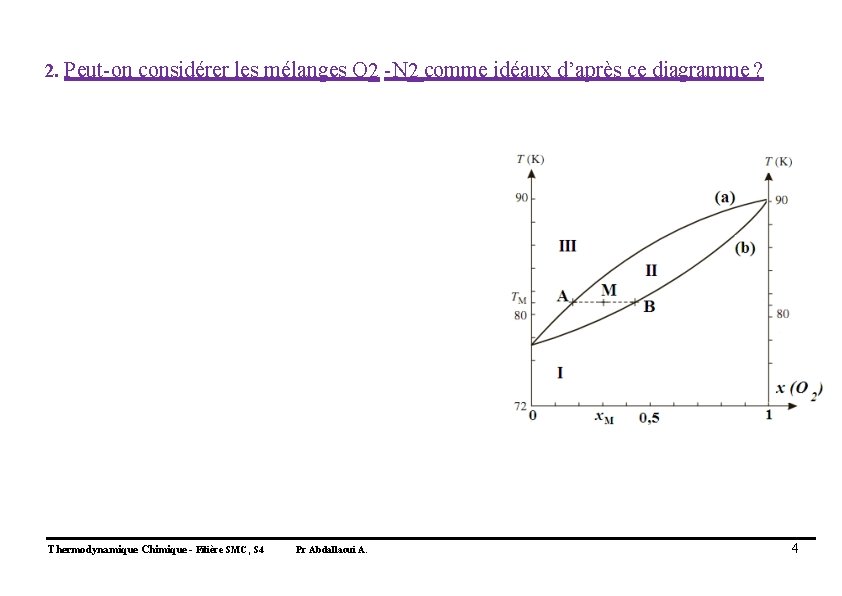
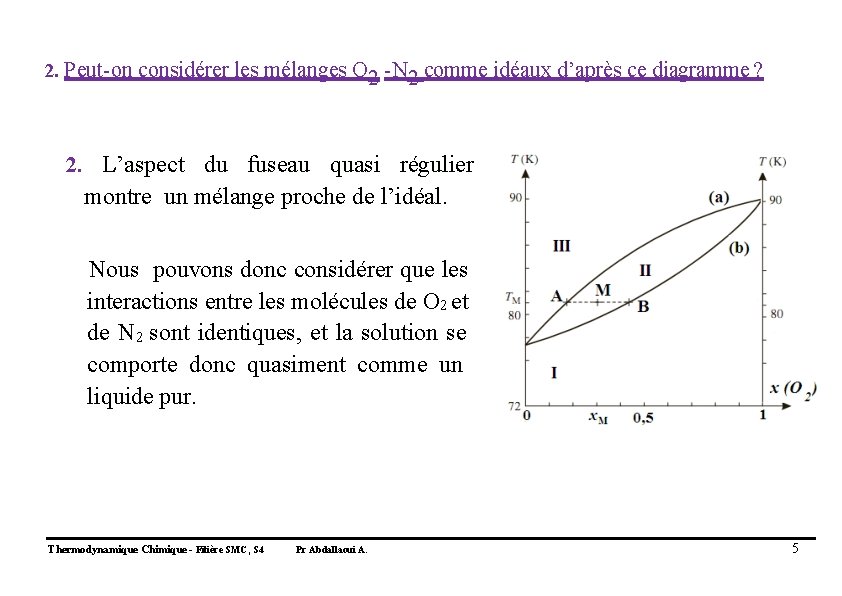
2. Peut-on considérer les mélanges O 2 -N 2 comme idéaux d’après ce diagramme ? Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 4

2. Peut-on considérer les mélanges O 2 -N 2 comme idéaux d’après ce diagramme ? 2. L’aspect du fuseau quasi régulier montre un mélange proche de l’idéal. Nous pouvons donc considérer que les interactions entre les molécules de O 2 et de N 2 sont identiques, et la solution se comporte donc quasiment comme un liquide pur. Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 5

3. Quelles sont les phases en présence dans les domaines I, II et III ? 3. S’agissant d’un diagramme liquide- vapeur, l’élévation de température fait passer le mélange de l’état liquide à l’état gazeux. Domaine I : phase liquide Domaine II : mélange liquide-vapeur Vapeur Liquide Domaine III : phase vapeur Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 6

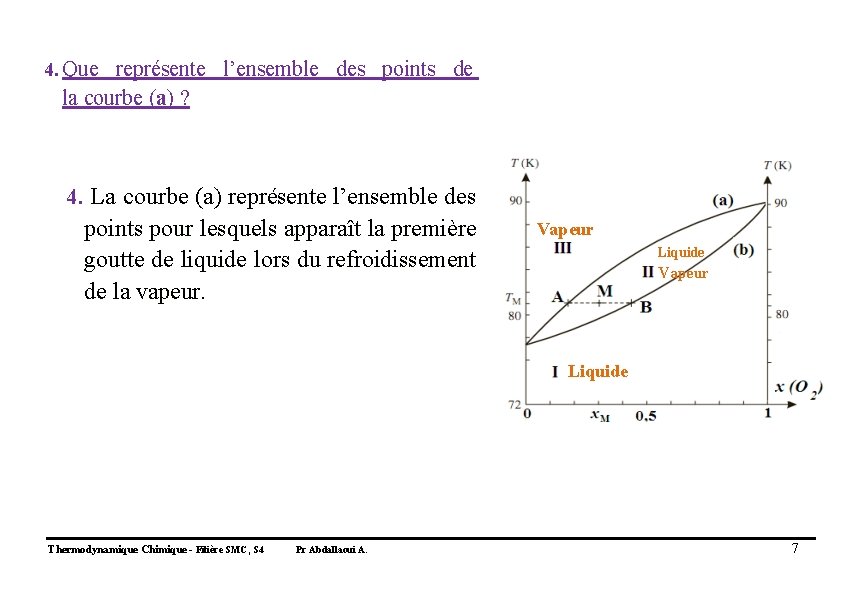
4. Que représente l’ensemble des points de la courbe (a) ? 4. La courbe (a) représente l’ensemble des points pour lesquels apparaît la première goutte de liquide lors du refroidissement de la vapeur. Vapeur Liquide Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 7

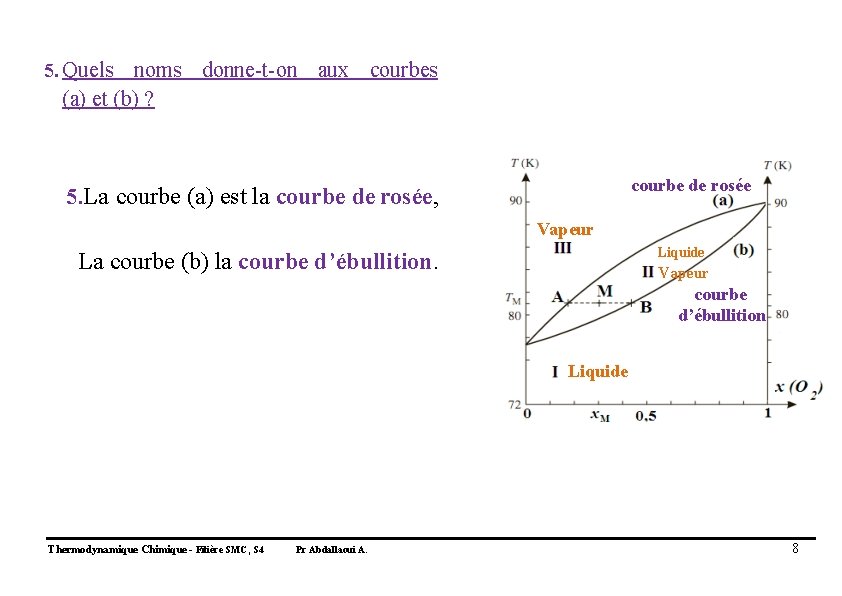
5. Quels noms donne-t-on aux courbes (a) et (b) ? courbe de rosée 5. La courbe (a) est la courbe de rosée, Vapeur Liquide La courbe (b) la courbe d’ébullition. Vapeur courbe d’ébullition Liquide Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 8

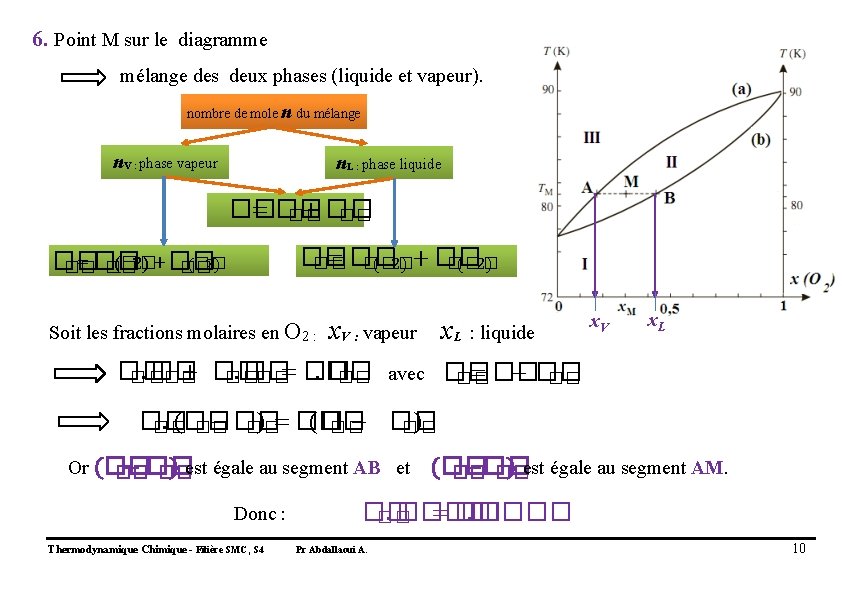
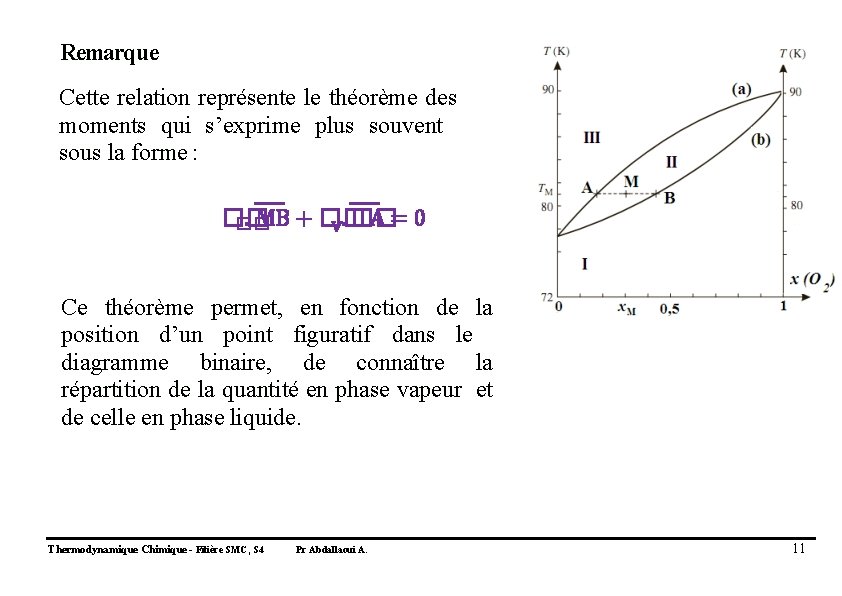
6. On considère n moles d’un mélange de composition x. M que l’on porte à la température TM. Soit n. L le nombre de moles de mélange en phase liquide. Montrer que n. L. AB = n. AM Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 9

6. Point M sur le diagramme mélange des deux phases (liquide et vapeur). nombre de mole n du mélange n. V : phase vapeur n. L : phase liquide �� = �� + �� �� = �� (�� �� �� 2) + �� �� (�� 2) = �� �� (�� 2) + �� (�� 2) �� �� �� Soit les fractions molaires en O 2 : x. V : vapeur x. L : liquide x. V x. L ��. �� + ��. �� = �� − �� �� �� avec �� ��. (�� − �� ) = �� (�� − �� ) �� �� �� Or (�� − �� ) est égale au segment AB et �� �� Donc : Thermodynamique Chimique - Filière SMC, S 4 (�� −�� ) est égale au segment AM. �� �� ��. ���� = ��. ���� �� Pr Abdallaoui A. 10

Remarque Cette relation représente le théorème des moments qui s’exprime plus souvent sous la forme : ��. MB + �� A=0 �� V. �� Ce théorème permet, en fonction de la position d’un point figuratif dans le diagramme binaire, de connaître la répartition de la quantité en phase vapeur et de celle en phase liquide. Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 11

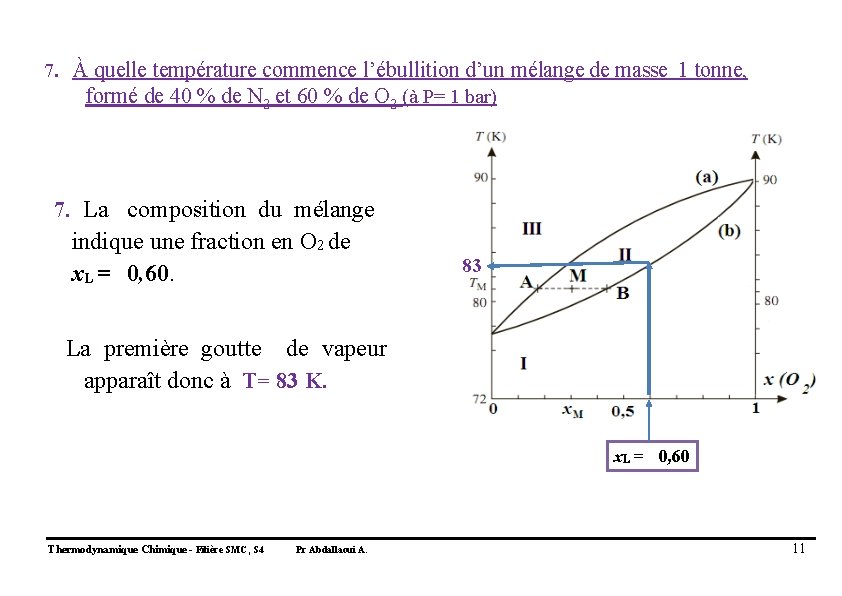
7. À quelle température commence l’ébullition d’un mélange de masse 1 tonne, formé de 40 % de N 2 et 60 % de O 2 (à P= 1 bar) 7. La composition du mélange indique une fraction en O 2 de x. L = 0, 60. 83 La première goutte de vapeur apparaît donc à T= 83 K. x. L = 0, 60 Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 11

8. À quelle température faut-il arrêter l’ébullition pour récupérer un liquide contenant 75 % de dioxygène (pourcentage molaire) ? 8. Il faut trouver T pour laquelle 85 la fraction molaire en O 2 est de x. L = 0, 75. Nous obtenons sur le diagramme T proche de 85 K. x. L = 0, 75 Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 13

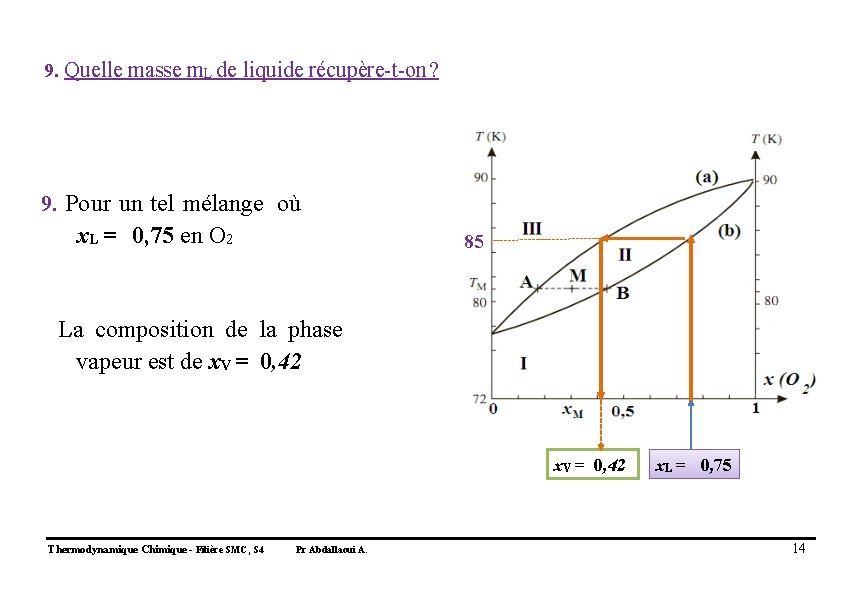
9. Quelle masse m. L de liquide récupère-t-on ? 9. Pour un tel mélange où x. L = 0, 75 en O 2 85 La composition de la phase vapeur est de x. V = 0, 42 Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. x. L = 0, 75 14

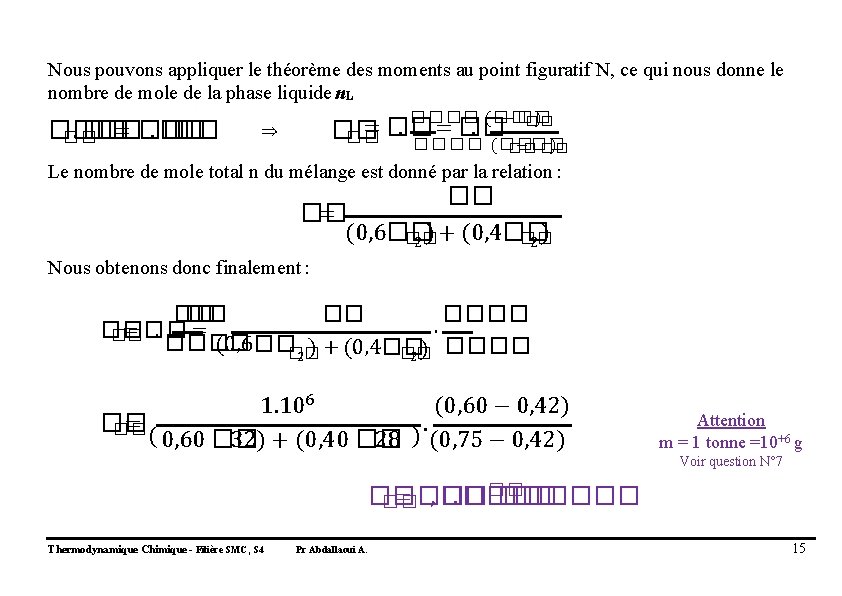
Nous pouvons appliquer le théorème des moments au point figuratif N, ce qui nous donne le nombre de mole de la phase liquide n. L ��. �� �� = ��. �� ���� (�� −�� ) �� = ��. �� �� ⇒ ���� (�� −�� ) �� �� Le nombre de mole total n du mélange est donné par la relation : �� �� = (0, 6�� ) + (0, 4�� ) �� �� 2 2 Nous obtenons donc finalement : �� ����. �� = �� ���� (0, 6���� ) + (0, 4�� �� 2 2) 1. 106 (0, 60 − 0, 42) �� =. �� ( 0, 60 �� ) 32) + (0, 40 �� 28 (0, 75 − 0, 42) Attention m = 1 tonne =10+6 g Voir question N° 7 �� �� = �� , ��. ������ �� Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 15

Cette quantité de liquide correspond à un mélange dont la composition est de 75 % de d O 2 et de 25 % de N 2. La masse molaire d’un tel mélange est donc de : �� = (0, 75�� �� �� 2) + (0, 25�� �� 2) �� = (0, 75 �� 32) + (0, 25 �� 28) = 31 �� /������ �� La masse de liquide récupérée est donc : �� = ��. �� �� �� = 1, 8. 104 �� Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. �� 31 = 5, 6. 105�� 16

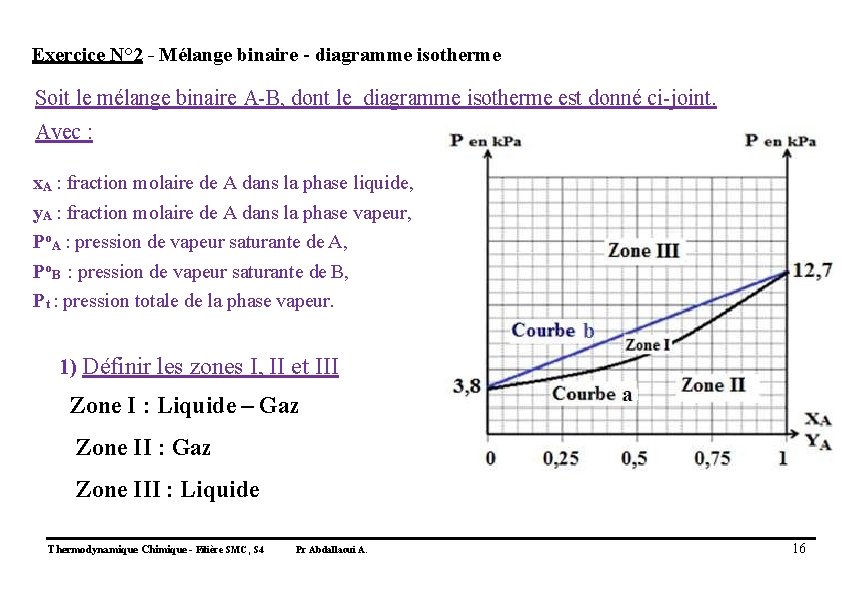
Exercice N° 2 - Mélange binaire - diagramme isotherme Soit le mélange binaire A-B, dont le diagramme isotherme est donné ci-joint. Avec : x. A : fraction molaire de A dans la phase liquide, y. A : fraction molaire de A dans la phase vapeur, Po. A : pression de vapeur saturante de A, Po. B : pression de vapeur saturante de B, Pt : pression totale de la phase vapeur. 1) Définir les zones I, II et III Zone I : Liquide – Gaz Zone II : Gaz Zone III : Liquide Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 16

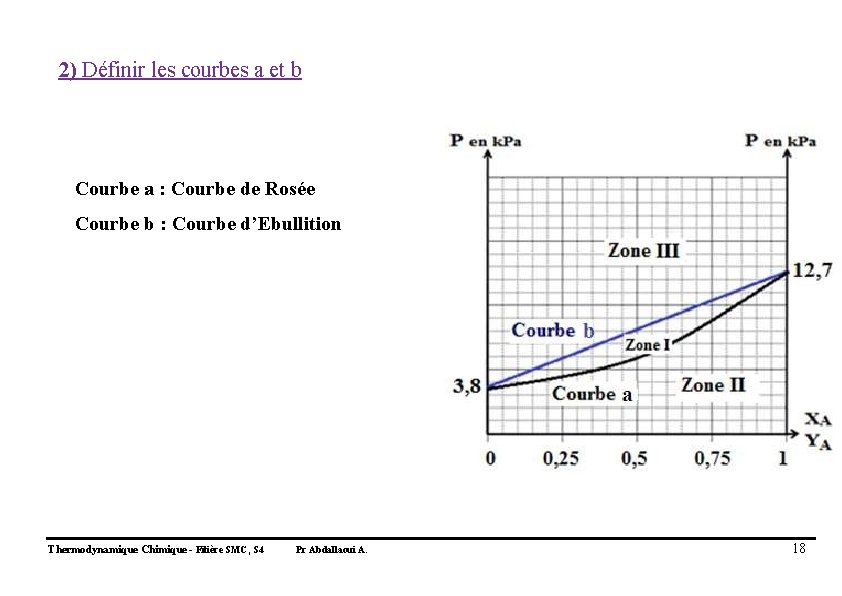
2) Définir les courbes a et b Courbe a : Courbe de Rosée Courbe b : Courbe d’Ebullition Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 18

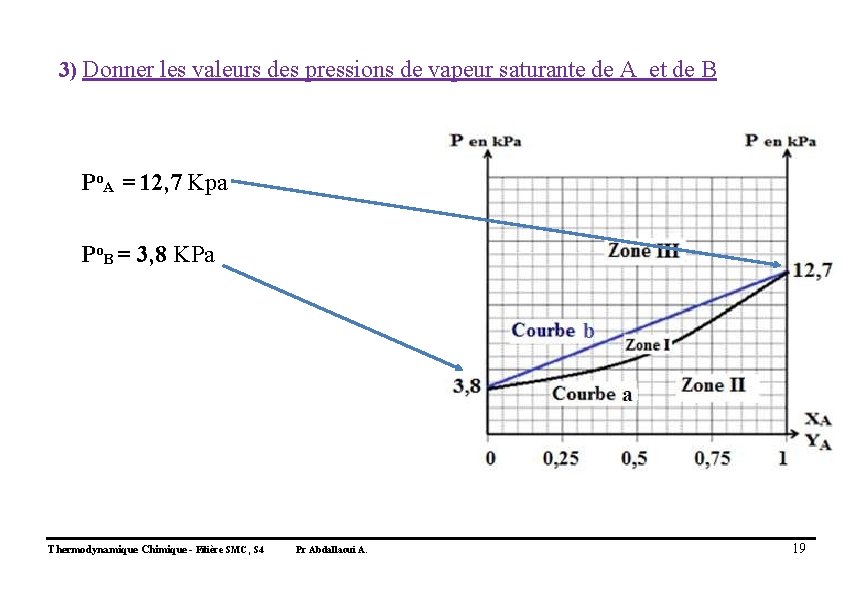
3) Donner les valeurs des pressions de vapeur saturante de A et de B Po. A = 12, 7 Kpa Po. B = 3, 8 KPa Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 19

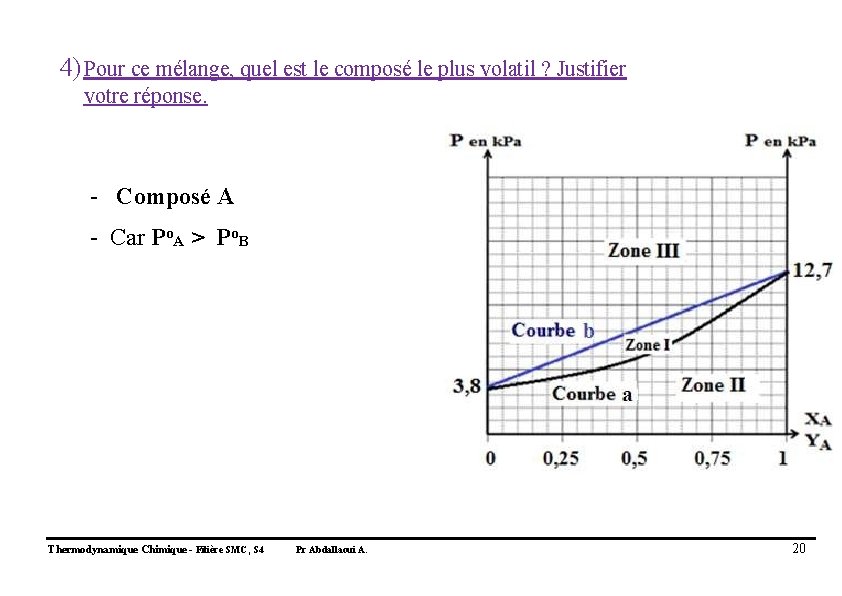
4) Pour ce mélange, quel est le composé le plus volatil ? Justifier votre réponse. - Composé A - Car Po. A > Po. B Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 20

5) Rappeler la loi de Raoult et donner la signification des termes de cette loi. PA x. A PA 0 PA : Pression de vapeur de A au-dessus de mélange ; x A : Fraction molaire de A dans la phase liquide ; PA 0 : Pression de vapeur saturante de A pur ; Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 21

6) Rappeler la loi de Dalton et donner la signification des termes de cette loi. P A y A Pt PA : Pression de vapeur de A ; y. A : Fraction molaire de A dans la phase vapeur ; Pt : Pression total de la phase vapeur ; Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 22

7) Donner l’équation mathématique qui relie Pt en fonction de x. A ; Po. A et Po. B Expression littéraire : Pt PB 0 x A P A 0 PB 0 Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 23

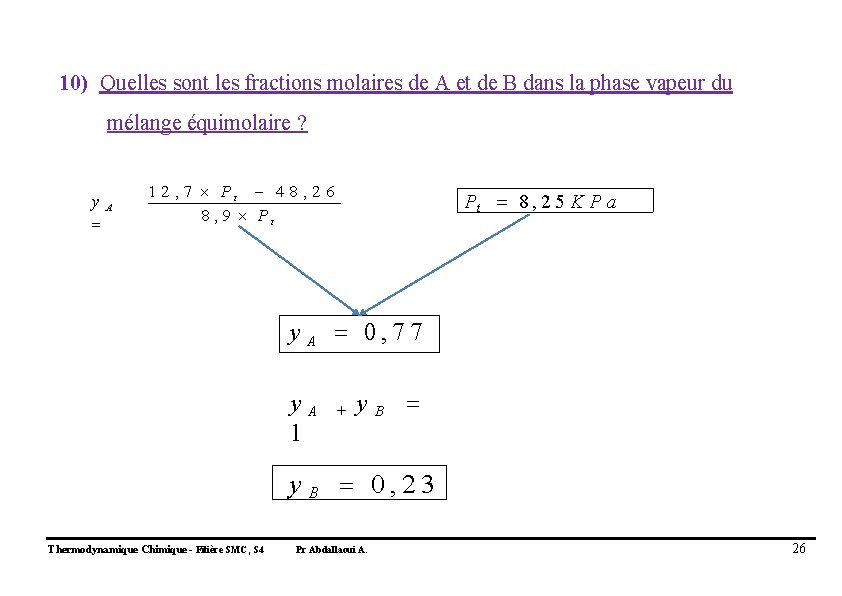
8) Donner l’équation mathématique qui relie y. A en fonction de Pt ; Po. A et Po. B y Expression littéraire Expression numérique Thermodynamique Chimique - Filière SMC, S 4 A y. A Pr Abdallaoui A. P t P A* P B* * P t P A P P B A 1 2 , 7 Pt 4 8 , 2 6 8 , 9 Pt 24

9) Quelle est la pression de vapeur totale au-dessus d’un mélange équimolaire en A et B ? x A 0, 5 Mélange équimolaire Pt PB 0 x A PA 0 PB 0 Pt 8 , 2 5 K P a Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 25

10) Quelles sont les fractions molaires de A et de B dans la phase vapeur du mélange équimolaire ? y. A 1 2 , 7 Pt 4 8 , 2 6 8 , 9 Pt Pt 8 , 2 5 K P a y A 0, 77 y. A 1 + y. B y B 0, 23 Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 26

11) En comparant les fractions molaires du liquide et de vapeur, tirer une conclusion concernant la volatilité des composés de ce mélange. x. A x. B et y. A y. B A est plus volatil que B Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 27

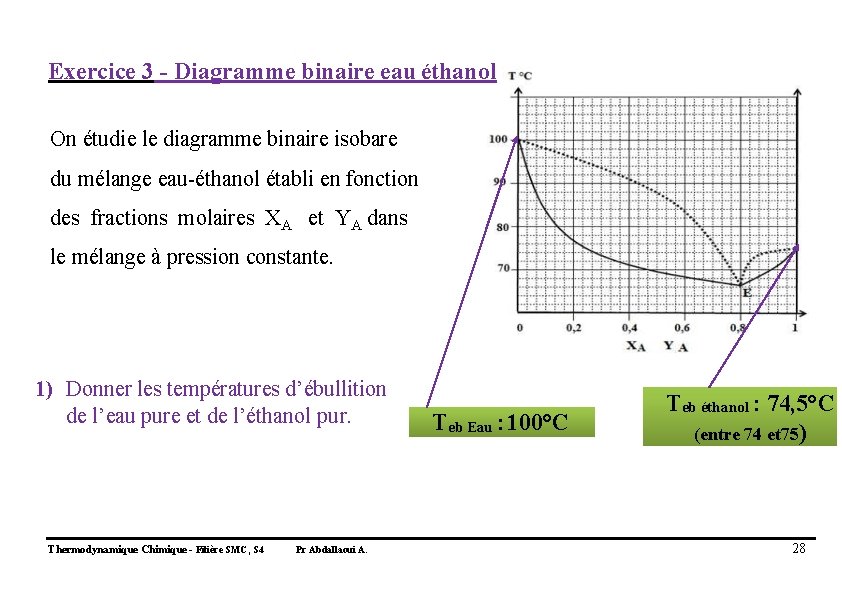
Exercice 3 - Diagramme binaire eau éthanol On étudie le diagramme binaire isobare du mélange eau-éthanol établi en fonction des fractions molaires XA et YA dans le mélange à pression constante. 1) Donner les températures d’ébullition de l’eau pure et de l’éthanol pur. Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. Teb Eau : 100°C Teb éthanol : 74, 5°C (entre 74 et 75) 28

2) Définir les fractions molaires XA et YA XA : Fraction molaire de l’éthanol dans la phase liquide. YA : Fraction molaire de l’éthanol dans la phase vapeur. Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 29

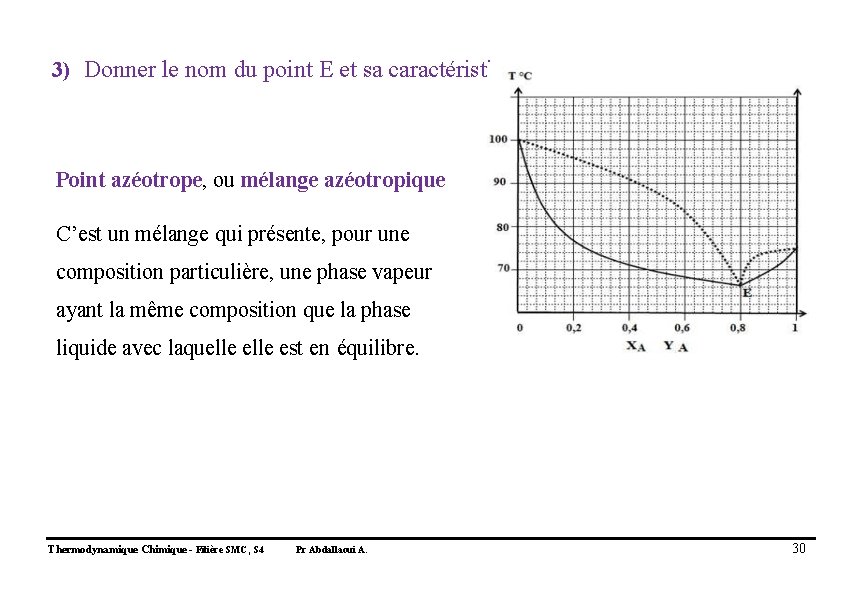
3) Donner le nom du point E et sa caractéristique : Point azéotrope, ou mélange azéotropique C’est un mélange qui présente, pour une composition particulière, une phase vapeur ayant la même composition que la phase liquide avec laquelle est en équilibre. Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 30

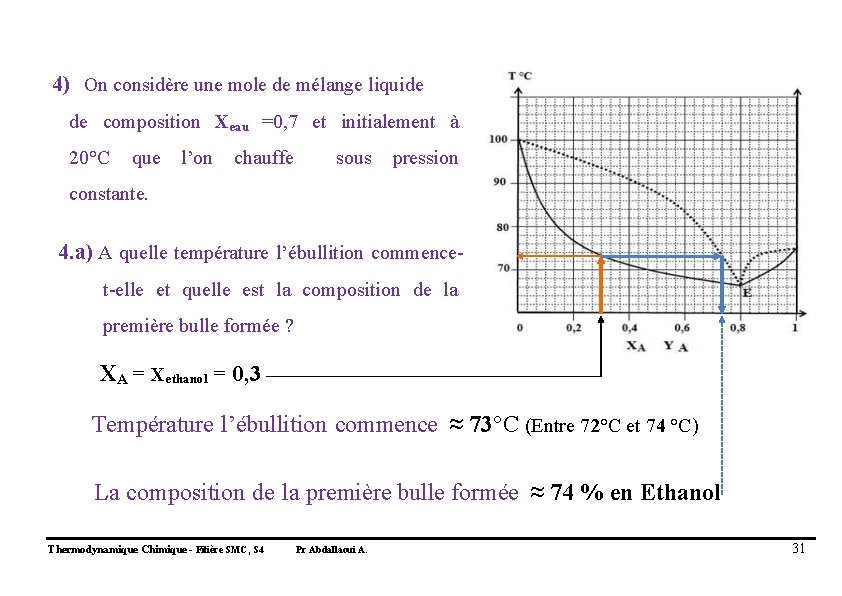
4) On considère une mole de mélange liquide de composition Xeau =0, 7 et initialement à 20°C que l’on chauffe sous pression constante. 4. a) A quelle température l’ébullition commencet-elle et quelle est la composition de la première bulle formée ? XA = Xethanol = 0, 3 Température l’ébullition commence ≈ 73°C (Entre 72°C et 74 °C) La composition de la première bulle formée ≈ 74 % en Ethanol Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 31

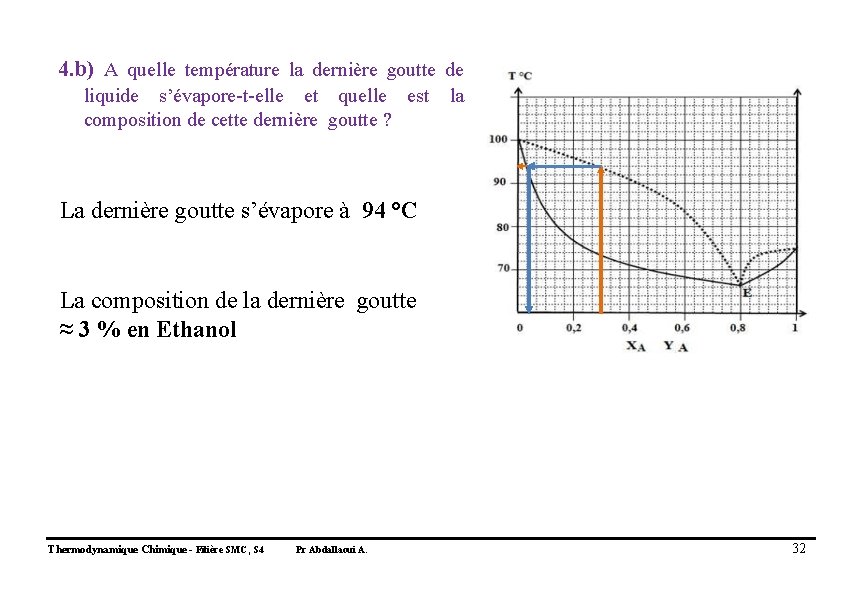
4. b) A quelle température la dernière goutte de liquide s’évapore-t-elle et quelle est composition de cette dernière goutte ? la La dernière goutte s’évapore à 94 °C La composition de la dernière goutte ≈ 3 % en Ethanol Thermodynamique Chimique - Filière SMC, S 4 Pr Abdallaoui A. 32

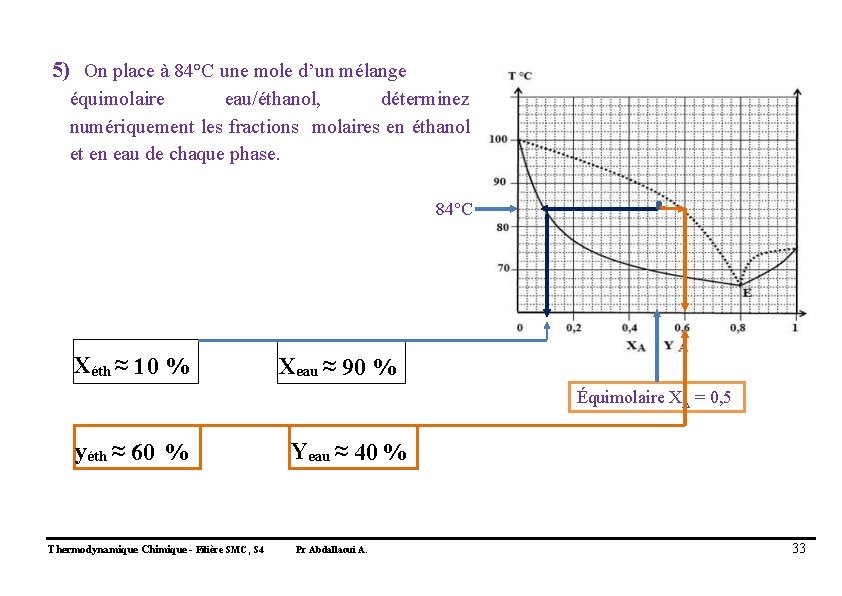
5) On place à 84°C une mole d’un mélange équimolaire eau/éthanol, déterminez numériquement les fractions molaires en éthanol et en eau de chaque phase. 84°C Xéth ≈ 10 % Xeau ≈ 90 % Équimolaire XA = 0, 5 yéth ≈ 60 % Thermodynamique Chimique - Filière SMC, S 4 Yeau ≈ 40 % Pr Abdallaoui A. 33
 1er principe de la thermodynamique
1er principe de la thermodynamique Transfert thermique
Transfert thermique Enthalpie libre
Enthalpie libre Transformation isochore
Transformation isochore Thermodynamique gaz parfait
Thermodynamique gaz parfait Transformation adiabatique
Transformation adiabatique Thermodynamique
Thermodynamique Transformation isochore
Transformation isochore Thermodynamique
Thermodynamique Filire
Filire Formule structurale olivine
Formule structurale olivine Affinité chimique
Affinité chimique Déplacement chimique
Déplacement chimique Filire
Filire Flu produit chimique
Flu produit chimique Traceur chimique
Traceur chimique Famille chimique
Famille chimique Molécule simple
Molécule simple Systme digestif
Systme digestif Filire
Filire Filire
Filire Filire
Filire Filire
Filire Filire
Filire Metallo chimique beerse
Metallo chimique beerse Formule cuivre
Formule cuivre Famille chimique
Famille chimique La filire
La filire équilibre chimique
équilibre chimique La filire
La filire Risque chimique définition
Risque chimique définition Les dérives du pétrole sont des matériaux synthétiques
Les dérives du pétrole sont des matériaux synthétiques Filire
Filire Procédé chimique
Procédé chimique