Cours de Chimie gnrale 1 LIAISON CHIMIQUE LIAISONS






![Cours de Chimie Minérale générale 2. Exemple: [Fe(H 2 O)6]3+ Fe 3+ + 6 Cours de Chimie Minérale générale 2. Exemple: [Fe(H 2 O)6]3+ Fe 3+ + 6](https://slidetodoc.com/presentation_image_h2/7e0f337c1adabd451cc92f866e3516f0/image-10.jpg)

![Cours de Chimie Minérale générale 2. Exemples : [Fe(CN)6]3 - et [Fe(H 2 O)6]3+ Cours de Chimie Minérale générale 2. Exemples : [Fe(CN)6]3 - et [Fe(H 2 O)6]3+](https://slidetodoc.com/presentation_image_h2/7e0f337c1adabd451cc92f866e3516f0/image-13.jpg)
![Cours de Chimie Minérale générale 2. [Fe(H 2 O)6]3+ H 2 O est un Cours de Chimie Minérale générale 2. [Fe(H 2 O)6]3+ H 2 O est un](https://slidetodoc.com/presentation_image_h2/7e0f337c1adabd451cc92f866e3516f0/image-15.jpg)

![Cours de Chimie Minérale générale 2. Autres exemples : [Pt(Cl)4]2 - , [Pd(NH 3)4]2+, Cours de Chimie Minérale générale 2. Autres exemples : [Pt(Cl)4]2 - , [Pd(NH 3)4]2+,](https://slidetodoc.com/presentation_image_h2/7e0f337c1adabd451cc92f866e3516f0/image-17.jpg)
![Cours de Chimie Minérale générale 2. [Pt(Cl)4]2 Pt (Z=78) Couche de valence: 5 d Cours de Chimie Minérale générale 2. [Pt(Cl)4]2 Pt (Z=78) Couche de valence: 5 d](https://slidetodoc.com/presentation_image_h2/7e0f337c1adabd451cc92f866e3516f0/image-18.jpg)
![Cours de Chimie Minérale générale 2. [Pd(NH 3)4]2+, [Ni(CN)4]2 - …. Pd (Z=46) Pd Cours de Chimie Minérale générale 2. [Pd(NH 3)4]2+, [Ni(CN)4]2 - …. Pd (Z=46) Pd](https://slidetodoc.com/presentation_image_h2/7e0f337c1adabd451cc92f866e3516f0/image-19.jpg)
- Slides: 19

Cours de Chimie générale 1 “LIAISON CHIMIQUE". LIAISONS CHIMIQUES Mme I. ALAOUI Mr M. SABBAR Département de Chimie Faculté des Sciences Université Chouaïb Doukkali

Cours de Chimie générale 1 “LIAISON CHIMIQUE". Introduction aux composés de coordinations (complexes des métaux de transitons)

Cours de Chimie générale 1 “LIAISON CHIMIQUE". INTRODUCTION: Les éléments de la 2ème ou la 3ème période sont caractérisés par des configurations électroniques du type : […. nsx, npy] avec x + y varie de 1 à 8. Pour les éléments de transitions la configuration électronique est de type : […. (n-1)dx, nsy] avec x varie de 1 à 10 et y = 1 ou 2. Exemple : Fe (Z= 26) Ni (Z=28) Fe (Z= 26) …. 3 d 64 s 2 Ni (Z=28) …. 3 d 84 s 2 Fe 2+ …. 3 d 6 Ni 2+ …. 3 d 8

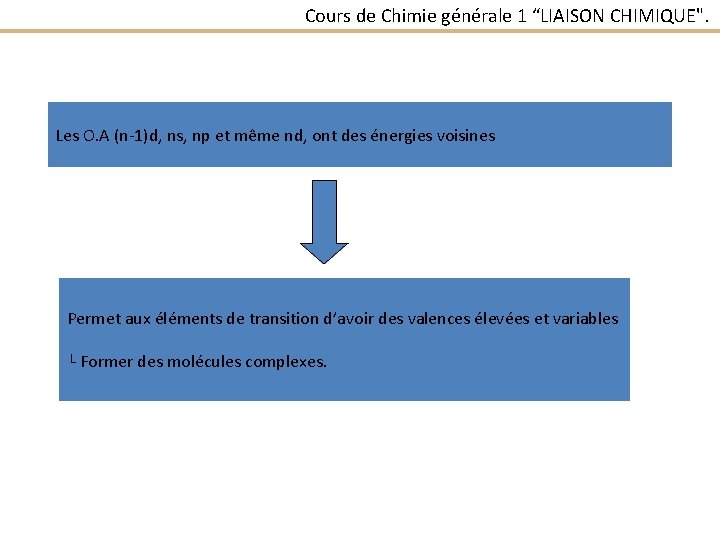
Cours de Chimie générale 1 “LIAISON CHIMIQUE". Les O. A (n-1)d, ns, np et même nd, ont des énergies voisines Permet aux éléments de transition d’avoir des valences élevées et variables └ Former des molécules complexes.

Cours de Chimie générale 1 “LIAISON CHIMIQUE". I- DEFINITIONS. 1 - Une molécule complexe est une espèce chimique dans laquelle un atome (C) est lié à un nombre d’autres atomes ou groupe d’atomes (L), qui excèdent la charge ou le degré d’oxydation de l’atome (C) (par des liaisons de coordinations). C : Atome centrale ou nucléaire (souvent un métal de transition). L : Ligand ou coordinat (atome ou groupement d’atomes donneur d’électrons). Exemple : [Fe(CN)6]4 - ion hexacyanoferrate(II) (mononucleaire) Fe 2+ : Atome central ou nucléaire CN- : Ligand ou coordinat

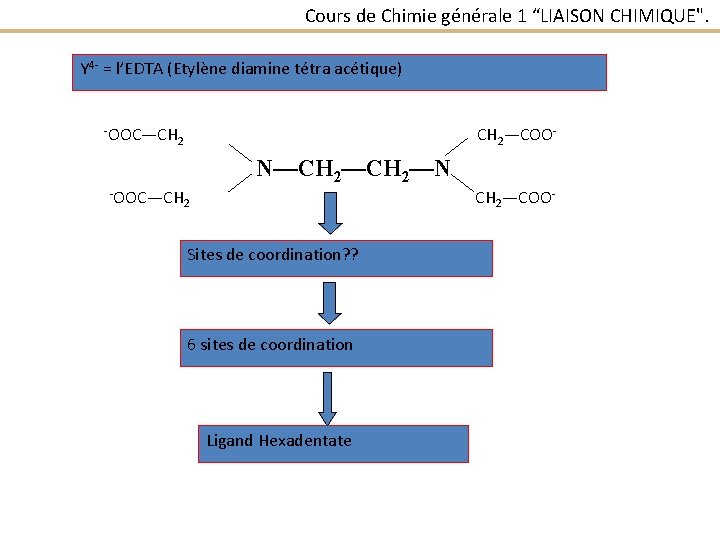
Cours de Chimie générale 1 “LIAISON CHIMIQUE". 2 - Site de coordination : Dans un ligand constitué de plusieurs atomes, ou site de coordinateur est l’atome directement lié à l’atome central (C) coordination ou atome 3 - Un ligand est dit monodentate s’il possède un seul site de coordination Exemple : ׀ NH 3 Ligand Bidentate : 2 sites de coordination Exemple : H 2 N─CH 2─NH 2

Cours de Chimie générale 1 “LIAISON CHIMIQUE". Y 4 - = l’EDTA (Etylène diamine tétra acétique) -OOC—CH CH 2—COO- 2 N—CH 2—N -OOC—CH CH 2—COO- 2 Sites de coordination? ? 6 sites de coordination Ligand Hexadentate

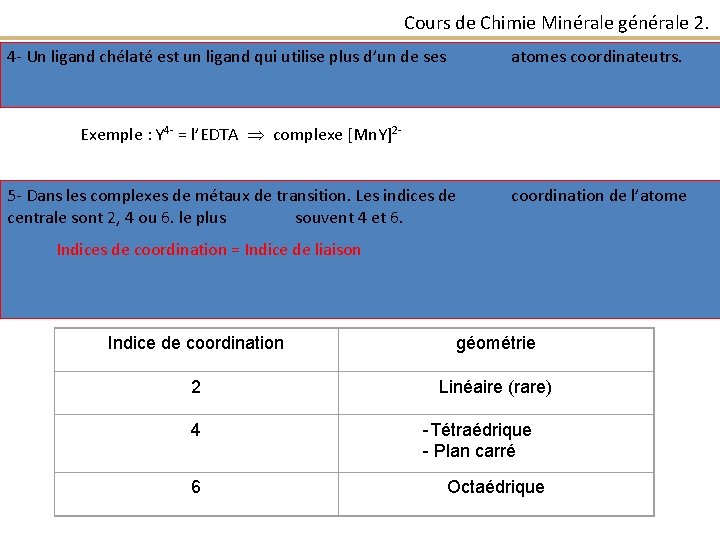
Cours de Chimie Minérale générale 2. 4 - Un ligand chélaté est un ligand qui utilise plus d’un de ses atomes coordinateutrs. Exemple : Y 4 - = l’EDTA complexe [Mn. Y]25 - Dans les complexes de métaux de transition. Les indices de centrale sont 2, 4 ou 6. le plus souvent 4 et 6. coordination de l’atome Indices de coordination = Indice de liaison Indice de coordination géométrie 2 Linéaire (rare) 4 6 -Tétraédrique - Plan carré Octaédrique

Cours de Chimie Minérale générale 2. II- STABILITE DES COMPLEXES CLm Kd C + m. L Kf La constante d’équilibre de dissociation (Kd) : Kd =[C][L]m / [CLm] La constante d’équilibre de formation (Kf): Kf = 1/Kd = [CLm] / [C][L]m Plus la constante d’équilibre de formation d’un complexe est grande plus le complexe est stable.
![Cours de Chimie Minérale générale 2 Exemple FeH 2 O63 Fe 3 6 Cours de Chimie Minérale générale 2. Exemple: [Fe(H 2 O)6]3+ Fe 3+ + 6](https://slidetodoc.com/presentation_image_h2/7e0f337c1adabd451cc92f866e3516f0/image-10.jpg)
Cours de Chimie Minérale générale 2. Exemple: [Fe(H 2 O)6]3+ Fe 3+ + 6 H 2 O 6 CN- [Fe(CN)6]3 - + 6 H 2 O Car [Fe(CN)6]3 - a une constante de formation beaucoup plus grande que celle de [Fe(H 2 O)6]3+.

Cours de Chimie Minérale générale 2. III- THEORIE DE LA LIAISON DE VALENCE. Théorie de Pauling - Permet d’interpréter la structure des complexes - Prévoir la géométrie des complexes - Prévoir les propriétés magnétiques des complexes

Cours de Chimie Minérale générale 2. L’hybridation de l’atome central (métal de transition) dans les composés de coordination est de type spxdy ou dx’spy’ L’hybridation dans les complexes dépend de la nature du ligand: - Ligand fort conduit à la formation d’un complexe à spin faible. - Ligand faible conduit à la formation d’un complexe à spin fort.
![Cours de Chimie Minérale générale 2 Exemples FeCN63 et FeH 2 O63 Cours de Chimie Minérale générale 2. Exemples : [Fe(CN)6]3 - et [Fe(H 2 O)6]3+](https://slidetodoc.com/presentation_image_h2/7e0f337c1adabd451cc92f866e3516f0/image-13.jpg)
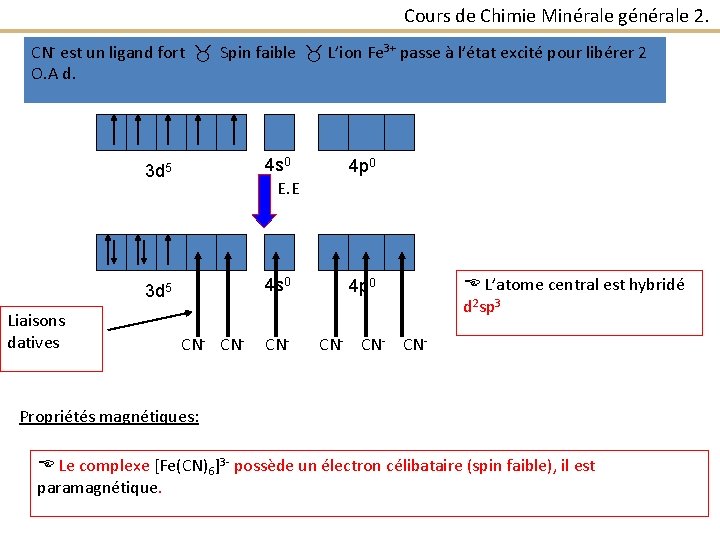
Cours de Chimie Minérale générale 2. Exemples : [Fe(CN)6]3 - et [Fe(H 2 O)6]3+ CN- est un ligand fort et H 2 O est un ligand faible. [Fe(CN)6]3 - : CN- est un ligand fort Spin faible Fe Couche de valence: 3 d 64 s 2 Fe 3+ couche de valence: 3 d 5 4 s 0 4 p 0 Le complexe [Fe(CN)6]3 - étant octaédrique : - L’atome central (Fe 3+ ) forme 6 liaisons dative ou de coordination avec 6 ligands (CN-).

Cours de Chimie Minérale générale 2. CN- est un ligand fort Spin faible L’ion Fe 3+ passe à l’état excité pour libérer 2 O. A d. Liaisons datives 3 d 5 4 s 0 E. E 4 p 0 3 d 5 4 s 0 4 p 0 CN- CN- L’atome central est hybridé d 2 sp 3 CN- CN- Propriétés magnétiques: Le complexe [Fe(CN)6]3 - possède un électron célibataire (spin faible), il est paramagnétique.
![Cours de Chimie Minérale générale 2 FeH 2 O63 H 2 O est un Cours de Chimie Minérale générale 2. [Fe(H 2 O)6]3+ H 2 O est un](https://slidetodoc.com/presentation_image_h2/7e0f337c1adabd451cc92f866e3516f0/image-15.jpg)
Cours de Chimie Minérale générale 2. [Fe(H 2 O)6]3+ H 2 O est un ligand faible Spin fort 3 d 5 4 s 0 H 2 O 4 p 0 4 d 0 H 2 O H 2 O L’atome central est hybridé sp 3 d 2 Propriétés magnétiques: Le complexe [Fe(H 2 O)6]3+ possède 5 électrons célibataires (spin fort), il est paramagnétique.

Cours de Chimie Minérale générale 2. Remarque : En général les complexes à spins couplés sont plans carrés et les complexes à spins libres (fort) sont tétraédrique ou souvent des octaédriques.
![Cours de Chimie Minérale générale 2 Autres exemples PtCl42 PdNH 342 Cours de Chimie Minérale générale 2. Autres exemples : [Pt(Cl)4]2 - , [Pd(NH 3)4]2+,](https://slidetodoc.com/presentation_image_h2/7e0f337c1adabd451cc92f866e3516f0/image-17.jpg)
Cours de Chimie Minérale générale 2. Autres exemples : [Pt(Cl)4]2 - , [Pd(NH 3)4]2+, [Ni(CN)4]2 - …. L’atome central est ici entouré de quatre ligands situés tous dans un même plan, l’angle entre deux liaisons est de 90°. Complexes plan carré A faire : Vérifier que tous ces complexes de coordination 4 sont diamagnétiques et que l’atome central est hybridé dsp 2.
![Cours de Chimie Minérale générale 2 PtCl42 Pt Z78 Couche de valence 5 d Cours de Chimie Minérale générale 2. [Pt(Cl)4]2 Pt (Z=78) Couche de valence: 5 d](https://slidetodoc.com/presentation_image_h2/7e0f337c1adabd451cc92f866e3516f0/image-18.jpg)
Cours de Chimie Minérale générale 2. [Pt(Cl)4]2 Pt (Z=78) Couche de valence: 5 d 86 s 2 Pt 2+ couche de valence: 5 d 8 6 s 0 6 p 0 [Pt(Cl)4]2 - est plan carré 6 s 0 5 d 8 Cl - 6 p 0 - Cl Cl -
![Cours de Chimie Minérale générale 2 PdNH 342 NiCN42 Pd Z46 Pd Cours de Chimie Minérale générale 2. [Pd(NH 3)4]2+, [Ni(CN)4]2 - …. Pd (Z=46) Pd](https://slidetodoc.com/presentation_image_h2/7e0f337c1adabd451cc92f866e3516f0/image-19.jpg)
Cours de Chimie Minérale générale 2. [Pd(NH 3)4]2+, [Ni(CN)4]2 - …. Pd (Z=46) Pd 2+ couche de valence: 4 d 8 5 s 05 p 0 Ni (Z=28) Ni 2+ couche de valence: 3 d 8 4 s 04 p 0
 Socit gnrale
Socit gnrale Liaisons interdites
Liaisons interdites Modélisation des liaisons
Modélisation des liaisons Formule chimique c
Formule chimique c Traceur chimique
Traceur chimique Procédé chimique
Procédé chimique Famille chimique
Famille chimique Procédé chimique
Procédé chimique Espèce chimique naturelle exemple
Espèce chimique naturelle exemple Relation entre kp et kc
Relation entre kp et kc Famille chimique
Famille chimique Composition d'un poisson
Composition d'un poisson Elmet berango
Elmet berango Déplacement chimique
Déplacement chimique Plagioclase formule
Plagioclase formule Potentiel chimique
Potentiel chimique La digestion in vitro du pain par l amylase salivaire
La digestion in vitro du pain par l amylase salivaire Risque chimique définition
Risque chimique définition équilibre chimique
équilibre chimique Systme digestif
Systme digestif




































