3 Das chemische Gleichgewicht 3 8 Redoxvorgnge Elektrolyse





















































- Slides: 60

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolyse

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolyse

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolyse

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolyse

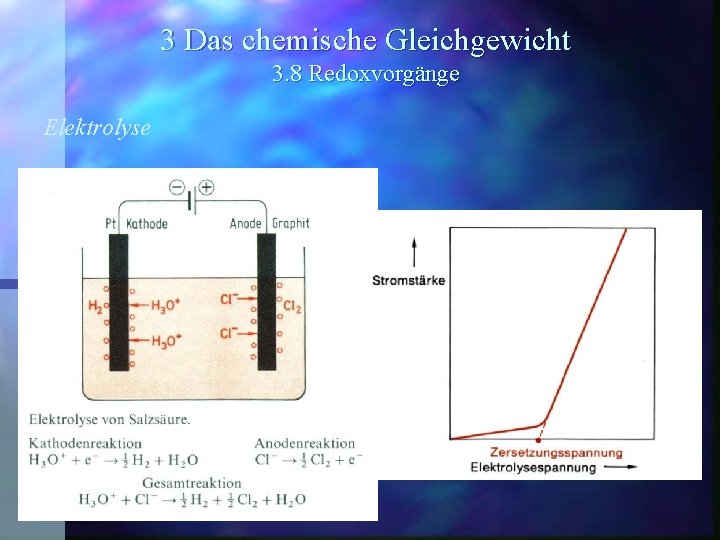
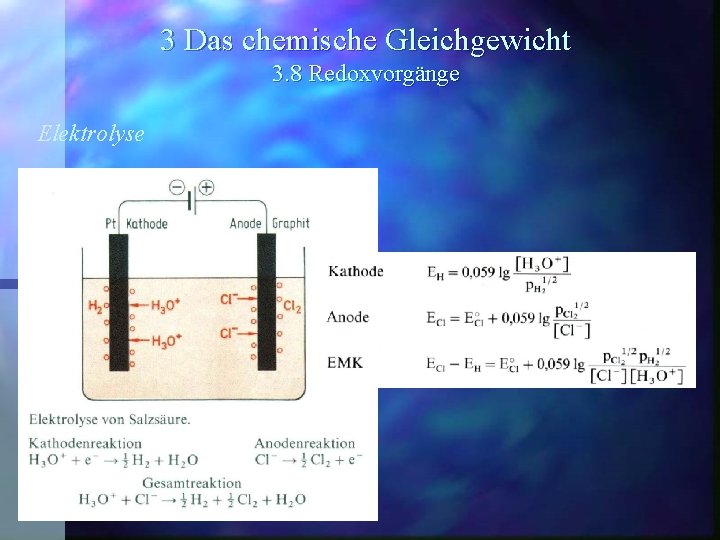
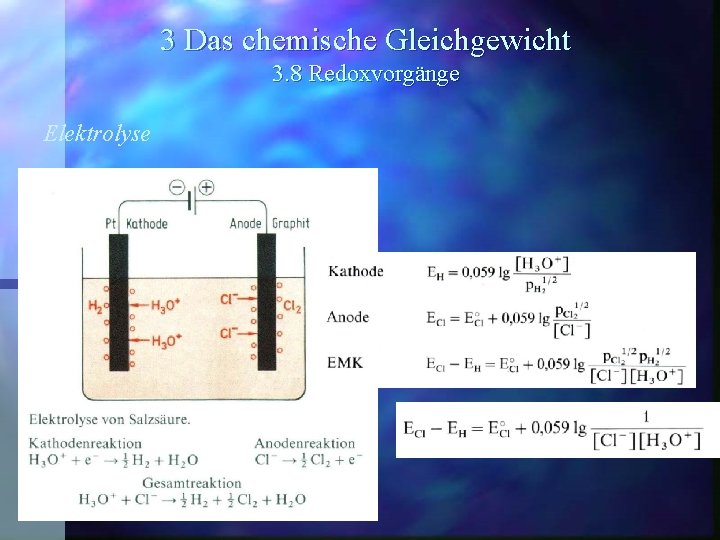
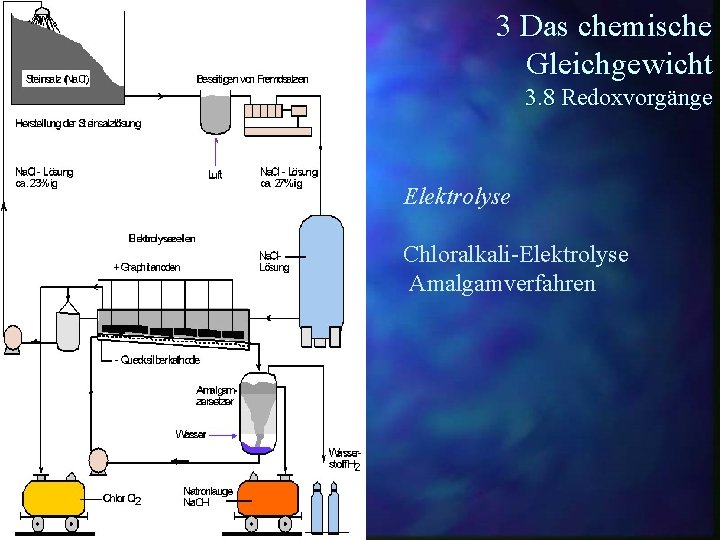
3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolysiert man eine wäßrige Lösung , die verschiedene Ionensorten enthält, so scheiden sich mit wachsender Spannung die einzelnen Ionensorten nacheinander ab.

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolysiert man eine wäßrige Lösung , die verschiedene Ionensorten enthält, so scheiden sich mit wachsender Spannung die einzelnen Ionensorten nacheinander ab. An der Kathode wird zuerst die Kationensorte mit dem positivsten Potential entladen. Je edler ein Metall ist, umso leichter sind seine Ionen reduzierbar.

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolysiert man eine wäßrige Lösung , die verschiedene Ionensorten enthält, so scheiden sich mit wachsender Spannung die einzelnen Ionensorten nacheinander ab. An der Kathode wird zuerst die Kationensorte mit dem positivsten Potential entladen. Je edler ein Metall ist, umso leichter sind seine Ionen reduzierbar. An der Anode werden zuerst diejenigen Ionen oxidiert, die negativsten Redoxpotentiale haben.

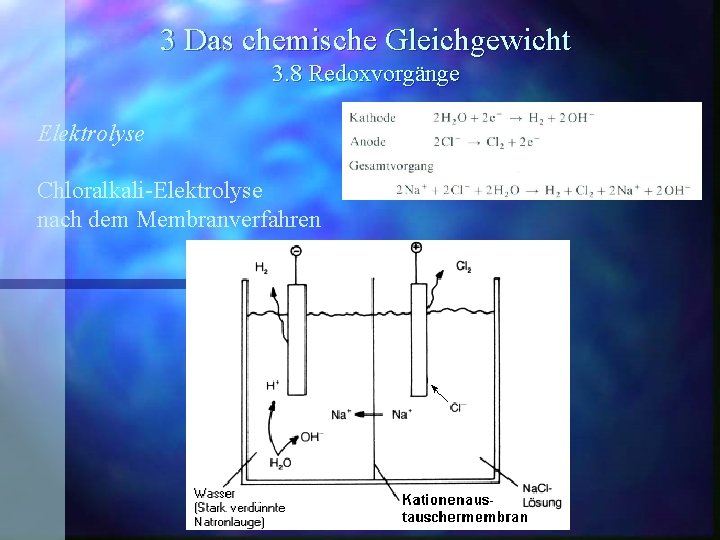
3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolyse Chloralkali-Elektrolyse

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolyse Chloralkali-Elektrolyse

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolyse Chloralkali-Elektrolyse

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolyse Chloralkali-Elektrolyse nach dem Membranverfahren

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolyse Chloralkali-Elektrolyse Amalgamverfahren

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolyse Chloralkali-Elektrolyse Amalgamverfahren

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolyse Chloralkali-Elektrolyse Amalgamverfahren

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolyse Äquivalent Ein Äquivalent ist der Bruchteil 1/z* eines Teilchens X. z* wird Äquivalentzahl genannt.

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolyse Äquivalent Ein Äquivalent ist der Bruchteil 1/z* eines Teilchens X. z* wird Äquivalentzahl genannt. Beispiel Neutralisationsäquivalent (Säure-Base-Äquivalent) 1/2 H 2 SO 4, 1/2 Ba(OH)2, 1/3 H 3 PO 4

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolyse Äquivalent Ein Äquivalent ist der Bruchteil 1/z* eines Teilchens X. z* wird Äquivalentzahl genannt. Beispiel Redoxäquivalent (Aufnahme oder Abgabe eines Elektrons) 1/5 KMn. O 4, 1/6 K 2 Cr 2 O 7

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolyse Äquivalent Ein Äquivalent ist der Bruchteil 1/z* eines Teilchens X. z* wird Äquivalentzahl genannt. Beispiel Ionenäquivalent (Bruchrteils eines Ions, das eine Elementarladung trägt. 1/3 Fe 3+, 1/2 Mg 2+, 1/2 SO 42 -

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolyse Äquivalent Die Stoffmenge von Äquivalenten ist gleich dem Produkt aus der Äquivalentzahl z* und der Stoffmenge n, bezogen auf die Teilchen X.

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolyse Äquivalent Die Stoffmenge von Äquivalenten ist gleich dem Produkt aus der Äquivalentzahl z* und der Stoffmenge n, bezogen auf die Teilchen X.

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolyse Äquivalent

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolyse Äquivalent

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolyse Faraday-Gesetz

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrolyse Faraday-Gesetz Durch die Ladungsmenge von 1 F werden 1 mol Ionenäquivalente abgeschieden. Durch 1 F werden also gerade 1 mol Me+-Ionen (Na+, Ag+), 1/2 mol Me 2+-Ionen (Cu 2+, Zn 2+) und 1/3 mol Me 3+-Ionen (Al 3+, Fe 3+) abgeschieden.

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Man unterscheidet Primärelemente und Sekundärelemente

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Man unterscheidet Primärelemente und Sekundärelemente

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Bleiakkumulator

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Bleiakkumulator Besteht aus einer Bleielektrode und einer Bleidioxidelektrode; als Elektrolyt wird ca. 20%ige Schwefelsäure verwendet.

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Bleiakkumulator Besteht aus einer Bleielektrode und einer Bleidioxidelektrode; als Elektrolyt wird ca. 20%ige Schwefelsäure verwendet.

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Bleiakkumulator Besteht aus einer Bleielektrode und einer Bleidioxidelektrode; als Elektrolyt wird ca. 20%ige Schwefelsäure verwendet.

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Bleiakkumulator

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Bleiakkumulator

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Natrium-Schwefel-Akkumulator

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Natrium-Schwefel-Akkumulator Besteht aus bei der Betriebstemperatur von 300 - 350 °C flüssigen Elektroden aus Natrium und Schwefel.

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Natrium-Schwefel-Akkumulator Besteht aus bei der Betriebstemperatur von 300 - 350 °C flüssigen Elektroden aus Natrium und Schwefel. Beide Elektroden sind durch einen für Na+ - Ionen durchlässigen Festelektrolyten voneinander getrennt.

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Natrium-Schwefel-Akkumulator Besteht aus bei der Betriebstemperatur von 300 - 350 °C flüssigen Elektroden aus Natrium und Schwefel. Beide Elektroden sind durch einen für Na+ - Ionen durchlässigen Festelektrolyten voneinander getrennt. Betriebsspannung 2, 08 V

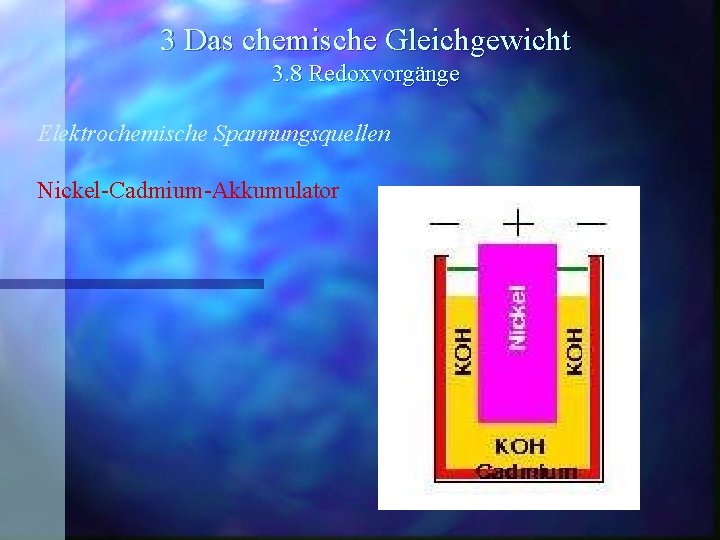
3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Nickel-Cadmium-Akkumulator

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Nickel-Cadmium-Akkumulator

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Nickel-Cadmium-Akkumulator

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Nickel-Cadmium-Akkumulator

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Leclanché-Element

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Leclanché-Element

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Leclanché-Element

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Leclanché-Element

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Leclanché-Element

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Leclanché-Element

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Leclanché-Element

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Leclanché-Element

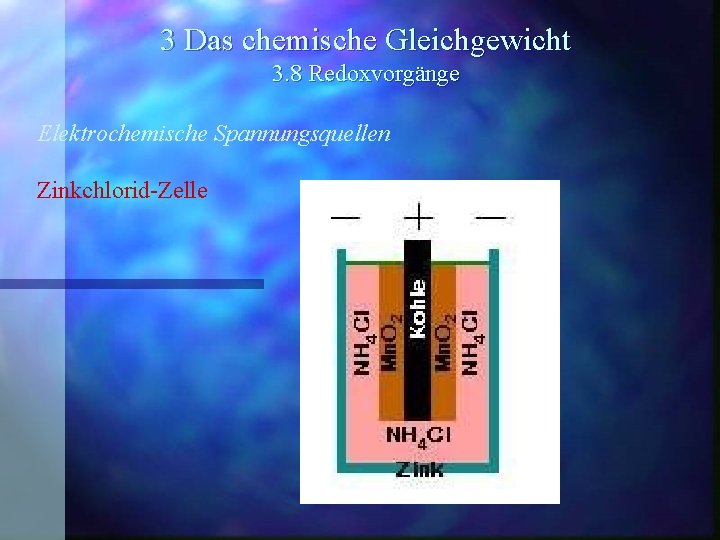
3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Zinkchlorid-Zelle

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Zinkchlorid-Zelle

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Zinkchlorid-Zelle gute Auslaufsicherheit, da Wasser verbraucht wird.

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Zinkchlorid-Zelle

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Alkali-Mangan-Zelle

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Alkali-Mangan-Zelle

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Alkali-Mangan-Zelle Betrieb bis -35 °C.

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Alkali-Mangan-Zelle

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Silber-Zink-Zelle

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Silber-Zink-Zelle

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Silber-Zink-Zelle Betriebsspannung 1, 5 V

3 Das chemische Gleichgewicht 3. 8 Redoxvorgänge Elektrochemische Spannungsquellen Brennstoffzelle
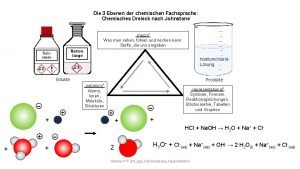
 Johnstone dreieck
Johnstone dreieck Elektrolyse einer kupferchloridlösung
Elektrolyse einer kupferchloridlösung Elektrolyse koperchloride
Elektrolyse koperchloride Zinkchlorid elektrolyse
Zinkchlorid elektrolyse Elektrolyse kupfersulfatlösung
Elektrolyse kupfersulfatlösung Multiplikatoreffekt akzeleratoreffekt
Multiplikatoreffekt akzeleratoreffekt Grundlagen der elektrochemie
Grundlagen der elektrochemie Aktivierungsvolumen
Aktivierungsvolumen Nash gleichgewicht
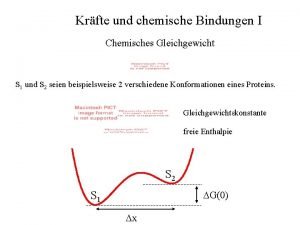
Nash gleichgewicht Gleichgewichtskonstante druck
Gleichgewichtskonstante druck Massenwirkungsgesetz ammoniak
Massenwirkungsgesetz ammoniak Voorbeelden van chemische energie
Voorbeelden van chemische energie Bindung
Bindung Exotherme reactie grafiek
Exotherme reactie grafiek Chemische formel schokolade
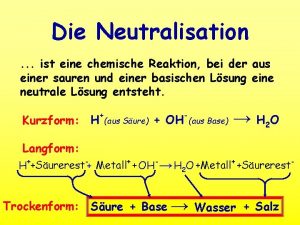
Chemische formel schokolade Chemische neutralisation
Chemische neutralisation Teloglia
Teloglia Chemische curettage
Chemische curettage Das alles ist deutschland das alles sind wir
Das alles ist deutschland das alles sind wir Ich bin die wahrheit und das licht
Ich bin die wahrheit und das licht Das alte ist vergangen das neue angefangen
Das alte ist vergangen das neue angefangen Reflexões do poeta canto v
Reflexões do poeta canto v é a vida gonzaguinha
é a vida gonzaguinha Ter amigos é como arvorear
Ter amigos é como arvorear Gautam das uta
Gautam das uta Algas pardas
Algas pardas Lei das proporções múltiplas
Lei das proporções múltiplas Preposio
Preposio Pseudocaule
Pseudocaule Das würfelhaus vom bild zur zahl
Das würfelhaus vom bild zur zahl Symptoms of anemia in pregnancy
Symptoms of anemia in pregnancy Welche stadt ist das
Welche stadt ist das Wiederkäuer
Wiederkäuer Das sofa steht neben
Das sofa steht neben Die der das chart
Die der das chart Für wen gilt das jugendarbeitsschutzgesetz
Für wen gilt das jugendarbeitsschutzgesetz Quais são as proibições das testemunhas de jeová
Quais são as proibições das testemunhas de jeová Nossa senhora das dores
Nossa senhora das dores Ein jahr hat vier jahreszeiten
Ein jahr hat vier jahreszeiten Para determinada espécie de planta a cor das pétalas
Para determinada espécie de planta a cor das pétalas Passiva sintética
Passiva sintética Absorção das vitaminas
Absorção das vitaminas Mapa das sete igrejas da ásia
Mapa das sete igrejas da ásia дни недели на немецком
дни недели на немецком Gimnospermas exemplos
Gimnospermas exemplos Lei de kirchhoff das correntes
Lei de kirchhoff das correntes Er ihn ihm sie ihr sie
Er ihn ihm sie ihr sie Um automóvel se desloca numa rodovia da cidade das rosas
Um automóvel se desloca numa rodovia da cidade das rosas Metagênese
Metagênese Recanto das letras
Recanto das letras Ciclo das rochas 6 ano
Ciclo das rochas 6 ano Lei de kirchhoff das tensões
Lei de kirchhoff das tensões Internet das coisas
Internet das coisas Arten von cybermobbing
Arten von cybermobbing Elementos constitutivos das artes visuais
Elementos constitutivos das artes visuais Nomenclatura das bases
Nomenclatura das bases Eixos coordenados
Eixos coordenados Chaitanya charan das
Chaitanya charan das Via das hexoses monofosfato
Via das hexoses monofosfato Das unbild
Das unbild Einfach spitze das du da bist
Einfach spitze das du da bist