2 Enlace qumico e interacciones no covalentes Estructura
















- Slides: 28

2. Enlace químico e interacciones no covalentes

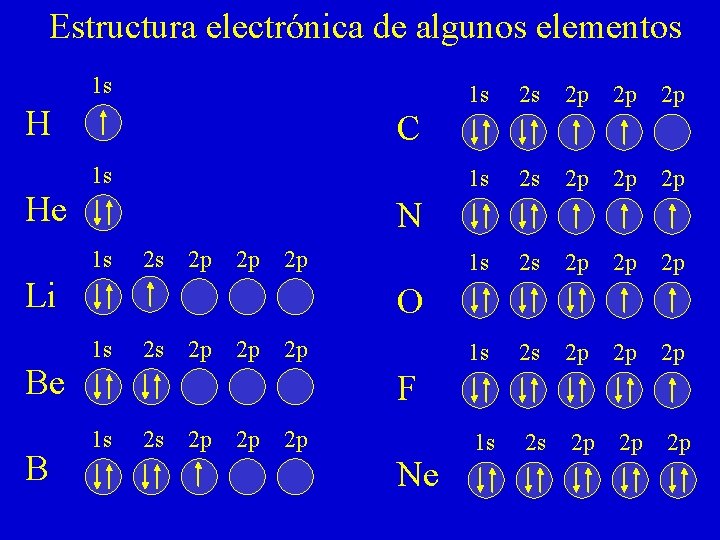
Estructura electrónica de algunos elementos 1 s H He 2 p 2 p 2 p 1 s 2 s 2 p 2 p 2 p N 1 s 2 s 2 p 2 p 2 p Li B 2 s C 1 s Be 1 s O 1 s 2 s 2 p 2 p 2 p F 1 s 2 s 2 p 2 p 2 p Ne

Enlaces iónicos A • + B • A+ + : B- 1. Fuertes (>50 kcal/mol) 2. Propios del estado cristalino 3. Elementos extremos en la Tabla Periódica

Enlace iónico Cristal de Cl. Na

Enlaces covalentes 1. Compartición de electrones en orbitales moleculares 2. Estado sólido, líquido y gas 3. Fuertes (>50 kcal/mol) 4. Tantos como orbitales con electrones desapareados

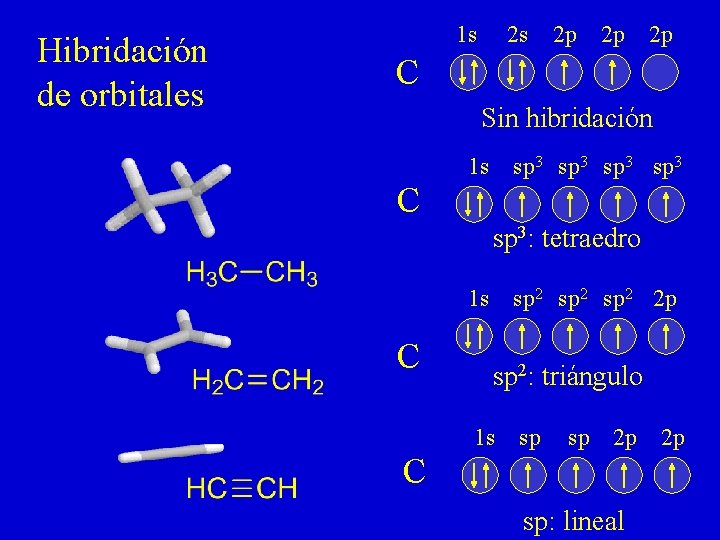
Hibridación de orbitales 1 s 2 s 2 p 2 p 2 p C Sin hibridación 1 s sp 3 C sp 3: tetraedro 1 s C sp 2 2 p sp 2: triángulo 1 s sp sp 2 p 2 p C sp: lineal

Energía de enlaces covalentes, kcal/mol H-H H-Cl 102 HO-H H 2 N-H H 3 C-H 103 119 107 102

Enlaces de coordinación Orbital molecular formado por: - Un orbital vacío - Un par electrónico Dador: átomos con pares electrónicos: N, O Aceptor: orbital vacío (átomos metálicos)

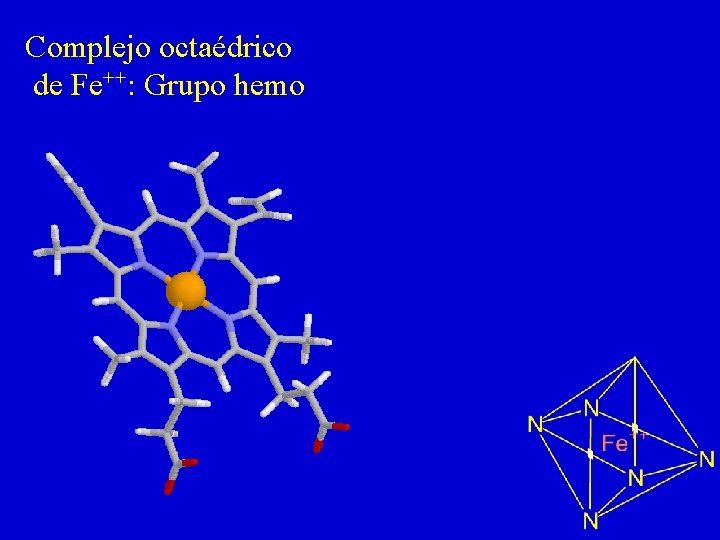
Complejo octaédrico de Fe++: Grupo hemo

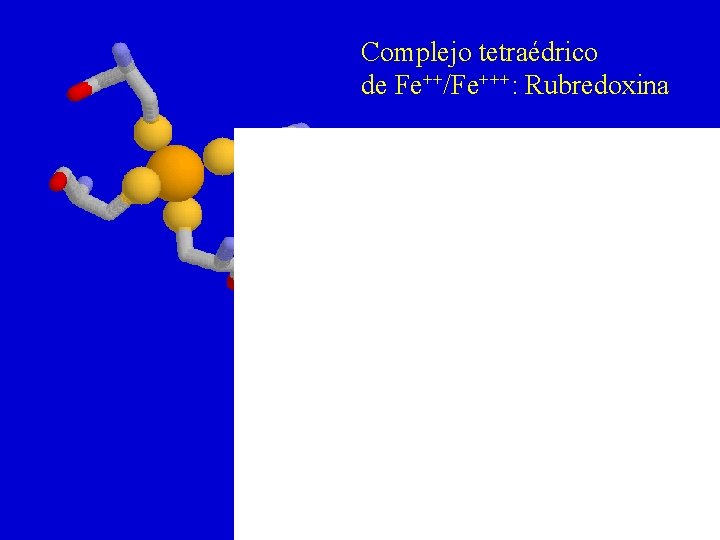
Complejo tetraédrico de Fe++/Fe+++: Rubredoxina

Interacciones débiles 1. Fuerzas de van der Waals 2. Enlaces de hidrógeno 3. Interacciones iónicas o salinas

Fuerzas de van der Waals n. RT = PV n. RT = (P + a/V 2)(V- b) (Gas perfecto) (Gas real) a: Atracción intermolecular b: Volumen de la molécula 1. Dipolos transitorios 2. Dipolos inducidos 3. Dipolos permanentes

Momento dipolar, m H 2 Cl 2 HF HCl H 2 O NH 3 CH 4 0 0 1. 91 1. 08 1. 85 1. 47 0

Fuerzas de van der Waals - Son interacciones muy débiles - En el medio biológico tienen importancia en ausencia de agua - Rotas por detergentes

Compuestos hidrofóbicos Benceno Colesterol Decano

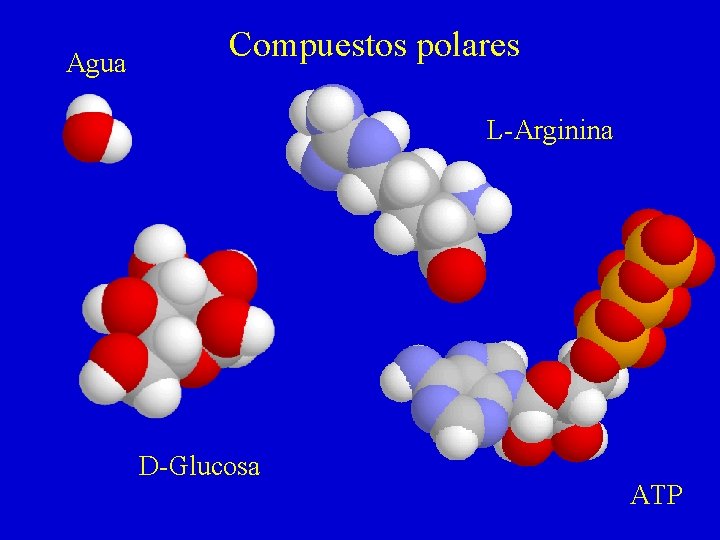
Agua Compuestos polares L-Arginina D-Glucosa ATP

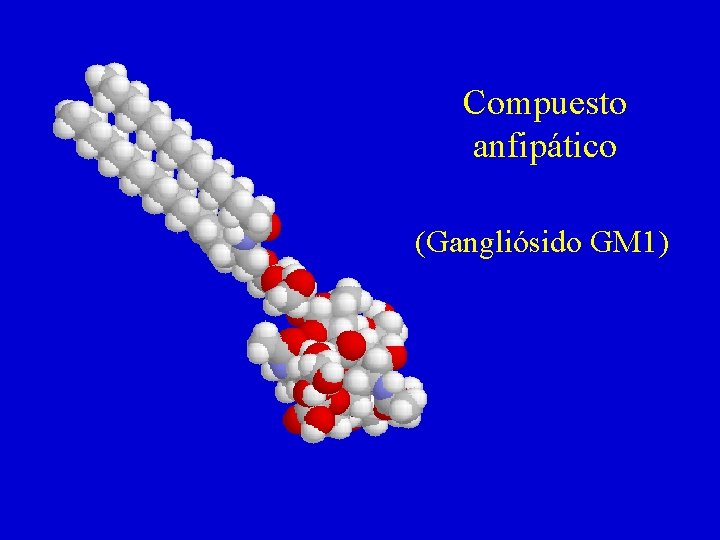
Compuesto anfipático (Gangliósido GM 1)

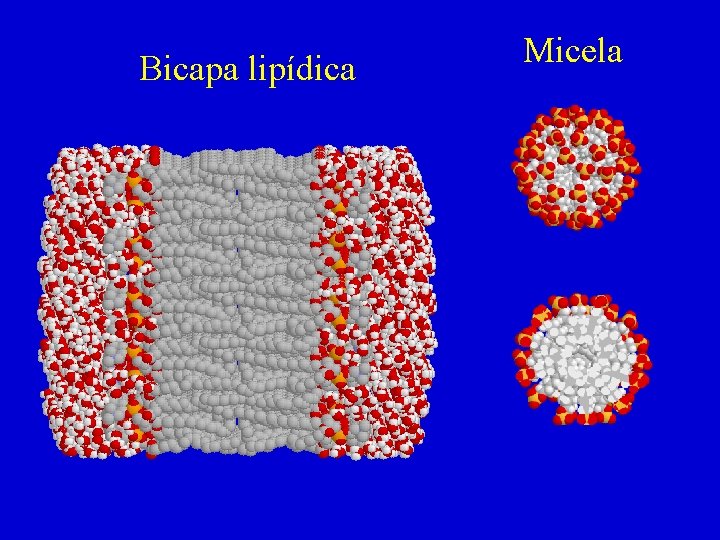
Bicapa lipídica Micela

Enlaces de hidrógeno - Compartición de un protón entre dos pares electrónicos - Dador: Grupo X-H con cierto momento dipolar - Aceptor: Grupo Y: con un par electrónico - Débil (mucho más fuerte que int. de van der Waals) - Rotas por urea 6 M, guanidina 8 M

Algunos enlaces de hidrógeno

DNA conformación B Estructura mantenida por enlaces de H

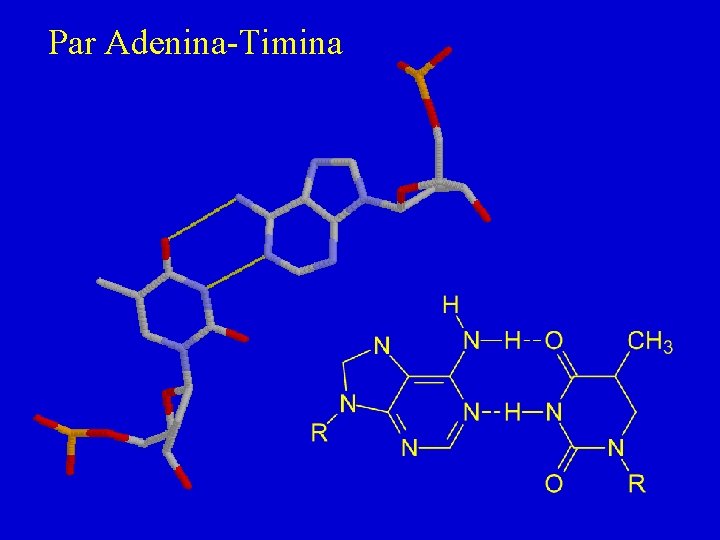
Par Adenina-Timina

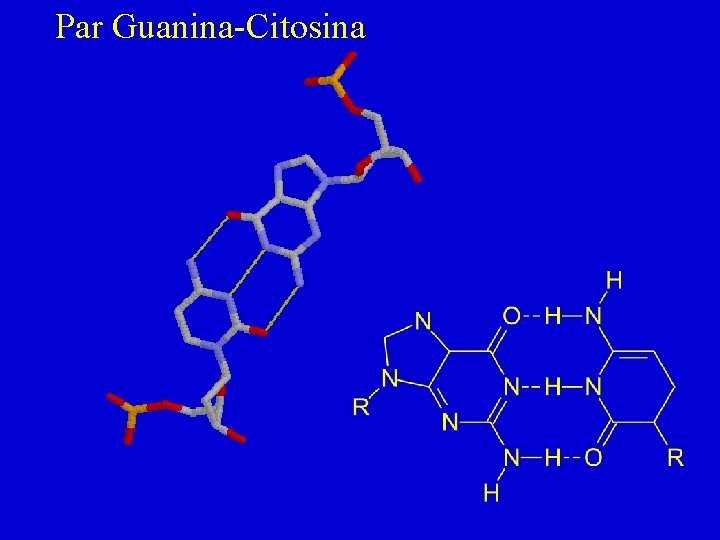
Par Guanina-Citosina

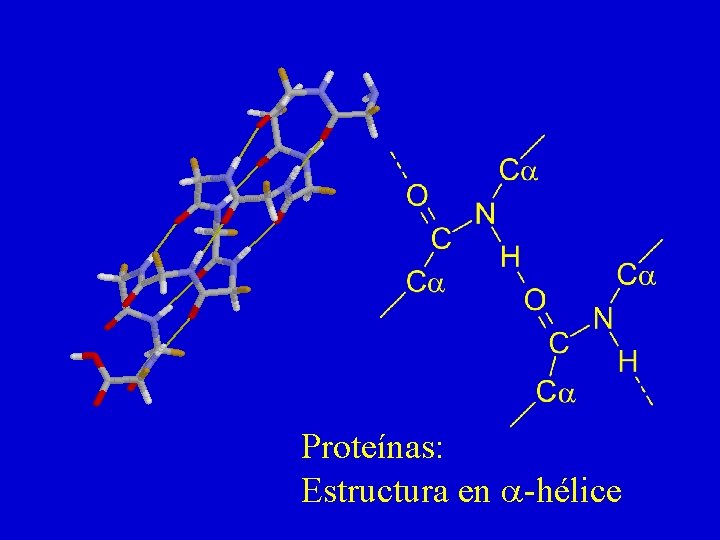
Proteínas: Estructura en a-hélice

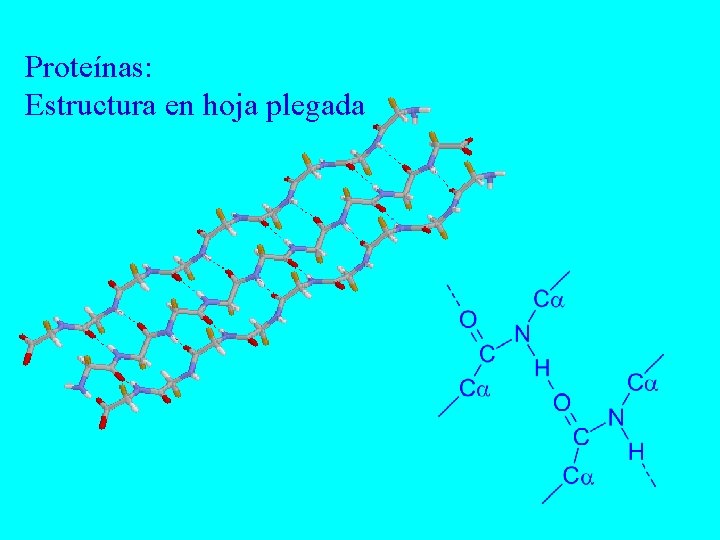
Proteínas: Estructura en hoja plegada

Interacciones iónicas o salinas (No confundir con enlace iónico) - Entre grupos de carga opuesta en solución - Débiles (más fuertes que int. de van der Waals) - Los iones participantes aparecen solvatados - Rotas por altas concentraciones salinas, extremos de p. H

Solvatación de iones en solución

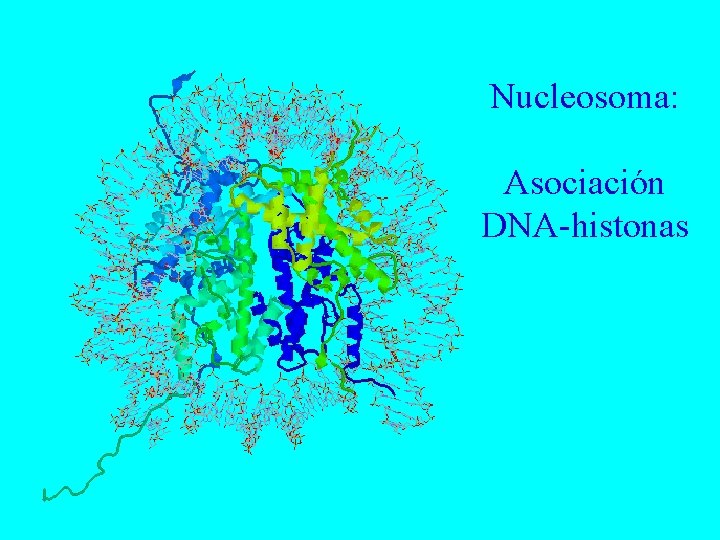
Nucleosoma: Asociación DNA-histonas
 Interacciones no covalentes
Interacciones no covalentes Oxígeno tipo de enlace
Oxígeno tipo de enlace Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Fqcolindres 2 eso
Fqcolindres 2 eso Holoproteínas globulares
Holoproteínas globulares Estructura de un polipeptido
Estructura de un polipeptido Ejemplo de enlace sigma
Ejemplo de enlace sigma Ejemplos de atomos aislados
Ejemplos de atomos aislados Enlace polar ejemplo
Enlace polar ejemplo Ejemplos de atomos aislados
Ejemplos de atomos aislados Esto significa
Esto significa O que é a regra do octeto
O que é a regra do octeto Enlace covalente
Enlace covalente Slidetodoc.com
Slidetodoc.com Tipos de interacciones medicamentosas
Tipos de interacciones medicamentosas Genes ortologos y paralogos
Genes ortologos y paralogos Grupos funcionales
Grupos funcionales Interacciones alelicas
Interacciones alelicas Como se calcula el momento dipolar
Como se calcula el momento dipolar Pentacloruro de fosforo hibridacion
Pentacloruro de fosforo hibridacion Interacciones mecanicas
Interacciones mecanicas A que se refiere la imagen
A que se refiere la imagen Quenodiol link
Quenodiol link Zymoliase
Zymoliase Enlace so
Enlace so Polisacáridos ejemplos
Polisacáridos ejemplos Enrutamiento por estado de enlace
Enrutamiento por estado de enlace