Propiedades de los compuestos qumicos Reconocer algunas caractersticas








- Slides: 10

Propiedades de los compuestos químicos Reconocer algunas características comunes de los compuestos químicos según la formación de enlaces. Fuente: Química 1° Medio 20018. – Archivos de departamento

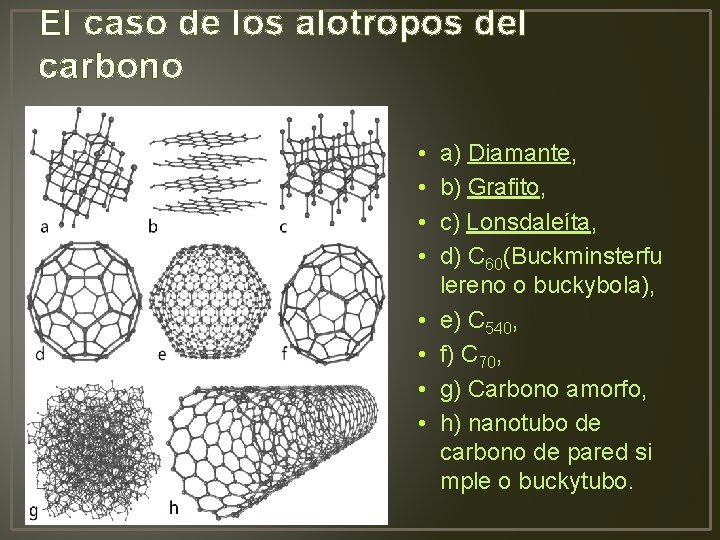
El caso de los alotropos del carbono • • a) Diamante, b) Grafito, c) Lonsdaleíta, d) C 60(Buckminsterfu lereno o buckybola), e) C 540, f) C 70, g) Carbono amorfo, h) nanotubo de carbono de pared si mple o buckytubo.

Propiedades de los compuestos químicos • Las propiedades de las sustancias están determinadas, en su mayor parte, por los enlaces químicos que mantienen unidos a sus átomos. • Compuestos iónicos • Muchos de los productos y materiales que se encuentran en nuestras casas y usamos diariamente son compuestos iónicos.


• Los iones son las unidades estructurales de los compuestos iónicos. Esto significa que los iones se ordenan siguiendo un patrón regular que resulta del equilibrio de fuerzas de atracción y repulsión entre ellos. Este patrón se llama estructura cristalina o red cristalina. • Las redes cristalinas pueden ordenarse según un sistema cristalino ¿Y no que era el átomo la unidad mínima?

Sistemas cristalinos

• Se encuentran en estado sólido a temperatura ambiente. • Tienen altos puntos de fusión y de ebullición. • Se disuelven en disolventes polares como el agua. • No conducen la electricidad en estado sólido, pero sí lo hacen cuando están en fundidos. • Son frágiles, es decir, se rompen con facilidad.

Propiedades de los compuestos covalentes • Pueden encontrarse en estado sólido, líquido y gaseoso. • Tienen puntos de fusión y de ebullición relativamente bajos (inferiores a 100 ˚C). • Son solubles en disolventes polares como el agua cuando presentan polaridad. • Algunos pueden formar redes y se conocen como compuestos covalentes reticulares (sacarosa o azúcar común). • Son malos conductores del calor y de la electricidad. • En su mayoría son blandos y no presentan resistencia mecánica.

Algunos ejemplos de sustancias covalentes comunes: • Agua (H 2 O) compuesto molecular más abundante del planeta. • Alcohol etílico o etanol (C 2 H 5 OH) usado como desinfectante y en las bebidas alcohólicas. • Cloruro de hidrogeno disuelto en agua forma el ácido clorhídrico, se usa en laboratorios y a veces como limpiador de metales.

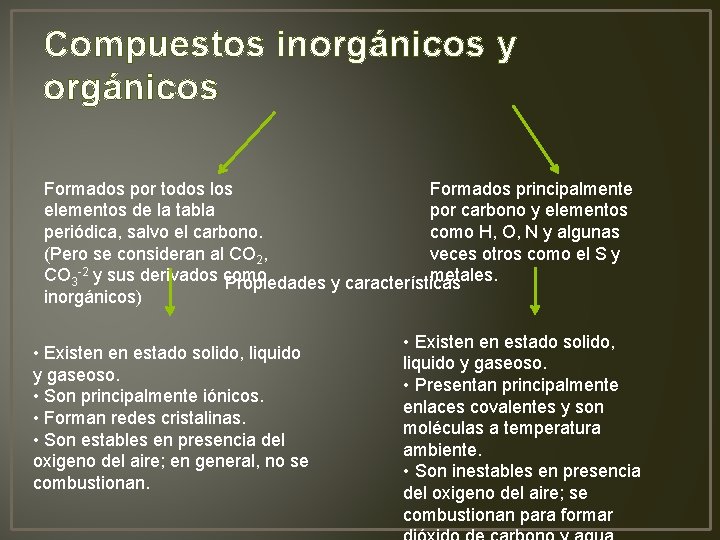
Compuestos inorgánicos y orgánicos Formados por todos los Formados principalmente elementos de la tabla por carbono y elementos periódica, salvo el carbono. como H, O, N y algunas (Pero se consideran al CO 2, veces otros como el S y CO 3 -2 y sus derivados como metales. Propiedades y características inorgánicos) • Existen en estado solido, liquido y gaseoso. • Son principalmente iónicos. • Forman redes cristalinas. • Son estables en presencia del oxigeno del aire; en general, no se combustionan. • Existen en estado solido, liquido y gaseoso. • Presentan principalmente enlaces covalentes y son moléculas a temperatura ambiente. • Son inestables en presencia del oxigeno del aire; se combustionan para formar