1 GEN TEDAVS Ylmaz iremi GEN TEDAVS 24






































- Slides: 62

1 GEN TEDAVİSİ Yılmaz Çiğremiş GEN TEDAVİSİ 24. 5. 2021

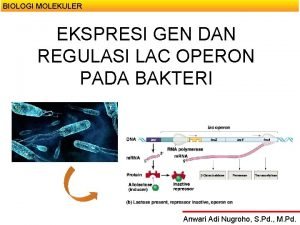
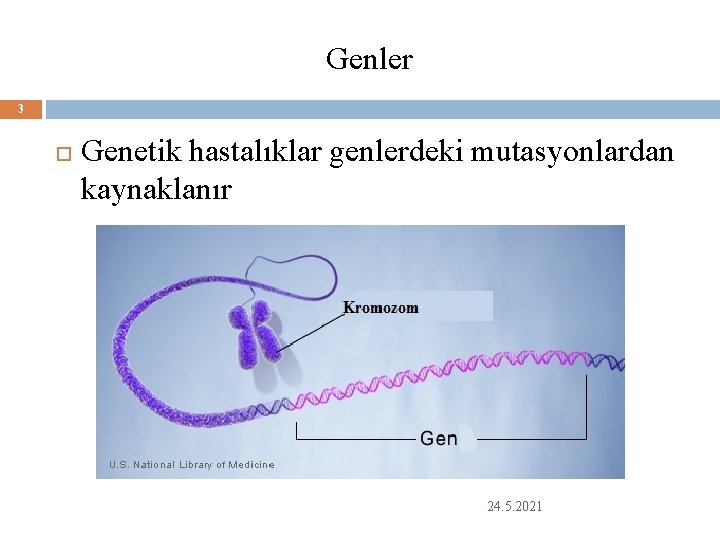
Genler 2 Bir kromozomda taşınan Kalıtımın temel birimi En basit tanımıyla bir proteini kodlayan DNA parçacığı Proteinler yaşamsal fonksiyonların çoğunu gerçekleştirir Genlerde bir problem olduğunda proteinde fonksiyonel bozulma yaşanır 24. 5. 2021

Genler 3 Genetik hastalıklar genlerdeki mutasyonlardan kaynaklanır 24. 5. 2021

Gen Tedavisi nedir? 4 Gen terapi; hastalıklarla mücadele veya önleme amaçlı olarak bir kişinin hücrelerine genetik materyalin aktarılması kapsayan deneysel bir tedavidir. Gelecekte bu teknikle bir hastalığın tedavisi hücrelere bir genin yerleştirilmesiyle mümkün olabilecektir. 24. 5. 2021

Hangi hastalıklar 5 Genetik hastalıklar Kanser Kalp- damar hastalıkları Nörolojik hastalıklar Enfeksiyon hastalıkları İmmun-yetmezlik hastalıkları 24. 5. 2021

6 Gen tedavisi, bir veya daha fazla mutant allel taşıyan somatik hücreye normal alleli yerleştirmektir. Bir vektör yada gen aktarım sistemi ile yapılır. 24. 5. 2021

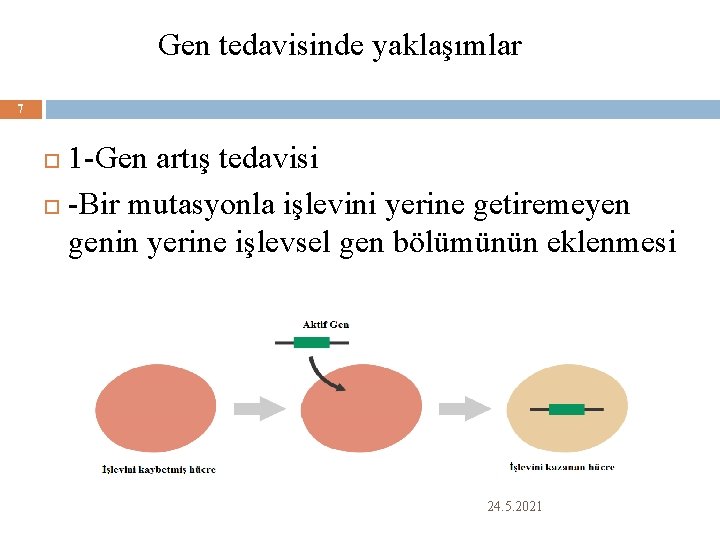
Gen tedavisinde yaklaşımlar 7 1 -Gen artış tedavisi -Bir mutasyonla işlevini yerine getiremeyen genin yerine işlevsel gen bölümünün eklenmesi 24. 5. 2021

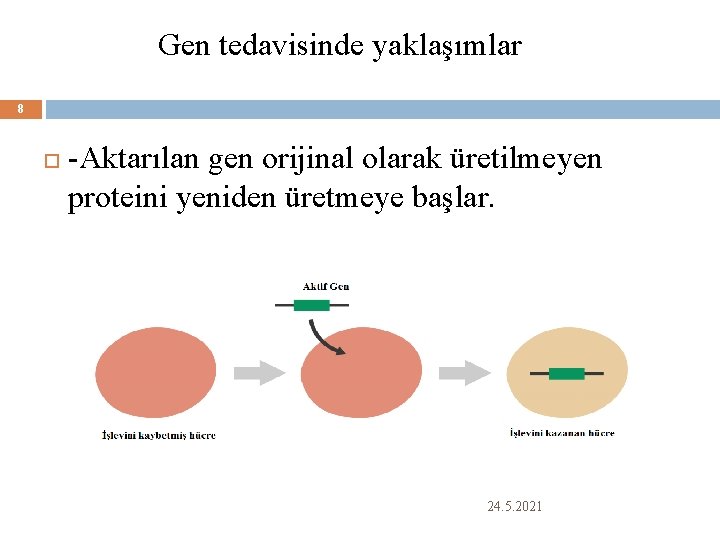
Gen tedavisinde yaklaşımlar 8 -Aktarılan gen orijinal olarak üretilmeyen proteini yeniden üretmeye başlar. 24. 5. 2021

9 24. 5. 2021

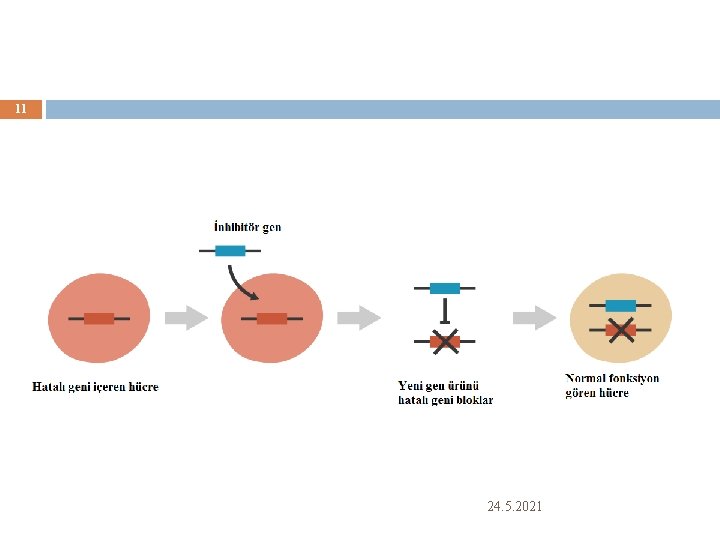
Gen tedavisinde yaklaşımlar 10 2 -Gen inhibisyon tedavisi -Enfeksiyon hastalıkları, kanser, kalıtımsal hastalıkların tedavisinde uygundur Genin ifadesi engellenir Hastalıklı hücrelerin büyümesini teşvik eden genin aktivitesinin durdurulması temeldir Onkogen aktivitesinin bloklanması 24. 5. 2021

11 24. 5. 2021

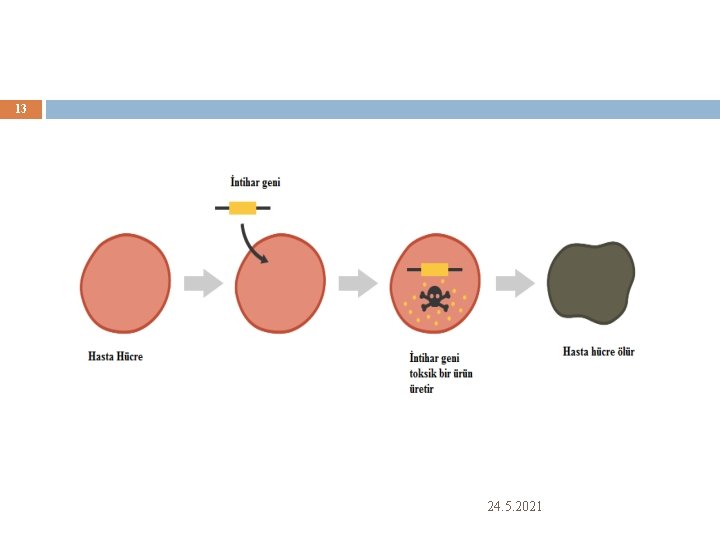
12 3 - Spesifik hücrelerin öldürülmesi Kanser tedavisinde uygundur Hasta hücreye DNA aktarılarak hücrenin iki yolla ölmesi sağlanır a-Yerleştirilen DNA hasta hücreyi öldürebilen oldukça toksik bir ürün üretebilen «intihar» geni içerir. 24. 5. 2021

13 24. 5. 2021

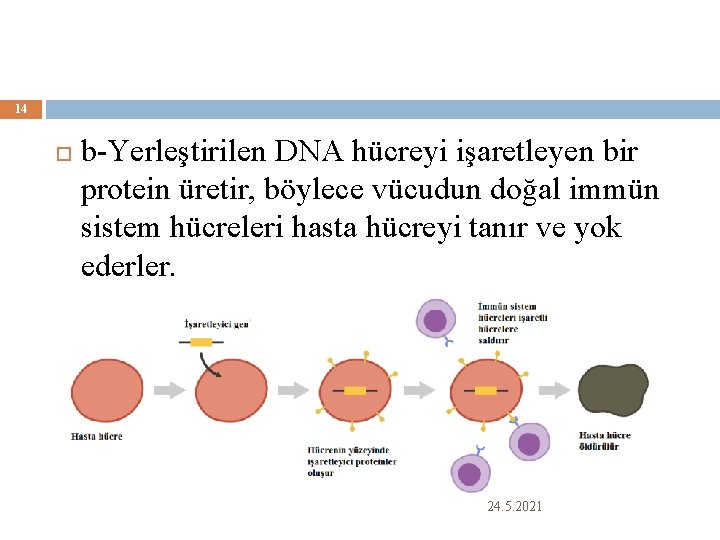
14 b-Yerleştirilen DNA hücreyi işaretleyen bir protein üretir, böylece vücudun doğal immün sistem hücreleri hasta hücreyi tanır ve yok ederler. 24. 5. 2021

15 Kanser hücrelerine yerleştirilen bu genler kanser hücrelerinin kemoterapi, radyasyon terapi veya hormon terapilerine karşı dirençlerini kırar veya daha hassas hale getirebilirler. 24. 5. 2021

16 Hücre tipine göre iki farklı gen tedavisi vardır -Somatik gen tedavisi: Yumurta ve sperm meydana getirmeyen herhangi bir vücut hücresine DNA’nın bir kısmının aktarılması -Germline (Üreme hücre) gen tedavisi: Yumurta ve sperm üreten hücrelere DNA’nın bir kısmının aktarılması 24. 5. 2021

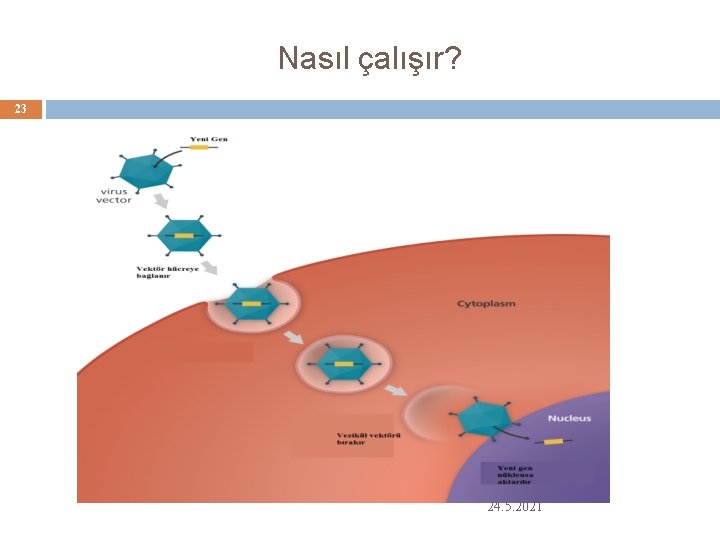
Nasıl yapılır? 17 Bir genin hücre içerisine doğrudan yerleştirilmesi kolay değildir Bir taşıyıcı kullanılır (vektör) Gen tedavisinde kullanılan en yaygın vektörler virüslerdir Hücreleri tanırlar ve genetik materyali o hücrelere aktarırlar Araştırmacılar virüslerden hastalık yapan genleri kaldırmakta, hastalığın durdurulmasını sağlayacak genleri virüslere aktarmaktadırlar 24. 5. 2021

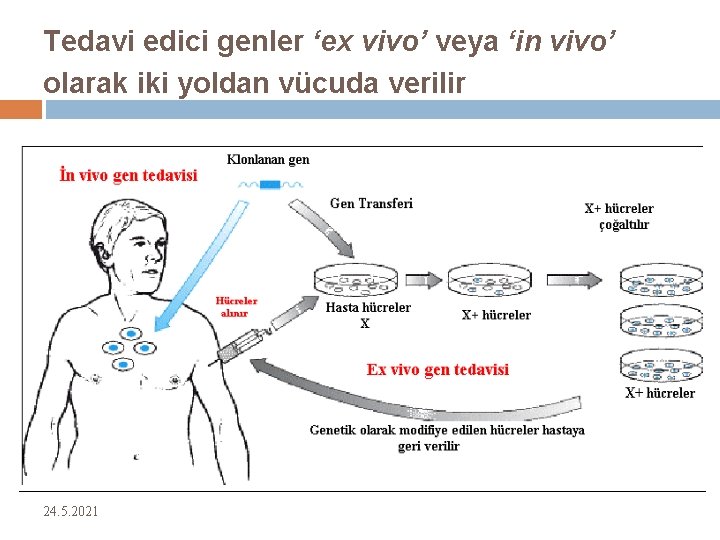
Tedavi edici genler ‘ex vivo’ veya ‘in vivo’ olarak iki yoldan vücuda verilir 24. 5. 2021 18

Ex vivo (vücut dışı) gen transferi 19 Kültürde büyümüş hücrelerin içine klonlanmış gen transferi Düzgün transforme hücreler seçilir, in vitro hücre kültüründe çoğaltılır sonra hastaya verilir Otolog hücreler kullanılır (immün rejeksiyonu engellemek için) Sadece vücuttan çıkarılabilen dokulara uygulanabilir (hematopoetik sistem hücreleri ve kök hücreleri) 24. 5. 2021

In vivo gen transferi 20 Klonlanmış genler hastanın dokularına direk transfer edilir Beyin hücreleri gibi in vitro ortamda kendi başına yeterli sayıda çoğalamayan hücreler için yapılabilir Lipozomlar ve viral vektörler Özellikle VPC (vektör üreten hücreler) kullanılır, bunlar recombinant virüsler tarafından in vitro enfekte edilmiş hücrelerdir 24. 5. 2021

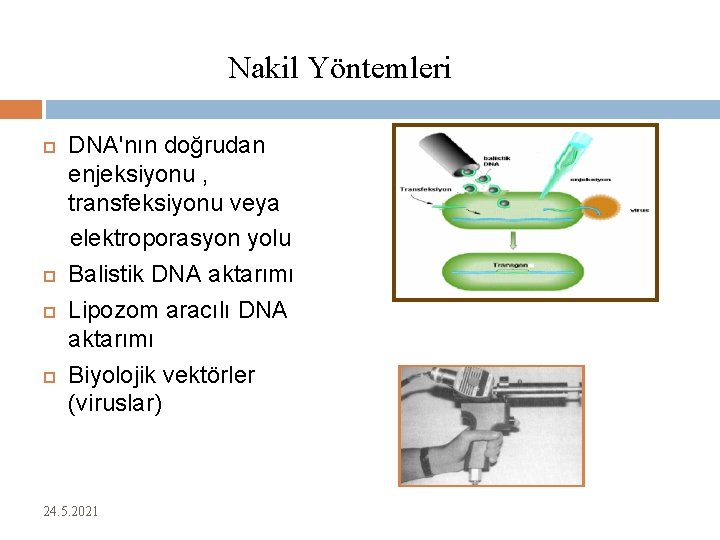
Nakil Yöntemleri DNA'nın doğrudan enjeksiyonu , transfeksiyonu veya elektroporasyon yolu Balistik DNA aktarımı Lipozom aracılı DNA aktarımı Biyolojik vektörler (viruslar) 24. 5. 2021 21

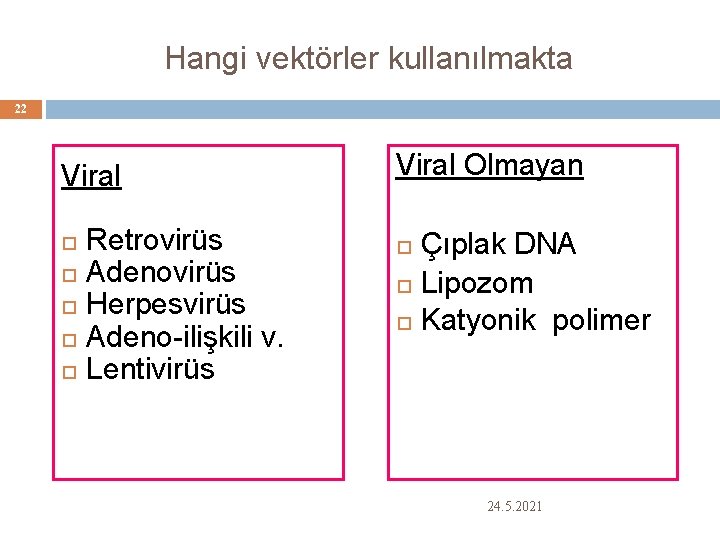
Hangi vektörler kullanılmakta 22 Viral Retrovirüs Adenovirüs Herpesvirüs Adeno-ilişkili v. Lentivirüs Viral Olmayan Çıplak DNA Lipozom Katyonik polimer 24. 5. 2021

Nasıl çalışır? 23 24. 5. 2021

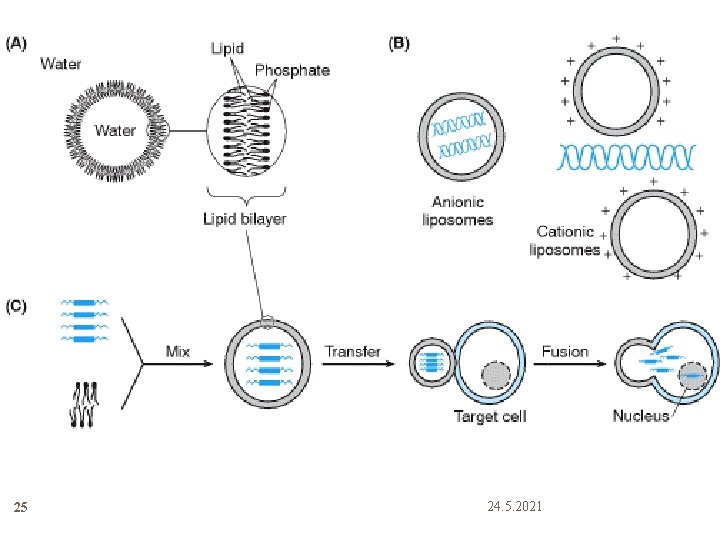
Lipozomlar 24 Sentetik bilayer membrana sahip küre vesiküller DNA in vitro olarak paketlenip lipozomlara sokulur, in vivo olarak hastaya verilir Lipid kaplaması DNA’nın in vivo yaşamasını, hücrelere bağlanmasını ve endositoz olmasını mümkün kılar Katyonik vesiküller (lipozomların + yükleri –DNA’yı stabilize eder) in vivo kullanılır Viral vektörlerden farklı olarak hazırlanmaları kolay Sınır kb yok Düşük verimlilik 24. 5. 2021

25 24. 5. 2021

Direk Enjeksiyon / Partikül Bombardımanı 26 DNA şırıngayla kas gibi bir dokuya enjekte edilir Gen tabancası(bombardıman) Farklı dokulara başarılı gen aktarımı Basit ve güvenli Gen transferi az verimli Enjekte edilen DNA’nın entegrasyonu az Prolifere hücrelerde sık bombardıman gerekli 24. 5. 2021

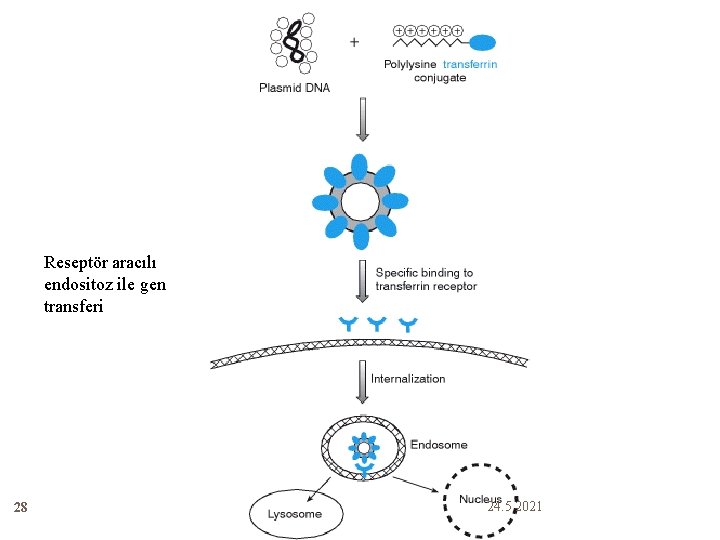
Reseptör Aracılı Endositoz 27 DNA spesifik hücre yüzey reseptörüne bağlanan hedef moleküle bağlanır - yüklü DNA + yüklü polylizine bağlanır Polylizin gibi bir polikatyon üzerinden bir transfer Yüksek verim DNA endozomlarda sıkışıp lizozomda degrade olabilir 24. 5. 2021

Reseptör aracılı endositoz ile gen transferi 28 24. 5. 2021

29 Viral olmayan vektörler; Kolay üretilirler, immunojen değildirler Hücreye ve nukleusa girişleri etkin değildir Dolaşımda , dokuda, hücre içinde kolayca sindirilebilirler Geçici ifade yaparlar 24. 5. 2021

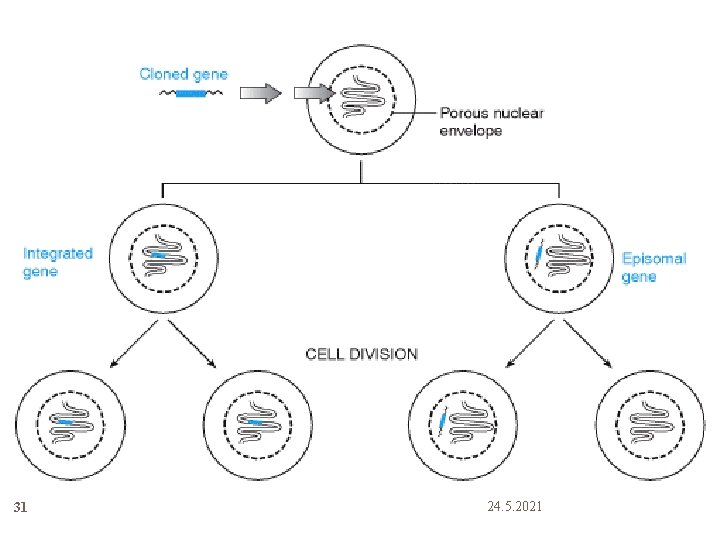
30 Gen transferinden sonra aktarılan genler ya kromozomlara entegre olur ya da ekstrakromozomal genetik elemanlar olarak kromozom dışında kalırlar (epizom) 24. 5. 2021

31 24. 5. 2021

Kromozomlara entegre genler 32 Bir geni kromozoma entegre etmenin en büyük avantajı geni ebedi kılmaktır Bu sayede gen terapi bazı kalıtsal hastalıkların tedavisinde kullanılabilir Örneğin aktif şekilde bölünen hücrelerden oluşan dokularda hedef için anahtar hücreler kök hücrelerdir Kök hücreleri hem olgun hücreler için baz oluşturur hem de bu süreçte kendilerini yeniler Bu yüzden diğer tüm dokuların köken aldığı ölümsüz hücrelerdir Kök hücrelere gen transferi genetik bozuklukların tedavisinde kullanılır 24. 5. 2021

33 Kromozomal integrasyonun dezavantajları -Normal bölgeye doğru insersiyon nadiren olur -Aktarılan genin yeri her bölgede aynı olmaz -Çoğu zaman aktarılan genler eksprese olmaz -Bazen integrasyon konak hücreyi öldürebilir -Aktarılan gen normal hücre bölünmesini bozabilir KANSER/APOPTOZ 24. 5. 2021

Ekspresyonun Durdurulması 34 DNA seviyesinde transkripsiyon durdurulabilir DNAnın çift zincirine komplementer oligonükleotidler ile transkripsiyonun durdurulması Post transkripsiyonel sürecin durdurulduğu RNA seviyesi: RNAya spesifik oligonükleotidler veya polinükleotidlerle RNA transkriptinin parçalanması Posttranslasyonel işlemin protein çıkışının durdurulduğu protein seviyesinde 24. 5. 2021

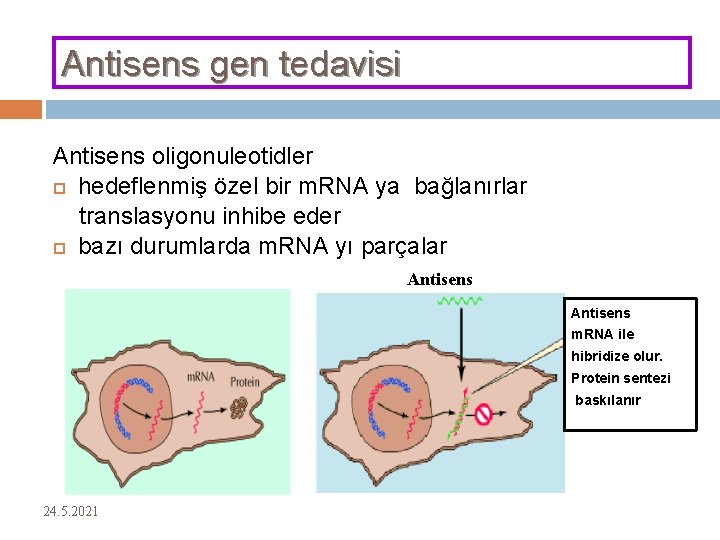
Spesifik m. RNA’ya bağlanan antisense oligonükleotidler yok edilmeyi sağlar 35 Antisense dizinin m. RNAya bağlanması translasyonu sekteye uğratır ve polipeptid sentezini inhibe eder. Sentetik oligonükleotidler ise m. RNAya komplementer olarak dizayn edilip hücreye transfer edildiğinde ilgili genin ekspresyonunu inhibe edebilir Antisense terapötikler viral genler veya kanser genleri ile mücadelede bu teknoloji kullanılır 24. 5. 2021

Antisens gen tedavisi Antisens oligonuleotidler hedeflenmiş özel bir m. RNA ya bağlanırlar translasyonu inhibe eder bazı durumlarda m. RNA yı parçalar Antisens m. RNA ile hibridize olur. Protein sentezi baskılanır 24. 5. 2021 36

Risk var mıdır? 37 İstenmeyen immün sistem reaksiyonları (inflamasyon, organ yetmezliği …) Yanlış hücre hedeflenmesi (virüsler birçok hücre tipine saldırabilmektedirler, ayrıca genetiği değiştirilmiş virus diğer hücreleri de etkileyebilir, sağlıklı hücrelerde hasar, kanser gelişebilir) Virus vücuda girence tekrar hastalık yapıcı etkisini kazanabilir Yeni genler DNA’da yanlış noktalara bağlanırsa Tümor oluşumuna neden olabilir 24. 5. 2021

Tedavide ortak adımlar 38 Hastalığa neden olan genin tayini Genin en uygun şekilde ekspresyonunu yapacak vektöre klonlanması Hasta genin düzgün işleyen kopyasının hedeflenen hücrelere nakledilmesi Düzgün genin sokulduğu hücre içinde ekspresyon (transgenik protein üretimi) seviyesinin kontrolü 24. 5. 2021

39 1980 -Martin Cline, rekombinant DNA’yı kapsayan onaylanmamış ilk gen terapiyi yaptı. Beta talassemili iki hastadan alınan kemik iliği hücreleri saflaştırıldı ve insan beta globin geni ile transforme edildi. 24. 5. 2021

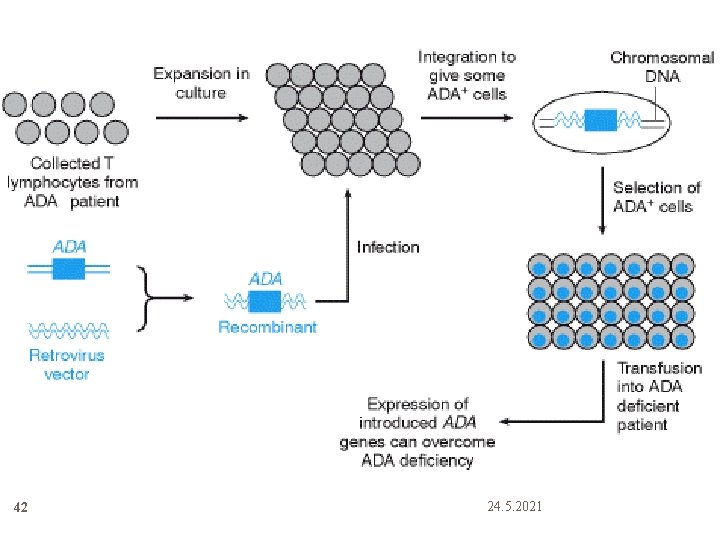
İlk onaylanmış somatik gen tedavisi 40 1990 -Michael Blaese ve ark. İlk onaylı gen tedavisini yaptılar. Ağır kombine immün yetmezliği olan iki çocuğun T hücrelerinin içine Adenozin deaminaz (ADA) genini retroviral vektörle aktardılar. Bu enzimin kalıtsal bozukluğu T lenfositlere zarar verir ve immün yetersizlik ortaya çıkar Ashanti De. Silva. Enzim replasman tedavisi de alıyordu. 24. 5. 2021

ADA GEN TERAPİ 41 Normal bir ADA geninin retroviral vektöre klonlanması ADA rekombinantını hastadan alınıp kültüre edilmiş ADA T- lenfositlere transfeksiyonu ADA T+ hücreleri seçip sayılarını arttırmak Hastaya bu hücreleri tekrar vermek 24. 5. 2021

42 24. 5. 2021

Ashanti De. Silva 1990 - 4 yaşında – tedavi başlangıcı 43 2003 24. 5. 2021

44 1992 - Claudio Bordignın ve ark. Genetik olarak modifiye edilmiş kök hücreleri kapsayan ilk insan gen tedavisine başladılar. 1999 -Jesse Gelsinger olayı. Gen tedavisinde ilk ölüm. 24. 5. 2021

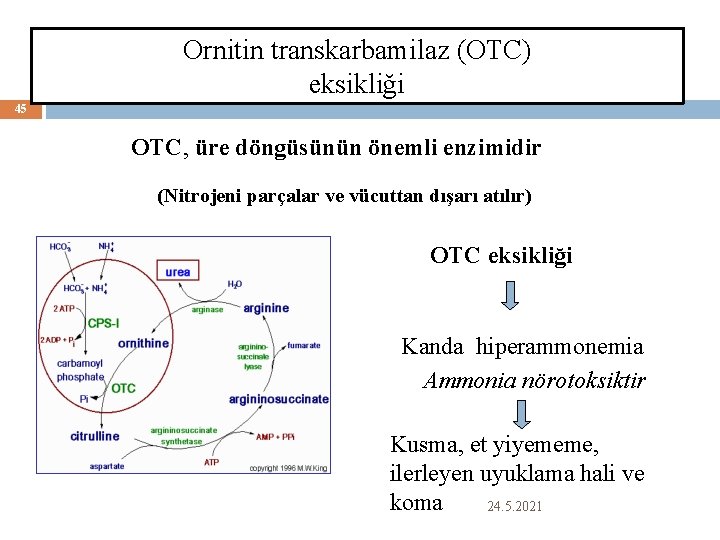
Ornitin transkarbamilaz (OTC) eksikliği 45 OTC, üre döngüsünün önemli enzimidir (Nitrojeni parçalar ve vücuttan dışarı atılır) OTC eksikliği Kanda hiperammonemia Ammonia nörotoksiktir Kusma, et yiyememe, ilerleyen uyuklama hali ve koma 24. 5. 2021

46 Jesse Gelsinger 19 yaşında ornitin transkarbamilaz eksikliğine sahip hasta OT geni aktarılmış adenovirus vektör ile hepatik artere tek injeksiyon yapıldı. Akciğer ve çoklu organ yetmezliği 24. 5. 2021

Ciddi şüpheler 47 Adenoviral vektörlerin, hastalığı tedavi etmektenden ziyade hücreleri öldürmek için (kanserde) kullanımı daha uygundur. Doz arttırma çalışmaları daha iyi kontrol edilmelidir. Tamamen viral genlerden arınmış vektörler kullanılmalıdır. 24. 5. 2021

Klinik uygulamada gerekenler 48 Hastalık ve sebep olduğu semptomların detaylı bilgisi olmalı Hastalık için bir hayvan modeli olmalı İn vitro büyüyebilen insan hücrelerinde başarı elde edilmeli Deneysel uygulamalar emniyetli olmalı Hastalık için alternatif tedavi yoksa veya bir gurup hastada klasik tedavi etkili olmuyor ise 24. 5. 2021

İlk tamamlanan tedavi 49 2000 -Alain Fisher-SCID X e bağlı tipini taşıyan çocuklara normal geni taşıyan retroviral vektörle kemik iliği hücreleri muamele edilmişlösemi gelişmiş ve 10 çocuktan 2 ölüm. 2003 tedaviler geçici olarak durduruluyor. 24. 5. 2021

50 2003 -Shenzen Si. Biono Gen Tech-Adenovirus vektor p 53 tumor supressör gen içeren. Baş ve boyun kanserleri, P 53 eksik hücreler hedef 2003 -Carl June-il lentiviral vektör denemesi. 2008 -İntrogen terapotik-Advexin-p 53 tumor supressor gen içeren adeno virus vektor, baş ve boyun kanserleri 2008 - Ark terapotik-malignant glioma 24. 5. 2021

51 2009 -Jean Bennet-Leber amorozu-körlük gelişiyor-AAV vektör ile retinal pigment epitelyum spesifik 65 k. Da protein ifade eden gen aktarımı. Retinaya enjeksiyon. 2010 -Philip Leboulch-Ağır betatalessemi hastalarına Lentiviral vektörle kemik iliği hücrelerine beta globin geni aktarımı 24. 5. 2021

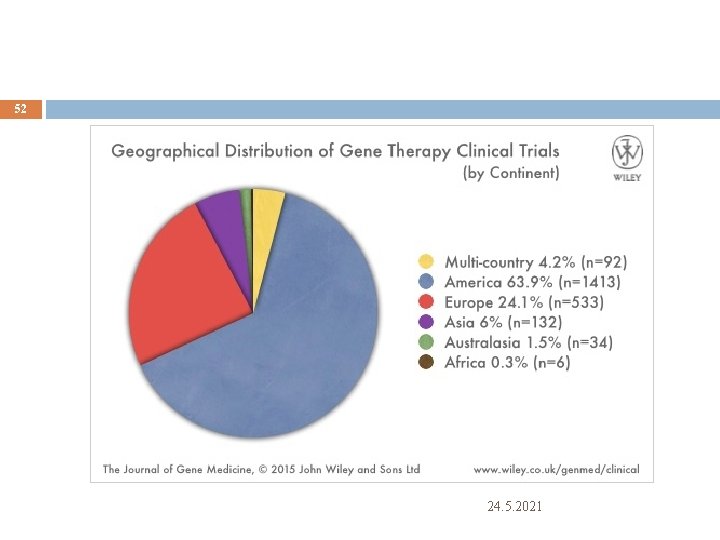
52 24. 5. 2021

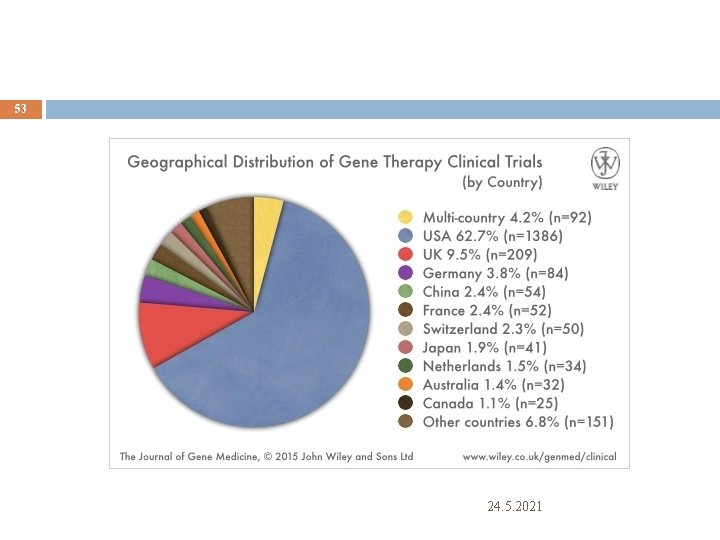
53 24. 5. 2021

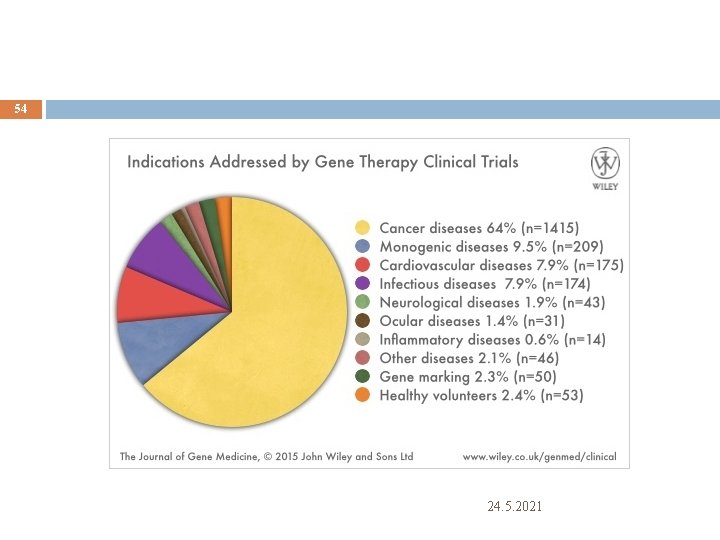
54 24. 5. 2021

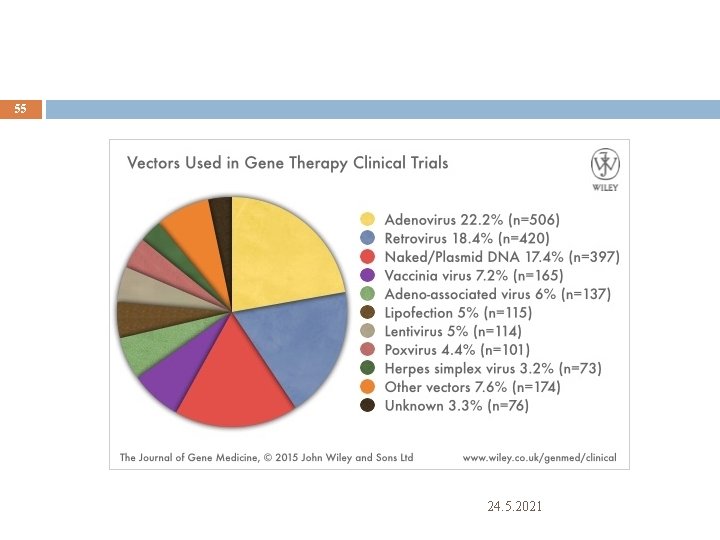
55 24. 5. 2021

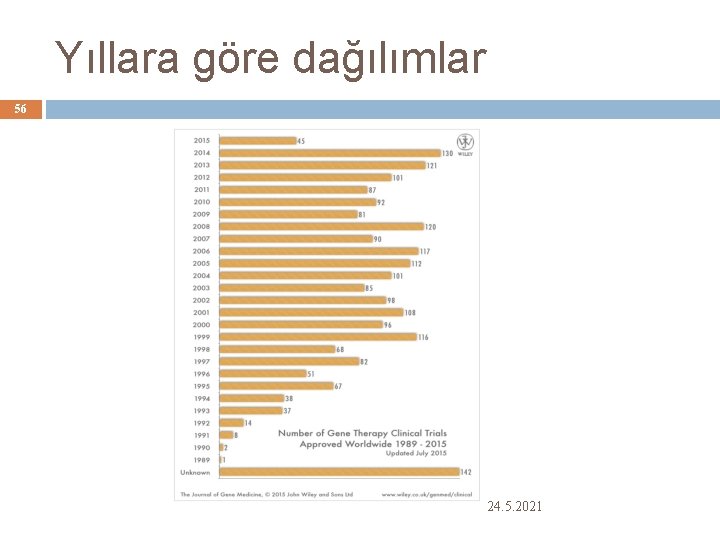
Yıllara göre dağılımlar 56 24. 5. 2021

57 2003 yılında baş boyun kanseri için geliştirilen P 53 proteini eksprese eden rekombinant adenovirüs gen tedavisi ilacı (r. Ad-P 53) Çinde onay almıştır. 24. 5. 2021

58 Glybera- Avrupada 2012’de onay almış, lipoprotein lipaz eksikliği tedavisinde kullanılmakta. Adeno-associated virus serotype 1 (AAV 1) viral vektor. Kas içi uygulama. Nukleusa yerleşir kromozoma entegre olmaz. 24. 5. 2021

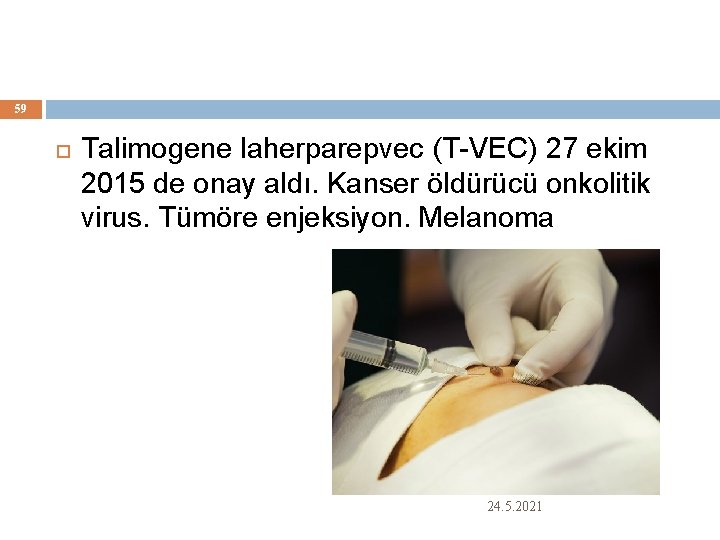
59 Talimogene laherparepvec (T-VEC) 27 ekim 2015 de onay aldı. Kanser öldürücü onkolitik virus. Tümöre enjeksiyon. Melanoma 24. 5. 2021

Gen Tedavisinin Geleceği 60 Problemler vektörlerle ilgilidir MLV ve adenovirüslerin birçok sakıncası bulunmaktadır. Jesse gelsingerde olduğu gibi immün yanıta neden olabilirler Konak kromozoma viral genomun katılması genin mutasyonuna veya inaktivasyonuna neden olabilir 24. 5. 2021

Neler yapılıyor 61 İlk kuşak gen tedavilerinin sonucunun ümit kırıcı ve ölümcül olması güven sorunu doğurdu Yeni viral vektörler ve hücre hedefleme stratejileri geliştirilmektedir. 24. 5. 2021

Gen Tedavisinde Etik Kaygılar 62 Günümüzde gen tedavileri somatik hücreleri hedef alacak şekilde sınırlandırılmıştır “Somatik gen tedavisi” Sadece birey etkilenir ve hastanın izni ve bilgisi dahilinde yapılır Onaylanmayan tedavi yaklaşımı “eşey hat (germ line) tedavisi 24. 5. 2021
 Santrifüjleme
Santrifüjleme Acordul in numar si gen clasa 2
Acordul in numar si gen clasa 2 Testicularis feminisatio
Testicularis feminisatio Aice general paper essay format
Aice general paper essay format Gen array
Gen array Next gen pos
Next gen pos Genesis 21 1
Genesis 21 1 Gen rececibo
Gen rececibo Pada tikus warna bulu hitam dikendalikan oleh gen r
Pada tikus warna bulu hitam dikendalikan oleh gen r Libsys gen
Libsys gen Jewish gen
Jewish gen Nys next generation math standards
Nys next generation math standards Next gen swg
Next gen swg Alelos
Alelos First generation antipsychotics vs second
First generation antipsychotics vs second Generation iv international forum
Generation iv international forum Beşgen özellikleri
Beşgen özellikleri Triptofan operonu
Triptofan operonu Gen 3 nu
Gen 3 nu Clin gen
Clin gen Gen cftr
Gen cftr Glsl outline shader
Glsl outline shader Regulasi ekspresi gen
Regulasi ekspresi gen Flippant
Flippant Next generation nclex
Next generation nclex Gen
Gen Psödootozomal bölge ne demek
Psödootozomal bölge ne demek Episoma
Episoma Gen z spoiled
Gen z spoiled Gluca gen
Gluca gen I gen
I gen Anlamlı zincir kalıp zincir
Anlamlı zincir kalıp zincir Gen 3:7
Gen 3:7 Jan henryk dąbrowski w panu tadeuszu
Jan henryk dąbrowski w panu tadeuszu Gen z
Gen z In-out+gen=acc
In-out+gen=acc Words with the root matri
Words with the root matri San gen shugi
San gen shugi Pokemon weakness chart gen 1
Pokemon weakness chart gen 1 Dna gen kromosom
Dna gen kromosom Kısa parmaklılık geni
Kısa parmaklılık geni Gen-4
Gen-4 Gen tel
Gen tel Next gen consulting
Next gen consulting Efek kokain
Efek kokain Genetica humana
Genetica humana 4th gen cephalosporins
4th gen cephalosporins Jmu gen ed
Jmu gen ed Intocmire devize intelsoft
Intocmire devize intelsoft Norming asset management
Norming asset management Elc 310
Elc 310 Iata new gen iss
Iata new gen iss Gen-tech services
Gen-tech services Tautan autosomal adalah
Tautan autosomal adalah Gen proxim si diferenta specifica
Gen proxim si diferenta specifica генотип и фенотип
генотип и фенотип Gen y food
Gen y food Next md patient portal
Next md patient portal Aice general paper
Aice general paper Newgenlib
Newgenlib Gen chem review for ochem
Gen chem review for ochem Mandatory kpps
Mandatory kpps Gen chem cheat sheet
Gen chem cheat sheet