Ykseltgenmendirgenme Redoks Reaksiyonlar Reaksiyonda iki tr arasnda elektron




















- Slides: 23

Yükseltgenme/İndirgenme (Redoks) Reaksiyonları Reaksiyonda iki tür arasında elektron alış verişi oluyorsa bu tür reaksiyonlara indirgenme yükseltgenme reaksiyonları denir. Elektron alan tür indirgenir elektron veren tür yükseltgenir. Elektron alış verişini göstermek için reaksiyon yarı tepkimelere ayrılır. Fe 3+ + e- → Fe 2+ + Cu+ → Fe 2+ + Cu 2+ Cu+ → Cu 2+ + e- İndirgen elektron vericisidir. (kendi yükseltgenirken diğer türün yükseltgenmesine neden olur. Yükseltgen elektron alıcısıdır. (kendi indirgenirken diğer türün yükseltgenmesini sağlar)

Redoks reaksiyonlarını denkleştirme 1 - reaksiyon 2 yarı reaksiyona bölünür 2 - her bir yarı reaksiyon ayrı denkleştirilir önce indirgenen ve yükseltgenen atom lar denkleştirilir. Yükseltgenmeveya indirgenmeyi göstermek için elektron eklenir Yükleri denkleştirmek için asidik ortamda H+ eklenip diğer taraftan su eklenir bazik ortamda OH- eklenip diğer tarafa su eklenir kütle ve yük lerin denk olup olmadığı kontrol edilir. 3 - yarı reaksiyonlar birleştirilir. Alınan verilen elektron sayısı eşit olacak şekilde toplanır. Soru: Fe 2+ + Mn. O 4 - → Fe 3+ + Mn 2+ asidik ortamda denkleştiriniz Soru: Cl 2 + Cr(OH)3 → Cl- + Cr. O 42 - bazik ortamda denkleştiriniz Soru: C 2 H 5 OH + Ce 4+ → CO 2 + Ce 3+ asidik ortamda denkleştiriniz

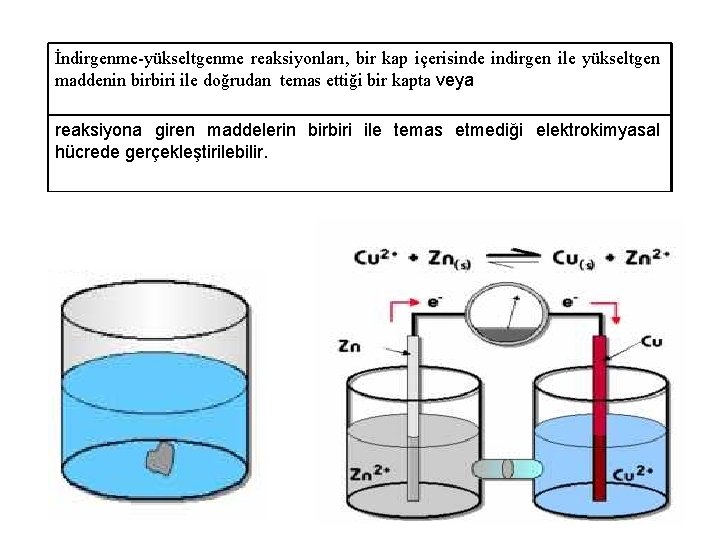
İndirgenme-yükseltgenme reaksiyonları, bir kap içerisinde indirgen ile yükseltgen maddenin birbiri ile doğrudan temas ettiği bir kapta veya reaksiyona giren maddelerin birbiri ile temas etmediği elektrokimyasal hücrede gerçekleştirilebilir.


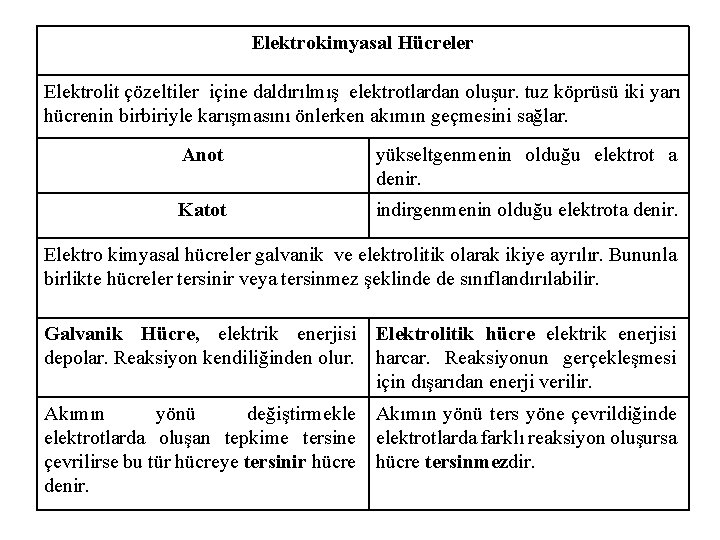
Elektrokimyasal Hücreler Elektrolit çözeltiler içine daldırılmış elektrotlardan oluşur. tuz köprüsü iki yarı hücrenin birbiriyle karışmasını önlerken akımın geçmesini sağlar. Anot yükseltgenmenin olduğu elektrot a denir. Katot indirgenmenin olduğu elektrota denir. Elektro kimyasal hücreler galvanik ve elektrolitik olarak ikiye ayrılır. Bununla birlikte hücreler tersinir veya tersinmez şeklinde de sınıflandırılabilir. Galvanik Hücre, elektrik enerjisi Elektrolitik hücre elektrik enerjisi depolar. Reaksiyon kendiliğinden olur. harcar. Reaksiyonun gerçekleşmesi için dışarıdan enerji verilir. Akımın yönü değiştirmekle Akımın yönü ters yöne çevrildiğinde elektrotlarda oluşan tepkime tersine elektrotlarda farklı reaksiyon oluşursa çevrilirse bu tür hücreye tersinir hücre tersinmezdir. denir.

Hücrenin şematik gösterimi I bir elektrot ve çözeltisi arasındaki faz sınırı ara yüzey olarak adlandırılır. II tuz köprüsünü ifade eder Önce yükseltgenmenin olduğu (anot) yarı hücre (elektrot ve çözeltisi) daha sonra indirgenmenin olduğu (katot) yarı hücre ( çözeltisi ve elektrot) yazılır, Cd(k) I Cd. Cl 2(aq)( M) II Ag. NO 3(aq) ( M) I Ag(k) Ag I Ag+ (0. 0200 M) II Cu 2+ (0. 0200 M) I Cu

Elektrot Potansiyelleri Bir hücrede katot ile anot arasında potansiyel farkı oluşur, reaksiyon ilerledikçe potasiyel farkı azalır, ve dengede sıfır olur. Voltmetrede hücre potansiyeli okunur. Yarı hücre potansiyeli okunamaz. Yarı hücre gerilimlerinin eldesinde elektrot gerilimi bilinen referans elektrotlar kullanılır. Elektrot potansiyelleri, referans elektrot olarak standart hidrojen elektrot kullanılan bir hücrenin potansiyeli olarak tanımlanır. Standart Hidrojen referans elektrodu SHE 2 H+ + 2 e- ↔ H 2(suda) ↔ H 2(g) 2 H+ + 2 e- ↔ H 2(g) Pt, H 2(p=1. 00 atm) I [H+]=. . M) II Hidrojen elektrot diğer yarı hücreye göre anot veya katot olarak davranabilir. Standart hidrojen elektrotun potansiyeli bütün sıcaklılarda sıfır kabul edilir.

Standart elektrot potansiyeli, E 0, reaksiyonda yer alan bütün türlerin aktiviteleri 1 birim olduğu zamanki elektrot potansiyelidir. Standart Elektrot potansiyeli potansiyelleri indirgenme yönünde yazılır. Hidrojen için standart elektrot potansiyeli sıfır kabul edilerek diğer reaksiyonlar için bağıl olarak hesaplanır. Sıcaklığa bağlıdır. Yarı reaksiyonda yer alan bileşenlerin mol sayısından bağımsızdır.

Nerst Denklemi AA + b. B + n e- ↔ c. C + d. D RT [C]c [D]d E = E 0 - ------- ln -------n. F [A]a [B]b E 0 = standart elektrot potansiyeli her yarı reaksiyonun kendine özgü sabiti T = sıcaklık Kelvin n = alınan verilen elektronların mol sayısı F = faraday sabiti 96485 C E = E 0 - 0. 0592 [C]c [D]d ------ log -------n [A]a [B]b

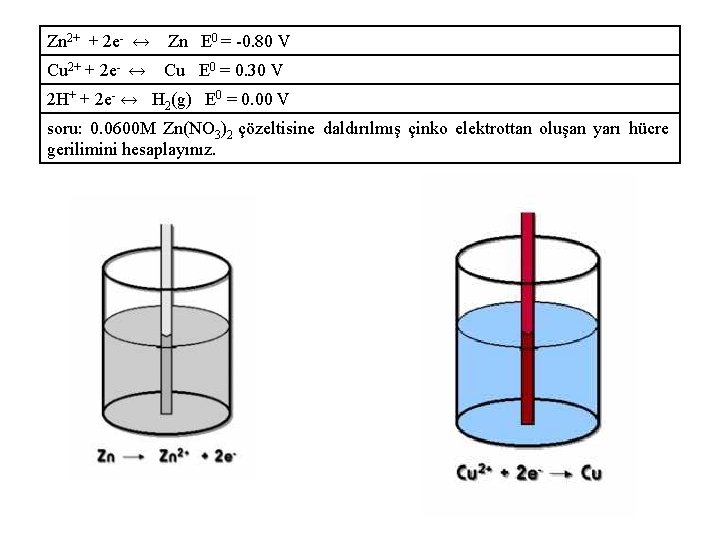
Zn 2+ + 2 e- ↔ Zn E 0 = -0. 80 V Cu 2+ + 2 e- ↔ Cu E 0 = 0. 30 V 2 H+ + 2 e- ↔ H 2(g) E 0 = 0. 00 V soru: 0. 0600 M Zn(NO 3)2 çözeltisine daldırılmış çinko elektrottan oluşan yarı hücre gerilimini hesaplayınız.

Elektro Kimyasal Hücrelerin Potansiyeli Bir hücrenin termodinamik potansiyeli katodun elektrot potansiyeli anodun elektrot potansiyelinden çıkarılarak bulunur. Ehücre = E katot – E anot Soru: Zn(k) I Zn. Cl 2 (suda, 0. 10 M) II Cu. SO 4(suda, 0. 10 M) I Cu hücresinin potansiyelini hesaplayınız.

Denge sabit, çözünürlük çarpımı ve kopmleks oluşum sabiti Hesapları Elektrot potansiyelleri kullanarak yükseltgenme indirgenme sistemi için denge sabiti hesaplanabilir. Denge anında Ehücre sıfıra eşit olacaktır, buradan Ekarot ve Eanot birine eşit olur ve anot ve katot reaksiyonları için Nerst eşitliği kullanarak denge sabiti hesaplanabilir. Soru: 2 Fe 2+ + 3 I- ↔ 2 Fe 3+ + I 3 - reaksiyonunun denge sabitini hesaplayınız. Fe 3+ +e- ↔ Fe 2+ E 0= 0. 771 I 3 - +2 e- ↔ 3 IE 0=0. 536 Soru: Az çözünen bir Cu. X 2 çözeltisi 0. 01 M Na. X tuzu ile doyurulmuş Cu elektrottan oluşan anot ve SHE elektrottan oluşan bir hücrenin gerilimi 0. 0103 V olarak ölçülmüştür. Cu. X 2 nin Kçç sini hesaplayınız.

Redoks Titrasyon eğrileri Eşdeğerlik noktası öncesi ve sonrası İndirgenme yükseltgenme reaksiyonları genelde hızlı ve tersinirdir bu yüzden her titrant ilavesinden sonra denge kurulur dolayısıyla Eanot =E katot olur ve nerst eşitliği ortamda herhangi biri için uygulanarak potansiyel hesaplanır. Eşdeğerlik noktasında da ortamda bulunan türlerde, bir türün indigemiş halinin konsantrasyonu diğer türün yükseltgenmiş haldeki konsantrasyonuna eşdeğer olacağı varsayılarak Eeşdeğer hesaplanır.

soru Sn 2+ + 2 Ce 4+ ↔Sn 4+ + 2 Ce 3+ Reaksiyonu için eşdeğerlik potansiyelini hesaplayınız. soru H 2 SO 4 konsantrasyonunu 1. 0 M olan ortamda 50. 0 ml 0. 0500 M Fe 2+ nın 0. 100 M Ce 4+ ile titrasyonunda 5 ml, 25 ml ve 25. 10 ml seryum ilavelerinde potansiyeli hesaplayınız ve titrasyon eğrisini çiziniz E 0 Ce 4+ = 1. 44, E 0 Fe 3+=0. 68.

İndirgenme yükseltgenme İndikatörleri Genel Redoks indikatörleri İndirgenmiş ve yükseltgenmiş hallerinin renkleri farklı olan maddelerdirrenk değişimleri sistemin elektrot potansiyelindeki değişimlere bağlıdır. Spesifik indikatörler titrasyonda yer alan türlerden biri ile reaksiyon vererek renk değiştirirler. Örneğin nişaşta elementel iyot ile koyu renkli kompleks oluşturur.

POTANSi. YOMETRİK YÖNTEMLER bir çözeltiye daldırılan iki elektrot arasındaki gerilim farkının ölçülmesi ilkesine dayanır. Elektrotlar ve elektrotlann daldırıldığı çözelti bir elektrokimyasal hücre oluşturur. Elektrotlar arasındaki gerilim farkı bir p. H/m. V metre kullanılarak ölçülür. Elektrotlardan biri karşılaştırma elektrodu olup bu elektrodun yarı hücre gerilimi sabittir. çalışma elektrodu olarak tanımlanan ikinci elektrodun yarı hücre gerilimi ise çözeltideki türlerin aktiflikleriyle değişir. Yarı hücre gerilimleri, gerilimi sıfır olan standart hidrojen elektroduna (SHE) güre ölçülür ve tablolarda da bu değerler belirtilir. Bir elektrokimyasal hücrenin gerilimi, Ehücre= Eçalışma - Ekarşılaştırma + Esıvı-bağ. Veya E = Ekatot – Eanot + Es esitliği ile verilir. Ehücre = elektrokimyasal hücrenin gerilimi E karşılaştırma =referanselektrodunyarı hücregerilimi. Referanselektrod potansiyeli, daldırıldığı çözeltiden etkilenmez. Potansiyeli, sıcaklık değişmediği sürece sabit kalır Esıvı-bağ. =sıvı bağlantı gerilimi'dir. Eçalışma = çalışma (indikatör) elektrodunun yarı hücre gerilimi dir ve tayini yapılavak iyonun aktivitesine, Eçalışma=E 0 - RT / n. F ln (ai / ay ) ) eşitliği ile bağlıdır.

Referans Elektrodlar: 1. Standart Hidrojen Elektrodu: En önemli referans elektrottur. Ama kullanımı zordur. çözeltisi içine devamlı H 2 gazı verilir. Pt / H 2 (1 atm) , 1 M H+ // Eo = 0. 00000 V meydana gelen reaksiyon; H 2 2 H+ +2é 1 M HCl SHE’ta 2. Kalomel elektrot Hg / Hg 2 Cl 2 (doygun) , KCl // Doygun kalomel elektrodun elektrot potansiyeli 25 o. C de 0. 242 V’tur. Klorür çözeltinin iyonik kuvvetini sabit tutmaya yarar. Elektrotta oluşan denge reaksiyonu ; ½ Hg 2 Cl 2 (k) + é Hg (s) + Cl- (aq) 3. Ag / Ag. Cl: Çok kolay hazırlanabilir. Elektrot potansiyeli +0. 197 volt’tur.


İndikatör Elektrodlar: İyon-Seçici Elektrotlar Çözeltideki bir türün potansiyeline cevap veren elektroda iyon seçici elektrot adı verilir. Hiçbir elektrot sadece tek bir iyon çeşidine cevap vermez. Cam elektrot en seçici olanıdır.

Pek çok iyon seçici etektrodun prerısibi cam p. H elektrotu ile aynıdır. Bir iyona bağlı membran potansiyeli oluşabilmesi için membran yüzeyinin her iki tarafında bir iyon değişim dengesi mevcut olmalıdır. Bu potansiyelin ölçülebilmesi için membrandan çok küçük bir elektrik akımının herhangi bir tarzda geçebilmesi gerekir. Cam elektrotta bu akım, cam içindeki hafifçe hare ketli. Na+ iyonları vasıtasıyla geçer. Cam elektrodun çalışma prensibi şu şekildedir. Konsantrasyonu farklı iki asit çözeltisi özel olarak yapılmış ince bir cam levha ile ayrıldığı zaman cam levhanın iki yüzü arasında bir potansiyel farkı oluşur. Bu potansiyel farkı aşağıdaki eşitlik ile gösterilir. a 1 E = S + 0, 059 log a 2 Bu eşitlikteki a 1 ve a 2 çözeltilerin hidrojen iyonu aktiflikleri, S ise bir sabittir. Bu eşitlikten yararlanarak potansiyometrik olarak p. H tayinleri yapılır. Bunun için çözeltilerden birinin aktifliği örneğin, a 2 sabit tutulur. Böylece şu eşitlik elde edilir. E = s + 0, 059 log a 1 E = s – 0, 059 p. H


Gümüş indikatör elektrod Ag+ iyonları içeren bir çözeltiye daldırıldığında Standast. Hidrojen elektroda karşı +0. 692 V potansiyel okunduğuna göre çözeltideki Ag+ iyonları konsantrasyonunu hesaplayınız Ag+ + e < > Ag E 0=0. 800 V

 Contoh reaksi redoks
Contoh reaksi redoks Menurut bohr elektron-elektron dalam atom
Menurut bohr elektron-elektron dalam atom ışığa bağımlı evre
ışığa bağımlı evre Kademeli reaksiyonlar
Kademeli reaksiyonlar Iki kat dört daireli zil ve kapı otomatiği tesisatı
Iki kat dört daireli zil ve kapı otomatiği tesisatı Karşılıklı çağırma tesisatı
Karşılıklı çağırma tesisatı Contoh soal reaksi redoks
Contoh soal reaksi redoks Kuvvetli elektrolit örnekleri
Kuvvetli elektrolit örnekleri Indikator difenilamin
Indikator difenilamin Stopnie utlenienia
Stopnie utlenienia Reaksi redoks
Reaksi redoks Materi penyetaraan reaksi redoks kelas 12
Materi penyetaraan reaksi redoks kelas 12 Redoks tepkimesi
Redoks tepkimesi Contoh oksidasi
Contoh oksidasi Penyetaraan reaksi redoks
Penyetaraan reaksi redoks Soy metaller
Soy metaller Reaksi redoks adalah gabungan dari reaksi
Reaksi redoks adalah gabungan dari reaksi Redoks potansiyeli nedir
Redoks potansiyeli nedir Redoks taşıyıcısının solunum zincirindeki sırası
Redoks taşıyıcısının solunum zincirindeki sırası Redoks
Redoks Metallerin aktiflik sıralaması
Metallerin aktiflik sıralaması Tuliskan persamaan reaksi proses pengkaratan pada besi
Tuliskan persamaan reaksi proses pengkaratan pada besi Titrasi redoks
Titrasi redoks Jelaskan daya pengoksidasi dan daya reduksi unsur halogen
Jelaskan daya pengoksidasi dan daya reduksi unsur halogen