REDOX reakcije Elementi elektron donori kationi elektron akceptori


















- Slides: 23

REDOX reakcije -Elementi - elektron donori (kationi) - elektron akceptori (anioni)

- elektron donor gubi elektron → oksidacija -elektron akceptor prima elektrona → redukcija - broj e- otpuštenih u oksidaciji = broj e- primljenih u redukciji el. donor se oksidira (redukcijsko sredstvo = reducens) el. akceptor se reducira (oksidacijsko sredstvo = oksidans)

OKSIDACIJSKI BROJ Pravila za određivanje oksidacijskog broja: 1. Oksidacijski broj atoma u elementarnom stanju jednak je nuli. 2. Oksidacijski broj vodika u spojevima iznosi +1. Izuzetak su hidridi metala (npr. Li. H), u kojima vodik ima oksidacijski broj – 1. 3. Oksidacijski broj kisika u spojevima iznosi – 2. Izuzetak su peroksidi (spojevi koji sadrže peroksidni (npr. H 2 O 2), u kojima kisik ima oksidacijski broj – 1 i superoksidi (npr. KO 2) u kojima kisik ima oksidacijski broj – 1/2. Kada je vezan na fluor, kisik ima pozitivan stupanj oksidacije (npr. u F 2 O oksidacijski broj kisika iznosi + 2). 4. Oksidacijski broj alkalnih metala iznosi +1, a zemnoalkalnih metala +2. 5. Oksidacijski broj fluora uvijek je -1, a oksidacijski broj ostalih halogenih elemenata uglavnom je -1. 6. Oksidacijski brojevi dodjeljuju se atomima u molekuli ionskom kompleksu na način da je suma oksidacijski brojeva u neutralnoj molekuli jednaka nuli. Odredi oksidacijski broj mangana u slijedećim spojevima: KMn. O 4; Mn. O 2, Mn 2 O 3

Polureakcije Redoks jednadžbe rješavaju se pomoću parcijalnih elektronskih jednadžbi: – odvojeno se pišu polureakcije - reakcije oksidacije i reakcije redukcije s odgovarajućim brojem prenesenih elektrona – ukoliko broj elektrona u jednadžbama polureakcija nije jednak, parcijalne jednadžbe množe se odgovarajućim cijelim brojem kako bi se dobio najmanji zajednički višekratnik Npr. 2 Fe 3+ + 6 e 3 Cl 20 + 6 e- 6 Cl 2 Fe + 3 Cl 2 2 Fe 3+ + 6 Cl- (oksidacija) (redukcija) (redox) 4 Fe. S 2 + 44 H 2 O 4 Fe(OH)3 + 8 SO 42 - + 76 H+ + 68 e- (oksidacija) 17 O 2 + 68 H+ + 68 e- 34 H 2 O(l) (redukcija) 4 Fe. S 2 + 17 O 2 +10 H 2 O 4 Fe(OH)3 + 8 SO 42 - + 8 H+ (redox)

Elektrokemijska ćelija Elektrokemijski niz Npr. Zn + Fe 2+ → Zn 2+ + Fe katoda Dr. G 0 = -16, 29 kcal/mol Fe + Cu 2+ → Fe 2+ + Cu Dr. G 0 = -34, 51 kcal/mol Zn 2+ + SO 42 - Cu + 2 Ag+ → Cu 2+ + 2 Ag Dr. G 0 = -21, 21 kcal/mol Zn → Zn 2+ + 2 e- polupropusna membrana Cu 2+ + 2 e- → Cu Zn + Cu 2+ → Zn 2+ + Cu Zn - najjači reducens u navedenim reakcijama Ag - najslabiji reducens (najjači oksidans) u navedenim reakcijama Dr. G 0 = -50, 8 kcal/mol

Elektromotorna sila (E) - razlika potencijala između dviju različitih elektroda koje su uronjene u isti elektrolit ili između dva polučlanka spojenih elektrolitnim mostom. -veza između Dr. G 0 i elektromotorne sile (E) REDOX reakcije glasi: Dr. G 0 = n. FE Dr. G 0 - promjena Gibb. energ. reakcije n - broj elektrona izmijenjen u reakciji F - Faradayeva konst. (96 489 C/mol; 23, 06 kcal/(V×g) E - elektromotorna sila Standardni uvjeti → Standardna elektromotorna sila - ako se vratimo na reakciju: Zn + Cu 2+ → Zn 2+ + Cu Dr. G 0 = -50, 8 kcal/mol

Elektrokemijski niz - kemijski elementi složeni po svom standardnom elektrodnom potencijalu Dogovorno je uzeto da je potencijal standardne vodikove elektrode jednak nuli: H+ (aq) + e- → ½ H 2 (g) E 0 = 0, 0 V Gf 0(H+) = Gf 0(e-) = 0, 00 Elektrodni potencijal po definiciji je redukcijski potencijal. Što je negativniji standardni elektrodni potencijal to je metal elektropozitivniji, i može reducirati elektronegativnije elemente (elemente ispod sebe u elektrokemijskom nizu).

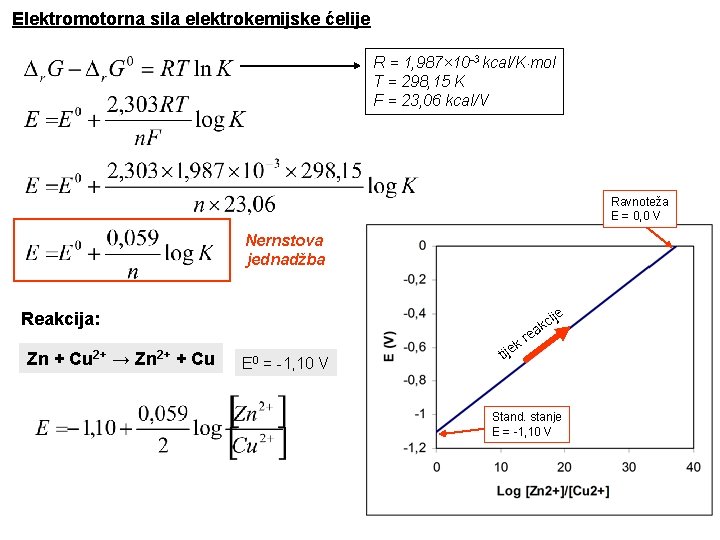
Elektromotorna sila elektrokemijske ćelije R = 1, 987× 10 -3 kcal/K×mol T = 298, 15 K F = 23, 06 kcal/V Ravnoteža E = 0, 0 V Nernstova jednadžba Reakcija: Zn + Cu 2+ → Zn 2+ + Cu c ak ije e E 0 = -1, 10 V r k e tij Stand. stanje E = -1, 10 V

Eh - elektromotorna sila razvijena između neke elektrode (bez obzira na stanje) i Helektrode u standardnom stanju Npr. oksidacija Fe 2+ u Fe 3+ Fe 2+ → Fe 3+ + e. H+ + e- → ½ H 2 Fe 2+ + H+ → Fe 3+ + ½ H 2 Dr. G 0 = [Gf 0(Fe 3+) + ½ Gf 0(H 2)] - [Gf 0(H+) + Gf 0(Fe 2+)] Gf 0(H 2) = 0 Gf 0(H+) = 0 Eh - karakteristika sredine, vrijednost Eh neke sredine ukazuje na njenu sposobnost da bude elektron donor ili elektron akceptor s obzirom - omjer [Fe 3+]/[Fe 2+] ovisi samo o Eh sredine

Stabilnost vode u Eh - p. H dijagramu H 2 O (l) ↔ ½ O 2 (g) + H 2 (g) H 2 O (l) ↔ ½ O 2 + 2 H+ + 2 e- Dr. G 0 = [2 Gf 0(H+) + ½ Gf 0(O 2) + 2 Gf 0(e-)] - [Gf 0(H 2 O (l))] E 0 = +1, 23 V Dr. G 0 = +58, 687 kcal/mol -p. H za p. O 2 = 1 atm Eh = 1, 23 - 0, 059 p. H

H+ + e- ½ H 2(g) za p. H 2 = 1 atm Eh = 1, 23 0 , 059 Eh = - 0, 059 p. H Eh =- 0, 0 59 p. H

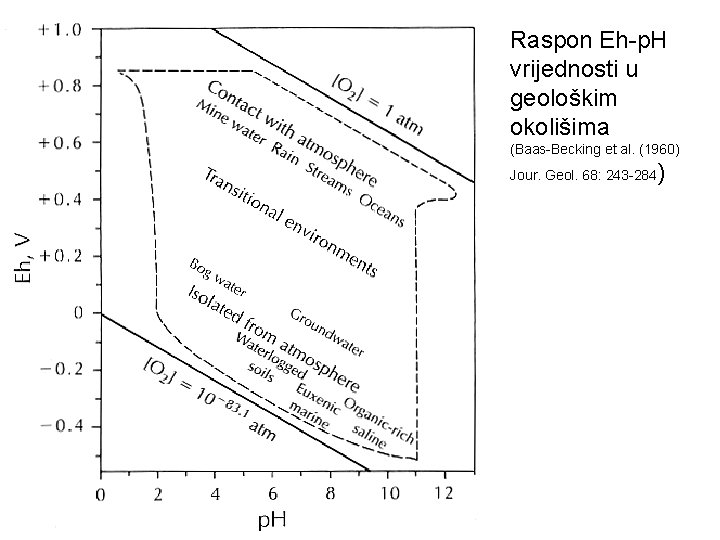
Raspon Eh-p. H vrijednosti u geološkim okolišima (Baas-Becking et al. (1960) Jour. Geol. 68: 243 -284 )

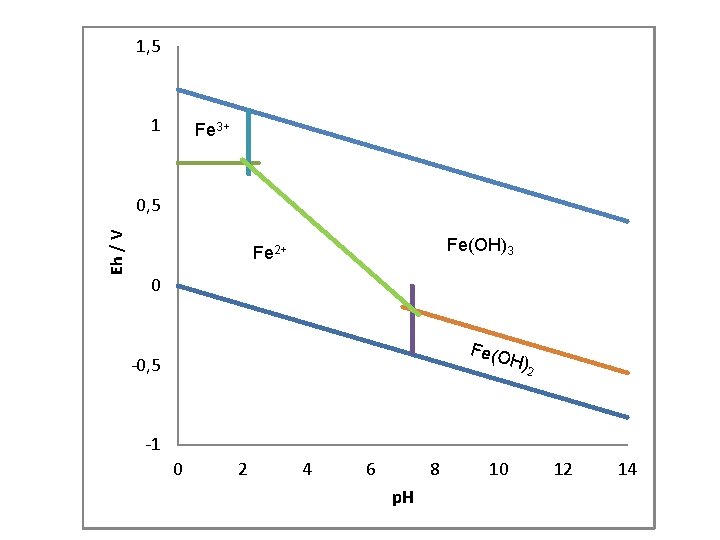
Stabilnost Fe-vrsta u Eh-p. H dijagramu Fe-H 2 O sustav Fe 2+/Fe 3+ granica Fe 2+ (aq) → Fe 3+ (aq) + e – Dr. Go = Dr. Go (Fe 3+) - Dr. Go (Fe 2+) = ( -16, 7 k. J/mol) - (-90, 0 k. J/mol ) = 73, 3 k. J/mol [Fe 3+] = [Fe 2+]

1, 5 1 Fe 3+ Eh / V 0, 5 Fe(OH)3 Fe 2+ 0 Fe(O H) -0, 5 2 -1 0 2 4 6 8 p. H 10 12 14

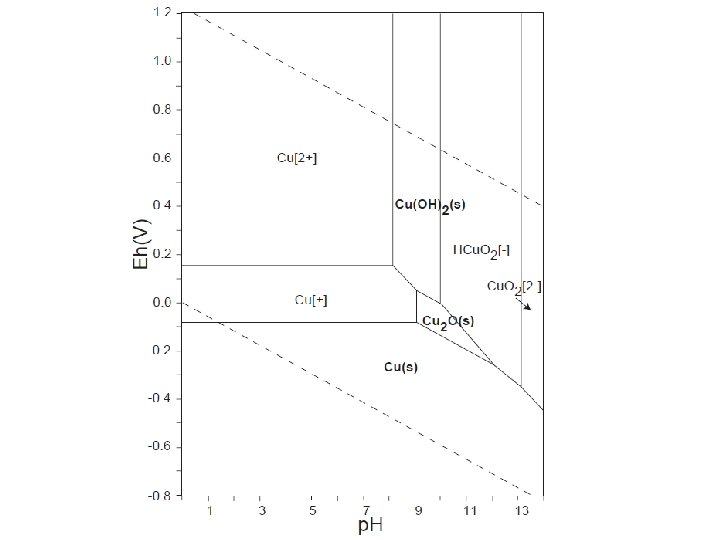
Eh-p. H dijagram za Fe-vrste (okside, sulfide, karbonate) pri 25°C i 1 atm. Ukupni otopljeni sumpor = 10 -6, ukupni otopljeni karbonati = 100 Garrels & Christ(1965): Solutions, Minerals, and Equilibria.







Trošenje halkopirita (Cu. Fe. S 2), Sibai, Rusija Limonit (Fe 2 O 3×n. H 2 O) Malahit (Cu 2 CO 3(OH)2) Vapnenac

 Elektrokemijski niz
Elektrokemijski niz Menurut bohr elektron-elektron dalam atom
Menurut bohr elektron-elektron dalam atom Egzergone reakcije
Egzergone reakcije Protoliza
Protoliza Nada pitinac
Nada pitinac Sila reakcije podloge formula
Sila reakcije podloge formula Fenotip cc dd ee
Fenotip cc dd ee Hemijska kinetika
Hemijska kinetika Reakcije na frustracije
Reakcije na frustracije Ekvilibrijske reakcije
Ekvilibrijske reakcije Plamenske reakcije barve
Plamenske reakcije barve Promena entalpije
Promena entalpije Oksidacija etanala
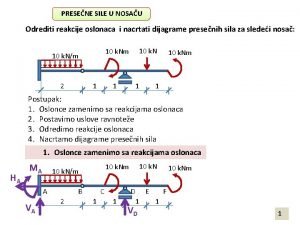
Oksidacija etanala Reakcije u osloncima
Reakcije u osloncima Dehidratacija alkohola
Dehidratacija alkohola Fenoli reakcije
Fenoli reakcije Porodica reakcije
Porodica reakcije Plamenske reakcije barve
Plamenske reakcije barve Homoliticko raskidanje veza
Homoliticko raskidanje veza Antikatalitički
Antikatalitički Oksido redukcije
Oksido redukcije Piroliza modre galice
Piroliza modre galice Brzina kemijske reakcije 8 razred
Brzina kemijske reakcije 8 razred Standardne entalpije stvaranja tablica
Standardne entalpije stvaranja tablica