Vortrag 4 Planung der klinischen Prfung Tagesseminar Klinische






























- Slides: 42

Vortrag 4 Planung der klinischen Prüfung Tagesseminar Klinische Prüfung und klinische Bewertung von Medizinprodukten ausgearbeitet von Prof. Dr. Andreas Ziegler Direktor des Instituts für Medizinische Biometrie und Statistik Universität zu Lübeck

Gliederung Planung der klinischen Prüfung Ä Biostatistik Ä Studiendesign Ä Festlegung der Endpunkte Ä Maßnahmen gegen Verzerrung Ä Prüfplan nach ISO 14155: 2011 -02 Ä Prüfbogen Ä Datenmanagement Ä Bereitstellung des MP Ä Antragstellung (DIMDI, BOB, Ethik-Kommission) Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten

Die erste klinische Prüfung Versuch’s doch mit deinen Knechten zehn Tage und lass uns Gemüse zu essen und Wasser zu trinken geben. Und dann lass dir unser Aussehen und das der jungen Leute, die von des Königs Speise essen, zeigen; und danach magst du mit deinen Knechten tun nach dem, was du sehen wirst. Und er hörte auf sie und versuchte es mit ihnen zehn Tage. Und nach den zehn Tagen sahen sie schöner und kräftiger aus alle jungen Leute, die von des Königs Speise aßen. Da tat der Aufseher die Speise und den Trank, die für sie bestimmt waren, weg und gab ihnen Gemüse. Prophet Daniel 1, 12 -15 Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 3

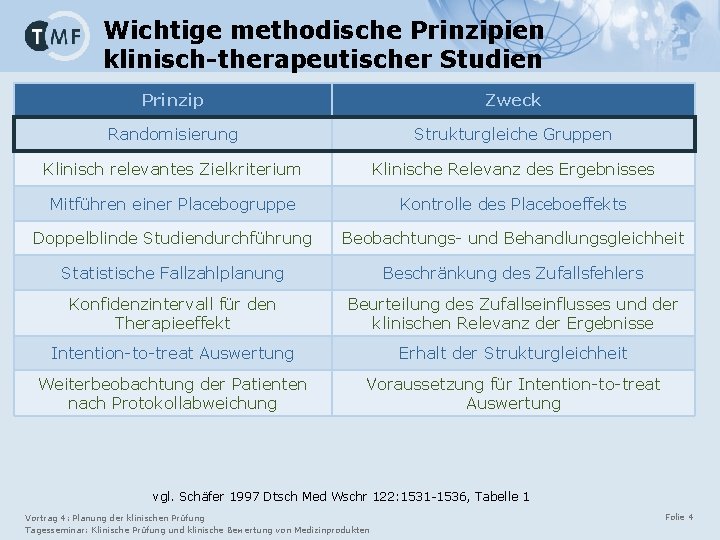
Wichtige methodische Prinzipien klinisch-therapeutischer Studien Prinzip Zweck Randomisierung Strukturgleiche Gruppen Klinisch relevantes Zielkriterium Klinische Relevanz des Ergebnisses Mitführen einer Placebogruppe Kontrolle des Placeboeffekts Doppelblinde Studiendurchführung Beobachtungs- und Behandlungsgleichheit Statistische Fallzahlplanung Beschränkung des Zufallsfehlers Konfidenzintervall für den Therapieeffekt Beurteilung des Zufallseinflusses und der klinischen Relevanz der Ergebnisse Intention-to-treat Auswertung Erhalt der Strukturgleichheit Weiterbeobachtung der Patienten nach Protokollabweichung Voraussetzung für Intention-to-treat Auswertung vgl. Schäfer 1997 Dtsch Med Wschr 122: 1531 -1536, Tabelle 1 Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 4

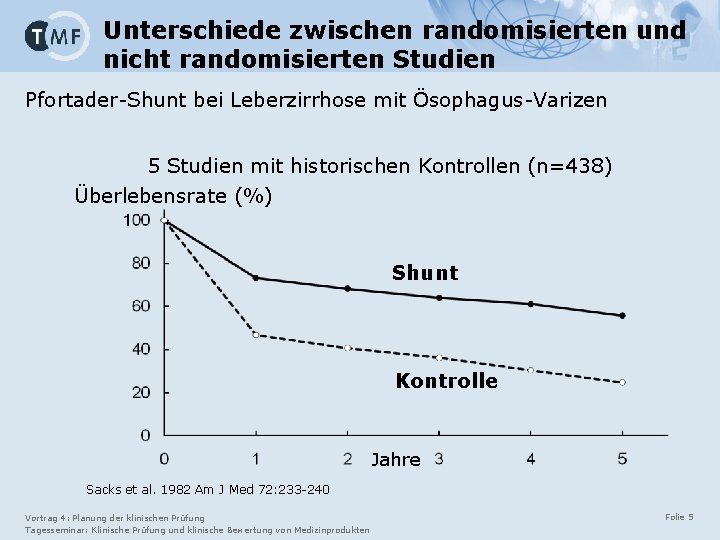
Unterschiede zwischen randomisierten und nicht randomisierten Studien Pfortader-Shunt bei Leberzirrhose mit Ösophagus-Varizen 5 Studien mit historischen Kontrollen (n=438) Überlebensrate (%) Shunt Kontrolle Jahre Sacks et al. 1982 Am J Med 72: 233 -240 Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 5

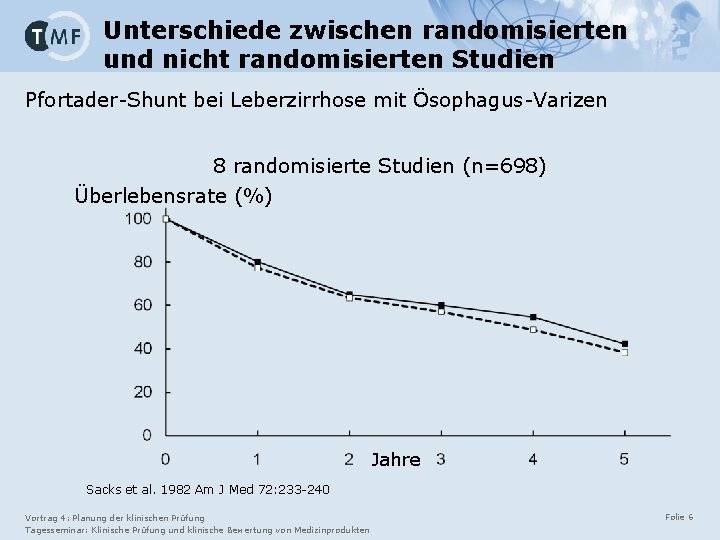
Unterschiede zwischen randomisierten und nicht randomisierten Studien Pfortader-Shunt bei Leberzirrhose mit Ösophagus-Varizen 8 randomisierte Studien (n=698) Überlebensrate (%) Jahre Sacks et al. 1982 Am J Med 72: 233 -240 Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 6

Wichtige methodische Prinzipien klinisch-therapeutischer Studien Prinzip Zweck Randomisierung Strukturgleiche Gruppen Klinisch relevantes Zielkriterium Klinische Relevanz des Ergebnisses Mitführen einer Placebogruppe Kontrolle des Placeboeffekts Doppelblinde Studiendurchführung Beobachtungs- und Behandlungsgleichheit Statistische Fallzahlplanung Beschränkung des Zufallsfehlers Konfidenzintervall für den Therapieeffekt Beurteilung des Zufallseinflusses und der klinischen Relevanz der Ergebnisse Intention-to-treat Auswertung Erhalt der Strukturgleichheit Weiterbeobachtung der Patienten nach Protokollabweichung Voraussetzung für Intention-to-treat Auswertung vgl. Schäfer 1997 Dtsch Med Wschr 122: 1531 -1536, Tabelle 1 Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 7

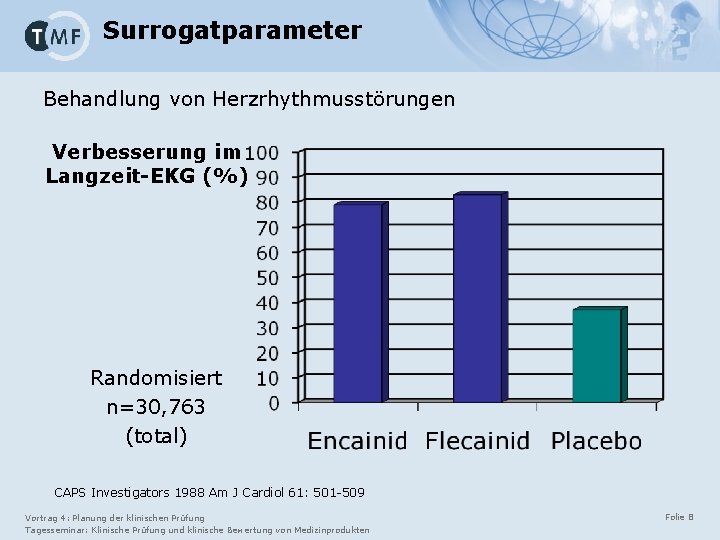
Surrogatparameter Behandlung von Herzrhythmusstörungen Verbesserung im Langzeit-EKG (%) Randomisiert n=30, 763 (total) CAPS Investigators 1988 Am J Cardiol 61: 501 -509 Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 8

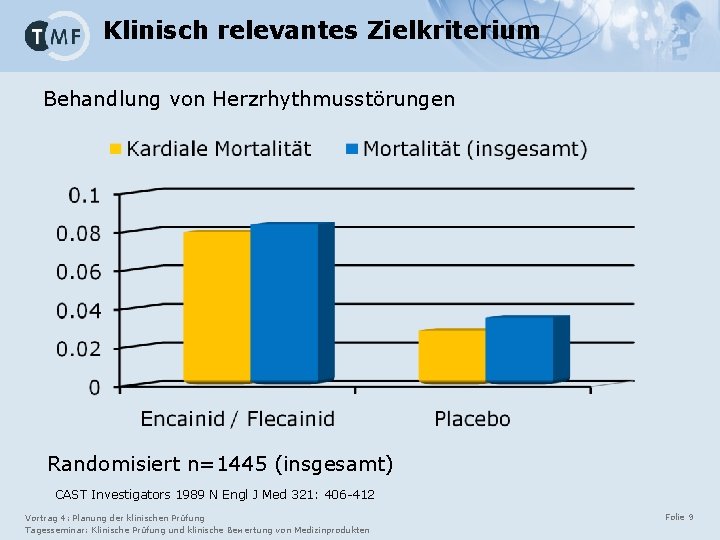
Klinisch relevantes Zielkriterium Behandlung von Herzrhythmusstörungen Randomisiert n=1445 (insgesamt) CAST Investigators 1989 N Engl J Med 321: 406 -412 Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 9

Zwei Ziele Regelung Konformitätsbewertung, in Betrieb nehmen, n CE-Kennzeichnung, Inverkehrbringen: von Bf. Ar. M oder EMA Benannte Stelle, bei Funktion und Sicherheit des MP Erstattung G-BA beschließt Hilfsmittelverzeichnis und Behandlungsleitlinien einschließlich MP bei medizinischem Nutzen und Wirtschaftlichkeit für Patienten nach Gutachten z. B. vom IQWi. G Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten n MPG, MPV, DIN EN ISO 14155, MPSV, MPBetreib. V. Prüfplan nach Stand der Wissenschaft § SGB V: erfordert effektiv Studien nach Stand der Wissenschaft Folie 10

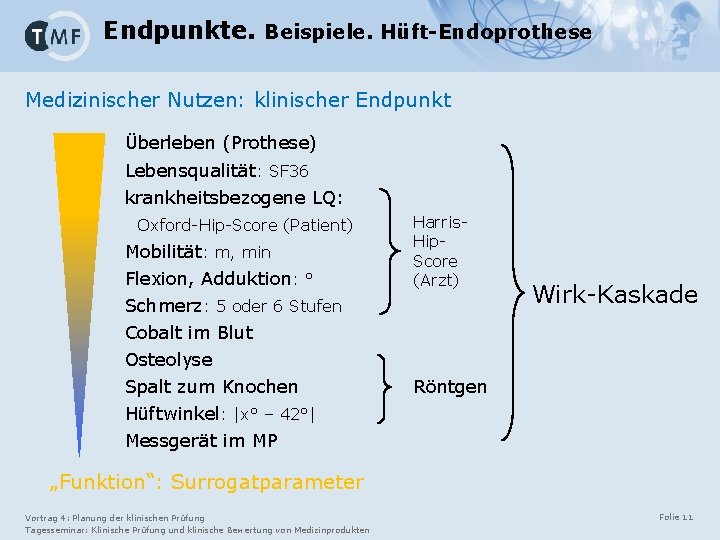
Endpunkte. Beispiele. Hüft-Endoprothese Medizinischer Nutzen: klinischer Endpunkt Überleben (Prothese) Lebensqualität: SF 36 krankheitsbezogene LQ: Oxford-Hip-Score (Patient) Mobilität: m, min Flexion, Adduktion: ° Schmerz: 5 oder 6 Stufen Cobalt im Blut Osteolyse Spalt zum Knochen Hüftwinkel: |x° – 42°| Messgerät im MP Harris. Hip. Score (Arzt) Wirk-Kaskade Röntgen „Funktion“: Surrogatparameter Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 11

Klinischer Endpunkt Klinisch relevantes Ergebnis Hüftendoprothese Vorteil der Therapie für den Patienten: ÄÜberleben (Verlängerung) ÄHeilung z. B. Mobilität ÄVerbesserung der Morbidität ÄKrankheitsprogression gestoppt z. B. Osteolyse ÄPrävention von Zweiterkrankungen z. B. Lungenentzündung der Bettlägrigen ÄLebensqualität z. B. selbständiges Leben (SF 36) Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 12

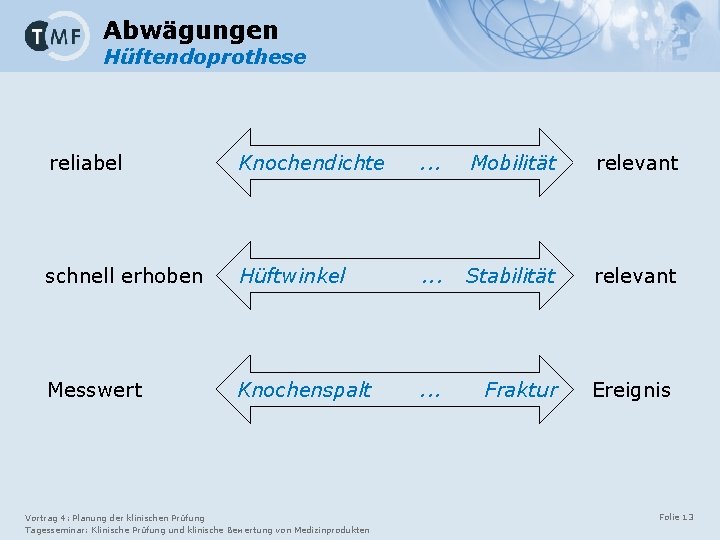
Abwägungen Hüftendoprothese reliabel Knochendichte . . . Mobilität relevant schnell erhoben Hüftwinkel . . . Stabilität relevant Messwert Knochenspalt . . . Fraktur Ereignis Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 13

Wichtige methodische Prinzipien klinisch-therapeutischer Studien Prinzip Zweck Randomisierung Strukturgleiche Gruppen Klinisch relevantes Zielkriterium Klinische Relevanz des Ergebnisses Mitführen einer Placebogruppe Kontrolle des Placeboeffekts Doppelblinde Studiendurchführung Beobachtungs- und Behandlungsgleichheit Statistische Fallzahlplanung Beschränkung des Zufallsfehlers Konfidenzintervall für den Therapieeffekt Beurteilung des Zufallseinflusses und der klinischen Relevanz der Ergebnisse Intention-to-treat Auswertung Erhalt der Strukturgleichheit Weiterbeobachtung der Patienten nach Protokollabweichung Voraussetzung für Intention-to-treat Auswertung vgl. Schäfer 1997 Dtsch Med Wschr 122: 1531 -1536, Tabelle 1 Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 14

Unspezifische Behandlungseffekte Erwartung Informiertheit Arzt Erwartung Aufmerksamkeit Interesse Mitgefühl Behandlung Situation Patient Eindruck Kosten Darreichung

Placeboeffekt ÄDrei Quellen ÄVon Wirkung trennen! ÄSchein-Operationen? ÄWartegruppen-Design? Verblindung ÄLogistik! ÄOft nicht Behandler, aber Nachbeobachter Anforderungen ÄAussehen, Geräusch, Gewicht, … gleich ÄNeutrale Information Beispiel: Zahnrad ausgebaut Lengsfeld et al. 2007 Spine 7: 531 -540

Wichtige methodische Prinzipien klinisch-therapeutischer Studien Prinzip Zweck Randomisierung Strukturgleiche Gruppen Klinisch relevantes Zielkriterium Klinische Relevanz des Ergebnisses Mitführen einer Placebogruppe Kontrolle des Placeboeffekts Doppelblinde Studiendurchführung Beobachtungs- und Behandlungsgleichheit Statistische Fallzahlplanung Beschränkung des Zufallsfehlers Konfidenzintervall für den Therapieeffekt Beurteilung des Zufallseinflusses und der klinischen Relevanz der Ergebnisse Intention-to-treat Auswertung Erhalt der Strukturgleichheit Weiterbeobachtung der Patienten nach Protokollabweichung Voraussetzung für Intention-to-treat Auswertung vgl. Schäfer 1997 Dtsch Med Wschr 122: 1531 -1536, Tabelle 1 Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 17

Fallzahlplanung Richtlinie 93/42/EWG, Anhang X, 2. 3. 1: Diese Prüfungen müssen eine angemessene Zahl von Beobachtungen umfassen, damit wissenschaftlich gültige Schlußfolgerungen gezogen werden können. Tier. Sch. G § 9, Abs. 2(2) Für den Tierversuch dürfen nicht mehr Tiere verwendet werden, als für den verfolgten Zweck erforderlich ist. ISO 14155: 2011 -02, Anhang A. 6: Beschreibung und Begründung für c) … das Signifikanzniveau und die Aussagekraft der klinischen Prüfung (meint Macht) m) … bei multizentrischen Prüfungen, die Mindest- und Höchstzahl an einzubeziehenden Versuchspersonen für jedes Prüfzentrum Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 18

Konfidenzintervalle CPMP/ICH/363/96, Abschnitt 5. 5 Ä Estimates of treatment effects should be accompanied by confidence intervals, whenever possible, and the way in which these will be calculated should be identified. Ä The approach of setting type I errors for one-sided tests at half the conventional type I error used in two-sided tests is preferable in regulatory settings. This promotes consistency with the two-sided confidence intervals that are generally appropriate for estimating the possible size of the difference between two treatments. Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 19

Wichtige methodische Prinzipien klinisch-therapeutischer Studien Prinzip Zweck Randomisierung Strukturgleiche Gruppen Klinisch relevantes Zielkriterium Klinische Relevanz des Ergebnisses Mitführen einer Placebogruppe Kontrolle des Placeboeffekts Doppelblinde Studiendurchführung Beobachtungs- und Behandlungsgleichheit Statistische Fallzahlplanung Beschränkung des Zufallsfehlers Konfidenzintervall für den Therapieeffekt Beurteilung des Zufallseinflusses und der klinischen Relevanz der Ergebnisse Intention-to-treat Auswertung Erhalt der Strukturgleichheit Weiterbeobachtung der Patienten nach Protokollabweichung Voraussetzung für Intention-to-treat Auswertung vgl. Schäfer 1997 Dtsch Med Wschr 122: 1531 -1536, Tabelle 1 Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 20

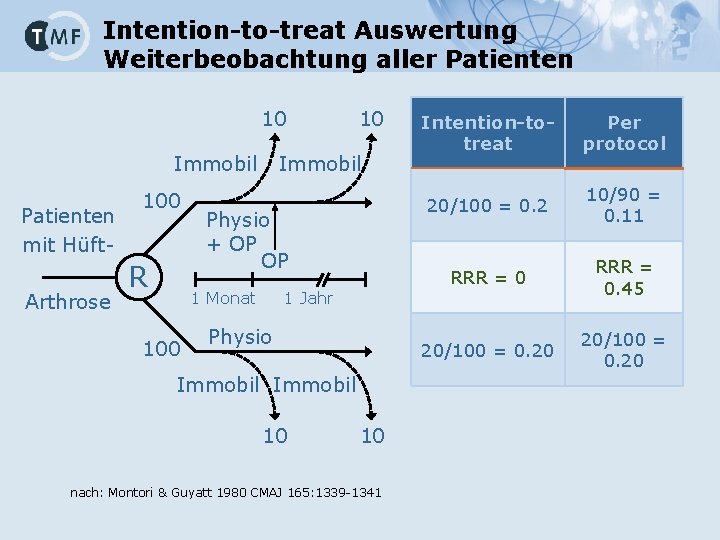
Intention-to-treat Auswertung Weiterbeobachtung aller Patienten 10 Immobil Patienten mit Hüft. Arthrose 100 R Immobil Physio + OP OP 1 Monat 100 10 Intention-totreat Per protocol 20/100 = 0. 2 10/90 = 0. 11 RRR = 0. 45 20/100 = 0. 20 1 Jahr Physio Immobil 10 10 nach: Montori & Guyatt 1980 CMAJ 165: 1339 -1341

Gliederung Planung der klinischen Prüfung Ä Biostatistik Ä Studiendesign Ä Festlegung der Endpunkte Ä Maßnahmen gegen Verzerrung Ä Prüfplan nach ISO 14155: 2011 -02 Ä Prüfbogen Ä Datenmanagement Ä Bereitstellung des MP Ä Antragstellung (DIMDI, BOB, Ethik-Kommission) Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten

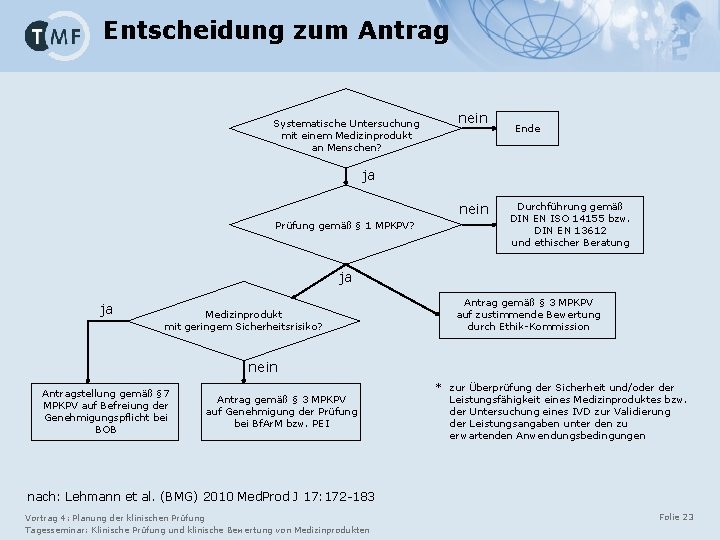
Entscheidung zum Antrag Systematische Untersuchung mit einem Medizinprodukt an Menschen? nein Ende ja nein Prüfung gemäß § 1 MPKPV? Durchführung gemäß DIN EN ISO 14155 bzw. DIN EN 13612 und ethischer Beratung ja ja Medizinprodukt mit geringem Sicherheitsrisiko? Antrag gemäß § 3 MPKPV auf zustimmende Bewertung durch Ethik-Kommission nein Antragstellung gemäß § 7 MPKPV auf Befreiung der Genehmigungspflicht bei BOB Antrag gemäß § 3 MPKPV auf Genehmigung der Prüfung bei Bf. Ar. M bzw. PEI * zur Überprüfung der Sicherheit und/oder Leistungsfähigkeit eines Medizinproduktes bzw. der Untersuchung eines IVD zur Validierung der Leistungsangaben unter den zu erwartenden Anwendungsbedingungen nach: Lehmann et al. (BMG) 2010 Med. Prod J 17: 172 -183 Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 23

Stand der Technik Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 24

Prüfplan ISO 14155: 2011 -02, Anhang A 1 Allgemeines Ä 1. 1 Identitätsmerkmale des klinischen Prüfplans Ä 1. 2 Sponsor Ä 1. 3 Prüfer, Prüfungsleiter, koordinierender Prüfer, Prüfstätte(n) Ä 1. 4 Gesamtübersicht über die klinische Prüfung 2 Identitätsbeschreibung und Beschreibung des zu prüfenden Medizinprodukts 3 Begründung des Designs der klinischen Prüfung 4 Risikobewertung für das Produkt und die Prüfung 5 Ziele der klinischen Prüfung 6 Design der klinischen Prüfung Ä 6. 1 Einzelheiten Ä 6. 2 Produkte und Vergleichsprodukte Ä 6. 3 Versuchspersonen Ä 6. 4 Behandlungen Ä 6. 5 Festlegungen für das Monitoring Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten 7 8 9 Statistische Überlegungen Datenmanagement Änderungen am klinischen Prüfplan 10 Abweichungen vom klinischen Prüfplan Verwendungsnachweis des Produkts Ethik, Normen und Bestimmungen Verfahren zum Einholen der Einverständniserklärung Unerwünschte Ereignisse und unerwünschte Wirkungen des Produkts Schutzbedürftige Population Vorzeitige Beendigung oder Aussetzen der Prüfung Veröffentlichungspolitik Bibliografie 11 12 13 14 15 16 17 18 Folie 25

Risikobewertung für Produkt und Prüfung ISO 14155: 2011 -02 5. 2, Anhang A, Abschnitt 4 Voraussichtlicher klinischer Nutzen Mit dem Produkt verbundene Risiken der Teilnahme an der klinischen Prüfung Vorhersehbare unerwünschte Wirkungen des Produkts nach Art, Auftreten, Schwere, Folgen Mögliche Wechselwirkungen Maßnahmen dagegen Nach verfügbaren Daten ! Verwendungsfertiges Produkt Normale Einsatzbedingungen DIN EN ISO 14155 -2: 2009 4. 5. 4, ISO 14155: 2011 -02 5. 2, A. 4 verweisen auf DIN EN ISO 14971: 2009: Medizinprodukte - Anwendung des Risikomanagements auf Medizinprodukte Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 26

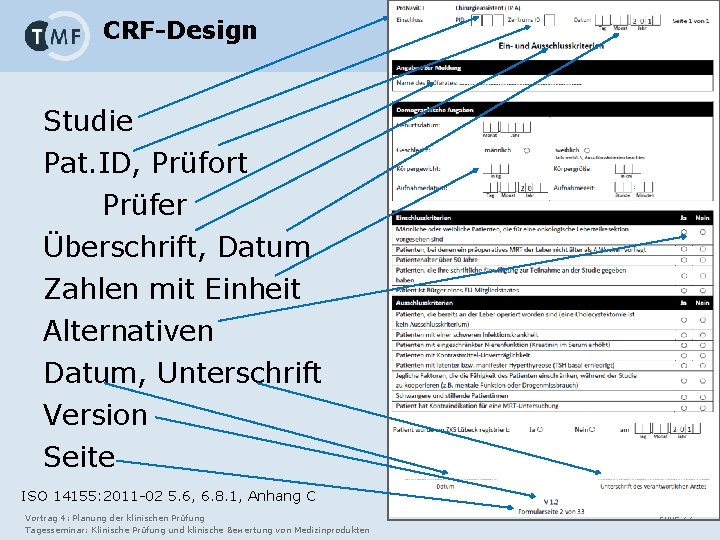
CRF-Design Studie Pat. ID, Prüfort Prüfer Überschrift, Datum Zahlen mit Einheit Alternativen Datum, Unterschrift Version Seite ISO 14155: 2011 -02 5. 6, 6. 8. 1, Anhang C Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 27

Prüfbögen Übliche Prüfbögen Ä Pre-Screening Ä Ein- und Ausschlusskriterien Ä Befinden zu und Behandlungen vor Beginn Ä Alle Behandlungen Ä Befinden am Ende Ä Unerwünschte Ereignisse (AE) Ä SAE-Meldebogen Ä Abbruch EN ISO 14155 -2: 2009 4. 14, Anhang A Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 28

Prüfbögen Ä Screening Ä Einverständniserklärung, Rekrutierungs-Datum Ä Einschluss/Ausschluss, Demografie, Diagnose Ä Anfangsbesuch, relevante frühere Behandlungen Ä Behandlungen, Untersuchungen Ä AE, erwartete schwerwiegende unerwünschte Wirkung des Produkts (ASADE), nicht-medizinische Beanstandungen Ä Begleiterkrankungen und –Behandlungen, ungeplante Besuche Ä Tagebuch Ä Behandlungs- oder Beobachtungsende Ä Abweichungen vom Prüfplan (CIP) Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten ISO 14155: 2011 -02 Anhang C 2. 4 Folie 29

Dokumente des Prüfers ISO 14155: 2011 -02 Anhang E Investigator Site File = Studienakten des Prüfers Ä Prüfer, deren Qualifikation, Kontaktdaten Ä Prüfplan, Prüferbroschüre, Handbuch des klinischen Prüfers Ä Korrespondenz, u. a. Ä Votum der zuständigen und der beteiligten Ethikkommission Ä Prüfervertrag, Versicherungsschein Ä Monitorberichte Ä Prüfbögen, SAE-Meldebögen, Verwendungsnachweise Ä Patienteninformation und –einwilligung Ä … Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 30

Akten am Prüfort Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 31

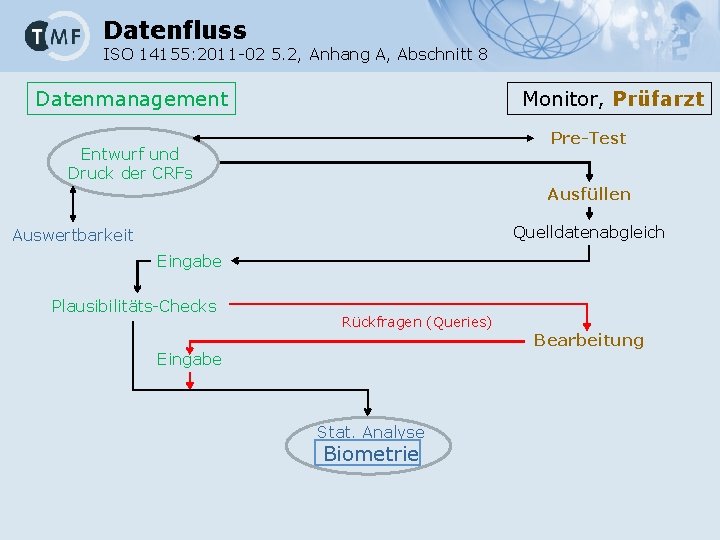
Datenfluss ISO 14155: 2011 -02 5. 2, Anhang A, Abschnitt 8 Datenmanagement Monitor, Prüfarzt Pre-Test Entwurf und Druck der CRFs Ausfüllen Quelldatenabgleich Auswertbarkeit Eingabe Plausibilitäts-Checks Rückfragen (Queries) Eingabe Stat. Analyse Biometrie Bearbeitung

Datenbank: Anforderungen Datenschutz: Pseudonymisierung MPG § 12: Aufbewahrung für 15 Jahre MPKPV § 10(2) Ä Vollst. Nachvollziehbarkeit aller Beobachtungen und Befunde Ä Korrekte Erhebung und Verarbeitung der Daten Ä Korrekte Ableitung von Schlussfolgerungen DIN ISO 14155 -2: 2009 4. 3. 5: Beschreibung der Verfahren ISO 14155: 2011 -02 6. 8. 3: Ä Validierung des gesamten computergestützten Systems Ä Korrekturen ohne Löschen Ä Nur berechtigte Zugriffe geschulter namentlich Bekannter Ä Datensicherheit FDA: 21 CFR part 11: e-Aufzeichnungen und e-Unterschrift Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 33

Datenbank: Maßnahmen Validierung computergestütztes System (TMF System. Validierungs. Master. Plan) Ä Nachvollziehbarkeit Ä Rollenmanagement Ä Edit-Trail Ä Fortgeschrittene elektronische Signatur (Sig. G) Ä Korrekte Verarbeitung Ä Dokumentierte Validierung Ä Zugangskontrolle Ä Abwehr von Schadprogrammen Ä Qualitäts- und Risikomanagement Ä SOPs und geschultes Personal Ä Pseudonymisierung an der Prüfstelle Ä Datensicherung, sichere Lagerung, Aufbewahrung für 15 Jahre Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 34

Bereitstellung des Produkts für die klinische Prüfung Prüfprodukt Vollständigkeit: Mit Zubehör, Gebrauchsanweisung, Beschreibung Wartung und Kalibrierung: Anweisung und Material Einweisung: Durch erfahrenes Personal, dokumentiert Bilanzierung und Rückverfolgbarkeit: Quittung bei Handwechsel, Dokumentation mit Datum, Typ- und Seriennummer Nur für klinische Prüfung verwenden; Etikett (MPKPV § 2(1)) ISO 14155: 2011 -02 Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 35

Gliederung Planung der klinischen Prüfung Ä Biostatistik Ä Studiendesign Ä Festlegung der Endpunkte Ä Maßnahmen gegen Verzerrung Ä Prüfplan nach ISO 14155: 2011 -02 Ä Prüfbogen Ä Datenmanagement Ä Bereitstellung des MP Ä Antragstellung (DIMDI, BOB, Ethik-Kommission) Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten

Planen Sie Zeithorizonte!

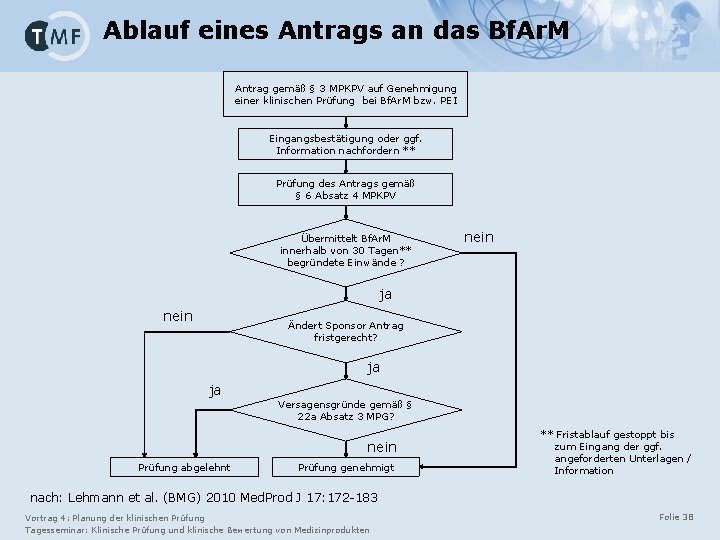
Ablauf eines Antrags an das Bf. Ar. M Antrag gemäß § 3 MPKPV auf Genehmigung einer klinischen Prüfung bei Bf. Ar. M bzw. PEI Eingangsbestätigung oder ggf. Information nachfordern ** Prüfung des Antrags gemäß § 6 Absatz 4 MPKPV Übermittelt Bf. Ar. M innerhalb von 30 Tagen** begründete Einwände ? nein ja nein Ändert Sponsor Antrag fristgerecht? ja ja Versagensgründe gemäß § 22 a Absatz 3 MPG? nein Prüfung abgelehnt Prüfung genehmigt ** Fristablauf gestoppt bis zum Eingang der ggf. angeforderten Unterlagen / Information nach: Lehmann et al. (BMG) 2010 Med. Prod J 17: 172 -183 Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 38

Anträge MPKPV § 3 (s. Vortrag 1) Per DIMDI an BOB (Bf. Ar. M) und Ethik-Kommission Formulare mit Anhängen Ä Prüfplan Ä Prüferbroschüre, Handbuch des klinischen Prüfers Ä Prüfbögen Ä Qualifikation der Prüfstellen und der Prüfer Ä Zusammenfassung der Risikoanalyse und –bewertung Ä … Achtung! Deklaration von Helsinki: Registrierung erforderlich Vortrag 4: Planung der klinischen Prüfung Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Folie 39

Ethik-Antrag 1 zuständige Ethik-Kommission: ü Sammelt Bewertungen der beteiligten Ethik. Kommissionen zur Eignung der Prüfstellen und Prüfer (30 Tage) ü Jedes ehrenamtliche Mitglied erhält die volle Information (noch nicht elektronisch) ü Votiert zustimmend (60 Tage)

Tagesseminar: Klinische Prüfung und klinische Bewertung von Medizinprodukten Vortrag 4 Planung der klinischen Prüfung Dieser Vortrag wurde erarbeitet von Prof. Dr. Andreas Ziegler Direktor des Instituts für Medizinische Biometrie und Statistik Universität zu Lübeck E-Mail: ziegler@imbs. uni-luebeck. de TMF – Technologie- und Methodenplattform für die vernetzte medizinische Forschung e. V. Neustädtische Kirchstraße 6 10117 Berlin Tel. : +49 (30) 31 01 19 50 info@tmf-ev. de Fax: +49 (03) 31 01 19 99 www. tmf-ev. de Die Erstellung des Curriculums, der Vorträge und der Schulungsunterlagen für das Tagesseminar "Klinische Prüfung und klinische Bewertung von Medizinprodukten" wurde von der TMF im Rahmen des Projekts V 075 -01 gefördert. Die Projektergebnisse werden nach Abschluss des Projekts ab Mitte Juli auf der TMF-Website zum freien Download verfügbar gemacht (www. tmf-ev. de> Rubrik "Produkte und Services"). Die TMF dankt der TMF-Arbeitsgruppe "Medizintechnik" und ihrem Sprecher Dr. Raimund Milnder, Uni. Transfer. Klink Lübeck Gmb. H, für die Initiierung und allen Projektmitgliedern für die Durchführung des Projekts: Prof. D. Horst Frankenberger (Lübeck), Dr. Steffen P. Luntz (Heidelberg), Anja Malenke (Lübeck), Annika Ranke (Lübeck), Dr. Reinhard Vonthein (Lübeck), Prof. Dr. Andreas Ziegler (Lübeck).

Nutzungsbedingungen Lizenzbedingung und Copyright für Arbeitsmaterialien der TMF: Dieses Werk ist einschließlich aller seiner Teile urheberrechtlich geschützt. Die Rechte liegen, sofern nicht anders angegeben, bei der TMF. Eine Gewähr für die Richtigkeit der Inhalte kann die TMF nicht übernehmen. Eine Vervielfältigung und Weiterleitung ist ausschließlich innerhalb Ihrer Organisation oder Firma sowie der TMF-Mitgliedschaft erlaubt, sofern keine anders lautende Vereinbarung mit der TMF besteht. Aus Gründen der Qualitätssicherung und der Transparenz bzgl. Verbreitung und Nutzung der TMF-Ergebnisse erfolgt die weitergehende Verbreitung ausschließlich über die TMF-Website oder die Geschäftsstelle der TMF. Dieses Werk wurde als Arbeitsmaterial konzipiert, weshalb Änderungen an Ausdrucken sowie an umbenannten Kopien der Originaldatei vorgenommen werden können, sofern diese angemessen gekennzeichnet werden, um eine Verwechslung mit dem Originaldokument auszuschließen. Die Nutzungsbedingungen sowie das TMF-Logo dürfen aus den geänderten Kopien entfernt werden. Die TMF empfiehlt, als Referenz stets das gedruckte Originaldokument oder die schreibgeschützte Originaldatei vorzuhalten. Auch die Vervielfältigung und Weiterleitung geänderter Versionen ist ausschließlich innerhalb Ihrer Organisation oder Firma sowie der TMF-Mitgliedschaft erlaubt, sofern keine anders lautende Vereinbarung mit der TMF besteht. Sofern geänderte Kopien oder mit Hilfe dieses Werks von Ihnen erstellten Dokumente in der Praxis zum Einsatz kommen, sollen diese per Email an die TMF Geschäftsstelle (info@tmf-ev. de) gesandt werden, sofern dem nicht gesetzliche oder vertragliche Regelungen (auch gegenüber Dritten) entgegenstehen. Diese zugesandten Dokumente werden von der TMF ausschließlich zum Zweck der Weiterentwicklung und Verbesserung der TMF-Ergebnisse genutzt und nicht publiziert.
 Sukzessivplanung
Sukzessivplanung Vortrag grundschule kriterien
Vortrag grundschule kriterien Bibb
Bibb Vortrag zusammenarbeit
Vortrag zusammenarbeit Planung enterprise service bus
Planung enterprise service bus Baugrundvereisung erfolgreich bei
Baugrundvereisung erfolgreich bei Schlittenfahren novak unterricht
Schlittenfahren novak unterricht Planung und analyse
Planung und analyse Klinische chemie
Klinische chemie Struma
Struma Urineweginfectie bij ouderen
Urineweginfectie bij ouderen Rasterzeugnis klinische psychologie
Rasterzeugnis klinische psychologie Klinische les palliatieve zorg
Klinische les palliatieve zorg Klinische diagnostik psychologie
Klinische diagnostik psychologie Klinische audits
Klinische audits Gegenstand der psychologie beispiel
Gegenstand der psychologie beispiel Erste tag der woche
Erste tag der woche Der seele heimat ist der sinn
Der seele heimat ist der sinn Der daumen pflückt die pflaumen
Der daumen pflückt die pflaumen At eternity's gate painting
At eternity's gate painting Steuerung der atmung
Steuerung der atmung Ezekiel 25 17 der pfad der gerechten
Ezekiel 25 17 der pfad der gerechten Grnder
Grnder Der skorpion und der frosch
Der skorpion und der frosch Teile einer burg im mittelalter
Teile einer burg im mittelalter Gott der stadt
Gott der stadt Scratch
Scratch Erikson stufenmodell
Erikson stufenmodell Elektrochemisches gleichgewicht
Elektrochemisches gleichgewicht Bernd schürmann berlin
Bernd schürmann berlin Forze di london
Forze di london Van der graaf generator fysica
Van der graaf generator fysica Herbsttag rainer maria rilke analyse
Herbsttag rainer maria rilke analyse Gründung der hj
Gründung der hj Dsd 1
Dsd 1 Gefahren an der einsatzstelle
Gefahren an der einsatzstelle Maß der zentralen tendenz
Maß der zentralen tendenz Suzanne van der woude
Suzanne van der woude Heinrich heine nachtgedanken
Heinrich heine nachtgedanken Inhaltsangabe ronja räubertochter
Inhaltsangabe ronja räubertochter Slawische sprachen
Slawische sprachen Reflexivsatz
Reflexivsatz Peter and the wolf instrument matching
Peter and the wolf instrument matching