Universit degli Studi di Perugia Corso di Laurea


















- Slides: 46

Università degli Studi di Perugia Corso di Laurea in Medicina e Chirurgia Corso di Chimica e Biochimica I Modulo di Chimica Generale e Chimica Organica STATO LIQUIDO Pier Luigi Orvietani Dipartimento di Medicina Sperimentale - Sezione di Biochimica Email: pier. orvietani@unipg. it A. A: 2017 -2018

uno stato intermedio fra lo stato solido e lo stato gassoso nello stato liquido, tra le molecole animate da moto caotico agiscono forze attrattive di entità sufficiente a non consentirne la separazione, ma insufficiente a bloccare le molecole nelle posizioni fisse di un reticolo cristallino tipico di un solido le molecole di un liquido sono in continuo movimento reciproco, e, a differenza di quanto succede in un gas, scorrono le une sulle altre senza separarsi presentano un volume proprio, assumono la forma del recipiente che li contiene e sono praticamente incomprimibili esistono infine liquidi con una struttura cristallina così definita da essere indicati col nome di cristalli liquidi.


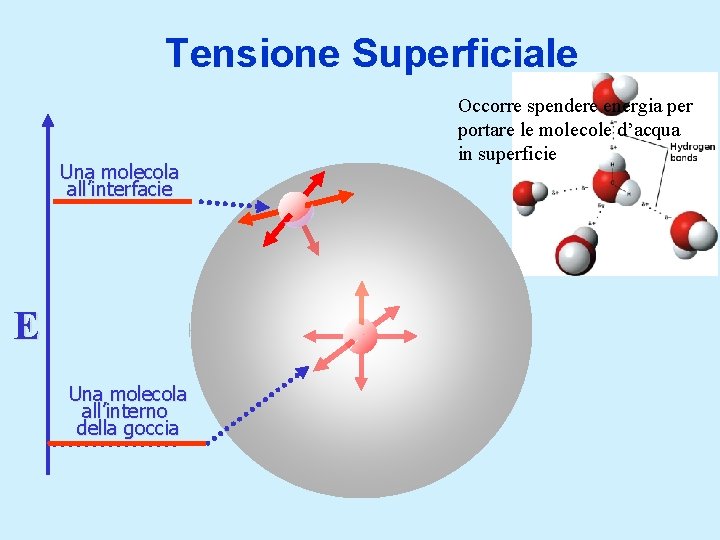
Tensione Superficiale

Tensione Superficiale Una molecola all’interfacie E Una molecola all’interno della goccia Occorre spendere energia per portare le molecole d’acqua in superficie

Tensione Superficiale Energia specifica superficiale Il lavoro che occorre compiere per aumentare di 1 cm 2 la superficie di una massa liquida L/S erg/cm 2

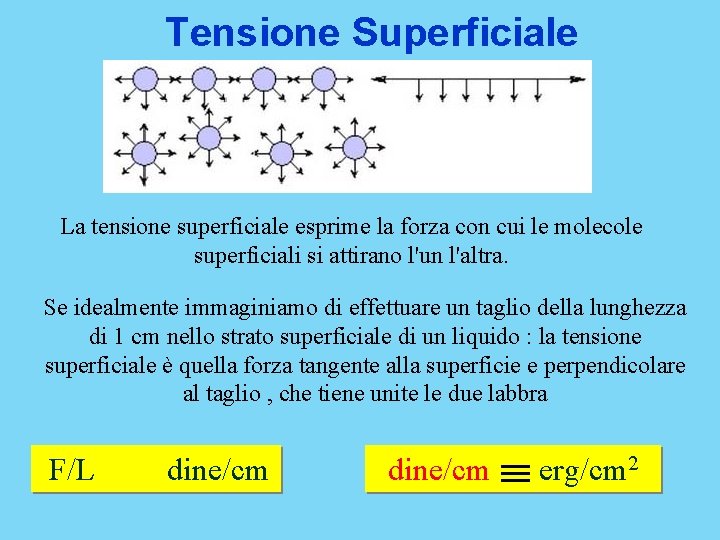
Tensione Superficiale La tensione superficiale esprime la forza con cui le molecole superficiali si attirano l'un l'altra. Se idealmente immaginiamo di effettuare un taglio della lunghezza di 1 cm nello strato superficiale di un liquido : la tensione superficiale è quella forza tangente alla superficie e perpendicolare al taglio , che tiene unite le due labbra F/L dine/cm erg/cm 2

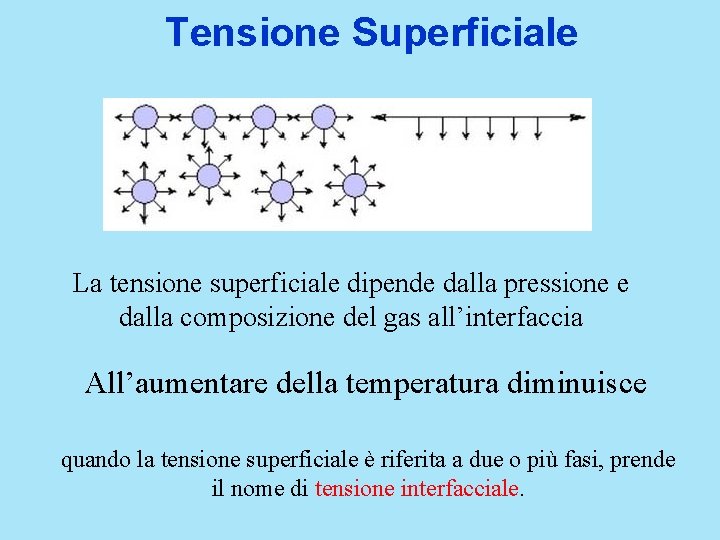
Tensione Superficiale La tensione superficiale dipende dalla pressione e dalla composizione del gas all’interfaccia All’aumentare della temperatura diminuisce quando la tensione superficiale è riferita a due o più fasi, prende il nome di tensione interfacciale.

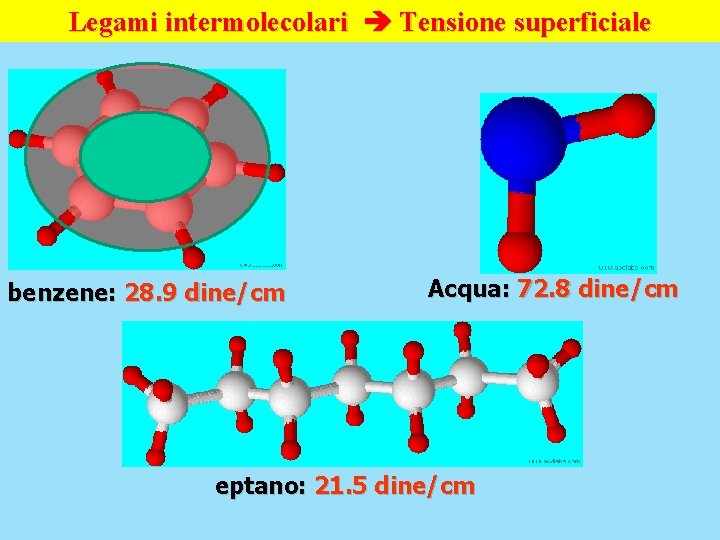
Legami intermolecolari Tensione superficiale benzene: 28. 9 dine/cm Acqua: 72. 8 dine/cm eptano: 21. 5 dine/cm

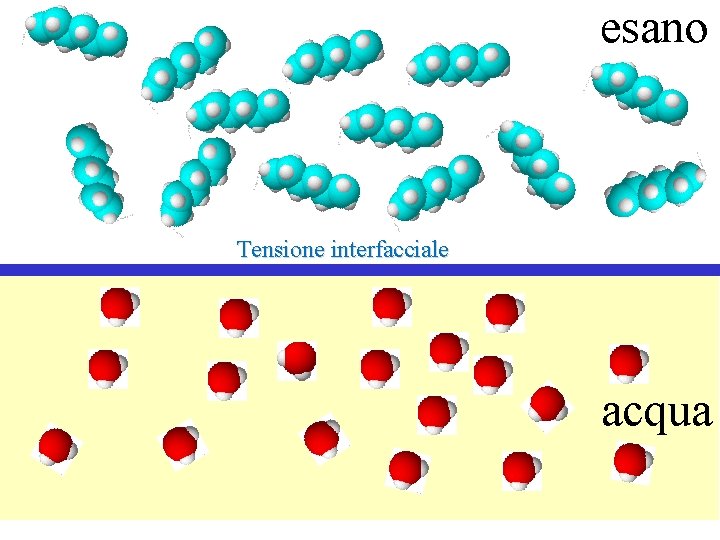
esano Tensione interfacciale acqua

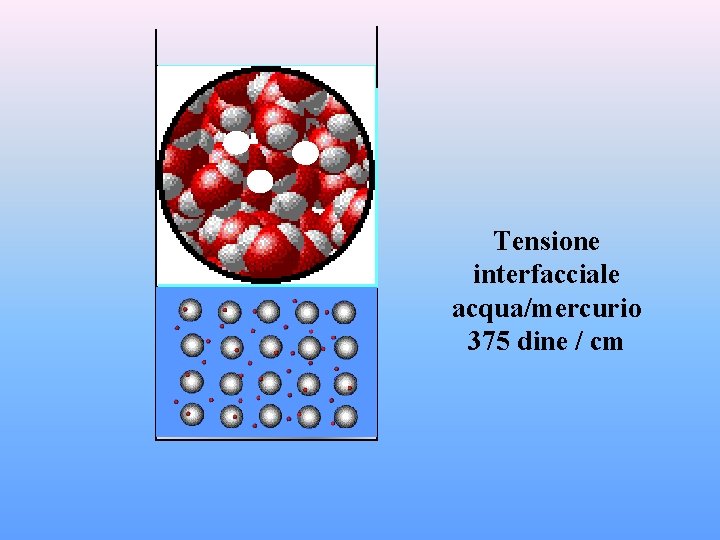
Hg Tensione interfacciale acqua/mercurio 375 dine / cm

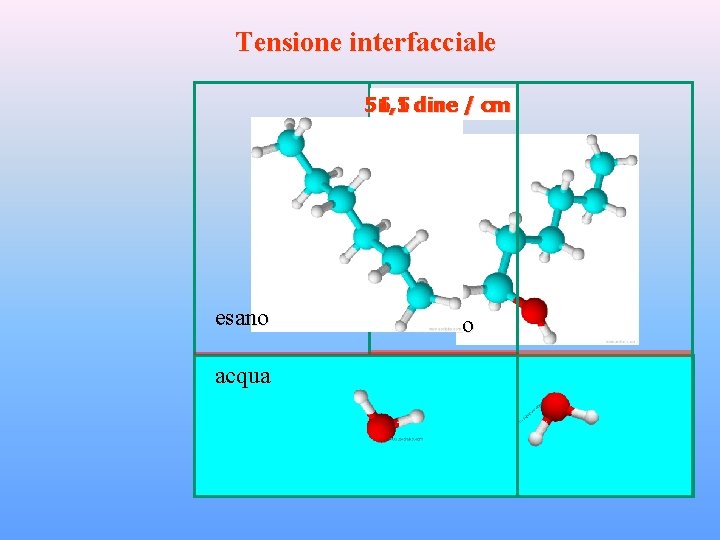
Tensione interfacciale 51, 1 6, 5 dine / cm esano 1 -esanolo acqua

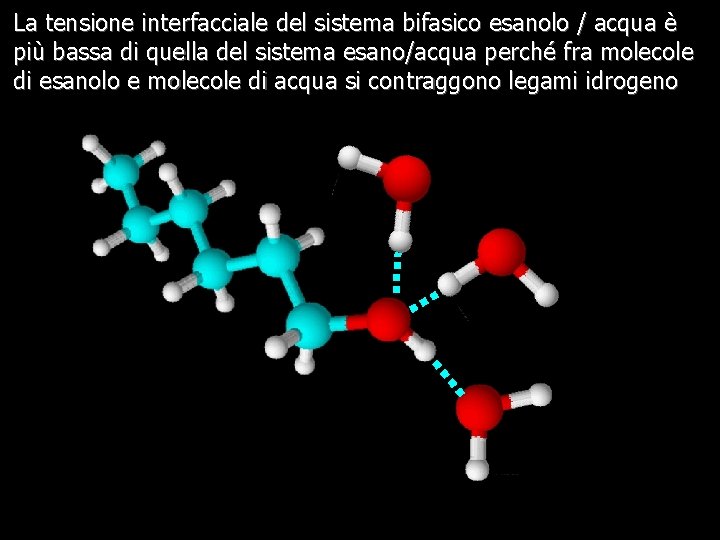
La tensione interfacciale del sistema bifasico esanolo / acqua è più bassa di quella del sistema esano/acqua perché fra molecole di esanolo e molecole di acqua si contraggono legami idrogeno

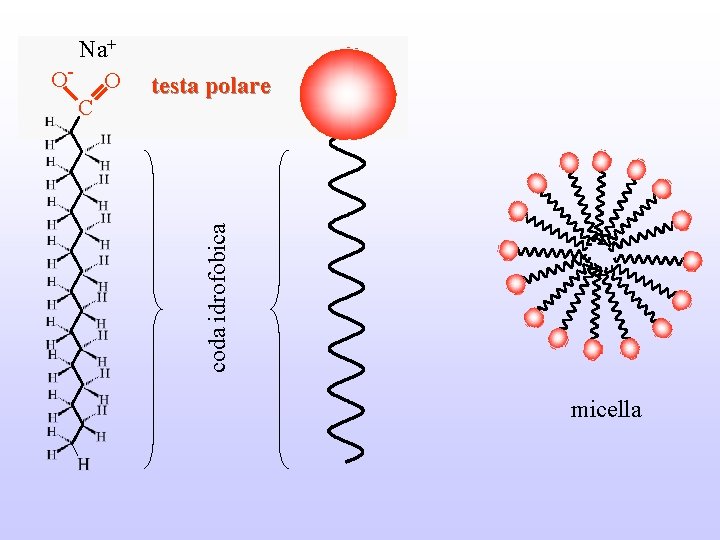
testa polare coda idrofobica Na+ O- O C micella

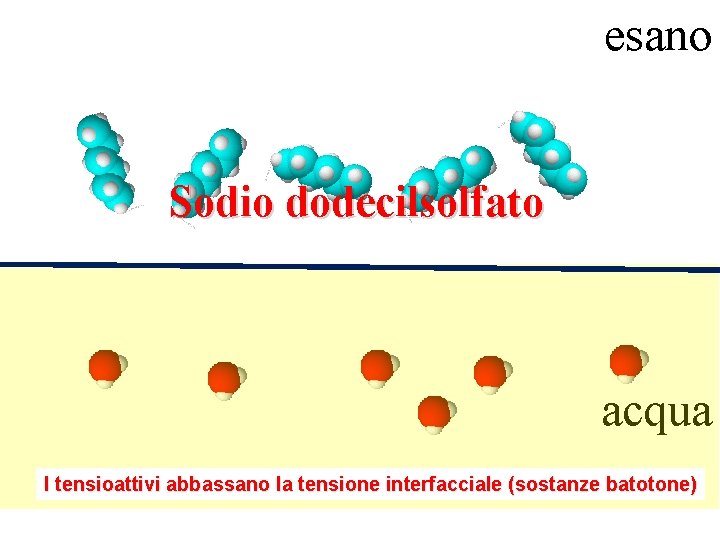
esano Sodio dodecilsolfato acqua I tensioattivi abbassano la tensione interfacciale (sostanze batotone)

TG I saponi portano i grassi in sospensione acquosa agendo da batotoni






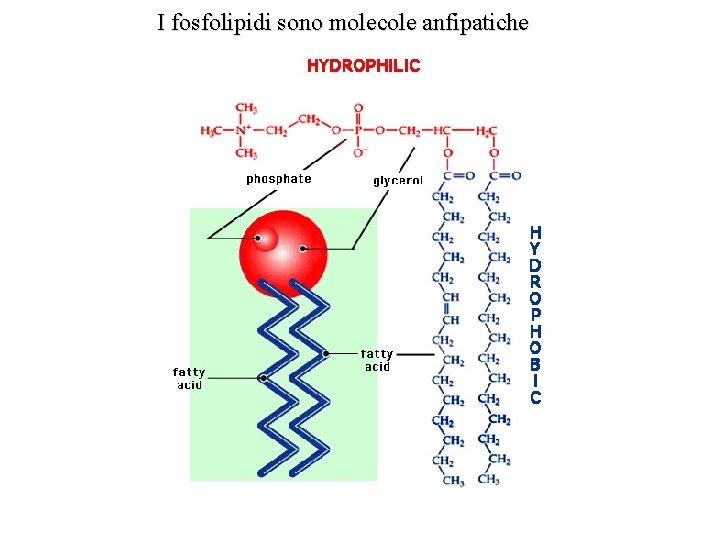
I fosfolipidi sono molecole anfipatiche

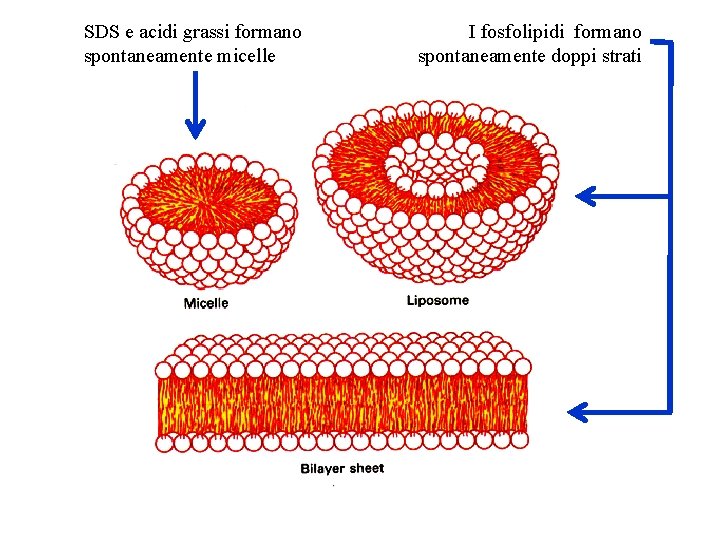
SDS e acidi grassi formano spontaneamente micelle I fosfolipidi formano spontaneamente doppi strati



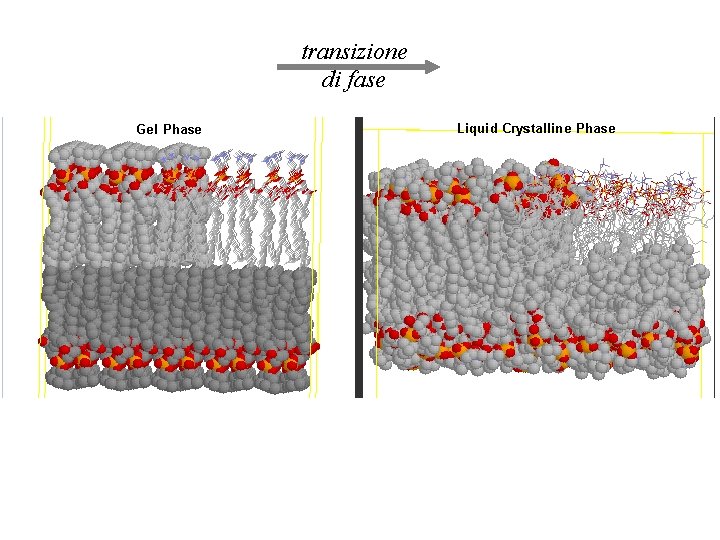
transizione di fase


Pressione di Vapore

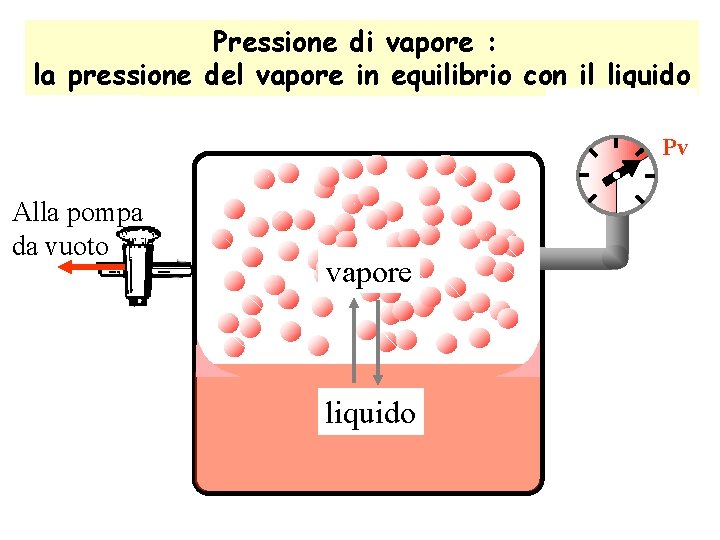
Pressione di vapore : la pressione del vapore in equilibrio con il liquido P=0 Pv Alla pompa da vuoto vapore liquido

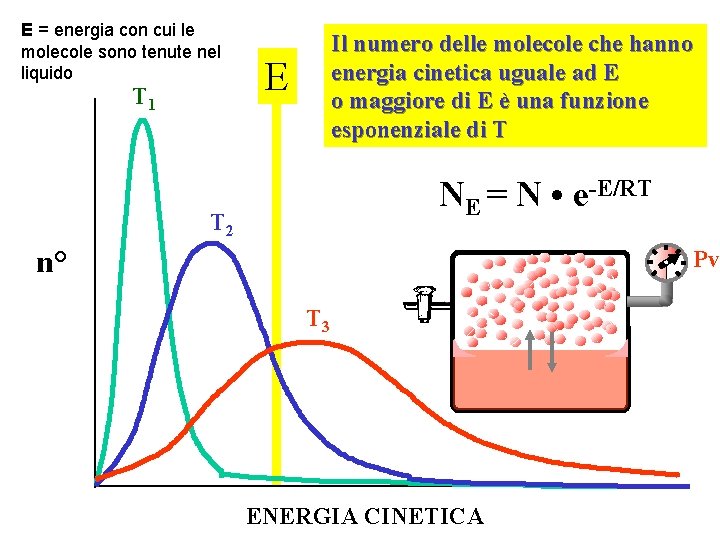
E = energia con cui le molecole sono tenute nel liquido T 1 Il numero delle molecole che hanno energia cinetica uguale ad E o maggiore di E è una funzione esponenziale di T E NE = N • e-E/RT T 2 n° Pv T 3 ENERGIA CINETICA

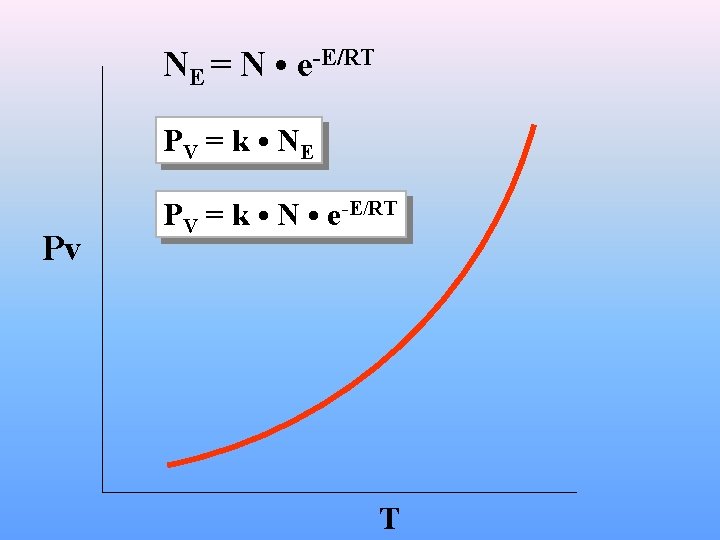
NE = N • e-E/RT PV = k • N E Pv PV = k • N • e-E/RT T


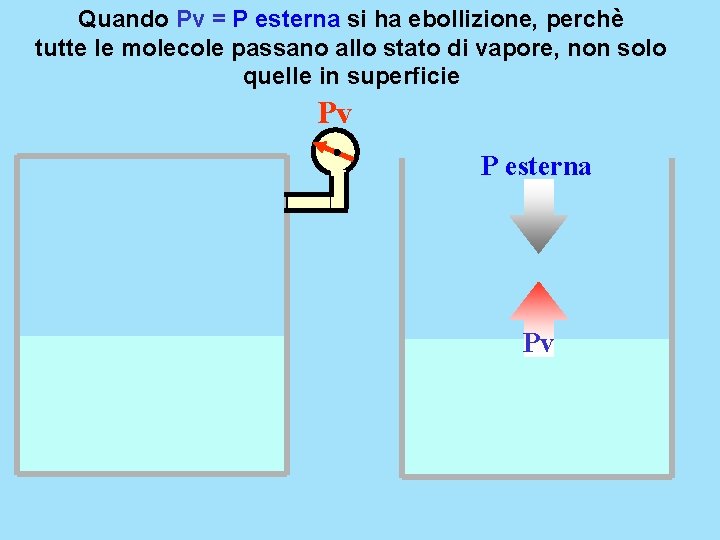
Quando Pv = P esterna si ha ebollizione, perchè tutte le molecole passano allo stato di vapore, non solo quelle in superficie Pv P esterna Pv

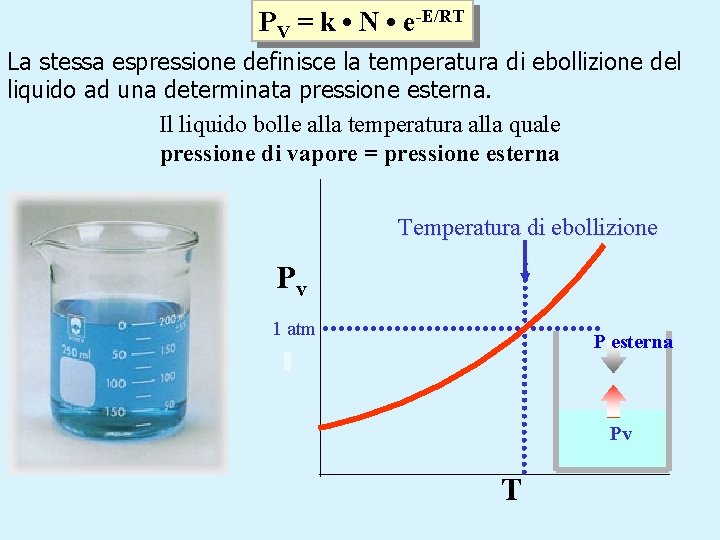
PV = k • N • e-E/RT La stessa espressione definisce la temperatura di ebollizione del liquido ad una determinata pressione esterna. Il liquido bolle alla temperatura alla quale pressione di vapore = pressione esterna Temperatura di ebollizione Pv 1 atm P esterna Pv T

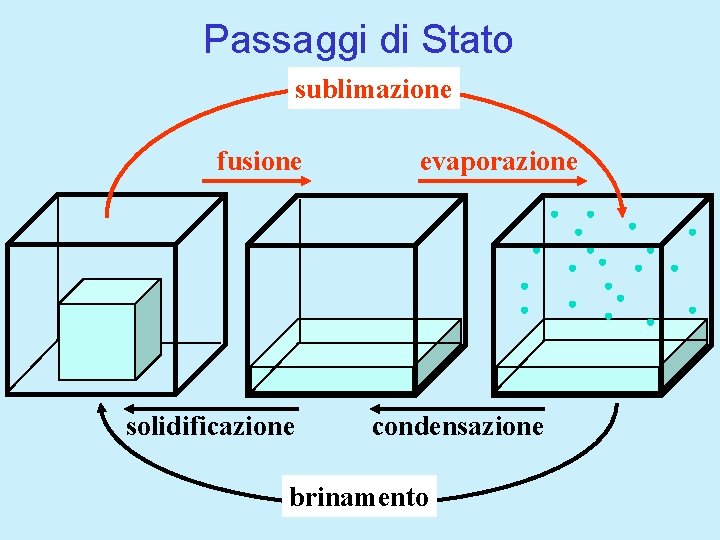
Passaggi di Stato sublimazione fusione solidificazione evaporazione condensazione brinamento

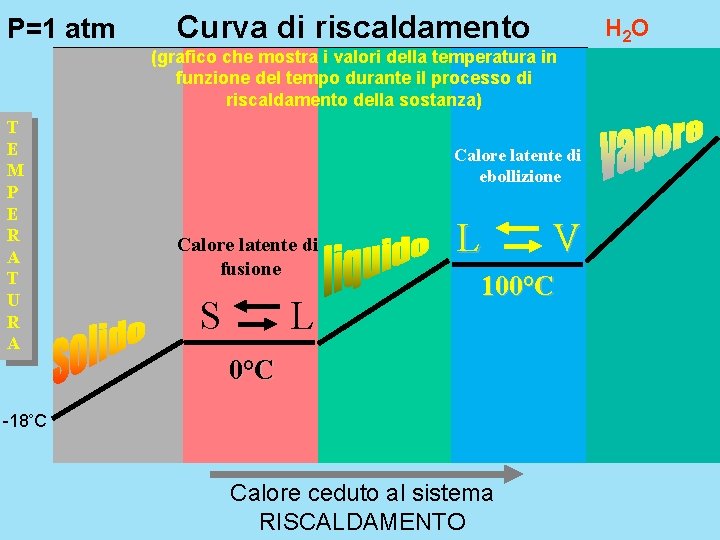
P=1 atm Curva di riscaldamento H 2 O (grafico che mostra i valori della temperatura in funzione del tempo durante il processo di riscaldamento della sostanza) T E M P E R A T U R A Calore latente di ebollizione Calore latente di fusione S L L V 100°C -18 C Calore ceduto al sistema RISCALDAMENTO

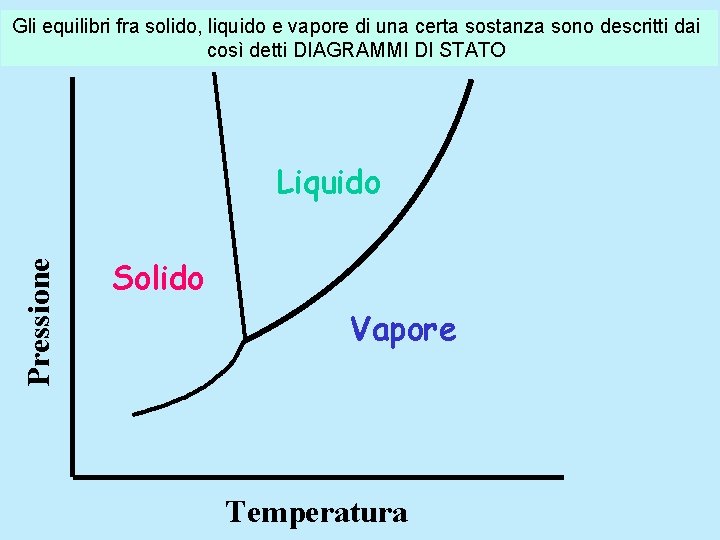
Gli equilibri fra solido, liquido e vapore di una certa sostanza sono descritti dai così detti DIAGRAMMI DI STATO Pressione Liquido Solido Vapore Temperatura

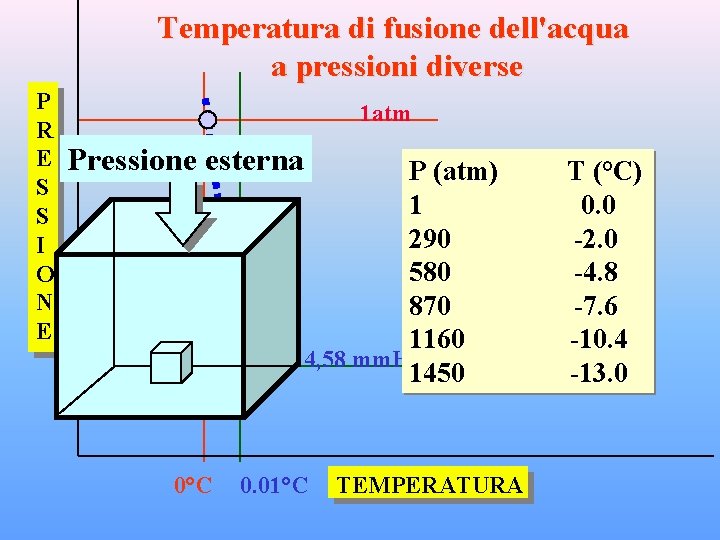
Temperatura di fusione dell'acqua a pressioni diverse Pressione esterna P (atm) 1 290 580 870 1160 1450 T (°C) 0. 0 -2. 0 -4. 8 -7. 6 -10. 4 -13. 0

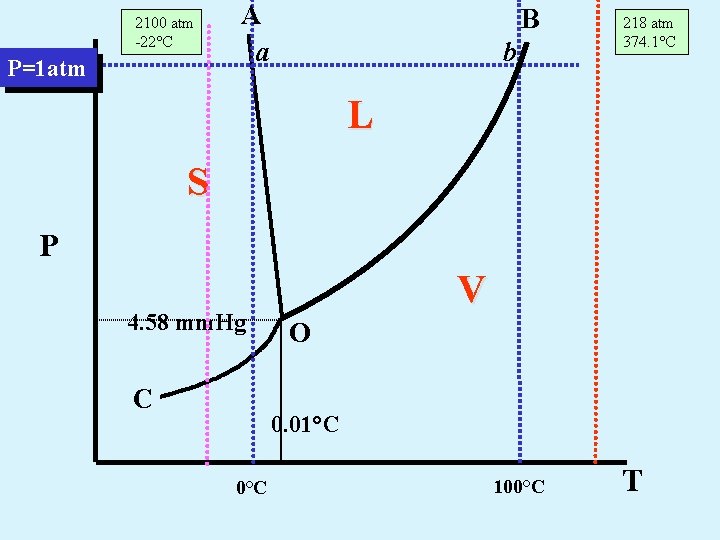
Temperatura di fusione dell'acqua a pressioni diverse P R E S S I O N E 1 atm Pressione esterna P (atm) 1 290 580 870 1160 4, 58 mm. Hg 1450 0°C 0. 01°C TEMPERATURA T (°C) 0. 0 -2. 0 -4. 8 -7. 6 -10. 4 -13. 0

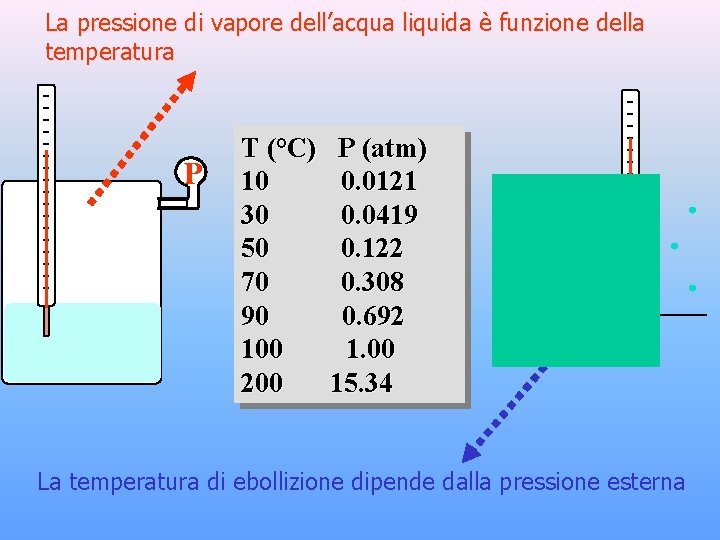
La pressione di vapore dell’acqua liquida è funzione della temperatura P T (°C) 10 30 50 70 90 100 200 P (atm) 0. 0121 0. 0419 0. 122 0. 308 0. 692 1. 00 15. 34 La temperatura di ebollizione dipende dalla pressione esterna

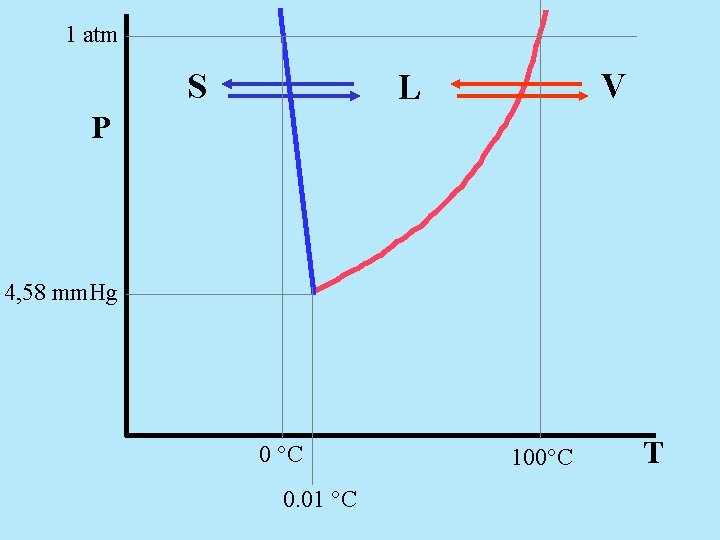
1 atm S V L P 4, 58 mm. Hg 0 °C 0. 01 °C 100°C T

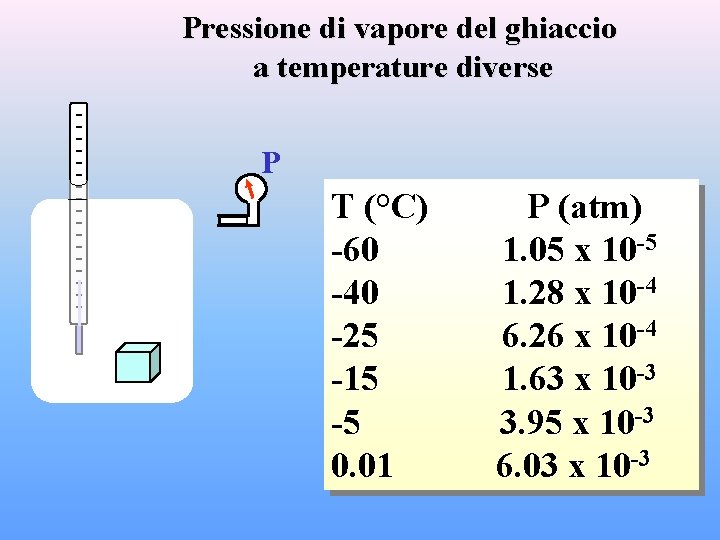
Pressione di vapore del ghiaccio a temperature diverse P T (°C) -60 -40 -25 -15 -5 0. 01 P (atm) 1. 05 x 10 -5 1. 28 x 10 -4 6. 26 x 10 -4 1. 63 x 10 -3 3. 95 x 10 -3 6. 03 x 10 -3

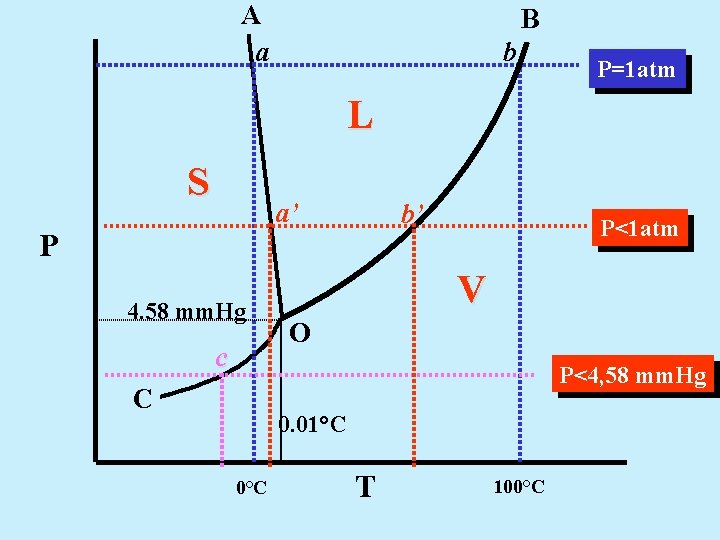
A a B b P=1 atm L S a’ P 4. 58 mm. Hg c b’ P<1 atm V O P<4, 58 mm. Hg C 0. 01°C 0°C T 100°C

2100 atm -22°C P=1 atm A a B b 218 atm 374. 1°C L S P 4. 58 mm. Hg C V O 0. 01°C 0°C 100°C T

*Ad una temperatura inferiore alla temperatura critica l’areiforme viene chiamato vapore e può essere trasformato in liquido per sola compressione. *Per valori superiori di temperatura, la stessa sostanza si chiama gas e non può essere trasformata in liquido per sola compressione.

Viscosità La viscosità di un fluido è una misura della resistenza che, all’interno del fluido stesso, gli strati adiacenti oppongono allo scorrimento reciproco Per una corretta interpretazione di questo fenomeno, si deve ammettere che il movimento del fluido all'interno, per esempio, di un condotto cilindrico, sia dovuto al movimento di strati lamellari concentrici Fluido con viscosità minore Fluido con viscosità maggiore
 Presidente corso di laurea
Presidente corso di laurea Language learning with youtube
Language learning with youtube Erasmus university rotterdam economics
Erasmus university rotterdam economics London universit
London universit Scuio ip nanterre
Scuio ip nanterre Universit
Universit Universit sherbrooke
Universit sherbrooke Erasmus traineeship unige
Erasmus traineeship unige Napoli
Napoli Kiro unipv giurisprudenza
Kiro unipv giurisprudenza Università degli studi di firenze psicologia
Università degli studi di firenze psicologia Università degli studi roma tre mascotte
Università degli studi roma tre mascotte Enpam riscatto laurea
Enpam riscatto laurea Erkki saari
Erkki saari Hyria wilma
Hyria wilma Cruciverba laurea esempio
Cruciverba laurea esempio Laurea finna
Laurea finna Toimintaterapeutti polkuopinnot
Toimintaterapeutti polkuopinnot L-39 laurea
L-39 laurea Laurea specialistica informatica
Laurea specialistica informatica Base laurea
Base laurea Unito domanda laurea
Unito domanda laurea Tiina ranta laurea
Tiina ranta laurea Paraortico
Paraortico Laurea finna
Laurea finna Laurea magistrale editoria e giornalismo
Laurea magistrale editoria e giornalismo Pakki laurea
Pakki laurea Laurea specialistica informatica
Laurea specialistica informatica Calcolo voto laurea unisalento
Calcolo voto laurea unisalento Icperugia13
Icperugia13 Dimisem perugia
Dimisem perugia Icpg11
Icpg11 Ecampus perugia
Ecampus perugia Aldo capitini perugia
Aldo capitini perugia Istituto comprensivo perugia 15
Istituto comprensivo perugia 15 Itis a volta perugia
Itis a volta perugia Scuola media pascoli perugia
Scuola media pascoli perugia Dipartimento medicina perugia
Dipartimento medicina perugia Liceo galileo galilei perugia
Liceo galileo galilei perugia Ic pg 6
Ic pg 6 Corso toscana 108
Corso toscana 108 Corso icq
Corso icq Corso di sociologia bagnasco barbagli cavalli
Corso di sociologia bagnasco barbagli cavalli Corso trattori agricoli ppt
Corso trattori agricoli ppt Slide corso trattori agricoli
Slide corso trattori agricoli Slide corso rspp datore di lavoro rischio basso
Slide corso rspp datore di lavoro rischio basso Corso somministratori cils
Corso somministratori cils