Unidad 5 Reacciones de oxidacinreduccin 1 Reacciones de
















- Slides: 25

Unidad 5 Reacciones de oxidaciónreducción

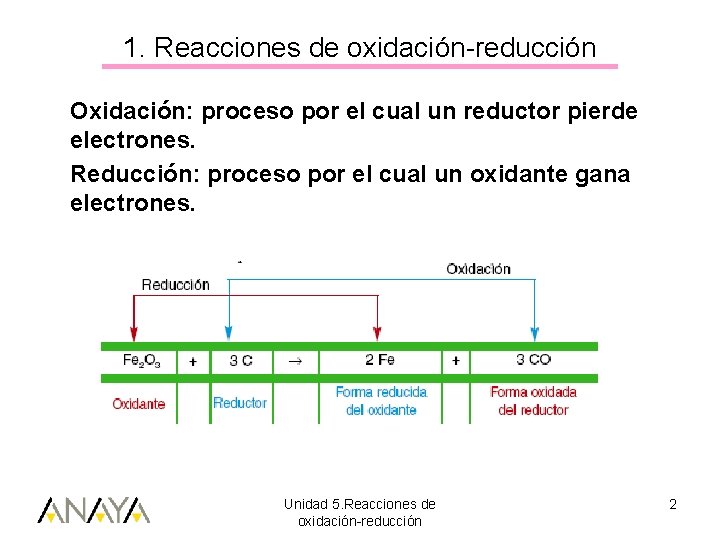
1. Reacciones de oxidación-reducción Oxidación: proceso por el cual un reductor pierde electrones. Reducción: proceso por el cual un oxidante gana electrones. Unidad 5. Reacciones de oxidación-reducción 2

2. Número de oxidación: número de cargas eléctricas que tendría un átomo de un compuesto si se asignasen los electrones del enlace al átomo más electronegativo. Unidad 5. Reacciones de oxidación- 3

3. Ajuste de ecuaciones redox. Método del ion-electrón Unidad 5. Reacciones de oxidación-reducción 4

3. Ajuste de ecuaciones redox. Método del ion-electrón Unidad 5. Reacciones de oxidación-reducción 5

3. Ajuste de ecuaciones redox. Método del ion-electrón Unidad 5. Reacciones de oxidación-reducción 6

3. Ajuste de ecuaciones redox. Método del ion-electrón Unidad 5. Reacciones de oxidación-reducción 7

3. Ajuste de ecuaciones redox. Método del ion-electrón Unidad 5. Reacciones de oxidación-reducción 8

3. Ajuste de ecuaciones redox. Método del ion-electrón Unidad 5. Reacciones de oxidación-reducción 9

3. Ajuste de ecuaciones redox. Método del ion-electrón Unidad 5. Reacciones de oxidación-reducción 10

4. Estequiometría de los procesos redox 4. 1 Tipos de procesos redox • Combinación: S + O 2 → SO 2 • Descomposición: 2 Hg. O → 2 Hg + O 2 • Desplazamiento: Cl 2 + 2 Na. Br → 2 Na. Cl + Br 2 • Dismutación: Br 2 + Na. OH → Na. Br + Na. Br. O 3 + H 2 O Unidad 5. Reacciones de oxidación-reducción 11

4. Estequiometría de los procesos redox 4. 2 Valoraciones • Masa equivalente: masa de una sustancia que reacciona o produce un mol de eeq(gramos)= Mm/ nº e • En valoraciones tendremos en cuenta que nº eq oxidante= nº eq reductor 2 Hg. O → 2 Hg + O 2 • Indicadores redox: sustancias que detectan el cambio del potencial de disolución • En general ajustaremos la reacción y realizaremos los cálculos estequiométricos pertinentes Unidad 5. Reacciones de oxidación-reducción 12

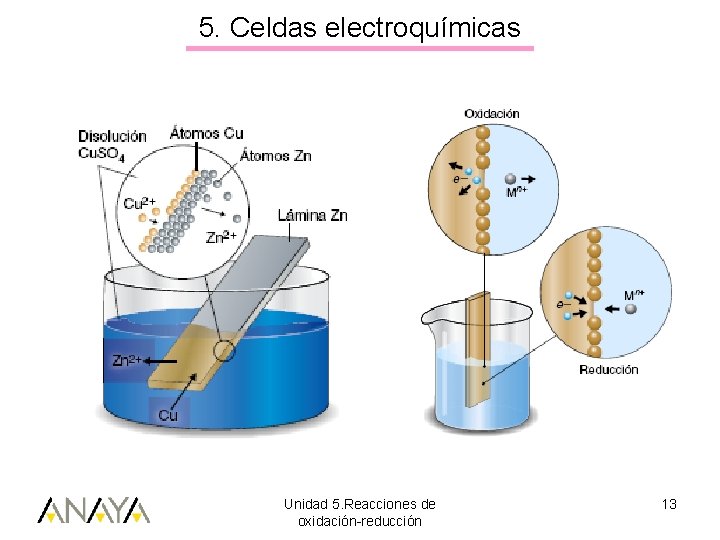
5. Celdas electroquímicas Unidad 5. Reacciones de oxidación-reducción 13

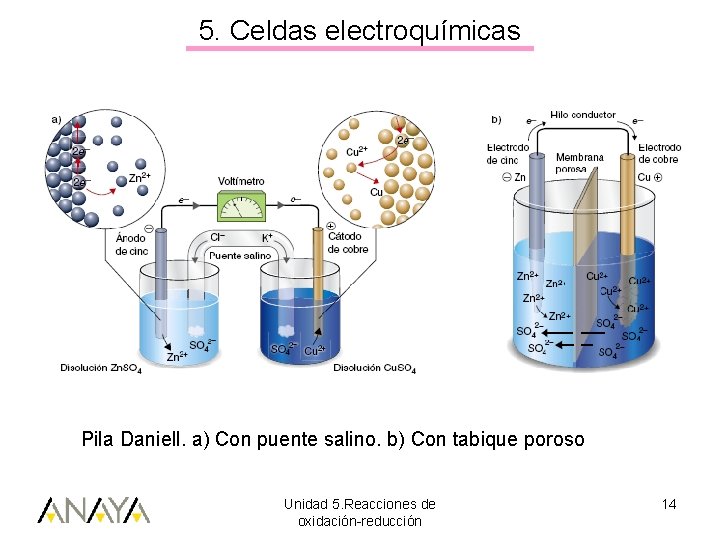
5. Celdas electroquímicas Pila Daniell. a) Con puente salino. b) Con tabique poroso Unidad 5. Reacciones de oxidación-reducción 14

5. Celdas electroquímicas 5. 1 Definición: Permite obtener corriente eléctrica a partir de redox espontánea 5. 2 Partes de una celda • Electrodos ánodo oxidación – cátodo reducción + • Hilo conductor • Sistema que separa las celdas: Tabique poroso o puente salino Permite obtener corriente eléctrica a partir de redox espontánea Unidad 5. Reacciones de oxidación-reducción 15

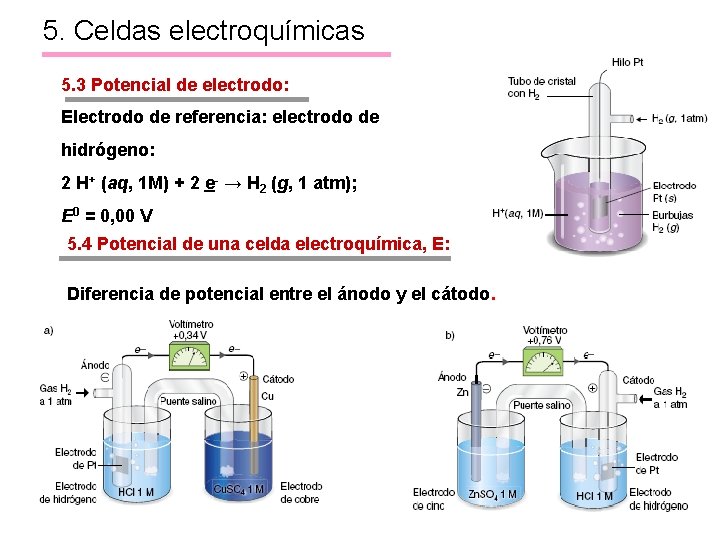
5. Celdas electroquímicas 5. 3 Potencial de electrodo: Electrodo de referencia: electrodo de hidrógeno: 2 H+ (aq, 1 M) + 2 e- → H 2 (g, 1 atm); E 0 = 0, 00 V 5. 4 Potencial de una celda electroquímica, E: Diferencia de potencial entre el ánodo y el cátodo. 16

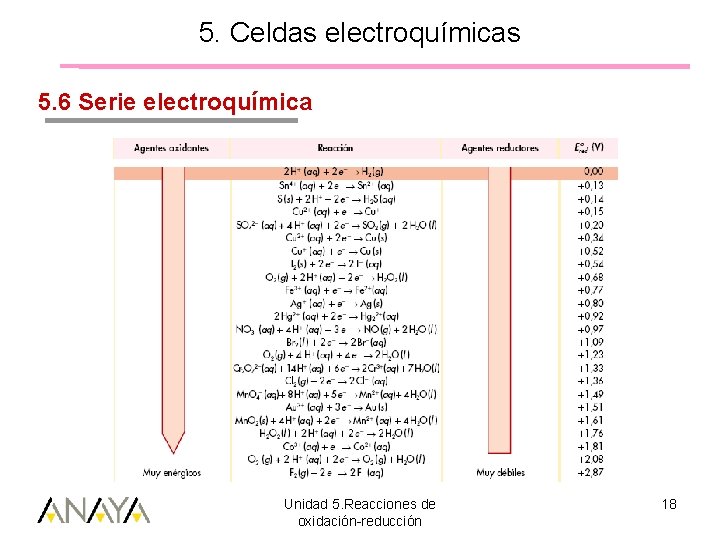
5. Celdas electroquímicas 5. 6 Serie electroquímica Unidad 5. Reacciones de oxidación-reducción 17

5. Celdas electroquímicas 5. 6 Serie electroquímica Unidad 5. Reacciones de oxidación-reducción 18

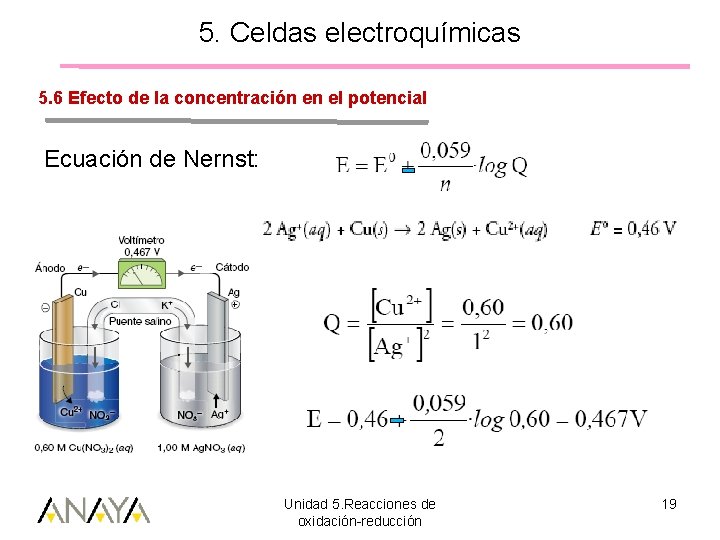
5. Celdas electroquímicas 5. 6 Efecto de la concentración en el potencial Ecuación de Nernst: Unidad 5. Reacciones de oxidación-reducción 19

5. Celdas electroquímicas 5. 7 Espontaneidad de una reacción redox Una reacción es espontánea si su potencial es positivo �� G = - n · F · Ecelda Unidad 5. Reacciones de oxidación-reducción 20

6. Electrólisis 6. 1 Concepto: Se produce una reacción química a partir de energía eléctrica 6. 2 Diferencias con la pila Daniell: Unidad 5. Reacciones de oxidación-reducción 21

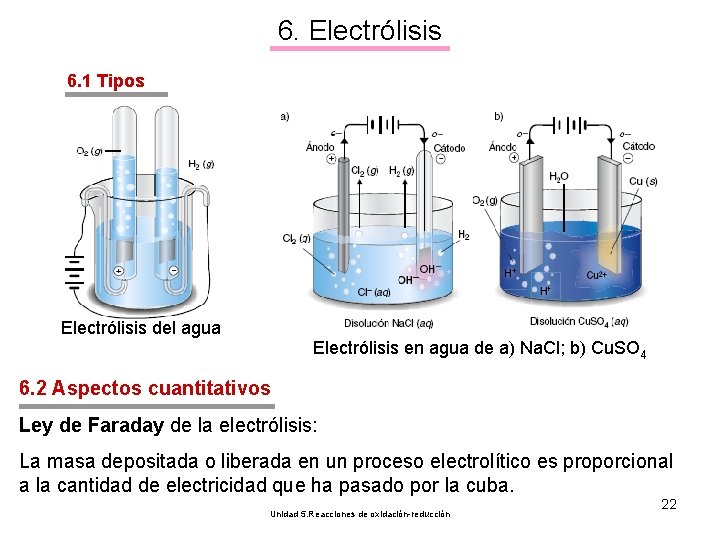
6. Electrólisis 6. 1 Tipos Electrólisis del agua Electrólisis en agua de a) Na. Cl; b) Cu. SO 4 6. 2 Aspectos cuantitativos Ley de Faraday de la electrólisis: La masa depositada o liberada en un proceso electrolítico es proporcional a la cantidad de electricidad que ha pasado por la cuba. Unidad 5. Reacciones de oxidación-reducción 22

6. Electrólisis 6. 2 Aspectos cuantitativos Ley de Faraday de la electrólisis: La masa depositada o liberada en un proceso electrolítico es proporcional a la cantidad de electricidad que ha pasado por la cuba. 1, 6022· 10 -19 C/e- x 6, 0022· 1023 e-/mol = 96485 C· /mol (carga de un mol de electrones= Faraday) Para una misma cantidad de electricidad que pase por varias cubas conectadas en serie, las masas depositadas o liberadas en los electrodos son proporcionales a sus respectivos equivalentes químicos, es decir que 1 F deposita o libera un equivalente de sustancia q=I·t q= cantidad de electricidad t= tiempo I= intensidad de corriente Unidad 5. Reacciones de oxidación-reducción 23

6. Electrólisis 6. 2 Aspectos cuantitativos Ley de Faraday de la electrólisis: El esquema del cálculo se puede resumir del siguiente modo I t q 1/F ne 1/z n metal Mm m metal En la reacción de reducción del ion Cu 2+: Cu 2+ (aq) +2 e- Cu(s) Se necesitan 2 mol de electrones para que se deposite 1 mol de átomos de Cu nmetal = ne/z La cantidad de electrones, ne que circula se puede determinar a partir de la carga eléctrica, Q y de la cte de Faraday, F, que es la carga por mol de electrones n e = q/F Y la carga eléctrica, q, se calcula a través de la intensidad de corriente (I) y el 24 tiempo(t) durante el cual circula. q = I·t

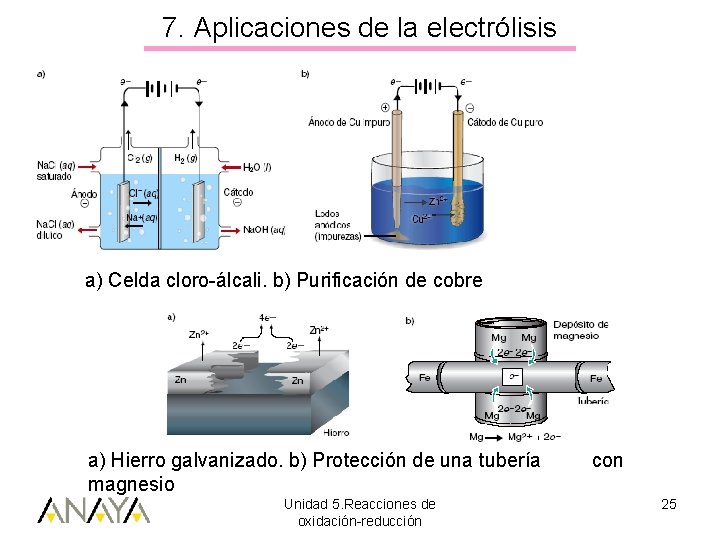
7. Aplicaciones de la electrólisis a) Celda cloro-álcali. b) Purificación de cobre a) Hierro galvanizado. b) Protección de una tubería magnesio Unidad 5. Reacciones de oxidación-reducción con 25
 Centenas
Centenas Reacciones oxido reduccion ejemplos
Reacciones oxido reduccion ejemplos Kc quimica
Kc quimica Tabla de potencial redox
Tabla de potencial redox Dalton gmez
Dalton gmez Aminas primarias ejemplos
Aminas primarias ejemplos Balanceo de ecuaciones quimicas
Balanceo de ecuaciones quimicas Reacciones supravitales
Reacciones supravitales Reacciones quimicas reversibles
Reacciones quimicas reversibles Doble sustitución ejemplos
Doble sustitución ejemplos Reacciones supravitales
Reacciones supravitales Descomposición química ejemplos
Descomposición química ejemplos Estado estacionario ejemplos
Estado estacionario ejemplos Reacciones de adicion electrofilica
Reacciones de adicion electrofilica Fisicia
Fisicia Exergónico
Exergónico Mol reacciones quimicas
Mol reacciones quimicas Reacciones quimicas
Reacciones quimicas Reacciones adversas a medicamentos antituberculosos
Reacciones adversas a medicamentos antituberculosos Ch3-ch-ch2-ch-ch3
Ch3-ch-ch2-ch-ch3 Mol reacciones quimicas
Mol reacciones quimicas Reacciones de hipersensibilidad
Reacciones de hipersensibilidad Calculos con reacciones quimicas
Calculos con reacciones quimicas Tipo de reacciones quimicas
Tipo de reacciones quimicas Ejemplos de reacciones irreversibles
Ejemplos de reacciones irreversibles Precipitacion reaccion quimica
Precipitacion reaccion quimica