TERMOKIMIA Kimia SMK KELAS XI SEMESTER 2 SMK




























- Slides: 32

TERMOKIMIA Kimia SMK KELAS XI SEMESTER 2 SMK MUHAMMADIYAH 3 METRO

SK DAN KD Standar Kompetensi v Menentukan perubahan entalpi berdasarkan konsep termokimia Kompetensi Dasar v Menjelaskan entalpi dan perubahan entalpi v Menentukan perubahan entalpi reaksi v Menentukan kalor pembakaran berbagai bahan bakar Hal. : 3 www. kimiaindah. wordpress. com Adaptif

TUJUAN PEMBELAJARAN 1. Siswa mampu mendefinisikan pengertian istilah- istilah dalam reaksi termokimia beserta contohnya 2. Siswa mampu menjelaskan pengertian entalpi suatu zat dan perubahannnya. 3. Siswa mampu menentukan ΔH reaksi berdasarkan hukum Hess, data perubahan entalpi pembentukan standar, eksperimen data energi ikatan Hal. : 3 www. kimiaindah. wordpress. com Adaptif

TERMOKIMIA v Mempelajari dinamika atau perubahan reaksi kimia dengan mengamati panasnya saja. v Sistem adalah sebagian dari alam semesta yang sedang kita pelajari, di luar sistem adalah lingkungan. Hal. : 3 www. kimiaindah. wordpress. com Adaptif

1. ENTALPI (H) DAN PERUBAHAN ENTALPI (ΔH) v. Nama lain dari entalpi adalah panas v. Panas reaksi pada tekanan tetap disebut perubahan entalpi dan reaksi dan diberikan dengan simbol ΔH. ΔH = H akhir – H mula Hal. : 3 www. kimiaindah. wordpress. com Adaptif

REAKSI EKSOTERM v Pada reaksi eksoterm terjadi perpindahan kalor dari sistem ke lingkungan atau pada reaksi tersebut dikeluarkan panas. v Pada reaksi eksoterm harga ΔH = negatif Contoh : C(s) + O(g) CO(g) + 393, 5 k. J ΔH = -393, 5 k. J Hal. : 3 www. kimiaindah. wordpress. com Adaptif

REAKSI ENDOTERM v Pada reaksi terjadi perpindahan kalor dari lingkungan ke sistem atau pada reaksi tersebut dibutuhkan panas. v Pada reaksi endoterm harga ΔH = positif Contoh : Ca. CO 3 (s) Ca. O (s) + CO 2 (g) -178, 5 KJ ΔH = +178, 5 KJ Hal. : 3 www. kimiaindah. wordpress. com Adaptif

3. PERUBAHAN ENTALPI STANDAR (ΔH 0) Perubahan entalpi reaksi diukur pada temperatur 298°K dan tekanan 1 atm disepakati sebagai entalpi standar, dinyatakan dengan simbol ΔH° Hal. : 3 www. kimiaindah. wordpress. com Adaptif

JENIS PERUBAHAN ENTALPI STANDAR 1. Perubahan Entalpi Pembentukan Standar (ΔHf ) (ΔHf = standar enthalpy of formation) v ΔH untuk membentuk 1 mol persenyawaan langsung dari unsurnya yang diukur pada 298 K dan tekanan 1 atm contoh : Hal. : 3 www. kimiaindah. wordpress. com Adaptif

2. Perubahan Entalpi Penguraian Standar (ΔHd)(ΔHd=standar enthalpy of decomposition) v ΔHd dari penguraian 1 mol persenyawaan langsung menjadi unsur-unsurnya (Kebalikan dari ΔH pembentukan) Contoh : Hal. : 3 www. kimiaindah. wordpress. com Adaptif

3. Perubahan Entalpi Pembakaran Standar ( ΔHc)(ΔHc = standar enthalpy Of combustion) v ΔH untuk membakar 1 mol persenyawaan dengan O 2 dari udara yang diukur pada 298 K dan tekanan 1 atm. Contoh : Hal. : 3 www. kimiaindah. wordpress. com Adaptif

4. ENTALPI REAKSI v ΔH dari suatu persamaan reaksi di mana zat-zat yang terdapat dalam persamaan reaksi dinyatakan dalam satuan mol dan koefisien persamaan reaksi bulat sederhana. Contoh : Hal. : 3 www. kimiaindah. wordpress. com Adaptif

5. ENTALPI NETRALISASI v ΔH yang dihasilkan (selalu eksoterm) pada reaksi penetralan asam atau basa. Contoh : Hal. : 3 www. kimiaindah. wordpress. com Adaptif

6. HUKUM LAVOISIER-LAPLACE "Jumlah kalor yang dilepaskan pada pembentukan 1 mol zat dari unsur-unsurnya sama dengan jumlah kalor yang diperlukan untuk menguraikan zat tersebut menjadi unsur-unsur pembentuknya. " Artinya : Apabila reaksi dibalik maka tanda kalor yang terbentuk juga dibalik dari positif menjadi negatif atau sebaliknya. Hal. : 3 www. kimiaindah. wordpress. com Adaptif

Contoh : Hal. : 3 www. kimiaindah. wordpress. com Adaptif

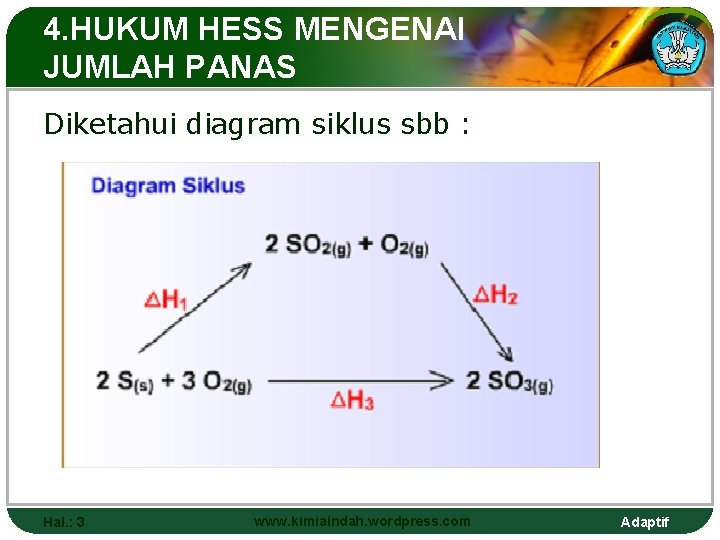
4. HUKUM HESS MENGENAI JUMLAH PANAS Diketahui diagram siklus sbb : Hal. : 3 www. kimiaindah. wordpress. com Adaptif

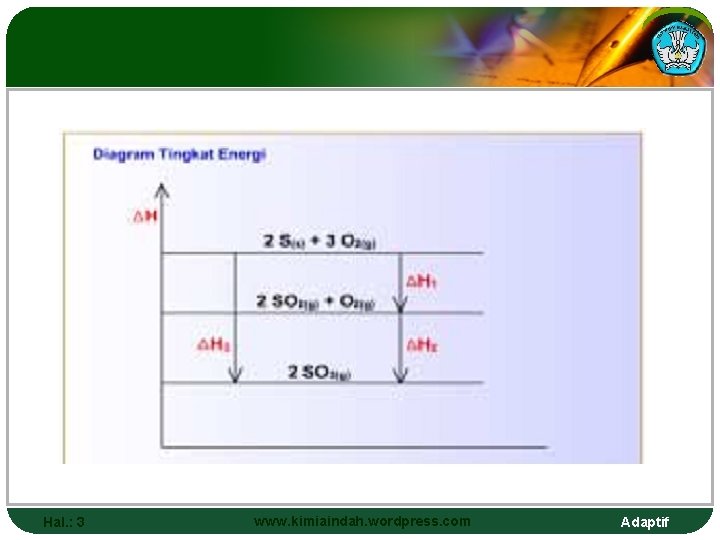
Maka reaksinya bisa digambarkan sbb : Hal. : 3 www. kimiaindah. wordpress. com Adaptif

Hal. : 3 www. kimiaindah. wordpress. com Adaptif

v Entalpi adalah fungsi keadaan, maka besaran ΔH dari reaksi kimia tak tergantung dari lintasan yang dijalani pereaksi untuk membentuk hasil reaksi. Hal. : 3 www. kimiaindah. wordpress. com Adaptif

TAHAP-TAHAP REAKSI Hal. : 3 www. kimiaindah. wordpress. com Adaptif

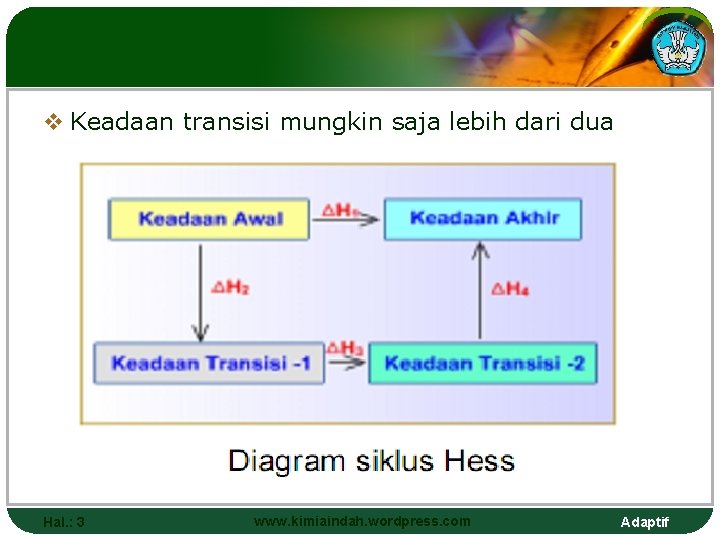
v Keadaan transisi mungkin saja lebih dari dua Hal. : 3 www. kimiaindah. wordpress. com Adaptif

CONTOH SOAL Buatlah diagram siklus dan diagram tingkat energinya! Hal. : 3 www. kimiaindah. wordpress. com Adaptif

Hal. : 3 www. kimiaindah. wordpress. com Adaptif

ENTALPI PEMBENTUKAN STANDAR Hal. : 3 www. kimiaindah. wordpress. com Adaptif

v Dalam mengerjakan perhitungan ini, kita anggap ΔH 0 f untuk setiap unsur pada keadaan murninya paling stabil pada suhu 250 C dan 1 atm = 0. Harga panas pembentukan standar untuk tiap elemen, ΔH 0 f = 0 Hal. : 3 www. kimiaindah. wordpress. com Adaptif

KAPASITAS PANAS DAN PANAS SPESIFIK v Kapasitas panas merupakan jumlah panas yang diperlukan untuk mengubah suhu temperatur suatu benda sebesar 10 C. v Panas spesifik merupakan jumlah panas yang diperlukan untuk menaikkan suhu 1 gram zat sebesar 10 C. v Contoh: panas spesifik (kalor jenis) air 4, 18 j/g 0 C, panas spesifik besi 0, 452 j/g 0 C Hal. : 3 www. kimiaindah. wordpress. com Adaptif

v. Rumus q = m. c. ΔT Keterangan q = jumlah kalor (joule) m = massa zat (gram) ΔT = perubahan suhu (takhir – tawal) c = kalor jenis Hal. : 3 www. kimiaindah. wordpress. com Adaptif

KALORIMETER v Kalorimeter adalah alat yang digunakan untuk mengukur panas reaksi Hal. : 3 www. kimiaindah. wordpress. com Adaptif

ENERGI IKATAN DAN ENTALPI REAKSI v Energi ikatan adalah energi yang diperlukan untuk memutuskan ikatan kimia dalam 1 mol senyawa Contoh : v Hitung energi ikatan jika entalpi pembentukan NH 3 adalah -46 k. J , energi ikatan H-H =436 k. J , energi ikatan N-H = 390 k. J , berapakah energi ikatan NΞN? Hal. : 3 www. kimiaindah. wordpress. com Adaptif

JAWAB Hal. : 3 www. kimiaindah. wordpress. com Adaptif

Hal. : 3 www. kimiaindah. wordpress. com Adaptif

Terimakasih Hal. : 3 www. kimiaindah. wordpress. com Adaptif
 Kedudukan garis terhadap garis lainnya
Kedudukan garis terhadap garis lainnya Materi bahasa inggris kelas 11 smk semester 1
Materi bahasa inggris kelas 11 smk semester 1 Fraksi mol
Fraksi mol Termokimia adalah cabang ilmu kimia yang mempelajari
Termokimia adalah cabang ilmu kimia yang mempelajari Contoh entalpi pengatoman standar
Contoh entalpi pengatoman standar Energi ikatan rata-rata
Energi ikatan rata-rata Apa yang dimaksud dengan termokimia
Apa yang dimaksud dengan termokimia Peta konsep perjalanan dinas
Peta konsep perjalanan dinas Turunan fungsi aljabar kelas 12 smk
Turunan fungsi aljabar kelas 12 smk Materi kas kecil kelas 12 smk
Materi kas kecil kelas 12 smk Sebatang baja berpenampang kecil yang panjangnya 20 meter
Sebatang baja berpenampang kecil yang panjangnya 20 meter Smk
Smk Kesimpulan aritmatika sosial
Kesimpulan aritmatika sosial Materi mice kelas 11 semester 2
Materi mice kelas 11 semester 2 Kunci jawaban aspirasi kelas 11 semester 2
Kunci jawaban aspirasi kelas 11 semester 2 Materi matematika kelas 11 semester 1
Materi matematika kelas 11 semester 1 Pengertian supremum dan infimum
Pengertian supremum dan infimum Materi desain grafis kelas 10 semester 2
Materi desain grafis kelas 10 semester 2 Kegiatan ekonomi kelas 7 semester 2
Kegiatan ekonomi kelas 7 semester 2 Materi agama katolik kelas 12 semester 1
Materi agama katolik kelas 12 semester 1 Materi segitiga smp kelas 7 semester 2
Materi segitiga smp kelas 7 semester 2 Materi fisika kelas xi semester 2
Materi fisika kelas xi semester 2 Bahan ajar geografi kelas xi semester 1
Bahan ajar geografi kelas xi semester 1 Aritmatika sosial kelas 7 kurikulum 2013
Aritmatika sosial kelas 7 kurikulum 2013 Peta konsep sosiologi kelas 11 semester 2
Peta konsep sosiologi kelas 11 semester 2 Tugas prakarya kelas 11
Tugas prakarya kelas 11 Materi tembang gambuh kelas 11 semester 2
Materi tembang gambuh kelas 11 semester 2 Tugas tik kelas 9 semester 2
Tugas tik kelas 9 semester 2 Jenis penilaian keterampilan
Jenis penilaian keterampilan Materi ips kelas 11
Materi ips kelas 11 Activity 2 identifying dialogues kelas 12
Activity 2 identifying dialogues kelas 12 Tugas tik kelas 9 semester 2
Tugas tik kelas 9 semester 2 Sudut luar bersebrangan
Sudut luar bersebrangan






















































