TEMA 9 REACTIVIDAD QUMICA Y REACCIONES ORGNICAS Una





- Slides: 18

TEMA 9 REACTIVIDAD QUÍMICA Y REACCIONES ORGÁNICAS

Una reacción orgánica consiste en la ruptura de ciertos enlaces en el sustrato y el reactivo y la formación de nuevos enlaces para formar los productos de la reacción, siendo: Sustrato: la molécula orgánica que se transforma Reactivo: pequeña molécula que promueve la transformación. La reactividad tanto del sustrato como del reactivo depende de la distribución electrónica de ambos: En el sustrato supeditado al efecto inductivo y al efecto mesómero En el reactivo dependiendo de su naturaleza nucleófila o electrófila

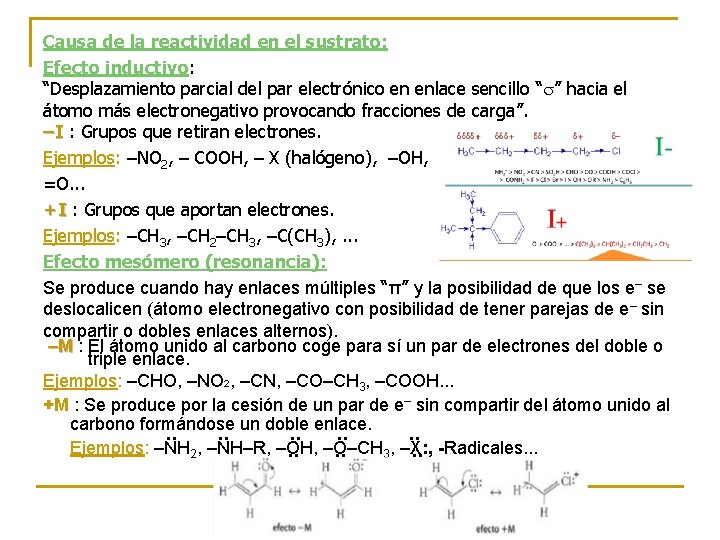
Causa de la reactividad en el sustrato: Efecto inductivo: “Desplazamiento parcial del par electrónico en enlace sencillo “ ” hacia el átomo más electronegativo provocando fracciones de carga”. –I : Grupos que retiran electrones. Ejemplos: –NO 2, – COOH, – X (halógeno), –OH, =O. . . +I : Grupos que aportan electrones. Ejemplos: –CH 3, –CH 2–CH 3, –C(CH 3), . . . Efecto mesómero (resonancia): Se produce cuando hay enlaces múltiples “π” y la posibilidad de que los e– se deslocalicen (átomo electronegativo con posibilidad de tener parejas de e– sin compartir o dobles enlaces alternos). –M : El átomo unido al carbono coge para sí un par de electrones del doble o triple enlace. Ejemplos: –CHO, –NO 2, –CN, –CO–CH 3, –COOH. . . +M : Se produce por la cesión de un par de e– sin compartir del átomo unido al carbono formándose un doble enlace. ·· , –NH–R, ·· ·· –O–CH ·· ·· -Radicales. . . Ejemplos: –NH –OH, , –X: , 2 3 ·· ·· ··

Causa de la reactividad en el reactivo: Se debe a la afinidad del reactivo por regiones del sustrato con densidades de carga + o – Según esto, podemos encontrar dos tipos de reactivos: n. Nucleófilos: (N-) q Atacan a partes de molécula con deficiencia de electrones. (+) q Suelen ser especies A-, con δ- , enlaces múltiples o pares e- sobrantes. X-, NH 3 , OH–, R–OH, R–O– , H 2 O, R–NH 2 , R – C N, R–COO– , n. Electrófilos: (E+) q Atacan a zonas con alta densidad electrónica (-) (enlaces π) q q Suelen ser especies C+, con δ+ u orbitales vacíos que admiten pares e- q H+ , NO 2+ , NO+ , R 3 C+ , X 2, HSO 3 +

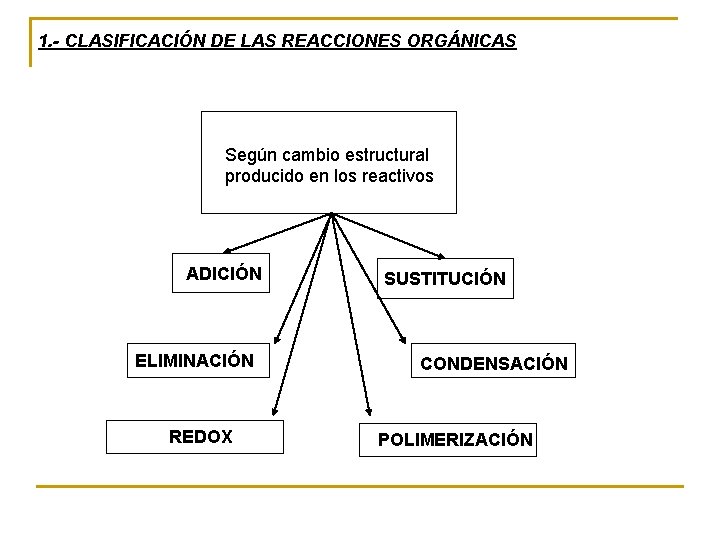
1. - CLASIFICACIÓN DE LAS REACCIONES ORGÁNICAS Según cambio estructural producido en los reactivos ADICIÓN ELIMINACIÓN REDOX SUSTITUCIÓN CONDENSACIÓN POLIMERIZACIÓN

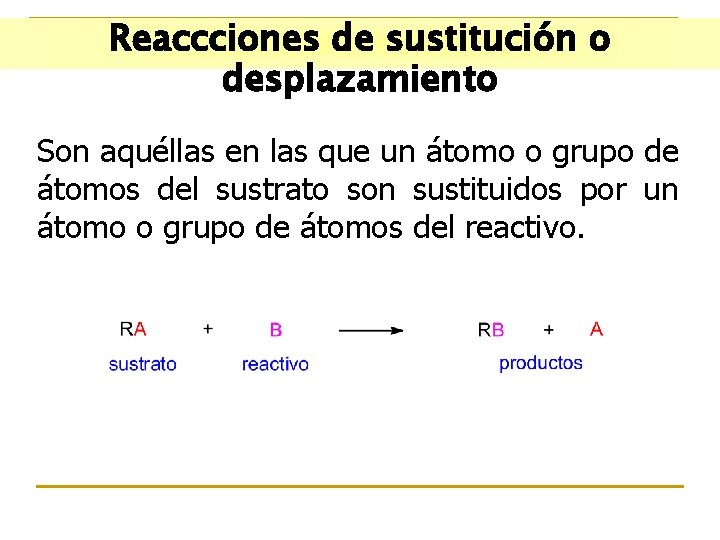
Reaccciones de sustitución o desplazamiento Son aquéllas en las que un átomo o grupo de átomos del sustrato son sustituidos por un átomo o grupo de átomos del reactivo.

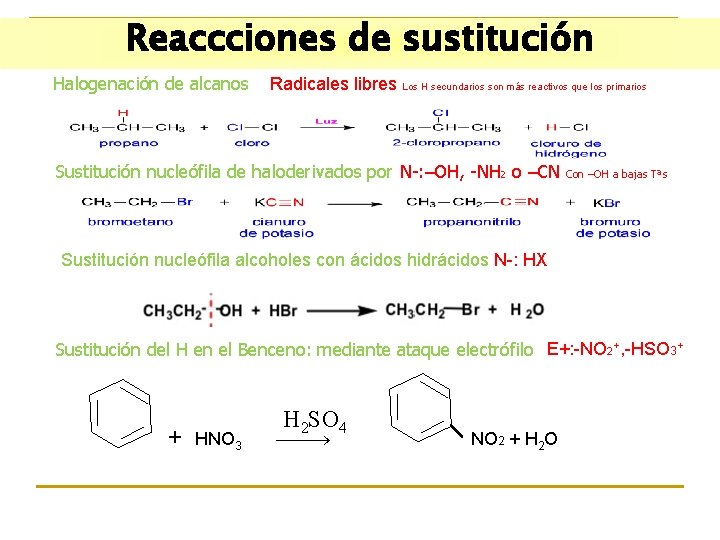
Reaccciones de sustitución Halogenación de alcanos Radicales libres Los H secundarios son más reactivos que los primarios Sustitución nucleófila de haloderivados por N-: –OH, -NH 2 o –CN Con –OH a bajas Tªs Sustitución nucleófila alcoholes con ácidos hidrácidos N-: HX Sustitución del H en el Benceno: mediante ataque electrófilo E+: -NO 2+, -HSO 3+ + HNO 3 H 2 SO 4 NO 2 + H 2 O

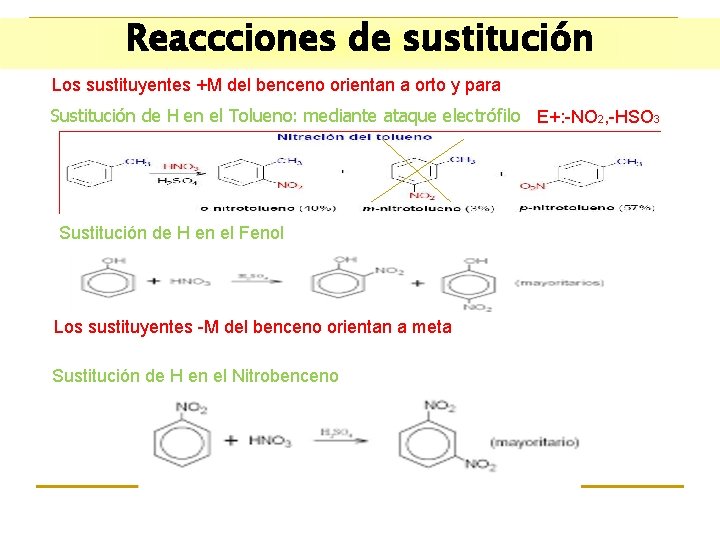
Reaccciones de sustitución Los sustituyentes +M del benceno orientan a orto y para Sustitución de H en el Tolueno: mediante ataque electrófilo E+: -NO 2, -HSO 3 Sustitución de H en el Fenol Los sustituyentes -M del benceno orientan a meta Sustitución de H en el Nitrobenceno

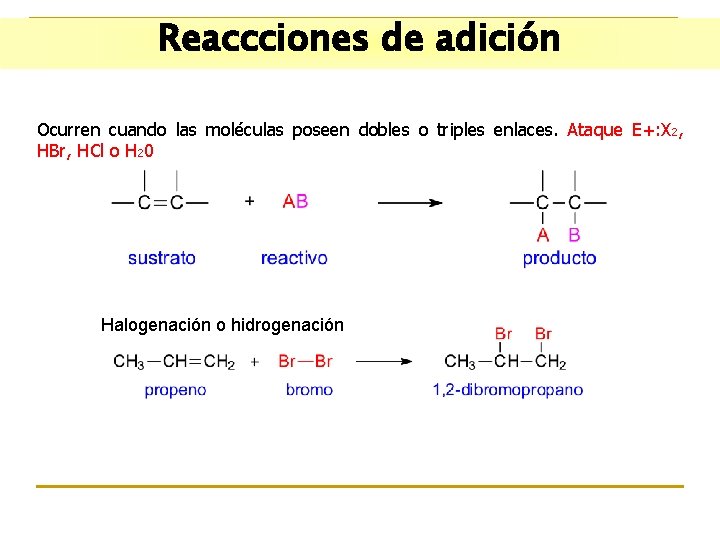
Reaccciones de adición Ocurren cuando las moléculas poseen dobles o triples enlaces. Ataque E+: X 2, HBr, HCl o H 20 Halogenación o hidrogenación

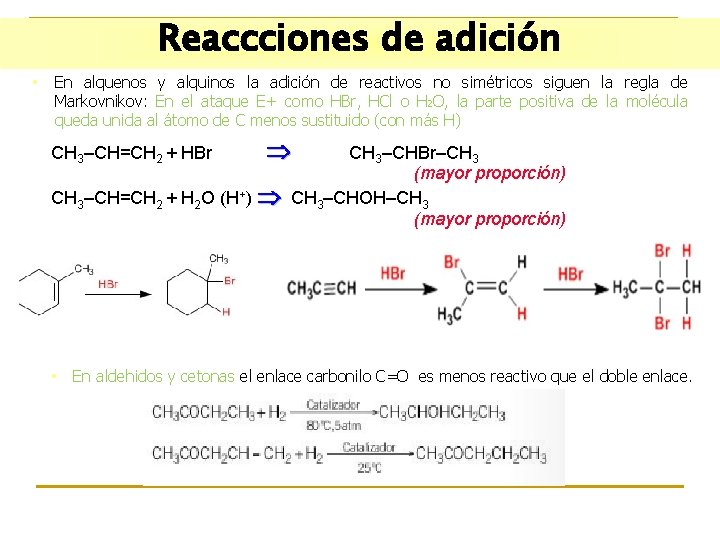
Reaccciones de adición • En alquenos y alquinos la adición de reactivos no simétricos siguen la regla de Markovnikov: En el ataque E+ como HBr, HCl o H 2 O, la parte positiva de la molécula queda unida al átomo de C menos sustituido (con más H) CH 3–CH=CH 2 + HBr CH 3–CH=CH 2 + H 2 O (H+) • CH 3–CHBr–CH 3 (mayor proporción) CH 3–CHOH–CH 3 (mayor proporción) En aldehidos y cetonas el enlace carbonilo C=O es menos reactivo que el doble enlace.

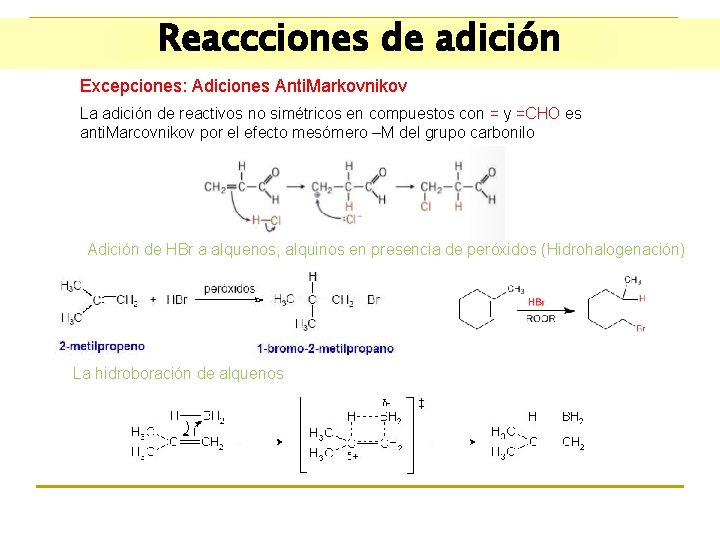
Reaccciones de adición Excepciones: Adiciones Anti. Markovnikov La adición de reactivos no simétricos en compuestos con = y =CHO es anti. Marcovnikov por el efecto mesómero –M del grupo carbonilo Adición de HBr a alquenos, alquinos en presencia de peróxidos (Hidrohalogenación) La hidroboración de alquenos

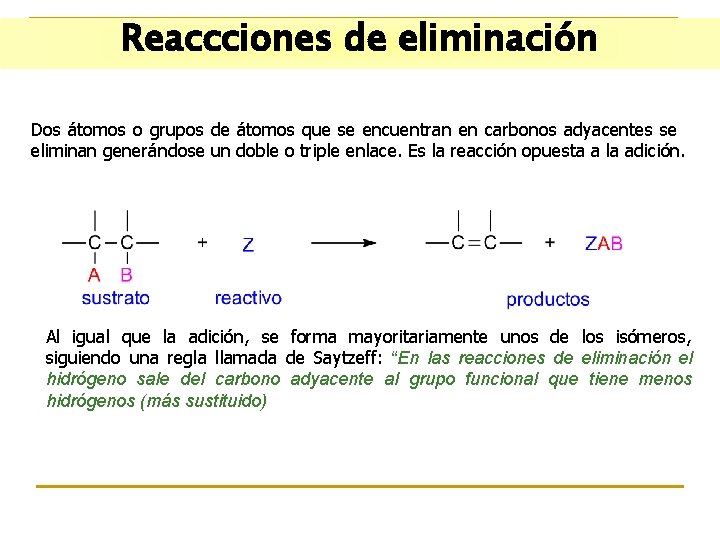
Reaccciones de eliminación Dos átomos o grupos de átomos que se encuentran en carbonos adyacentes se eliminan generándose un doble o triple enlace. Es la reacción opuesta a la adición. Al igual que la adición, se forma mayoritariamente unos de los isómeros, siguiendo una regla llamada de Saytzeff: “En las reacciones de eliminación el hidrógeno sale del carbono adyacente al grupo funcional que tiene menos hidrógenos (más sustituido)

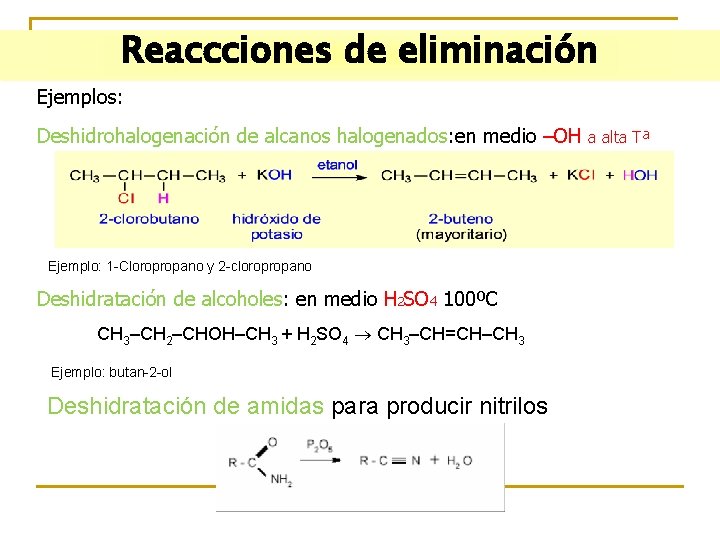
Reaccciones de eliminación Ejemplos: Deshidrohalogenación de alcanos halogenados: en medio –OH Ejemplo: 1 -Cloropropano y 2 -cloropropano Deshidratación de alcoholes: en medio H 2 SO 4 100ºC CH 3–CH 2–CHOH–CH 3 + H 2 SO 4 CH 3–CH=CH–CH 3 Ejemplo: butan-2 -ol Deshidratación de amidas para producir nitrilos a alta Tª

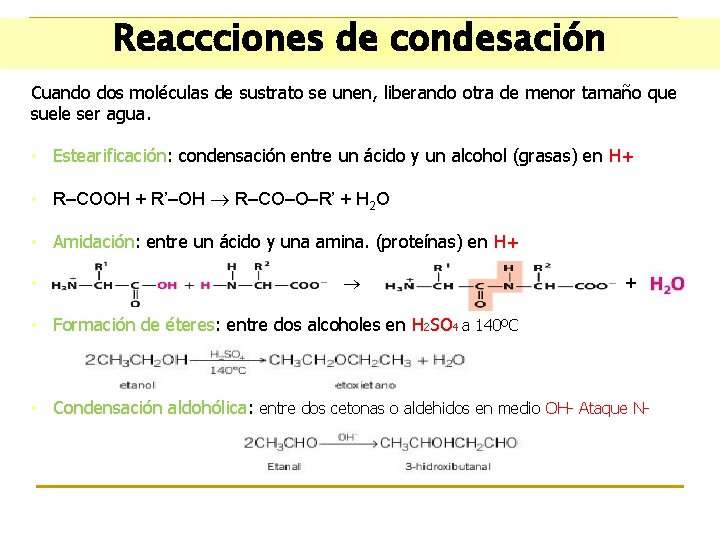
Reaccciones de condesación Cuando dos moléculas de sustrato se unen, liberando otra de menor tamaño que suele ser agua. • Estearificación: condensación entre un ácido y un alcohol (grasas) en H+ • R–COOH + R’–OH R–CO–O–R’ + H 2 O • Amidación: entre un ácido y una amina. (proteínas) en H+ • + • Formación de éteres: entre dos alcoholes en H 2 SO 4 a 140ºC • Condensación aldohólica: entre dos cetonas o aldehidos en medio OH- Ataque N-

Reaccciones Red. Ox Esta clase de reacciones consisten en un cambio en el estado de oxidación de un carbono de manera controlada. Combustión: oxidación completa por el O 2 a CO 2 y H 2 O CH 4+2 O 2→CO 2+2 H 20 Estos procesos se emplean para la producción de alcoholes, aldehídos, cetonas y ácidos carboxílicos. Oxidación de alcoholes primarios a aldehídos y ácidos: con dicromato, si solo queremos el aldehído usaremos Cr. O 3+Piridina Oxidación de alcoholes secundarios a cetonas: Cr. O 3 Oxidación de alcoholes terciarios a ácido y cetona: permanganato en H+

Reaccciones Red. Ox Reducción de aldehídos y cetonas a alcoholes: con Na. BH 4 Reducción de ésteres y ácidos a alcoholes: con Li. Al. H 4

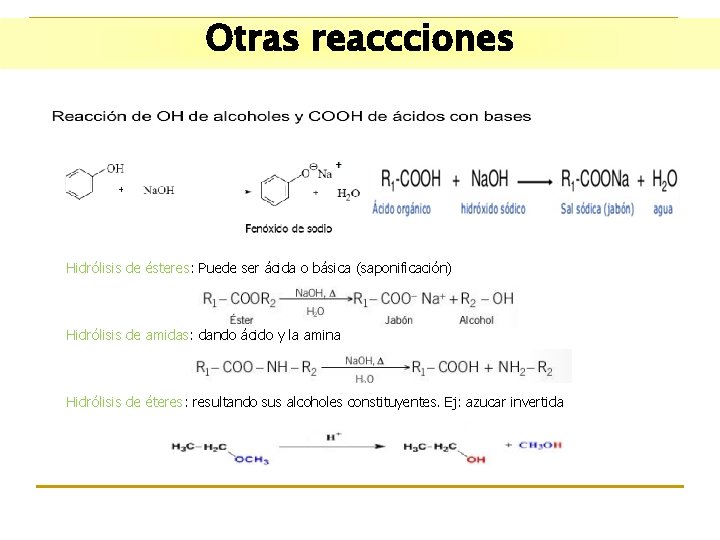
Otras reaccciones Hidrólisis de ésteres: Puede ser ácida o básica (saponificación) Hidrólisis de amidas: dando ácido y la amina Hidrólisis de éteres: resultando sus alcoholes constituyentes. Ej: azucar invertida

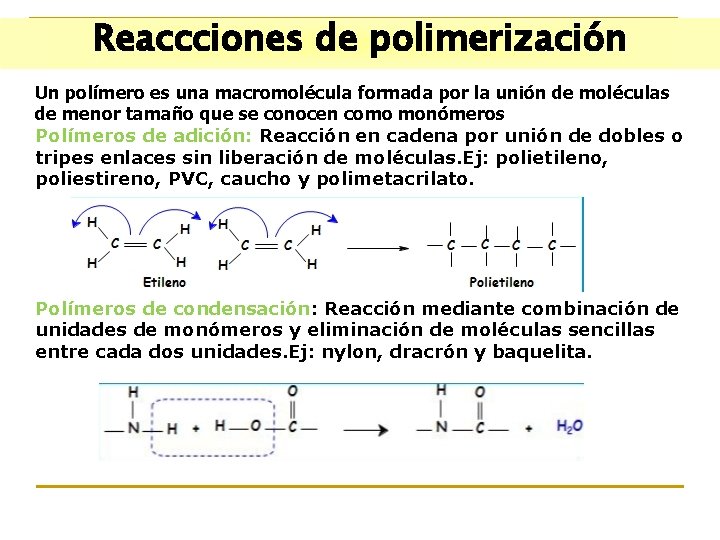
Reaccciones de polimerización Un polímero es una macromolécula formada por la unión de moléculas de menor tamaño que se conocen como monómeros Polímeros de adición: Reacción en cadena por unión de dobles o tripes enlaces sin liberación de moléculas. Ej: polietileno, poliestireno, PVC, caucho y polimetacrilato. Polímeros de condensación: Reacción mediante combinación de unidades de monómeros y eliminación de moléculas sencillas entre cada dos unidades. Ej: nylon, dracrón y baquelita.



































