Semana 29 AMINOCIDOS Y PPTIDOS QUMICA 2016 1














- Slides: 26

Semana 29 AMINOÁCIDOS Y PÉPTIDOS QUÍMICA 2016 1

AMINOÁCIDOS y PÉPTIDOS Aminoácidos: Definición, fuentes, estructura, grupos funcionales. Nomenclatura común (20 α-aminoácidos) Clasificación por: - la cadena lateral: Polares, Apolares, Ácidos y Básicos, Aromáticos, alifáticos, hidroxilados, imino, azufrados. - Requerimiento: esenciales y no esenciales Propiedades físicas Isomería óptica, formas D y L. Comportamiento anfótero Ionización de aminoácidos: catión, anión, zwitterion Péptidos: Formación de péptidos y representación general. Importancia biológica de: - Glutatión, Vasopresina (hormona antidiurética) y Oxitocina (hormona estimulante de contracciones) Laboratorio: Propiedades físicas y químicas de aminoácidos y proteínas 2

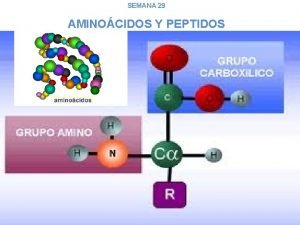
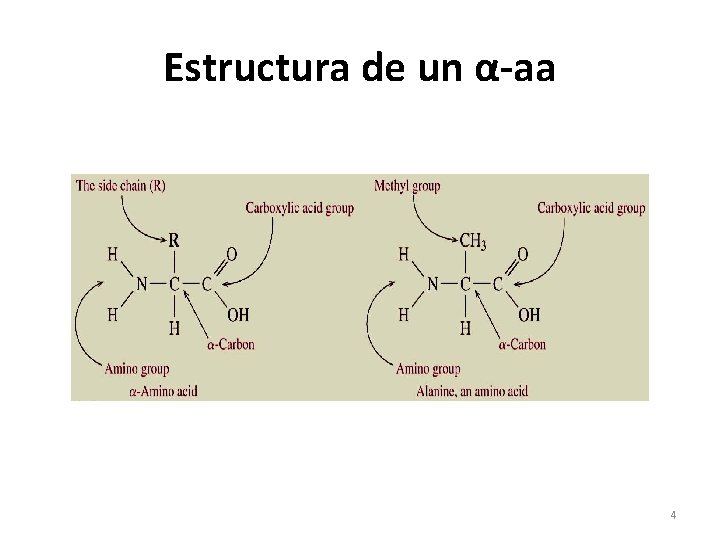
AMINOÁCIDOS (aa) • Son compuestos que contienen enlazados a su carbono α una función CARBOXILO(-COO), una función AMINO(-NH 2) y un RADICAL (-R) que es el que diferencia los aminoácidos entre sí. • Son las unidades estructurales de las PROTEÍNAS y existen 20 diferentes α-aa protéicos. • Se clasifican según su cadena lateral –R y según su requerimiento en la dieta. • Se nombran abreviando las 3 primeras letras de sus nombres. 3

Estructura de un α-aa 4

5

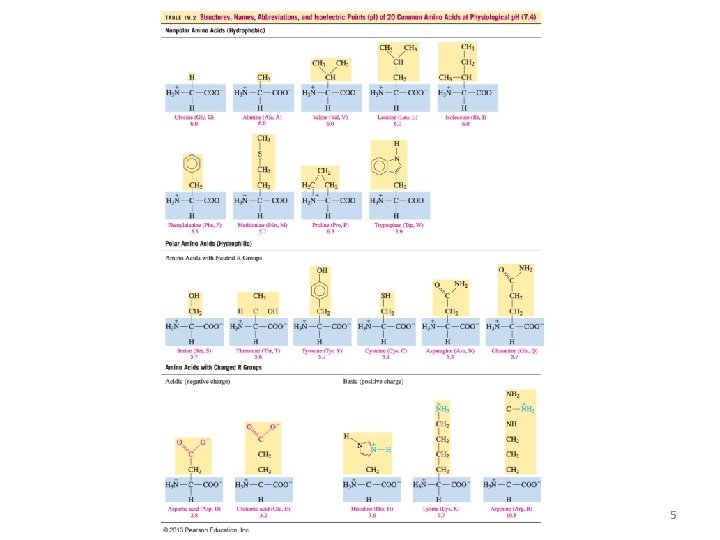
CLASIFICACIÓN de aminoácidos POR LA CADENA LATERAL: • Alifático (solo tienen C e H) pueden ser ramificados como la Valina, Leucina e Isoleucina. • Hidroxilados (tienen grupos –OH) • Azufrados (tienen azufre -S). • Ácidos (tienen más de grupos carboxílicos adicionales). • Básicos (tienen grupos amino adicionales). • Aromáticos (presentan anillos bencénicos). • Heterocíclicos(con anillos con C y N integrados a la estructura cíclica) POR SU REQUERIMIENTO: �Esenciales �No esenciales POR SU POLARIDAD: � No polares � Polares y neutros � Ácidos � Básicos 6

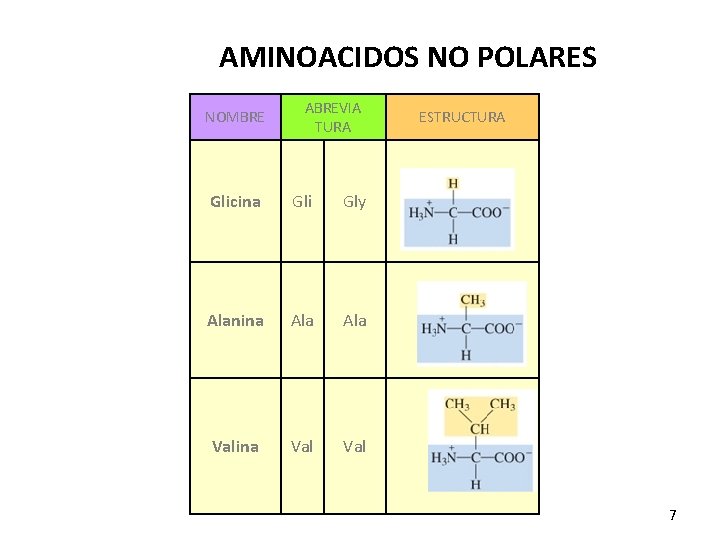
AMINOACIDOS NO POLARES NOMBRE ABREVIA TURA Glicina Gli Gly Alanina Ala Valina Val ESTRUCTURA 7

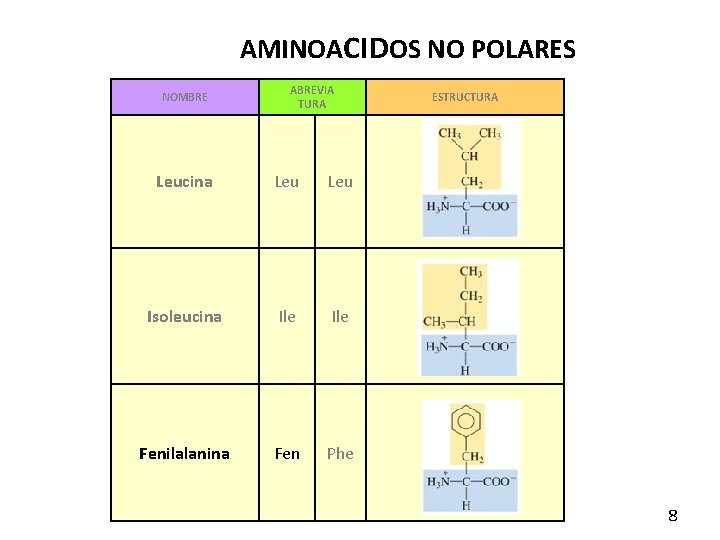
AMINOACIDOS NO POLARES NOMBRE ABREVIA TURA Leucina Leu Isoleucina Ile Fenilalanina Fen Phe ESTRUCTURA 8

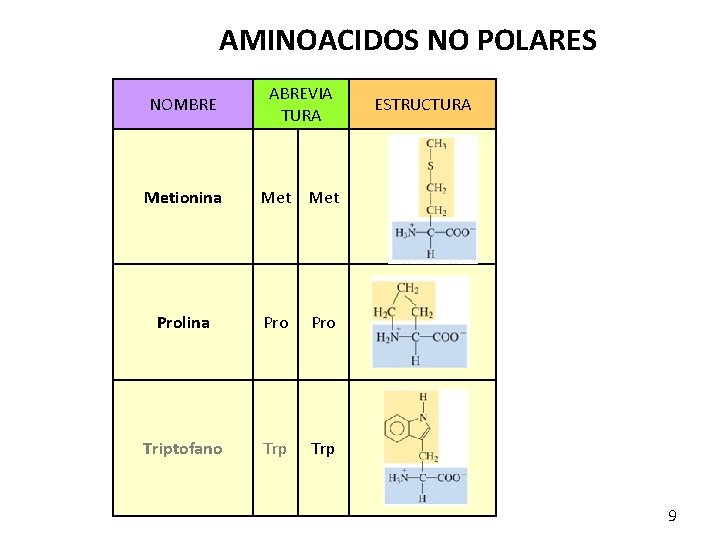
AMINOACIDOS NO POLARES NOMBRE ABREVIA TURA Metionina Met Prolina Pro Triptofano Trp ESTRUCTURA 9

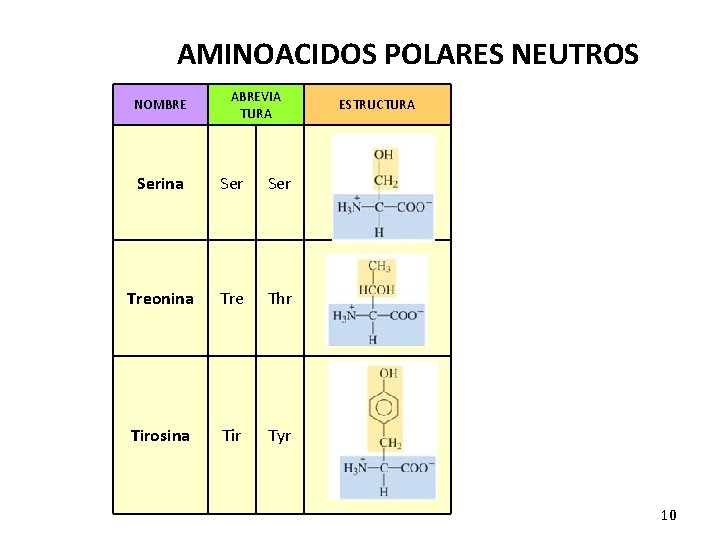
AMINOACIDOS POLARES NEUTROS NOMBRE ABREVIA TURA Serina Ser Treonina Tre Thr Tirosina Tir Tyr ESTRUCTURA 10

AMINOACIDOS POLARES NEUTROS NOMBRE ABREVIA TURA Cisteina Cis Cys Asparagina Asn Glutamina Gln ESTRUCTURA 11

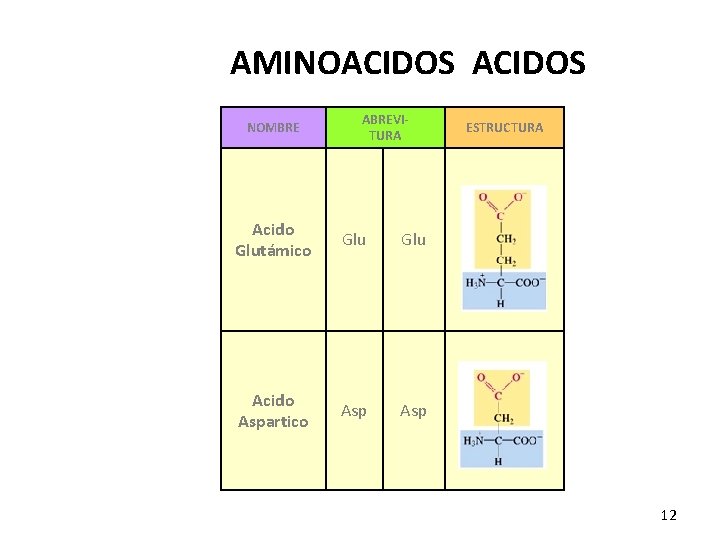
AMINOACIDOS NOMBRE ABREVITURA Acido Glutámico Glu Acido Aspartico Asp ESTRUCTURA 12

AMINOACIDOS BÁSICOS NOMBRE ABREVIA TURA Histidina His Lisina Lis Lys Arginina Arg ESTRUCTURA 13

Aminoácidos Esenciales • Son los que el organismo no sintetiza, por lo que son esenciales en la dieta. La ausencia de de estos aminoácidos esenciales impide la formación de proteínas. Son 10 ADULTOS VALINA LEUCINA METIONINA ISOLEUCINA FENILALANINA LISINA TREONINA TRIPTOFANO SOLO NIÑOS ARGININA HISTIDINA Va Le Me Iso Fe Lis Tre Tri 14

Aminoácidos no esenciales Son los que el organismo sí sintetizar o forma, por lo que no son esenciales en la dieta. 15

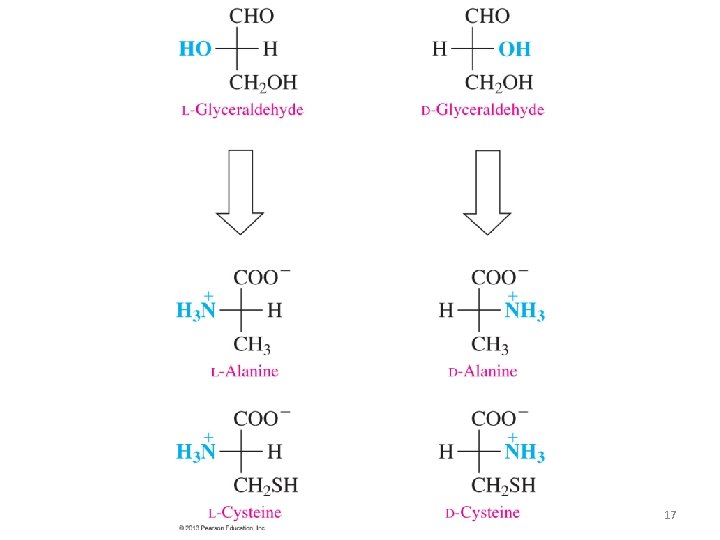
Propiedades de los aa • Todos los aa proteicos tienen ACTIVIDAD ÓPTICA porque tienen Carbonos asimétricos, excepto la GLICINA. • Los 20 α-aa protéicos tienen forma L (a diferencia de los carbohidratos que son D). • Son sólidos, cristalinos, punto de fusión mayor que 200º C • Son polares, solubles en agua. 16

17

Ionización de los aminoácidos, Zwitteriones, p. H isoeléctrico, anfóteros • En soluciones con p. H fisiológicos, los aa se encuentran ionizados. El grupo carboxilo se ioniza –COOH –COO El grupo amino se ioniza –NH 2 –NH 3+ y forman: ZWITTERIONES (sal interna, ión dipolar): Son las formas ionizadas que presentan cargas + y – en la misma molécula de aa. 18

PUNTO ISOELÉCTRICO (p. I) Ó p. H ISOELÉCTRICO es el p. H donde un aminoácido está en forma de zwitterión con carga eléctrica neta igual a 0 (carga + = cargas -) por lo que no migra al cátodo (+) ni al ánodo (-) en un campo eléctrico. Cada aminoácido tiene su propio p. H isoeléctrico (p. I). AMINOACIDOS p. H isoeléctrico aprox. NEUTROS 4. 8 - 6. 3 ACIDOS 2. 8 – 3. 2 BASICOS 7. 6 – 10. 8 19

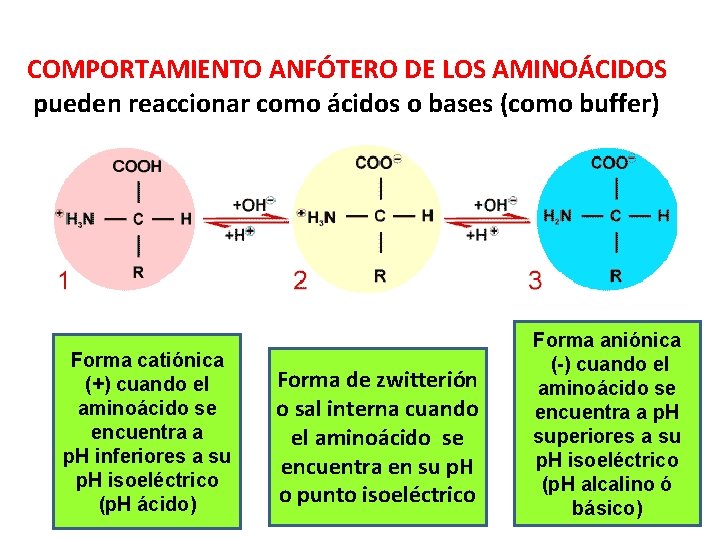
COMPORTAMIENTO ANFÓTERO DE LOS AMINOÁCIDOS pueden reaccionar como ácidos o bases (como buffer) Forma catiónica (+) cuando el aminoácido se encuentra a p. H inferiores a su p. H isoeléctrico (p. H ácido) Forma de zwitterión o sal interna cuando el aminoácido se encuentra en su p. H o punto isoeléctrico Forma aniónica (-) cuando el aminoácido se encuentra a p. H superiores a su p. H isoeléctrico (p. H alcalino ó básico) 20

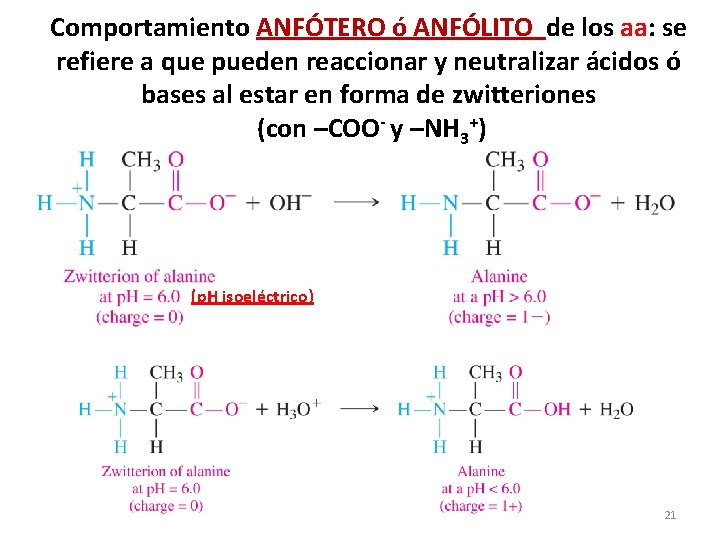
Comportamiento ANFÓTERO ó ANFÓLITO de los aa: se refiere a que pueden reaccionar y neutralizar ácidos ó bases al estar en forma de zwitteriones (con –COO- y –NH 3+) (p. H isoeléctrico) 21

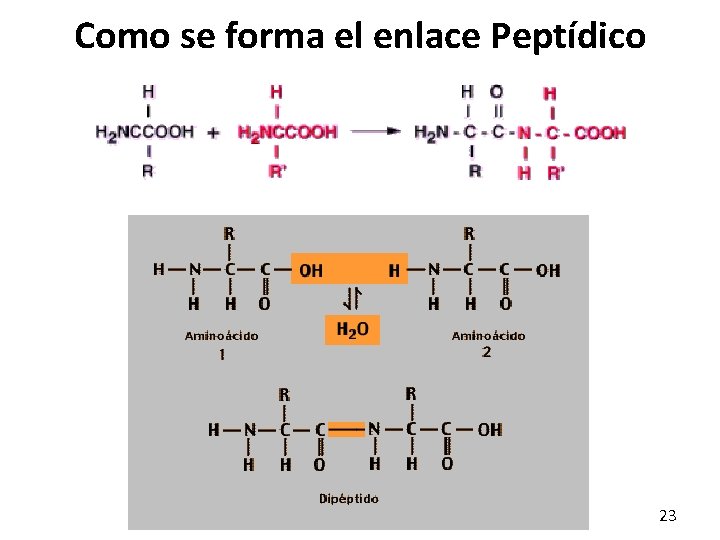
FORMACION DE PÉPTIDOS Y ENLACES PEPTÍDICOS En las proteínas y péptidos, los aminoácidos se unen entre sí por medio de enlaces amida llamados enlaces peptídicos, entre el grupo α-carboxilo de un aminoácido y el grupo α– amino de otro. No. de aminoácidos NOMBRE 2 DIPEPTIDO 3 TRIPEPTIDO 4 TRETAPEPTIDO 5 a 35 POLIPEPTIDO 22

Como se forma el enlace Peptídico 23

AMINOÁCIDO N-TERMINAL: es el aminoácido escrito a la izquierda del péptido, queda con su grupo amino libre (-NH 3 +) sin enlazar. AMINOÁCIDO C-TERMINAL: es el aa escrito a la derecha del péptido, queda con su grupo carboxilo libre (-COOH-) sin enlazar. N-TERMINAL C-TERMINAL 24

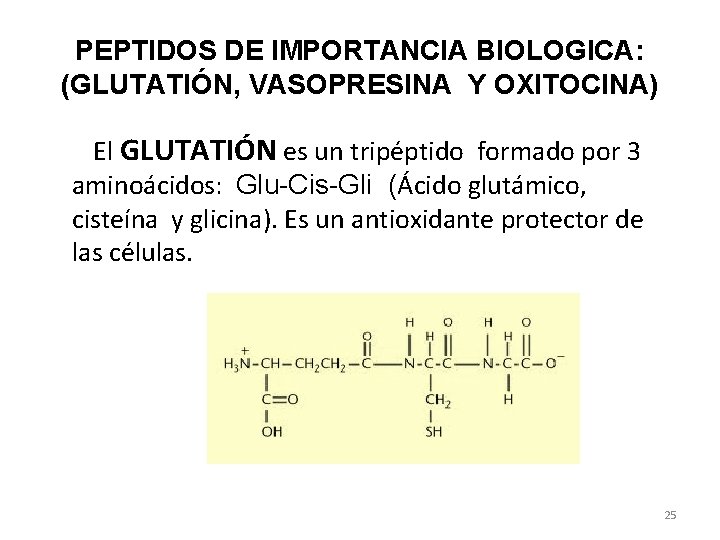
PEPTIDOS DE IMPORTANCIA BIOLOGICA: (GLUTATIÓN, VASOPRESINA Y OXITOCINA) El GLUTATIÓN es un tripéptido formado por 3 aminoácidos: Glu-Cis-Gli (Ácido glutámico, cisteína y glicina). Es un antioxidante protector de las células. 25

Vasopresina y Oxitocina: son nonapéptidos de estructuras parecidas y con funciones muy diferentes VASOPRESINA: hormona antidiurética OXITOCINA: hormona estimulante de las contracciones en el parto 26
 Qumica
Qumica Etapas da análise gravimétrica
Etapas da análise gravimétrica Qumica
Qumica Setas curvas
Setas curvas Truta
Truta Qumica
Qumica Reacciones de orden cero
Reacciones de orden cero Qumica
Qumica Energia en los enlaces quimicos
Energia en los enlaces quimicos Qumica
Qumica Mistura quimica
Mistura quimica Qumica
Qumica Qumica
Qumica Qumica
Qumica Ion bromonio
Ion bromonio C qumica
C qumica Qumica
Qumica Cinetica molecular
Cinetica molecular Qumica
Qumica Qumica
Qumica Carbono hibridacion
Carbono hibridacion Qumica
Qumica Cintica
Cintica Qumica
Qumica N
N Acidos organicos
Acidos organicos Enlace covalente coordinado
Enlace covalente coordinado