PROTEIN Mikchaell Panjaitan S Pi Senyawa Penyusun Protein




















- Slides: 28

PROTEIN Mikchaell Panjaitan S. Pi

Senyawa Penyusun Protein • Seperti Karbohidrat dan Lemak, Protein mengandung unsur - Oxygen(O), - Carbon(C), and - Hydrogen(H) • Protein juga mengandung Nitrogen(N).

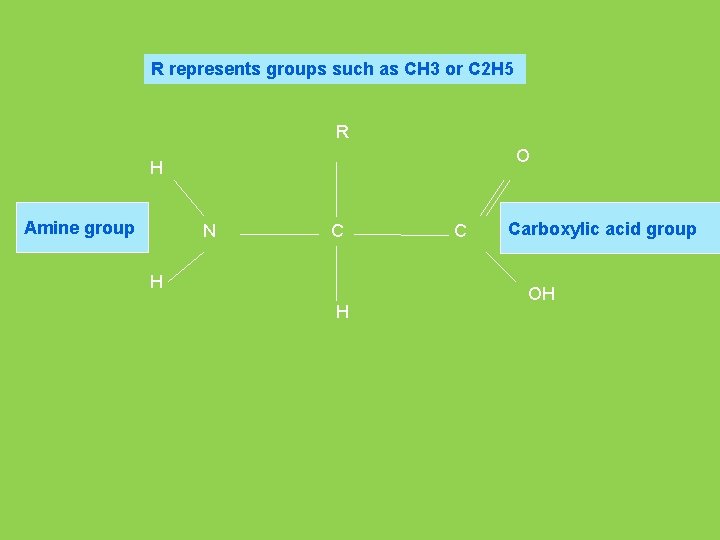
R represents groups such as CH 3 or C 2 H 5 R O H Amine group N C H H C Carboxylic acid group OH

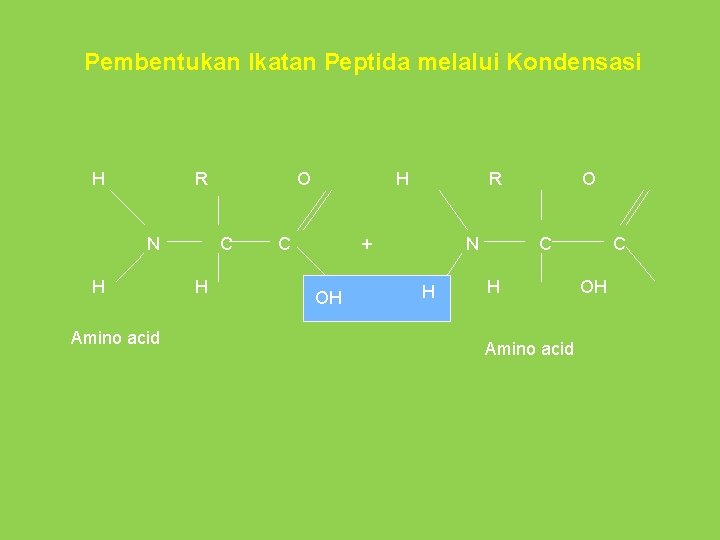
Bagaimana pembentukan protein ? • Asam amino saling berikatan • Terikat melalui ikatan peptida • 2 asam amino bergabung membentuk sebuah dipeptida • >2 asam amino bergabung membentuk rantai panjang polipeptida • Organisme menggabungkan asam amino dalam sekuens linier berbeda u/ membentuk beragam polipeptida dalam molekul kompleks, yaitu protein

Pembentukan Ikatan Peptida melalui Kondensasi H R N H Amino acid O C H H C R + OH N H O C H Amino acid C OH

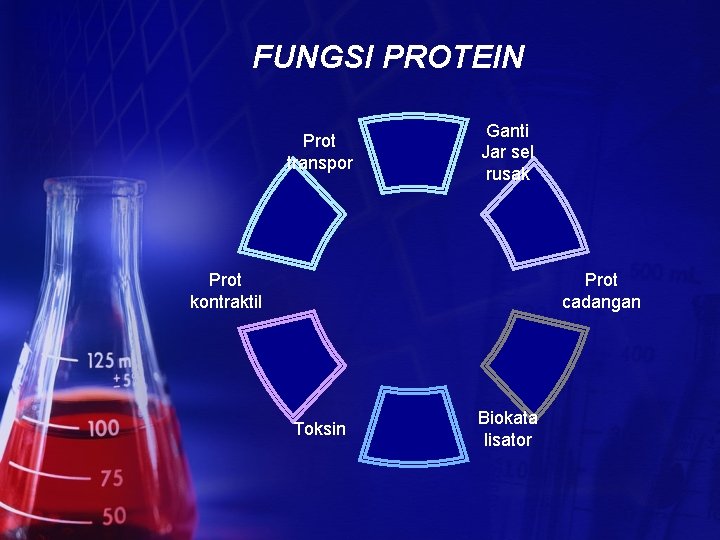
FUNGSI PROTEIN Prot transpor Ganti Jar sel rusak Prot kontraktil Prot cadangan Toksin Biokata lisator

KLASIFIKASI PROTEIN

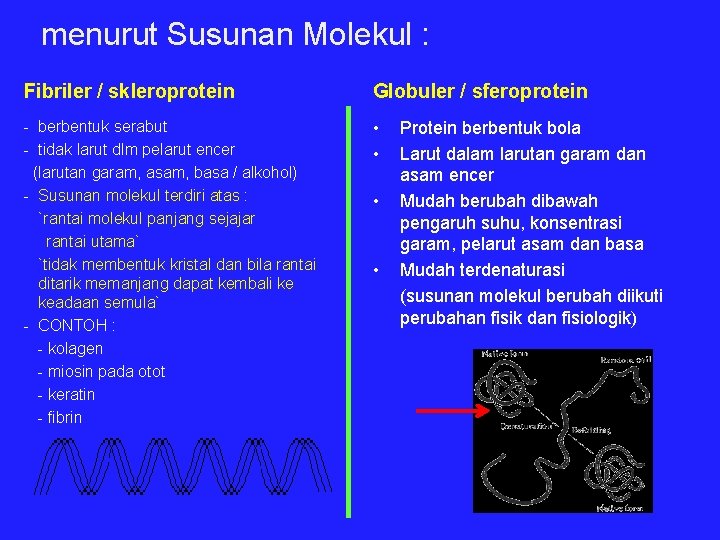
menurut Susunan Molekul : Fibriler / skleroprotein Globuler / sferoprotein - berbentuk serabut - tidak larut dlm pelarut encer (larutan garam, asam, basa / alkohol) - Susunan molekul terdiri atas : `rantai molekul panjang sejajar rantai utama` `tidak membentuk kristal dan bila rantai ditarik memanjang dapat kembali ke keadaan semula` - CONTOH : - kolagen - miosin pada otot - keratin - fibrin • • Protein berbentuk bola Larut dalam larutan garam dan asam encer Mudah berubah dibawah pengaruh suhu, konsentrasi garam, pelarut asam dan basa Mudah terdenaturasi (susunan molekul berubah diikuti perubahan fisik dan fisiologik)

Berdasarkan Kelarutan 1. Albumin - larut air, garam dan terkoagulasi oleh panas - albumin telur, serum, laktalbumin susu 2. Globulin - tidak larut dalam air, terkoagulasi oleh panas - larut dalam larutan garam encer - mengendap larutan garam konsentrasi tinggi (salting out) - miosinogen dalam otot, ovoglobulin dalam kuning telur • pseudoglobulin : larut air • euglobulin : tdk larut air yg bebas grm 3. Prolamin - larut etanol 70 -80%, tidak larut air / alkohol absolut - gliadin dalam gandum, zein pada jagung

4. Histon - larut air dan tidak larut dalam amonia encer - mengendap dalam pelarut protein lainnya - histon yg telah terkoagulasi o/pemanasan dapat larut lagi dalam larutan asam encer. - globin dalam hemoglobin 5. Glutelin - tidak larut dalam pelarut netral - larut dalam asam/basa encer - glutenin dlm gandum, orizenin dlm beras 6. Protamin - larut dalam air dan tidak terkoagulasi oleh panas - salmin dlm ikan salmon, klupein dlm herring, skombrin dlm ikan mackarel, sipirinin dlm ikan karper

BERDASARKAN KOMPOSISI • PROTEIN SEDERHANA • Protein yang tidak mengandung senyawa non protein • PROTEIN KONYUGASI • • • Protein yang mengandung senyawa lain non protein Nukleoprotein inti sel, kecambah biji-bijian Glikoprotein musin pada ludah Fosfoprotein kasein susu, vitelin kuning telur Kromoprotein (metaloprotein) hemoglobin Lipoprotein serum darah, kuning telur, susu, darah

Berdasarkan Struktur 1. Primer 2. Sekunder 3. Tersier 4. Kuarterner

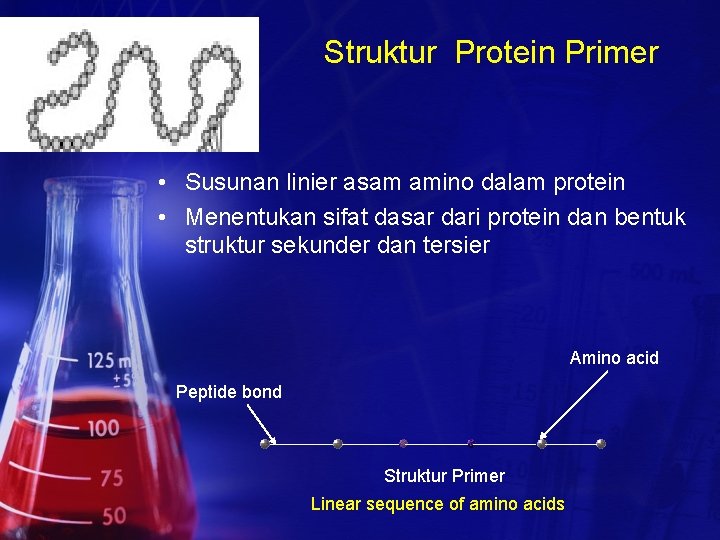
Struktur Protein Primer • Susunan linier asam amino dalam protein • Menentukan sifat dasar dari protein dan bentuk struktur sekunder dan tersier Amino acid Peptide bond Struktur Primer Linear sequence of amino acids

SEKUNDER • Struktur protein biasanya merupakan polipeptida yang terlipat-lipat, bentuk tiga dimensi dengan cabang-cabang rantai polipeptida tersusun saling berdekatan • Terdiri atas satu rantai polipeptida

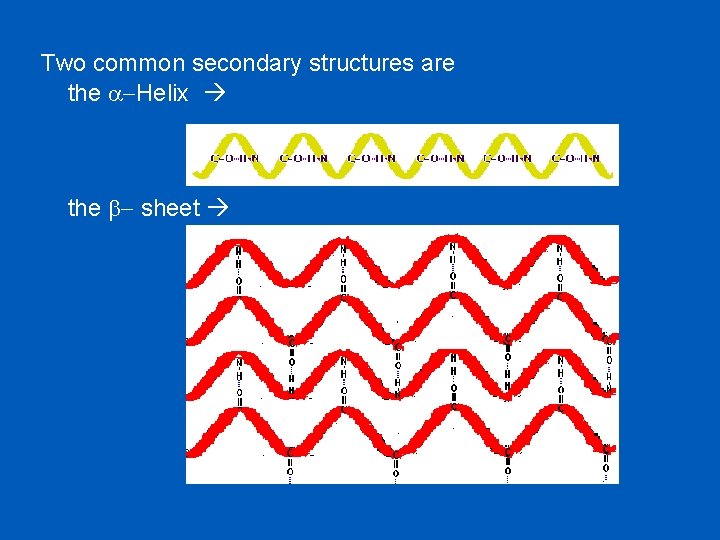
Two common secondary structures are the a-Helix the b- sheet

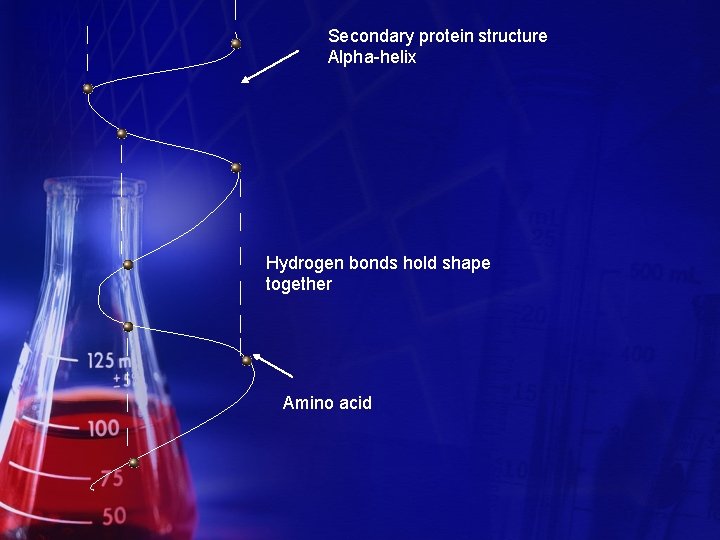
Secondary protein structure Alpha-helix Hydrogen bonds hold shape together Amino acid

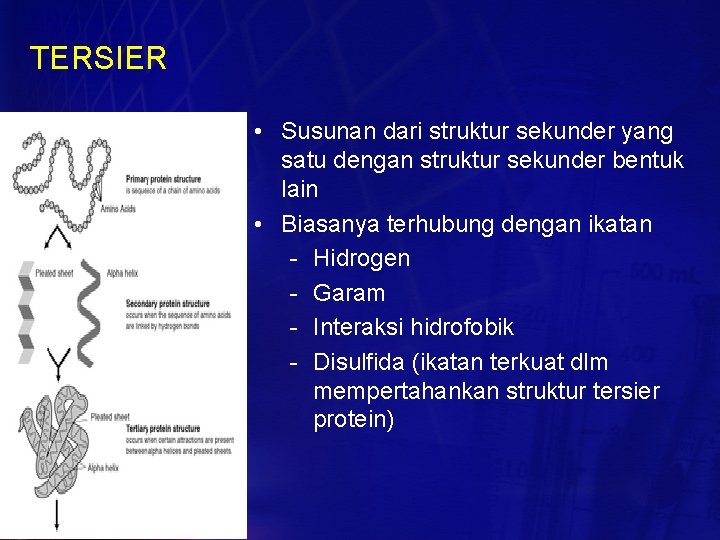
TERSIER • Susunan dari struktur sekunder yang satu dengan struktur sekunder bentuk lain • Biasanya terhubung dengan ikatan - Hidrogen - Garam - Interaksi hidrofobik - Disulfida (ikatan terkuat dlm mempertahankan struktur tersier protein)

• Ikatan hidrofobk terjadi antara ikatan non polar molekul-molekul • Ikatan garam cenderung bereaksi dengan ion sekitar molekul

Kuartener • Struktur primer, sekunder dan tersier umumnya hanya melibatkan satu rantai polipeptida. Tetapi bila struktur ini melibatkan beberapa polipeptida dalam membentuk suatu protein maka disebut struktur kuartener

Ikatan protein • • 1. Dua ikatan kuat : peptida, disulfida (sistein) 2. Tiga ikatan lemah : hidrogen, hidrofobik, elektrostatik • • • Ikatan Disulfida (sistein): 1. Stabil 2. Resisten pada penyebab denaturasi protein Senyawa yg mampu mengoksidasi ikatan disulfida 1. Asam performat 2. Beta merkaptoetanal Selama denaturasi protein ikatan hidrogen, hidrofobik, elektro statik pecah tapi ikatan peptida, disulfida tidak. Denaturasi protein (suhu tinggi, p. H) aktivitas biologis hilang dan perubahan konfigurasi rantai polipeptida

HYDROGEN BONDS The polypeptides are held in position by hydrogen bonds. In both alpha-helix and beta pleated sheets the C=O of one amino acid bonds to the H-N of an adjacent amino acid. As below: C=O----H-N Jelaskan !! (bonus 5 point)

KERUSAKAN PROTEIN

DENATURASI PROTEIN • Perubahan susunan ruang atau rantai polipeptida suatu molekul protein berubah • Perubahan / modifikasi terhadap struktur sekunder, tersier dan kuartener terhadap molekul protein, tanpa terjadi pemecahan ikatan kovalen. • Macam denaturasi: • Pengembangan rantai peptida (terjadi pada rantai polipeptida) • Pemecahan protein menjadi unit yang lebih kecil tanpa disertai pengembangan molekul (terjadi pada bagian molekul yg tergabung dlm ikatan sekunder)

Denaturing Proteins • Heat hydrogen bonds are broken by increased translational and vibrational energy. (coagulation of egg white albumin on frying. ) • Ultraviolet Radiation Similar to heat (sunburn) • Strong Acids or Bases salt formation; disruption of hydrogen bonds. (skin blisters and burns, protein precipitation. ) • Urea • Some Organic Solvents • Agitation competition for hydrogen bonds. (precipitation of soluble proteins. ) (e. g. ethanol & acetone) change in dielectric constant and hydration of ionic groups. (disinfectant action and precipitation of protein. ) shearing of hydrogen bonds. 24 (beating egg white albumin into a meringue. )

IKATAN YG MEMPENGARUHI DENATURASI • Ikatan hidrofobik • Ikatan hidrogen • Ikatan ionik antara gugus bermuatan positif dan negatif • Ikatan intramolekuler spt pada gugus disulfida dlm sistin

REAKSI SPESIFIK ASAM AMINO • Digunakan untuk uji asam amino (kualitatif), pengukuran (kuantitatif) dan sekuensi residu asam amino pada molekul protein. 1. Reaksi Ninhidrin 2. Reaksi gugus α-NH 2 dari asam α-amino dengan 1 -fluoro-2, 4 dinitrobenzen dengan menghasilkan turunan dinitrofenil (DNF) yang berwarna kuning sampai merah bata yaitu asam 2, 4 -dinitrofenilamino 3. Reaksi asam α-amino dengan pereaksi dansilklorida untuk identifikasi residu asam amino pada ujung terminal amino peptida

Reaksi Warna Ninhidrin • Dekarboksilasi oksidatif asam amino alfa menghasilkan CO 2, NH 3 dan aldehide. • Ninhidrin tereduksi kemudian bereaksi dng NH 3 membentuk warna biru (panjang gelombang 570 nm) dikenal test kuantitatif asam amino alfa

Beda alfa dan beta keratin Alfa keratin Mengandung sistin atau sistein tinggi Beta keratin Tidak mengandung sistin, atau sistein tapi mengandung glisin, alanin, serin
 Biografi hinca panjaitan
Biografi hinca panjaitan Perbedaan senyawa karbon dan hidrokarbon
Perbedaan senyawa karbon dan hidrokarbon Carrier vs channel proteins
Carrier vs channel proteins Protein-protein docking
Protein-protein docking Otot polos
Otot polos Organ penyusun sistem gerak pada tumbuhan
Organ penyusun sistem gerak pada tumbuhan Unit tekecil penyusun tubuh kita adalah …….. *
Unit tekecil penyusun tubuh kita adalah …….. * Bagian terkecil dari polimer
Bagian terkecil dari polimer Bahan dasar penyusun dna
Bahan dasar penyusun dna Sifat bahan dasar kain
Sifat bahan dasar kain Batuan penyusun kerak bumi
Batuan penyusun kerak bumi Penyusun enzim adalah
Penyusun enzim adalah Gambar penampang akar dikotil
Gambar penampang akar dikotil Unsur hara penyusun tanaman
Unsur hara penyusun tanaman Organ penyusun sistem gerak adalah …. *
Organ penyusun sistem gerak adalah …. * Kelompok tulang pipa
Kelompok tulang pipa Pengertian entity relationship diagram
Pengertian entity relationship diagram Organ penyusun sistem koordinasi
Organ penyusun sistem koordinasi Penyusun dinding sel
Penyusun dinding sel Senyawa turunan alkana
Senyawa turunan alkana Gugus amida
Gugus amida Pengertian senyawa kompleks
Pengertian senyawa kompleks Benzena termasuk senyawa
Benzena termasuk senyawa Keeletronegatifan
Keeletronegatifan Aldehid aromatik
Aldehid aromatik 40 gram suatu oksida besi (senyawa besi dan oksigen)
40 gram suatu oksida besi (senyawa besi dan oksigen) Apa yang dimaksud dengan senyawa
Apa yang dimaksud dengan senyawa Cincin pirol
Cincin pirol Pemanasan senyawa xy3 pada suhu 600
Pemanasan senyawa xy3 pada suhu 600