KIMIA UNSUR HALOGEN DISUSUN OLEH HANNA M HANNY




















- Slides: 21


KIMIA UNSUR HALOGEN DISUSUN OLEH : HANNA M. HANNY S. M. ALFIAN SALSABILA KELAS : XII IPA 3

fluor clor brom iodin Halogen berasal dari kata halos=garam, genes = pembentuk Merupakan unsur non logam paling reaktif. APAKAH ITU HALOGEN ? ? Yang termasuk unsur halogen adalah Flourin (F), Klourin(Cl), Broumin(Br), Iodin (I), dan Astatin(At)



Sumber Reaksi Kegunaan Sifat-sifat Halogen Reaksi-reaksi Halogen

Sumber • Flourin (melimpah) Terdapat dalam mineral fluorapatit dan mineral fluorit Garam-garam • Klorin (melimpah) dalam air laut, Terdapat dalam bentuk Na. Cl terlarut di lautan tidak terdapat • Brominin (kurang melimpah) bebas di alam Terdapat sebagai ion Br- dalam air laut • Iodin Terdapat sebagai Na. I dalam air laut dan Na. IOᶟ bersama-sama garam nitrat • Astatin (tidak dijumpai dialam) Karena bersifat radioaktif, sehingga mudah berubah menjadi unsur lain yang lebih stabil

Reaksi • Halogen bereaksi dengan logam Halogen bereaksi dengan semua logam akan membentuk halida logam Contoh : a. 2 Na + Br → 2 Na. Br b. 2 Fe + 3 Cl 2 → 2 Fe. Cl 3

• Halogen bereaksi dengan logam Fluorin bereaksi dengan semua non logam kecuali nitrogen, helium, neon, dan argon a. C + 2 Fe 2 → CF 4 b. Xe + 2 Fe 2 → XF 4 Flourin dapat juga bereaksi dengan kaca dan Silica a. Si. O 2 + 2 Fe 2 → Si. F 4 + O 2

Kegunaan Senyawa Kegunaan F₂ HF Na 4 PO 4 F SF 6 CCl 2 F 2 (C 2 F 4)n Pembuatan UF pada pengolahan uranium Ukiran gelas Campuran aditif pasta gigi Gas Isolator Pendingin pada kulkasdan AC (freon) Plastik tahan panas HCl Na. Cl KCl. O 3 NH 4 Cl Pembuatan senyawa halogen lain, pencuci permukaan logam Bumbu masak, bahan baku klor, pengisi sabun Pupuk batang dan akar Campuran bahan peledak dan korek api Elektrolit baterai Na. Br Obat penenang saraf I₂ Na. IO 3 Uji amilum. Larutannya dalam alkohol sebagai anti septik Campuran garam dapur untuk mencegah gondok

Sifat-sifat halogen Titik didih dan titik leleh a. Jari-jari atom unsur halogen bertambah dari flourin sampai astatin b. Panjang ikatan dalam molekul halogen (diatomik) meningkat c. Titik didh dan titik leleh dari flourin sampai astatin meningkat

Titik didih dan titik leleh unsur-unsur halogen Unsur Titik didih (‘C) Titik leleh (‘C) Fluorin -188, 14 -219. 62 Klorin -34, 6 -100, 98 Bromin 58, 78 -7, 25 Iodin 184, 35 113, 5 337 302 Astatin


Kereaktifan a. Jari-jari atom unsur halogen bertambah dari flourin sampai astatin b. Gaya tarik inti terhadap penerimaan (afinitas) elektro makin lemah c. Kereaktifan halogen dari flourin sampai astatin berkurang

Kelarutan a. Kelarutan flourin, klorin, dan bromin dalam air besar atau mudah larut b. kelarutan Iodin larut dalam air dalam jumlah kecil c. Iodin mudah larut dala larutan KI


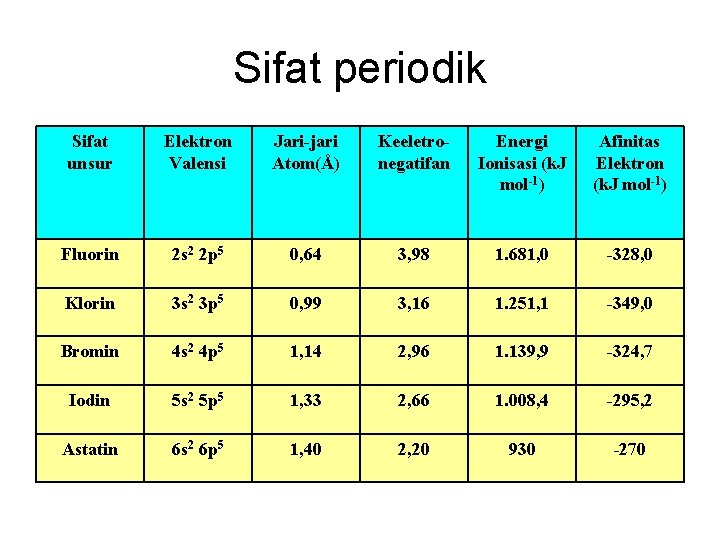
Sifat periodik Sifat unsur Elektron Valensi Jari-jari Atom(Å) Keeletronegatifan Energi Ionisasi (k. J mol-1) Afinitas Elektron (k. J mol-1) Fluorin 2 s 2 2 p 5 0, 64 3, 98 1. 681, 0 -328, 0 Klorin 3 s 2 3 p 5 0, 99 3, 16 1. 251, 1 -349, 0 Bromin 4 s 2 4 p 5 1, 14 2, 96 1. 139, 9 -324, 7 Iodin 5 s 2 5 p 5 1, 33 2, 66 1. 008, 4 -295, 2 Astatin 6 s 2 6 p 5 1, 40 2, 20 930 -270

SIFAT FISIS DAN KIMIA HALOGEN X 2 Fluor (F 2) Klor (Cl 2) 1. Molekulnya 2. Wujud zat (suhu kamar) 3. Warna gas/uap 4. Pelarutnya (organik) 5. Warna larutan (terhadap pelarut 4) 6. Kelarutan oksidator 7. Kereaktifan terhadap gas H 2 Diatom Brom (Br 2) Iodium (I 2) Gas Cair Padat Kuning muda Kuning hijau Coklat merah Ungu Tak berwarna Coklat Ungu CCl 4, CS 2 Tak berwarna (makin besar sesuai dengan arah panah)

Reaksi – reaksi halogen Reaksi halogen dengan gas hidrogen Ø Semua halogen (X₂) dapat bereaksi dengan gas hidrogen Ø Membentuk hidrogen haida(HX) H₂ + X₂ → 2 HX contoh H₂ + Cl → 2 HCl H₂ + I₂ → 2 HI


 Dr hanny rono
Dr hanny rono Struktur batin drama
Struktur batin drama Elektron valensi fluor
Elektron valensi fluor Unsur kimia kayu
Unsur kimia kayu Bab 3 kimia unsur
Bab 3 kimia unsur Unsur negara secara klasik
Unsur negara secara klasik Oopenheimer
Oopenheimer Parameter identitas nasional
Parameter identitas nasional Unsur unsur tabung
Unsur unsur tabung Apakah yang dimaksud pancagatra
Apakah yang dimaksud pancagatra Sistem informasi akuntansi lanjutan
Sistem informasi akuntansi lanjutan Sebutkan unsur-unsur musik
Sebutkan unsur-unsur musik Tegese tetembungan hamengku karya,
Tegese tetembungan hamengku karya, Sebutkan unsur unsur kebudayaan
Sebutkan unsur unsur kebudayaan Unsur unsur hukum perburuhan
Unsur unsur hukum perburuhan Unsur karangan ilmiah
Unsur karangan ilmiah Gambar unsur unsur kubus
Gambar unsur unsur kubus Tujuan komunikasi pendidikan
Tujuan komunikasi pendidikan Unsur unsur dimensi tiga
Unsur unsur dimensi tiga Pengertian lingkaran dan unsur-unsur lingkaran
Pengertian lingkaran dan unsur-unsur lingkaran Pengertian lingkaran
Pengertian lingkaran Sifat-sifat bangun ruang sisi datar
Sifat-sifat bangun ruang sisi datar