SENYAWA AMINA NITRO SENYAWA AMINA Turunan amonia dg





























- Slides: 50

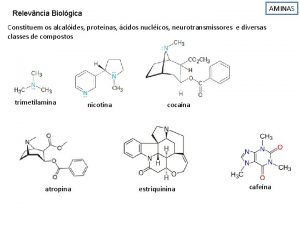
SENYAWA AMINA, NITRO

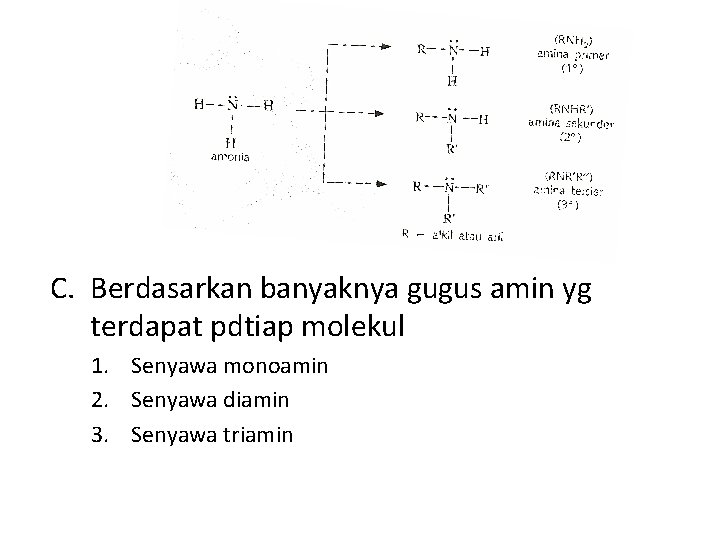
SENYAWA AMINA Turunan amonia dg mengganti 1, 2, at 3 H dari amonia dg gugus alkil at aril Penggolongan Amina : A. Berdasarkan intinya B. Berdasarkan banyaknya atom H dr NH 3 yg digantikan dg gugus aril at alkil 1. 2. 3. Amina 1˚ : 1 atom H pd NH 3 digantikan Amina 2˚ : 2 atom H pd NH 3 digantikan Amina 3˚ : 3 atom H pd NH 3 digantikan

C. Berdasarkan banyaknya gugus amin yg terdapat pdtiap molekul 1. Senyawa monoamin 2. Senyawa diamin 3. Senyawa triamin

Tatanama (IUPAC) • Amin sederhana akhiran –amin CH 3 – CH 2 – NH 2 Propilamin • > 1 gugus fungsi -NH 2 substituen amino pd molekul induk 3 -Amino-2 -propanon

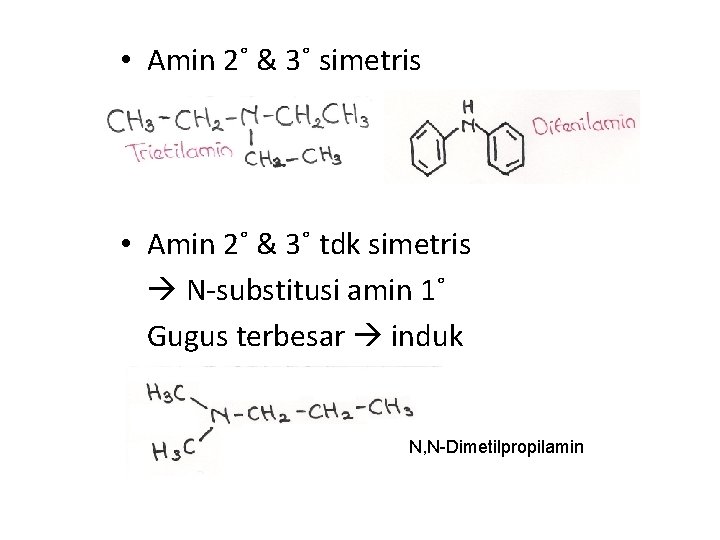
• Amin 2˚ & 3˚ simetris • Amin 2˚ & 3˚ tdk simetris N-substitusi amin 1˚ Gugus terbesar induk N, N-Dimetilpropilamin

• Seperti amonia, amin polar (kecuali 3˚) ikatan hidrogen intermolekul Ikatan hidrogen N---HN lebih lemah daripada O---HO N kurang elektronegatif dibandingkan O t. dnya berada diantara senyawa tanpa ik H (spt alkana at eter) & senyawa berik. H (spt alkohol, as. karboksilat) dg BM yg sama

CH 3 CH 2 OCH 2 CH 3 dietileter t. d 34, 5 ˚C (CH 3 CH 2)2 NH dietilamin t. d 56 ˚C CH 3 CH 2 CH 2 OH butanol t. d 117 ˚C • Amin 3˚ tdk mpyi ik. H t. d < 1˚ & 2˚ (BM sama) • Adanya elektron sunyi 1˚, 2˚, 3˚ dpt membentuk ik H dg air amin BM rendah (± 6 C) larut dalam air • Amin dapat larut dlm pelarut kurang polar eter, alkohol, benzen dll

• Metilamina dan etilamina mpyi bau spt amonia, sdgkan alkilamina yg lebih tinggi amis spt ikan • Arilamina tdk sebau busuk alkilamina ttp lebih toksik c/ anilin terserap mll kulit kanker • Garam amin & garam ammonium kuarterner = garam anorganik larut dalam air dan tdk berbau

Garam dari amina • Amin alifatis = amonia basa • Amin aromatis kurang basa (lebih lemah dr ion OH at etoksida, ttp lebih kuat dibandingkan alkohol, eter, ester dan air) Pe+ asam-asam mineral at asam-asam karboksilat garam, dg adanya ion OH amin bebas

• Membedakannya dr syw non-basa suatu senyawa organik yg tdk larut dalam air ttp dapat larut dlm HCl(e) suatu basa dipastikan amin dpt dipisahkan dr senyawa non-basa • Amin dpt diregenerasi dg me+kan larutan alkali, setelah dipisahkan

Amina dalam industri • Anilin dapat dibuat : a. Reduksi nitrobenzen dg Fe, HCl (e) at hidrogenasi katalitis b. Mereaksikan klorobenzen pd t↑ & tek↑ dg adanya katalis

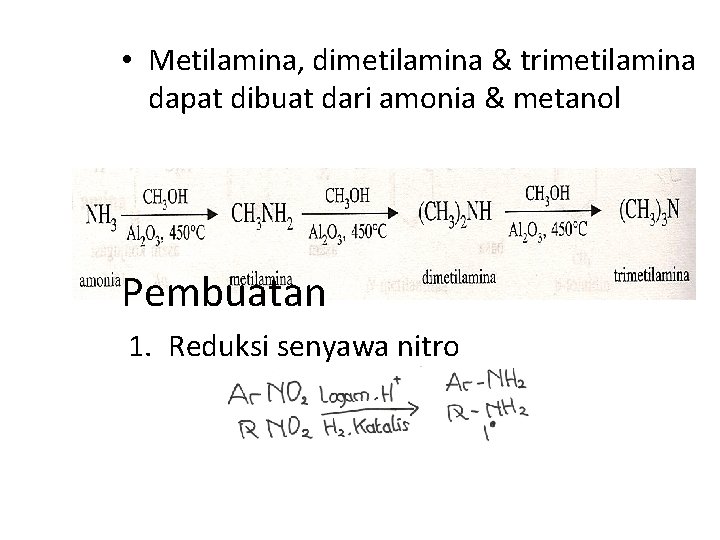
• Metilamina, dimetilamina & trimetilamina dapat dibuat dari amonia & metanol Pembuatan 1. Reduksi senyawa nitro

• Metode ini tdk dpt dgnkan jk molekul mengandung gugus lain yg mudah dihidrogenasi spt alkena, –C=C • Logam yg dpt dgnkan Fe, Al, Zn 2. Reaksi halida dg amonia at amin = reaksi alkilasi substitusi nukleofilik

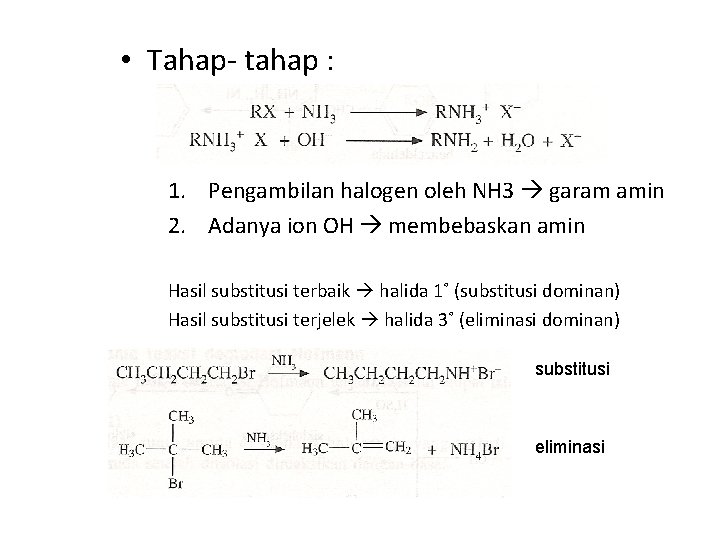
• Tahap- tahap : 1. Pengambilan halogen oleh NH 3 garam amin 2. Adanya ion OH membebaskan amin Hasil substitusi terbaik halida 1˚ (substitusi dominan) Hasil substitusi terjelek halida 3˚ (eliminasi dominan) substitusi eliminasi

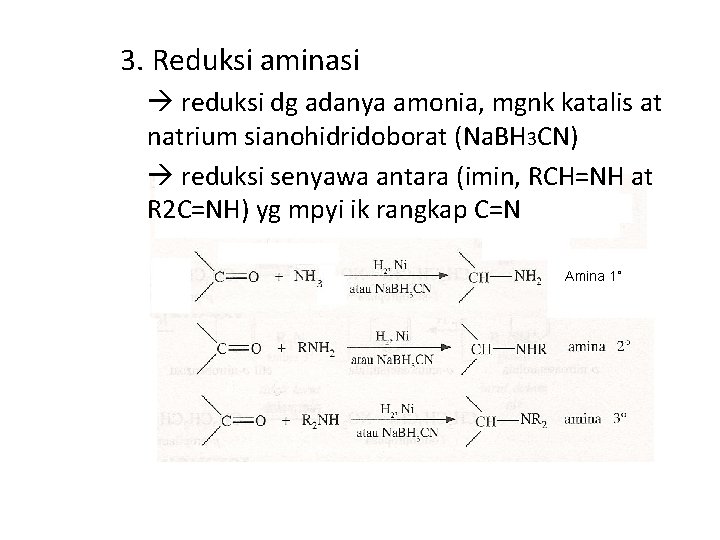
3. Reduksi aminasi reduksi dg adanya amonia, mgnk katalis at natrium sianohidridoborat (Na. BH 3 CN) reduksi senyawa antara (imin, RCH=NH at R 2 C=NH) yg mpyi ik rangkap C=N Amina 1˚

• Reduksi aminasi bisa menggunakan aldehid at keton baik alifatis maupun aromatis • Contoh reaksi aminasi

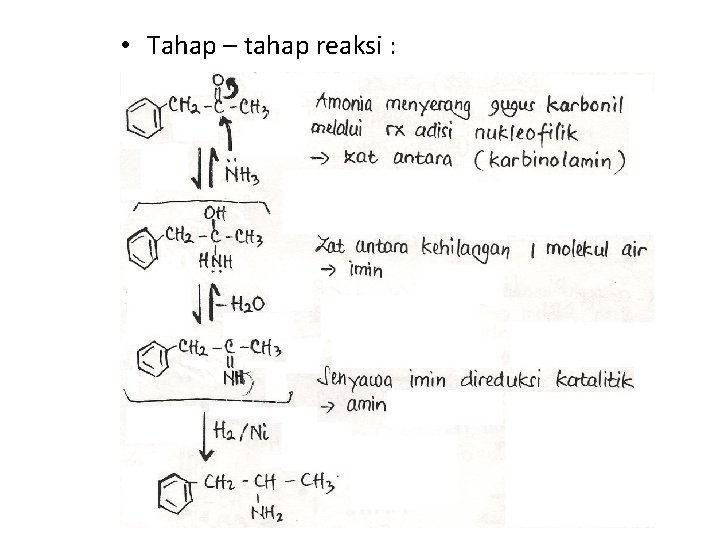
• Tahap – tahap reaksi :

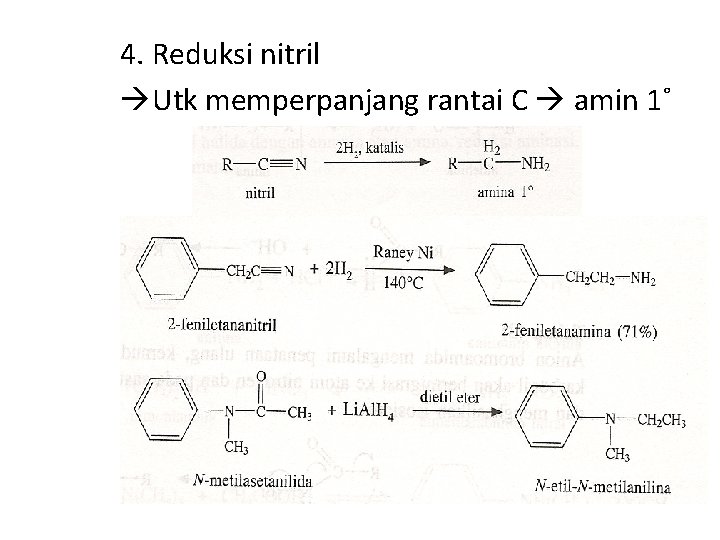
4. Reduksi nitril Utk memperpanjang rantai C amin 1˚

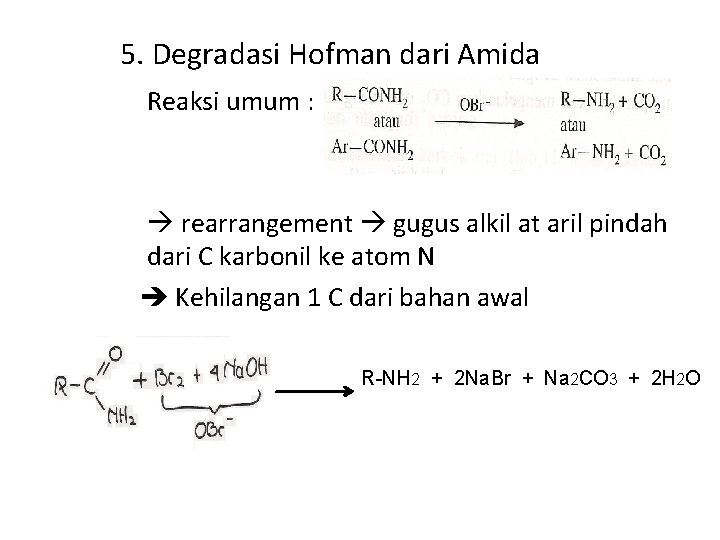
5. Degradasi Hofman dari Amida Reaksi umum : rearrangement gugus alkil at aril pindah dari C karbonil ke atom N Kehilangan 1 C dari bahan awal R-NH 2 + 2 Na. Br + Na 2 CO 3 + 2 H 2 O

• Contoh

Mekanisme reaksi degradasi Hofman Tahap (1) Halogenasi suatu amida dimana N-haloamida yg terjadi dpt diisolasi, kemudian N-haloamida setelah diisolasi direaksikan dg basa. Basa akan menarik proton dari NH 2 anion Anion bereaksi dg bromin pd rx α-substitusi Nbromoamida

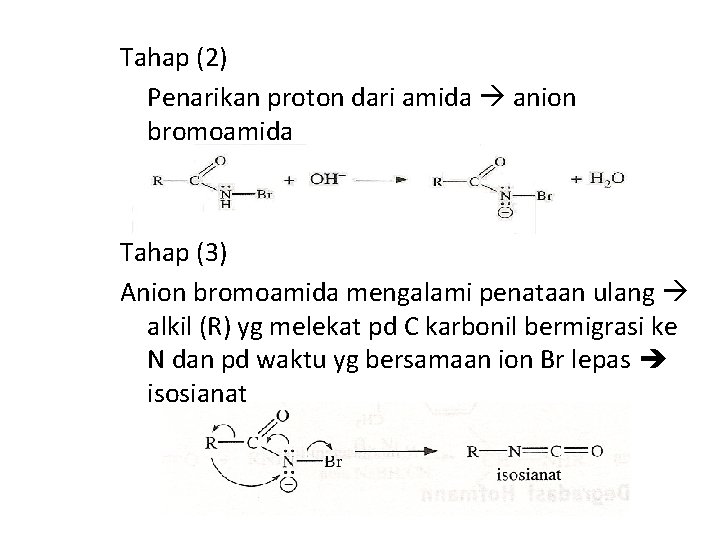
Tahap (2) Penarikan proton dari amida anion bromoamida Tahap (3) Anion bromoamida mengalami penataan ulang alkil (R) yg melekat pd C karbonil bermigrasi ke N dan pd waktu yg bersamaan ion Br lepas isosianat

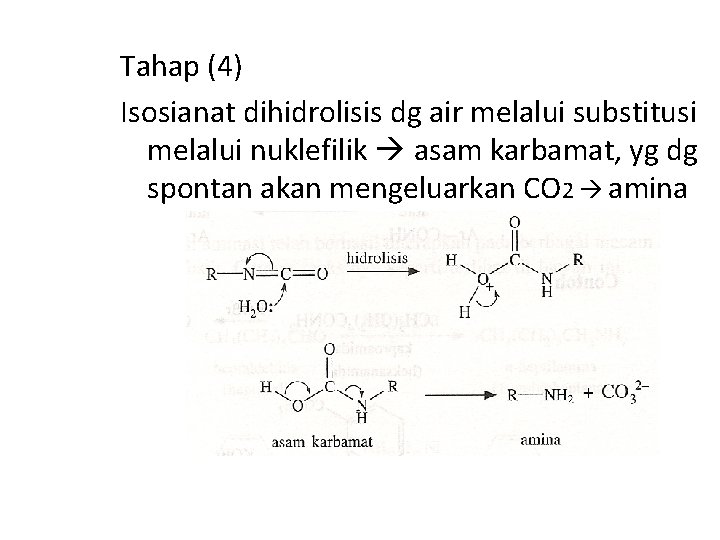
Tahap (4) Isosianat dihidrolisis dg air melalui substitusi melalui nuklefilik asam karbamat, yg dg spontan akan mengeluarkan CO 2 amina

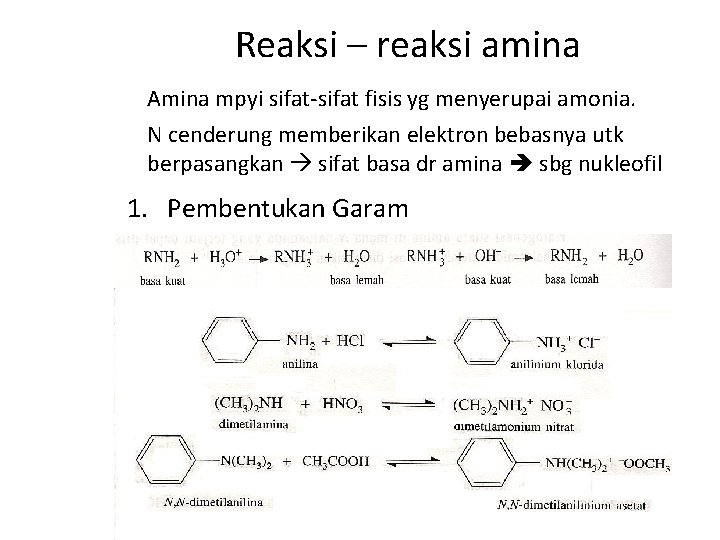
Reaksi – reaksi amina Amina mpyi sifat-sifat fisis yg menyerupai amonia. N cenderung memberikan elektron bebasnya utk berpasangkan sifat basa dr amina sbg nukleofil 1. Pembentukan Garam

2. Reaksi dg asil halida amida Tujuan : utk mensintesa amin lain dg merubahnya amida reduksi amin Senyawa amin nukleofilik menyerang C karbonil mengusir/menggantikan Cl dg kehilangan sebuah proton -Cl diganti oleh gugus –NHR at NR 2

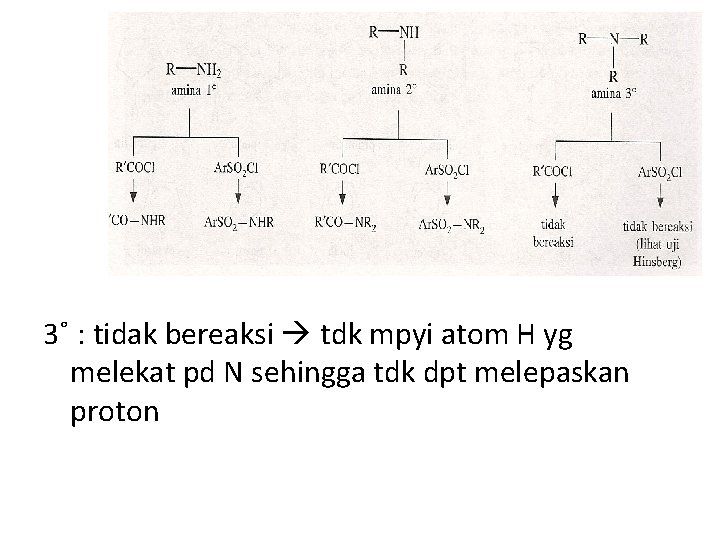
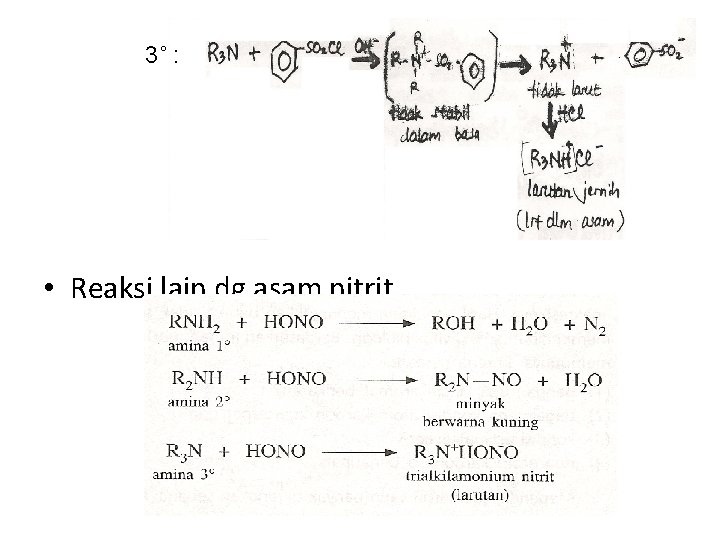
3˚ : tidak bereaksi tdk mpyi atom H yg melekat pd N sehingga tdk dpt melepaskan proton

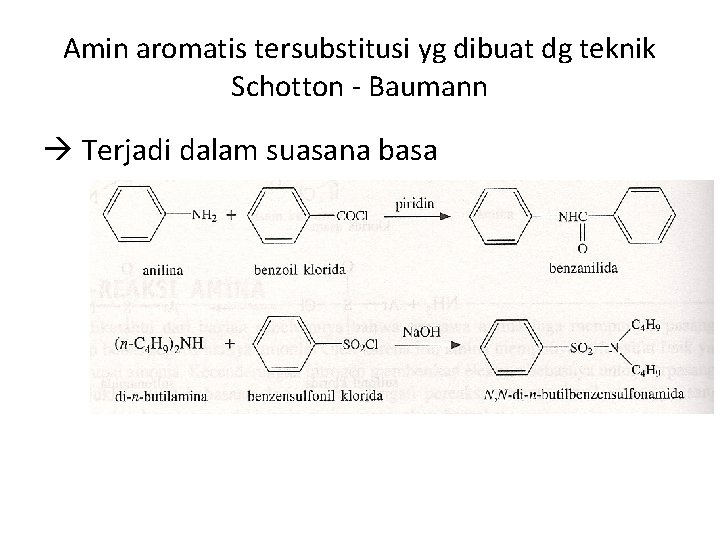
Amin aromatis tersubstitusi yg dibuat dg teknik Schotton - Baumann Terjadi dalam suasana basa

Reaksi Hinsberg Dg benzensulfonil klorida Utk membedakan amin 1˚, 2˚, 3˚ Senyawa amin dikocok dg benzensulfonil klorida dg adanya lar. KOH amin 1˚, 2˚ sulfonamida tersubstitusi 3˚ tdk bereaksi

• Sulfonamida monosubstitusi dari amin 1˚ I H pd N dg KOH garam yg larut ( C<8) ≠ larut (endapan) • Sulfonamida disubstitusi dr amin 2˚ tdk mpyi H yg bersifat asam tdk larut dalam basa kuat

3˚ : • Reaksi lain dg asam nitrit

Sulfanilamid (Sulfonamida) = p-aminobenzen sulfonamida Obat – obat sulfa Amida dari asam sulfanilat Bersifat amfoter dapat bereaksi dg asam at basa

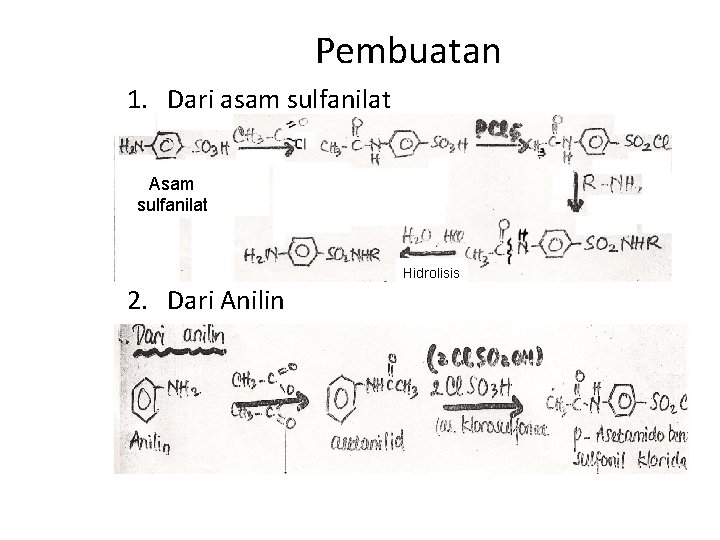
Pembuatan 1. Dari asam sulfanilat Asam sulfanilat Hidrolisis 2. Dari Anilin

Sulfanilamid tersubstitusi • Obat – obat sulfa antibakteri ‘metabolit antagonisme’ bakteri membutuhkan PABA COOH PABA

• Rumus sulfa mirip dg PABA terjadi kompetisi sulfa & PABA bakteri mengambil sulfa COOH PABA • Bakteri antivitamin metanolisme gagal pertumbuhan terhambat • Untuk mendapatkan sulfa berkhasiat baik tergantung pd R yg melekat pd N amida yg paling efektif jika R heterosiklik


Reaksi substitusi pd amin aromatis - NH 2 Penunjuk o, p pd substitusi NHR elektrofilik aromatis NR 2 NHCOR aktivator yg iebih lemah dibandingkan NH 2 ( penarikan elektron oleh O dr C karbonil N amida sumber elektron lebih miskin dar N amin) 1. Halogenasi substitusi terjadi pd setiap posisi orto & para

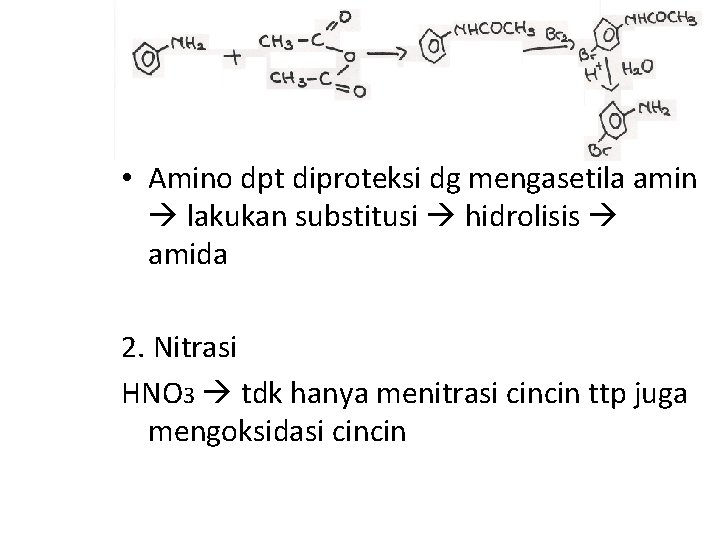
• Amino dpt diproteksi dg mengasetila amin lakukan substitusi hidrolisis amida 2. Nitrasi HNO 3 tdk hanya menitrasi cincin ttp juga mengoksidasi cincin

Dalam HNO 3 yg sangat kuat amin diubah ion anilium (-NH 3+) substitusi dikontrol pleh ion anilium bukan oleh amida –NH 2 pengarah meta Gugus amino perlu diproteksi Asetilasi amina substitusi hidrolisis amin

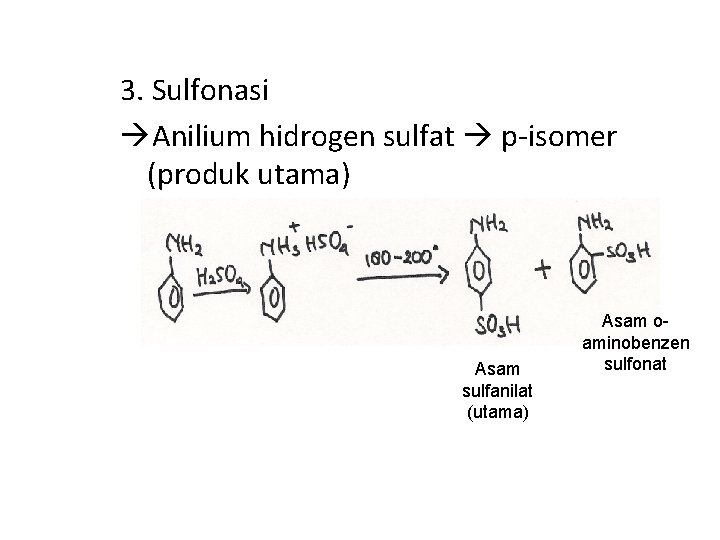
3. Sulfonasi Anilium hidrogen sulfat p-isomer (produk utama) Asam sulfanilat (utama) Asam oaminobenzen sulfonat

SENYAWA R – NO 2 NITROAr – NO 2 • Senyawa dg inti alifatis at aromatis yg mpyi gugus nitro sebagai satu-satunya substituen. • Derivat alkana dg menggantikan 1 ato Hnya dg -NO 2 • Nitroalkana adalah isomer dari ester alkil dg asam nitri alkil nitrit gugus nitro NO 2 terikat pd atom C melalui atom O H 3 C – NO 2 H 3 C – O – NO Nitrometana Metil nitrit

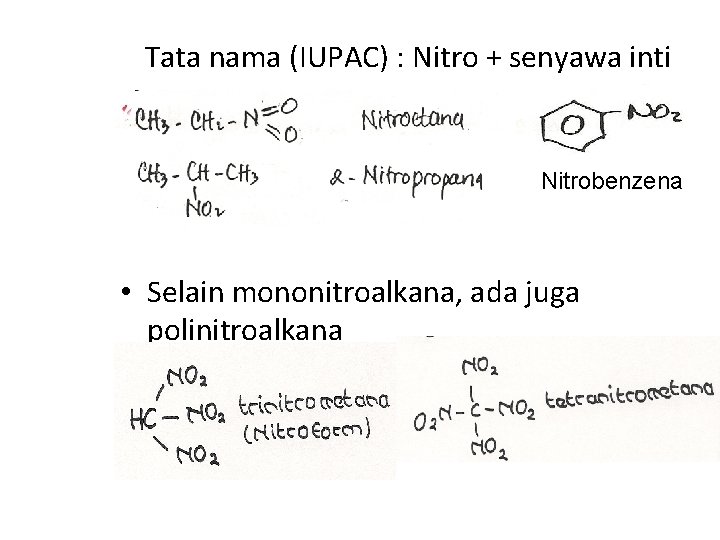
Tata nama (IUPAC) : Nitro + senyawa inti Nitrobenzena • Selain mononitroalkana, ada juga polinitroalkana

Senyawa nitro alifatis Nitroalkana (nitroparafin) Pembuatan 1. Nitrasi alkana dg HNO 3 Reaktivitas : alkana dg atom C 2˚ & 3˚ > mudah bereaksi dg HNO 3

• Jika alkana yg lebih tinggi dinitrasi akan dihasilkan campuran isomer senyawa nitro Propana Isomer nitro propana 2. Dalam laboratorium nitroalkana dibuat dg memanaskan alkil bromida/iodida dg lar. Na. NO 2 dalam DMF yg mengandung sedikit urea (kornblum)

2 -n-oktil nitrit 30% (1 -metilheptil nitrit) • Na. NO 2 dapat diganti dg Ag. NO 2 jumlah nitroalkana 1˚ lebih diperbaiki (prx. Meyer) Oktanaiodida Nitroaoktana

3. Nitroalkana 3˚ dibuat dg hasil terbaik oksidasi t-alkilamin dg KMn. O 4 4. Nitrometana dapat juga dibuat dg memanaskan asam kloroasetat dg lar. Na. NO 2 (kolbe) dekarboksilasi 5. Tetranitroalkana dapat dibuat dg mereaksikan HNO 3(p) berasap dg asetat anhidrat pd suhu rendah (dingin)

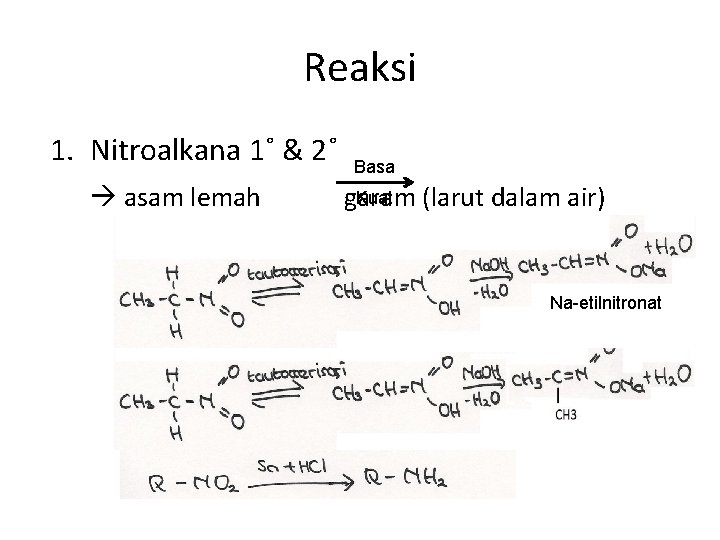
Reaksi 1. Nitroalkana 1˚ & 2˚ asam lemah Basa Kuat garam (larut dalam air) Na-etilnitronat

Sifat fisik • Cairan tidak berwarna • Bau haru, enak • Sedikit larut dalam air, mudah larut dalam pelarut organik Nitro Aromatis • Nitrobenzena • Nitrotoluena

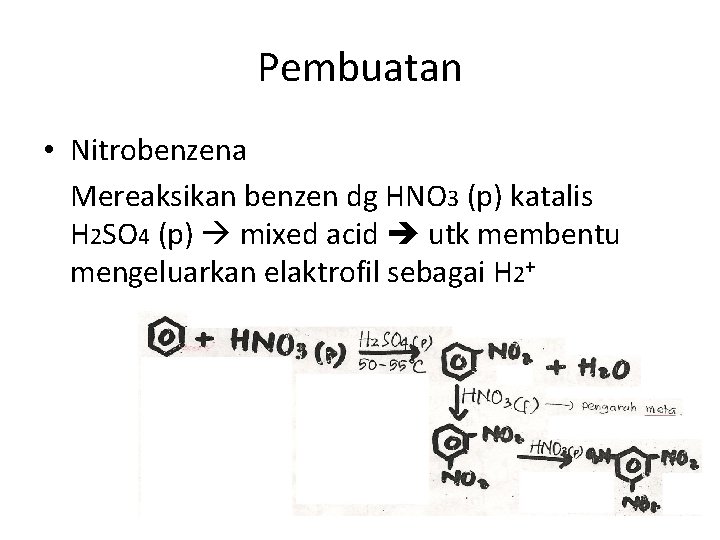
Pembuatan • Nitrobenzena Mereaksikan benzen dg HNO 3 (p) katalis H 2 SO 4 (p) mixed acid utk membentu mengeluarkan elaktrofil sebagai H 2+

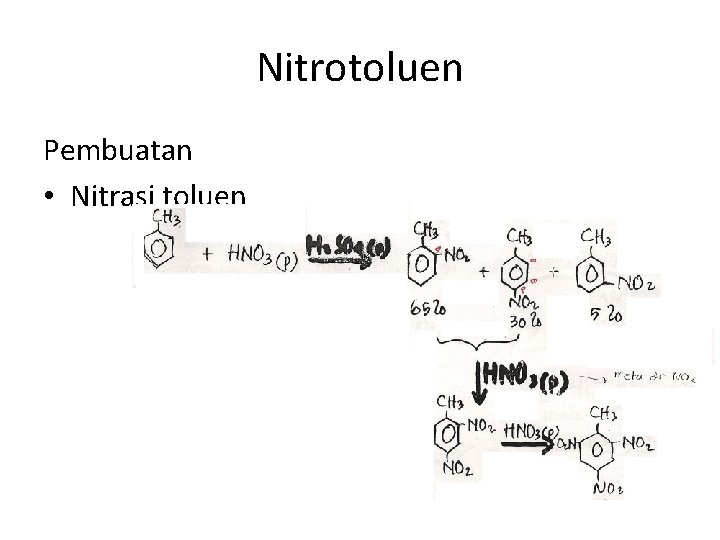
Nitrotoluen Pembuatan • Nitrasi toluen

• Nitrobenzen Sifat fisik – Cairan kuning pucat – Bau tajam (uap beracun, bereaksi dg Hb) – Tdk larut/sedikit larut dalam air, larut dalam pelarut organik • DNB – Kristal kuning pucat – Tdk larut dalam air, larut dalam pelarut organik • TNT – Kristal kuning pucat – Sedikit larut dalam air, alkohol & eter – Bersifat eksplosif, hanya bisa diledakkan dg bantuan detonator (Mercury fulminate)
 Trimetilamina
Trimetilamina Grupo nitro
Grupo nitro Etil metil amina
Etil metil amina Senyawa amina
Senyawa amina Senyawa turunan alkana kelas 12
Senyawa turunan alkana kelas 12 Gugus ester
Gugus ester Rantai karbon terbuka
Rantai karbon terbuka Nefrons
Nefrons Energi ikatan rata-rata
Energi ikatan rata-rata Metabolismo
Metabolismo Eksoterm
Eksoterm Proses ornitin adalah
Proses ornitin adalah Berapa gramkah massa 5 mol emas (ar au = 197) ……
Berapa gramkah massa 5 mol emas (ar au = 197) …… Amônia ureia e ácido úrico
Amônia ureia e ácido úrico Komponimet organike te karbonit
Komponimet organike te karbonit Aromatic ring ir spectrum
Aromatic ring ir spectrum Nitro
Nitro Nitro gem
Nitro gem Senegar mixture
Senegar mixture 1-octyne ir spectrum
1-octyne ir spectrum Nitro tavola periodica
Nitro tavola periodica Nitro ntype
Nitro ntype Hadoop 101
Hadoop 101 Nitro
Nitro Nitro safe
Nitro safe Nitro group ir spectrum
Nitro group ir spectrum Reduction of nitro compound
Reduction of nitro compound Spectroscopy equations
Spectroscopy equations Amina akbar
Amina akbar Aminas
Aminas Amina vs amida
Amina vs amida Amina boubendir
Amina boubendir Amina secundária
Amina secundária Tia amina
Tia amina Etil propil metil amina
Etil propil metil amina Ejemplo de alqueno
Ejemplo de alqueno Amina vasoativa
Amina vasoativa Amina alifatik
Amina alifatik Laura herrera scott
Laura herrera scott Amina purak
Amina purak Aminas biogenas neurotransmisores
Aminas biogenas neurotransmisores Dr sead dizdarevic tuzla
Dr sead dizdarevic tuzla Etyl metyl amin
Etyl metyl amin Amina ka matlab
Amina ka matlab Amina kilpatrick
Amina kilpatrick Amina ka matlab
Amina ka matlab Aminas
Aminas Amina secundaria
Amina secundaria Conclusion of to his coy mistress
Conclusion of to his coy mistress Amina slide that branches to different events
Amina slide that branches to different events Amina nh
Amina nh