Nomenclatura propriet fisiche e rappresentazioni strutturali Alcani lineari
















- Slides: 38


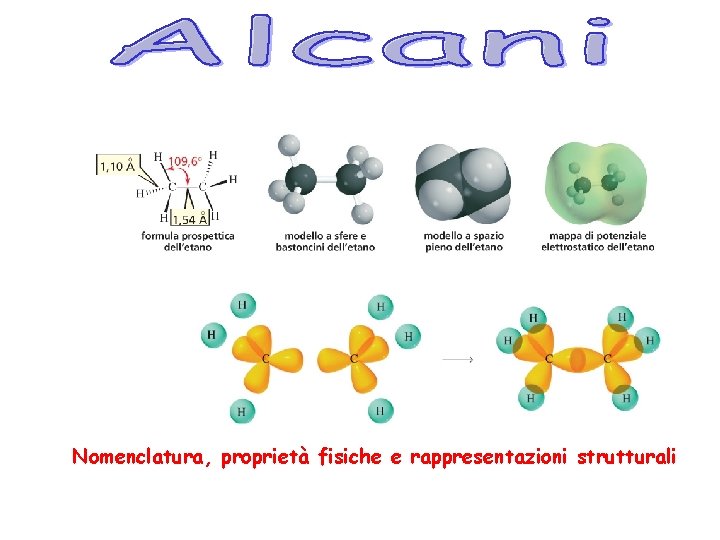
Nomenclatura, proprietà fisiche e rappresentazioni strutturali

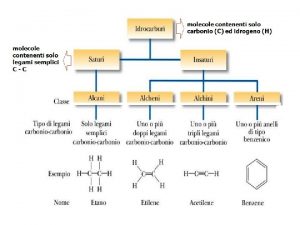
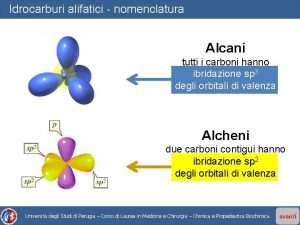
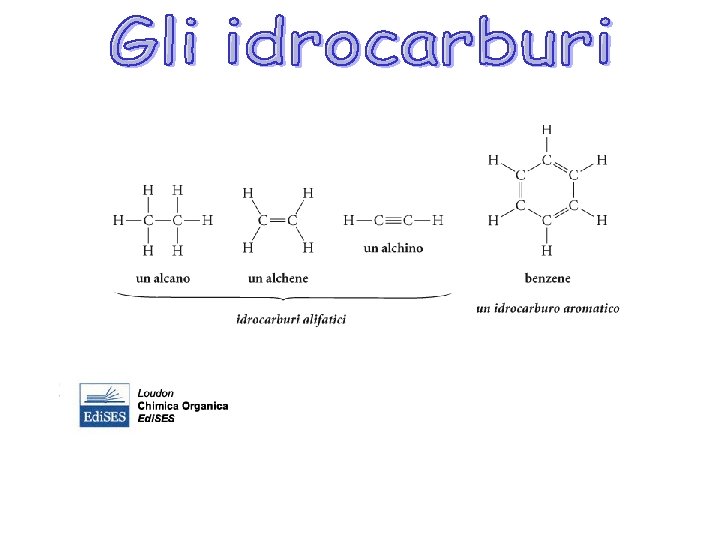
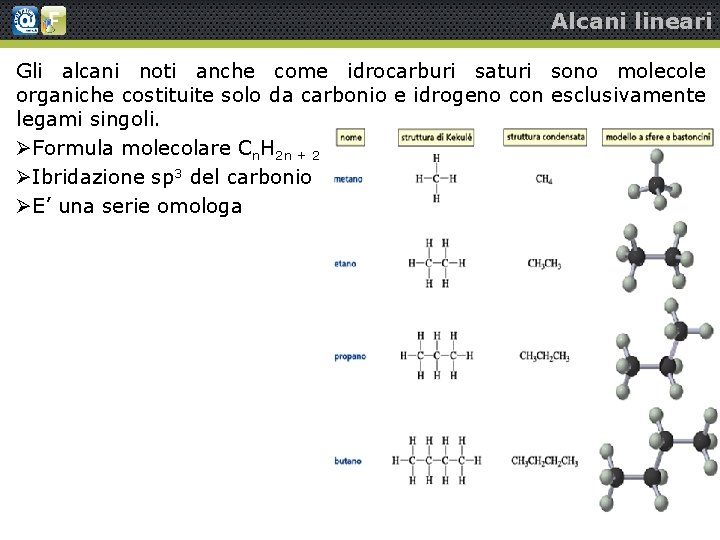
Alcani lineari Gli alcani noti anche come idrocarburi saturi sono molecole organiche costituite solo da carbonio e idrogeno con esclusivamente legami singoli. Formula molecolare Cn. H 2 n + 2 Ibridazione sp 3 del carbonio E’ una serie omologa Alcani semplici

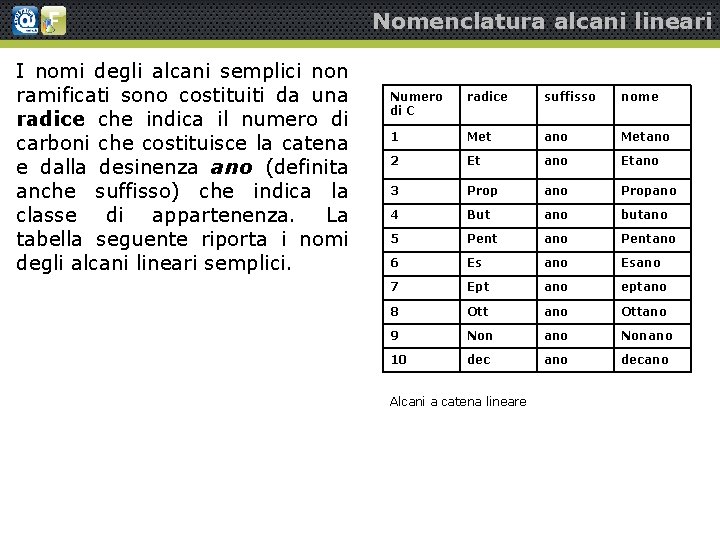
Nomenclatura alcani lineari I nomi degli alcani semplici non ramificati sono costituiti da una radice che indica il numero di carboni che costituisce la catena e dalla desinenza ano (definita anche suffisso) che indica la classe di appartenenza. La tabella seguente riporta i nomi degli alcani lineari semplici. Numero di C radice suffisso nome 1 Met ano Metano 2 Et ano Etano 3 Prop ano Propano 4 But ano butano 5 Pent ano Pentano 6 Es ano Esano 7 Ept ano eptano 8 Ott ano Ottano 9 Non ano Nonano 10 dec ano decano Alcani a catena lineare

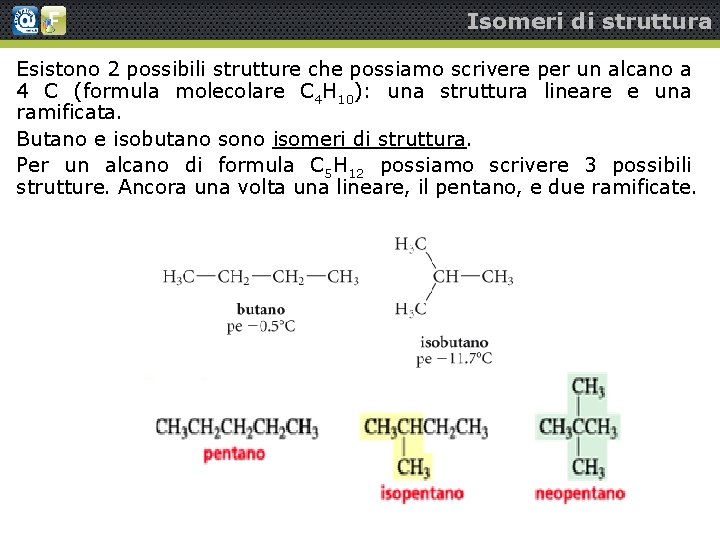
Isomeri di struttura Esistono 2 possibili strutture che possiamo scrivere per un alcano a 4 C (formula molecolare C 4 H 10): una struttura lineare e una ramificata. Butano e isobutano sono isomeri di struttura. Per un alcano di formula C 5 H 12 possiamo scrivere 3 possibili strutture. Ancora una volta una lineare, il pentano, e due ramificate.

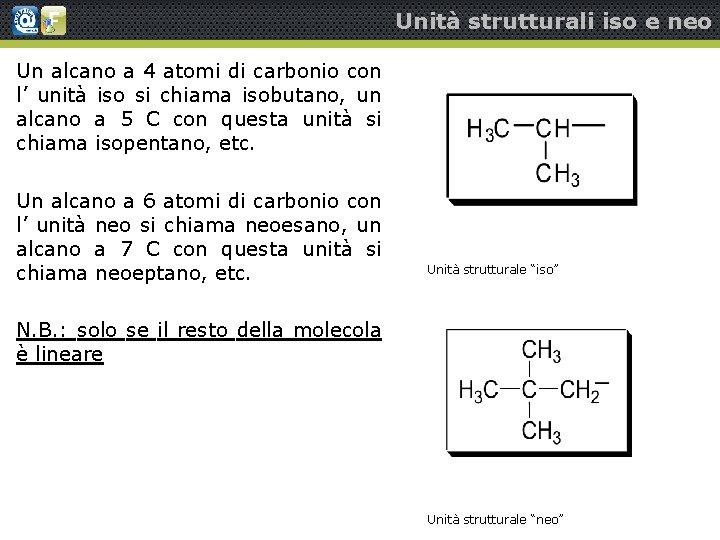
Unità strutturali iso e neo Un alcano a 4 atomi di carbonio con l’ unità iso si chiama isobutano, un alcano a 5 C con questa unità si chiama isopentano, etc. Un alcano a 6 atomi di carbonio con l’ unità neo si chiama neoesano, un alcano a 7 C con questa unità si chiama neoeptano, etc. Unità strutturale “iso” N. B. : solo se il resto della molecola è lineare Unità strutturale “neo”

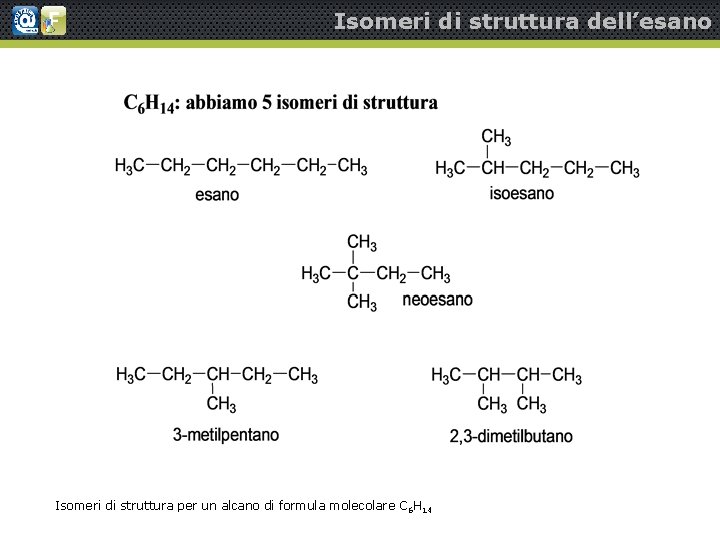
Isomeri di struttura dell’esano Isomeri di struttura per un alcano di formula molecolare C 6 H 14

Isomeri di struttura dell’eptano Isomeri di struttura per un alcano di formula molecolare C 7 H 16

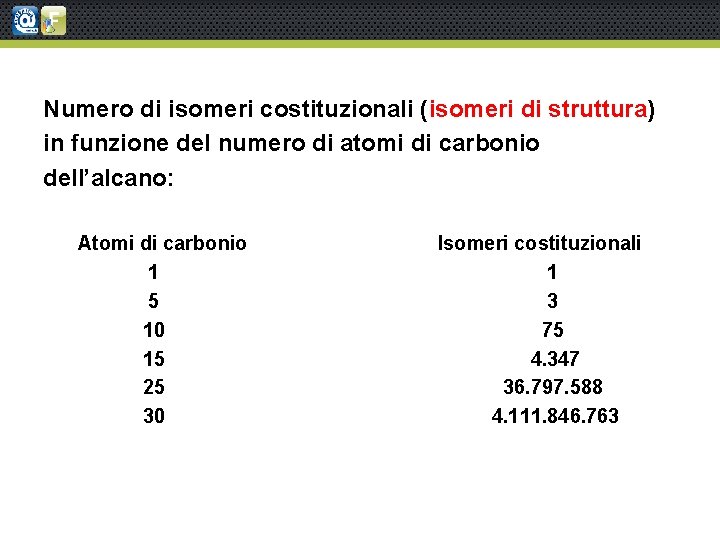
Numero di isomeri costituzionali (isomeri di struttura) in funzione del numero di atomi di carbonio dell’alcano: Atomi di carbonio 1 5 10 15 25 30 Isomeri costituzionali 1 3 75 4. 347 36. 797. 588 4. 111. 846. 763

Radicali alchilici Rimuovendo un idrogeno da una catena alchilica si ottiene un radicale alchilico. Il nome di un radicale alchilico si ottiene sostituendo il suffisso ano dell’alcano corrispondente con il suffisso ile. Il nome dei radicali alchilici è molto importante per la nomenclatura degli alcani ramificati. CH 4 metano CH 3 - metile CH 3 etano CH 3 CH 2 - etile CH 3 CH 2 CH 3 propano CH 3 CH 2 - propile

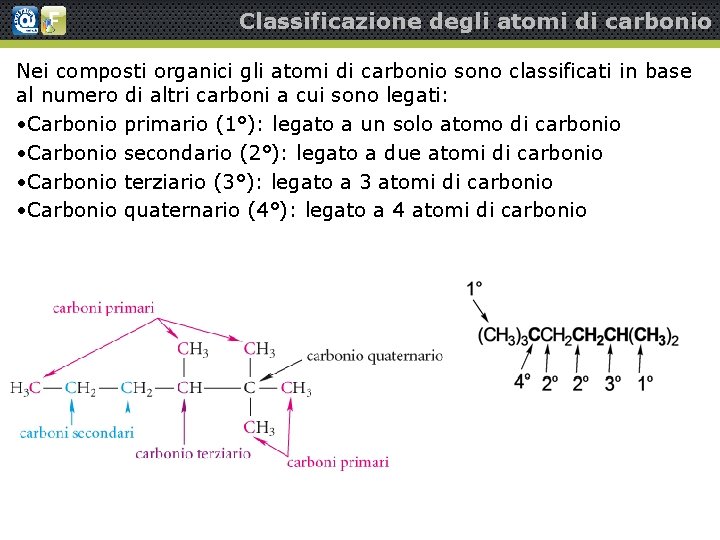
Classificazione degli atomi di carbonio Nei composti organici gli atomi di carbonio sono classificati in base al numero di altri carboni a cui sono legati: • Carbonio primario (1°): legato a un solo atomo di carbonio • Carbonio secondario (2°): legato a due atomi di carbonio • Carbonio terziario (3°): legato a 3 atomi di carbonio • Carbonio quaternario (4°): legato a 4 atomi di carbonio

I nternational U nion of P ure and A pplied C hemistry

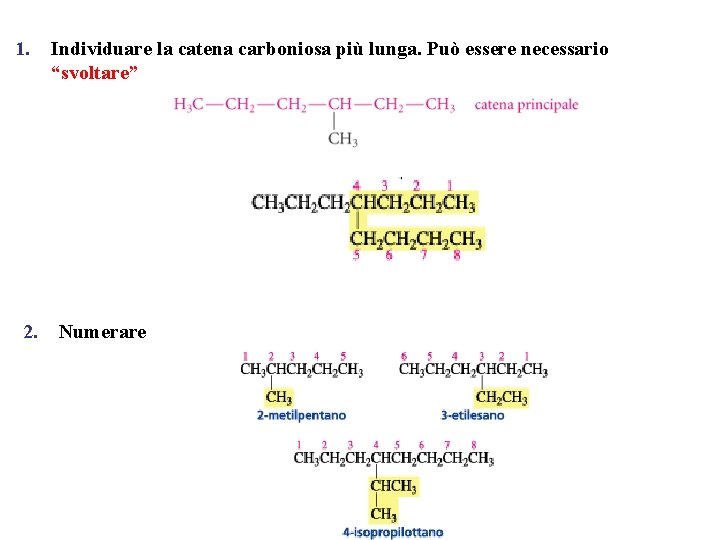
1. 2. Individuare la catena carboniosa più lunga. Può essere necessario “svoltare” Numerare

3. Numero più basso possibile al primo sostituente. Se tutte le possibili direzioni di numerazione portano allo stesso numero per il 1° sostituente: numero più basso al 2° sostituente.

5. Numero più basso al sostituente citato per primo Con due possibili catene a parità di lunghezza bisogna scegliere la più sostituita

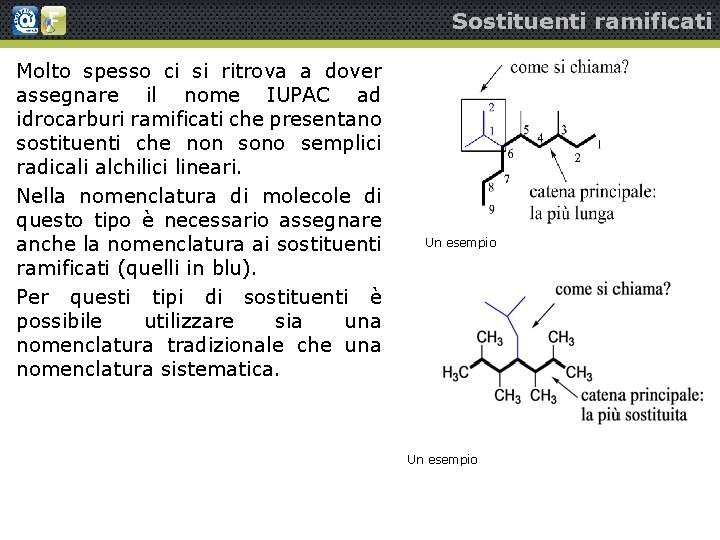
Sostituenti ramificati Molto spesso ci si ritrova a dover assegnare il nome IUPAC ad idrocarburi ramificati che presentano sostituenti che non sono semplici radicali alchilici lineari. Nella nomenclatura di molecole di questo tipo è necessario assegnare anche la nomenclatura ai sostituenti ramificati (quelli in blu). Per questi tipi di sostituenti è possibile utilizzare sia una nomenclatura tradizionale che una nomenclatura sistematica. Un esempio

Nomenclatura d’uso di sostituenti ramificati Per sostituenti ramificati costituiti da una catena principale a 2, 3, 4 e 5 atomi di carbonio è possibile utilizzare nomi d’uso. I principali nomi d’uso che possono essere usati nella nomenclatura IUPAC sono riportati nell’immagine a lato e ricordano le unità strutturali iso e neo oppure il tipo di carbonio sostituito (sec per secondario e tert per terziario). Nomenclatura d’uso di sostituenti ramificati

Nomenclatura sistematica di sostituenti ramificati Per assegnare la nomenclatura sistematica di sostituenti ramificati si procede nel modo seguente: individuare la catena principale del sostituente numerare la catena del sostituente dando il numero 1 al carbonio direttamente legato all’idrocarburo principale individuare le ramificazioni e la loro posizione il nome del sostituente va in parentesi insieme al numero che indica la posizione della ramificazione fuori dalla parentesi va posto il numero che si riferisce alla posizione sull’idrocarburo principale.

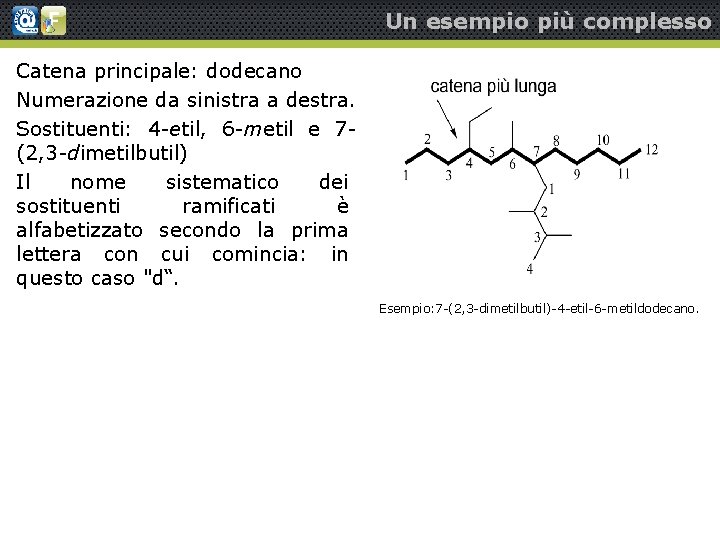
Un esempio più complesso Catena principale: dodecano Numerazione da sinistra a destra. Sostituenti: 4 -etil, 6 -metil e 7(2, 3 -dimetilbutil) Il nome sistematico dei sostituenti ramificati è alfabetizzato secondo la prima lettera con cui comincia: in questo caso "d“. Esempio: 7 -(2, 3 -dimetilbutil)-4 -etil-6 -metildodecano.

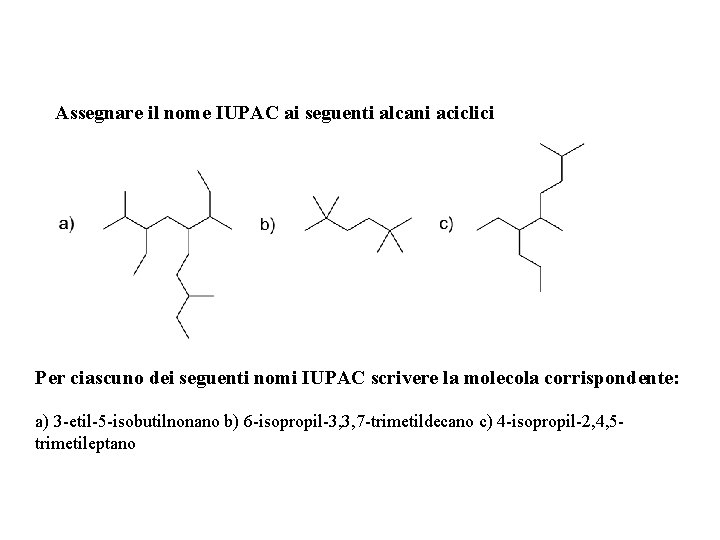
Assegnare il nome IUPAC ai seguenti alcani aciclici Per ciascuno dei seguenti nomi IUPAC scrivere la molecola corrispondente: a) 3 -etil-5 -isobutilnonano b) 6 -isopropil-3, 3, 7 -trimetildecano c) 4 -isopropil-2, 4, 5 trimetileptano

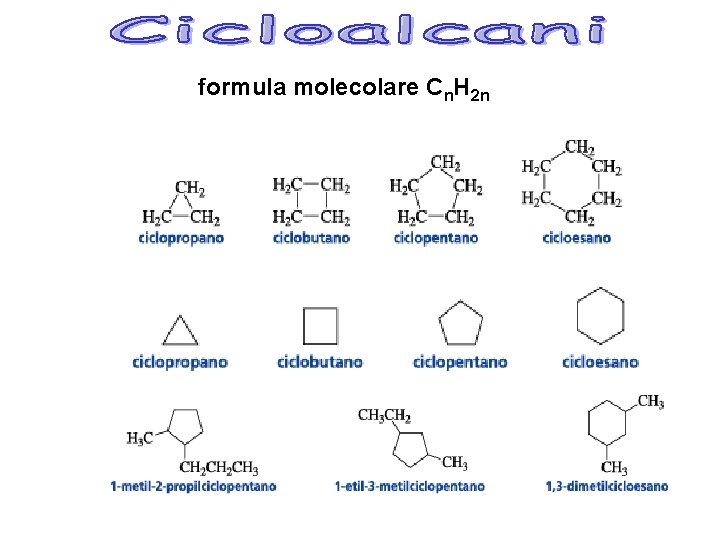
formula molecolare Cn. H 2 n

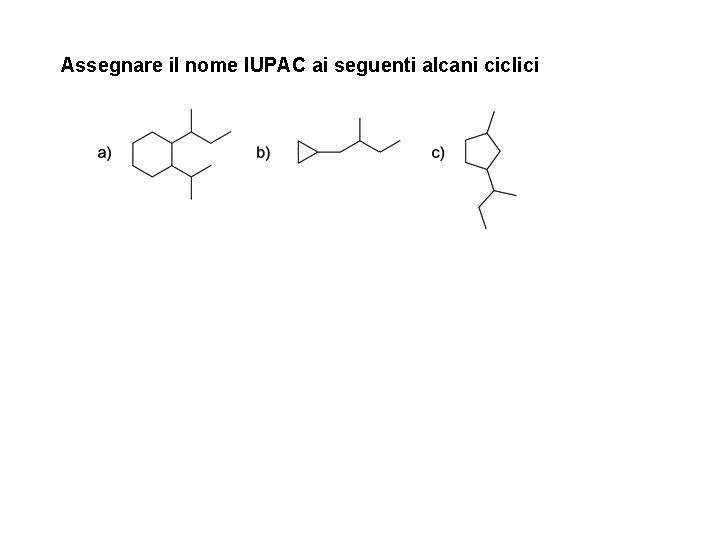
Assegnare il nome IUPAC ai seguenti alcani ciclici



Il neopentano ha una temperatura di ebollizione più bassa del pentano




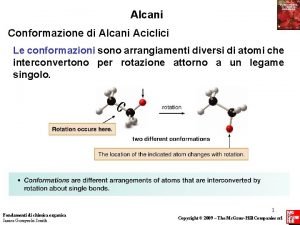
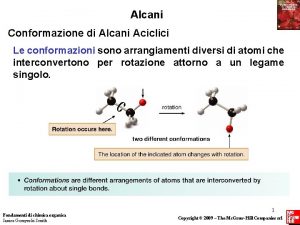
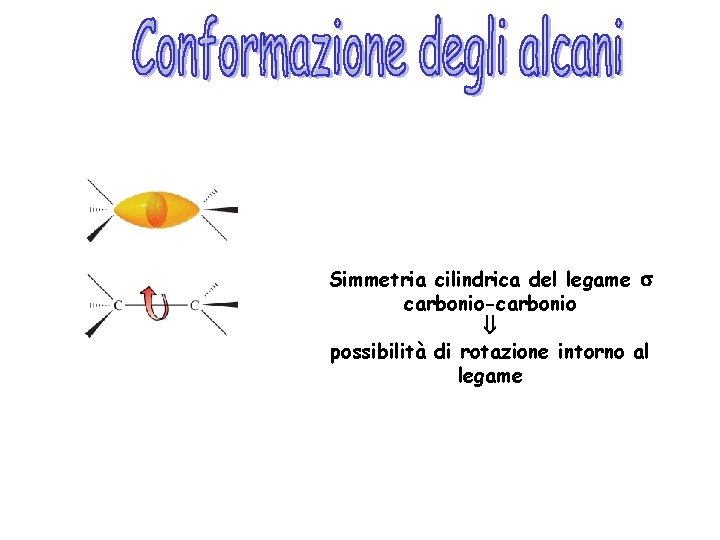
Simmetria cilindrica del legame s carbonio-carbonio possibilità di rotazione intorno al legame


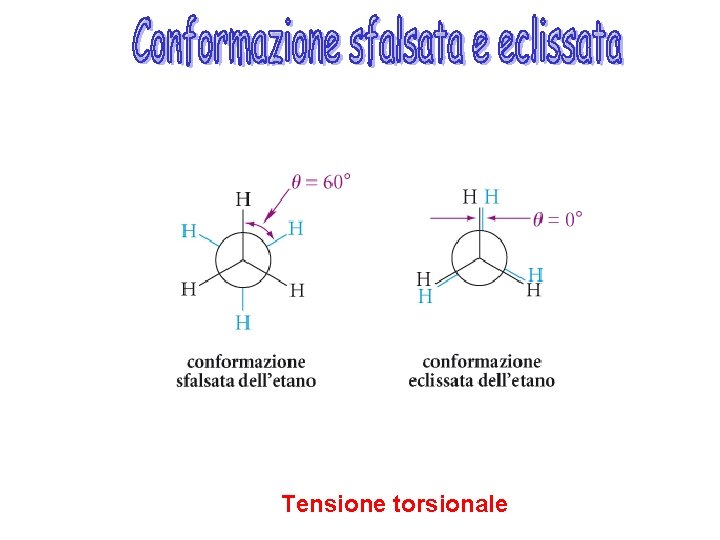
Tensione torsionale

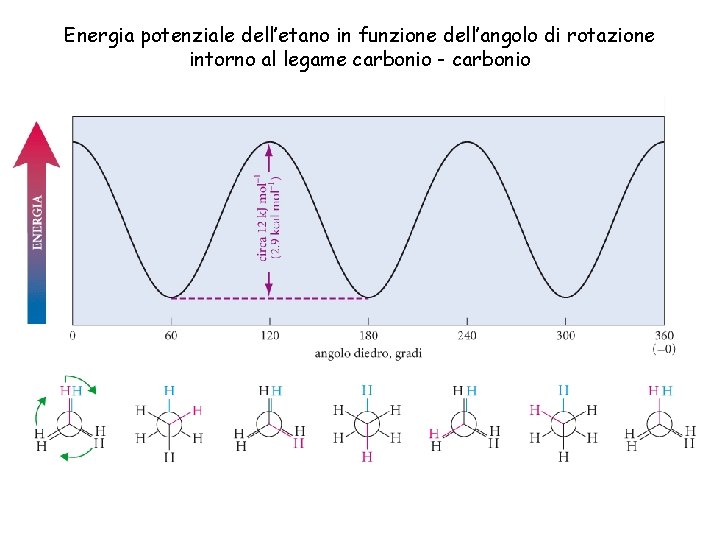
Energia potenziale dell’etano in funzione dell’angolo di rotazione intorno al legame carbonio - carbonio


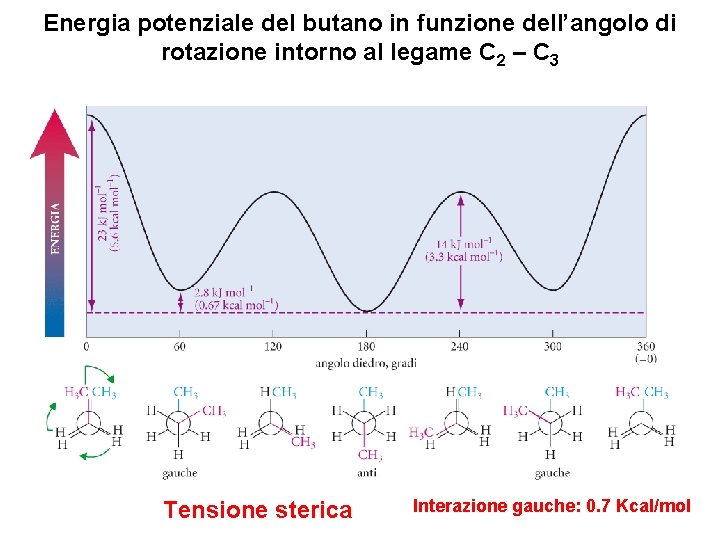
Energia potenziale del butano in funzione dell’angolo di rotazione intorno al legame C 2 – C 3 Tensione sterica Interazione gauche: 0. 7 Kcal/mol

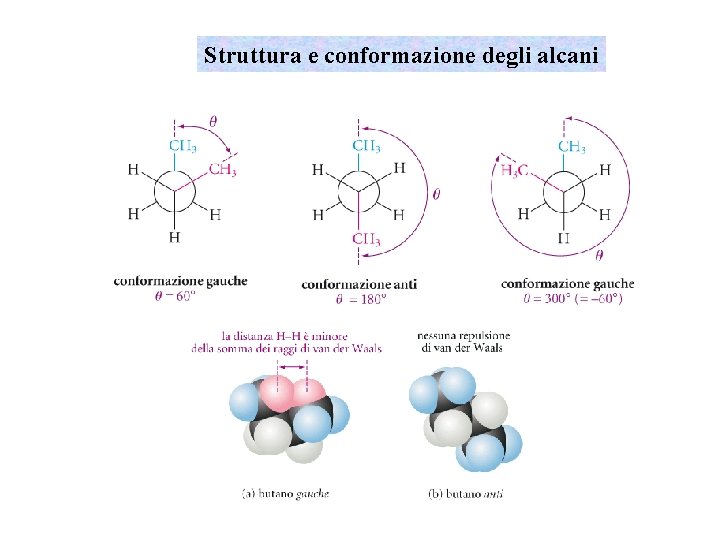
Struttura e conformazione degli alcani

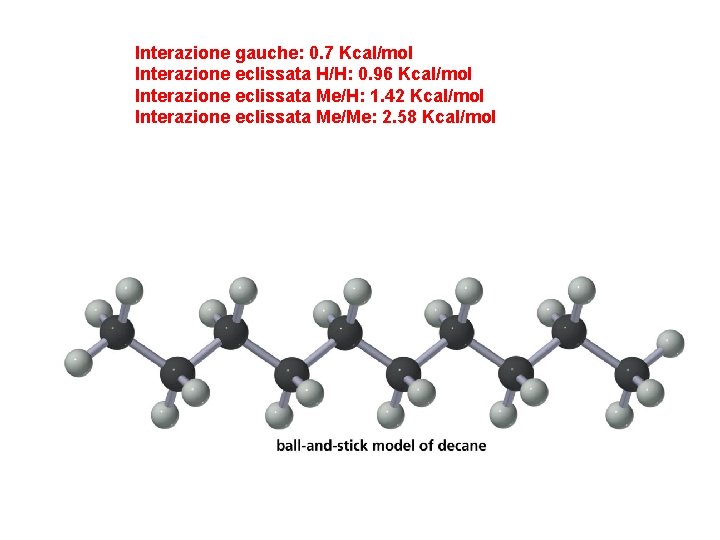
Interazione gauche: 0. 7 Kcal/mol Interazione eclissata H/H: 0. 96 Kcal/mol Interazione eclissata Me/H: 1. 42 Kcal/mol Interazione eclissata Me/Me: 2. 58 Kcal/mol


 Proprietà fisiche degli alcani
Proprietà fisiche degli alcani Irmag rappresentazioni materne
Irmag rappresentazioni materne Proposizioni mentali
Proposizioni mentali Elementi strutturali di una nave
Elementi strutturali di una nave Elementi strutturali coperture
Elementi strutturali coperture Tipologie strutturali
Tipologie strutturali Fabula testo narrativo
Fabula testo narrativo Guida ai fondi strutturali europei 2014-2020
Guida ai fondi strutturali europei 2014-2020 Ampere unità di misura
Ampere unità di misura Autore
Autore Multipli e sottomultipli
Multipli e sottomultipli Le grandezze fisiche riassunto
Le grandezze fisiche riassunto Stato termodinamico
Stato termodinamico Mappa concettuale trasformazioni fisiche e chimiche
Mappa concettuale trasformazioni fisiche e chimiche Sistema impossibile definizione
Sistema impossibile definizione Vulcani lineari
Vulcani lineari Dominio di una circonferenza
Dominio di una circonferenza Disequazioni simboli
Disequazioni simboli Funzioni lineari
Funzioni lineari Sistemi lineari tempo invarianti
Sistemi lineari tempo invarianti Sistema di disequazioni lineari
Sistema di disequazioni lineari Codici del linguaggio logico matematico
Codici del linguaggio logico matematico Sistemi di equazioni non lineari
Sistemi di equazioni non lineari Disequazioni di due variabili
Disequazioni di due variabili Sistemi non lineari
Sistemi non lineari Gruppi alchilici
Gruppi alchilici Combustione alcano
Combustione alcano Alcani saturi
Alcani saturi Etilciclobutano
Etilciclobutano 3 metil ciclopentino
3 metil ciclopentino Isomeri dell'eptano
Isomeri dell'eptano Gruppo alchenico
Gruppo alchenico Ciclo alcano
Ciclo alcano Etileptano
Etileptano Cicloalcadiena
Cicloalcadiena Alcani alcheni alchini
Alcani alcheni alchini Gruppo nh
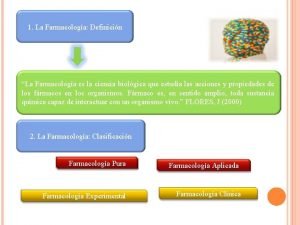
Gruppo nh Farmacología
Farmacología Alcoholes nomenclatura
Alcoholes nomenclatura