Chimica organica percorso di recupero e ripasso Alcani












- Slides: 21

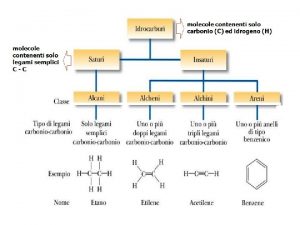
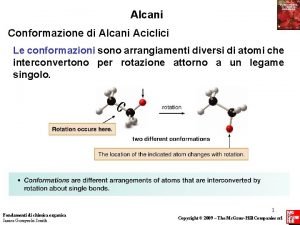
Chimica organica percorso di recupero e ripasso Alcani, isomeria

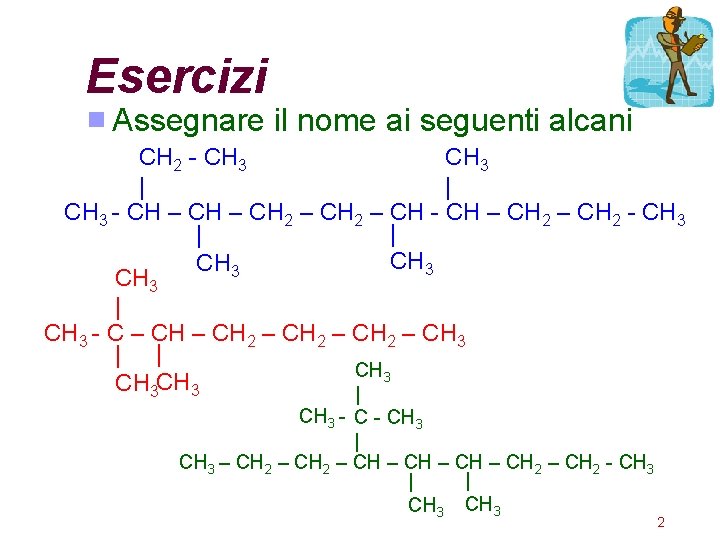
Esercizi Assegnare il nome ai seguenti alcani CH 2 - CH 3 | | CH 3 - CH – CH 2 – CH - CH – CH 2 - CH 3 | | CH 3 | CH 3 - C – CH 2 – CH 3 | | CH 3 CH 3 | CH 3 - CH 3 | CH 3 – CH 2 – CH 2 - CH 3 | | CH 3 2

Dal nome alla formula Dato il nome è possibile risalire alla formula di un alcano? Disegnare la struttura del 6 -ter-butil-2, 7 -dimetildodecano 1. 2. 3. Disegnare la struttura principale (12 atomi di carbonio) Individuare le posizioni delle ramificazioni Inserire i gruppi alchilici corretti Disegna le strutture dei seguenti alcani 2, 2, 4 -trimetilottano 5 -ter-butil-3 -metildecano 3

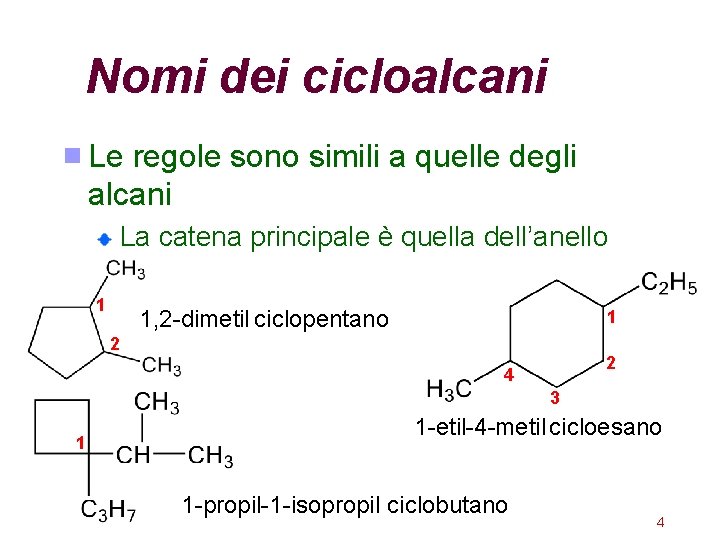
Nomi dei cicloalcani Le regole sono simili a quelle degli alcani La catena principale è quella dell’anello 1 1, 2 -dimetil ciclopentano 1 2 2 4 3 1 1 -etil-4 -metil cicloesano 1 -propil-1 -isopropil ciclobutano 4

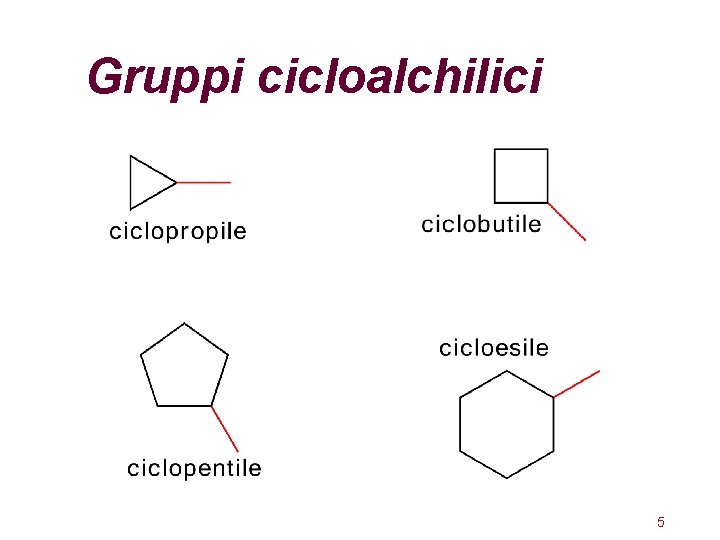
Gruppi cicloalchilici 5

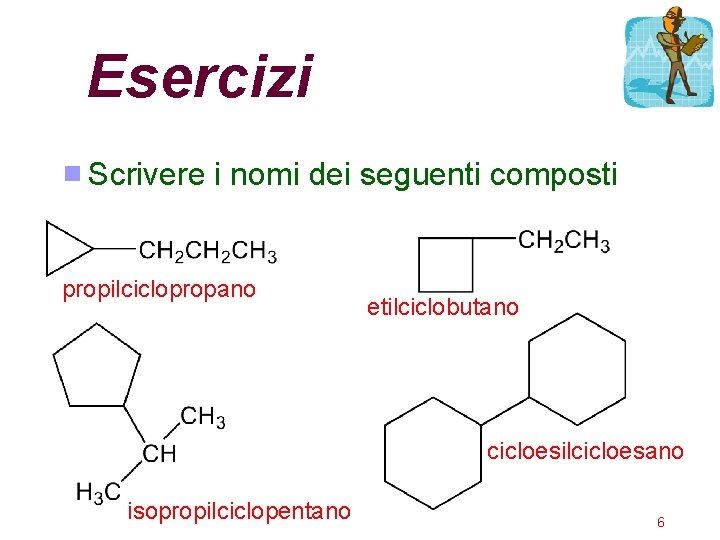
Esercizi Scrivere i nomi dei seguenti composti propilciclopropano etilciclobutano cicloesilcicloesano isopropilciclopentano 6

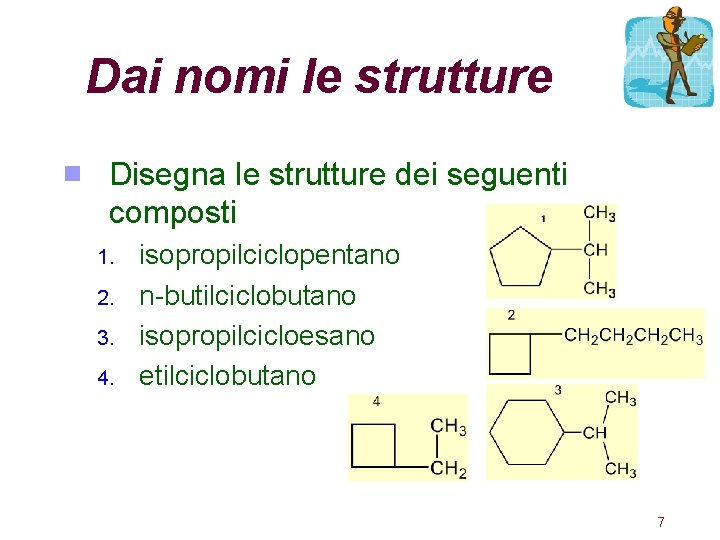
Dai nomi le strutture Disegna le strutture dei seguenti composti 1. 2. 3. 4. isopropilciclopentano n-butilciclobutano isopropilcicloesano etilciclobutano 7

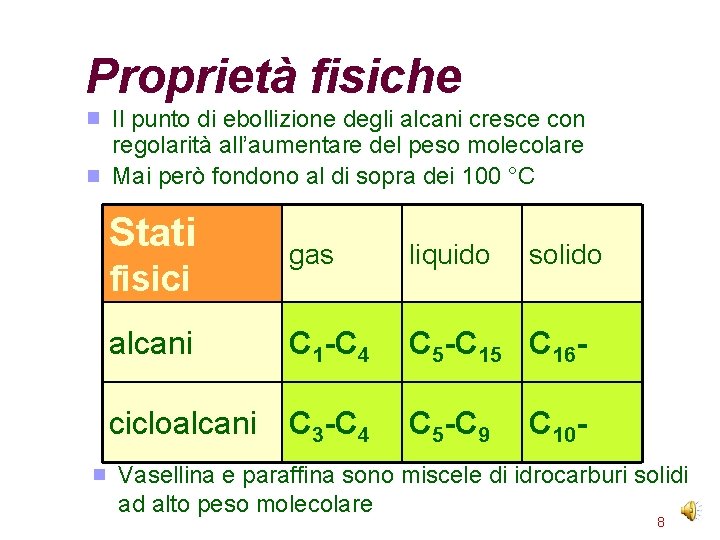
Proprietà fisiche Il punto di ebollizione degli alcani cresce con regolarità all’aumentare del peso molecolare Mai però fondono al di sopra dei 100 °C Stati gas liquido alcani C 1 -C 4 C 5 -C 15 C 16 - cicloalcani C 3 -C 4 C 5 -C 9 fisici solido C 10 - Vasellina e paraffina sono miscele di idrocarburi solidi ad alto peso molecolare 8

Fusione e solidificazione Il punto di ebollizione diminuisce con la ramificazione Il punto di fusione diminuisce con la ramificazione T pentano 2 -metilbutano p. f. – 129, 7 p. f. – 160 p. e. 36, 1 p. e. 29, 7 9

Densità relativa Sale anche la densità relativa con il peso molecolare Da 0, 416 g/ml per il metano A 0, 79 g/ml per l’eicosano (C 20) Tutti gli idrocarburi sono sostanze apolari e come tali non si sciolgono in acqua ma in solventi polari o costituiscono essi stessi buoni solventi apolari 10

Proprietà chimiche Gli alcani sono anche chiamati genericamente paraffine (parum affinis) Si intende una scarsa reattività (affinità) con i più aggressivi acidi e basi inorganici Anche i cicloalcani hanno proprietà simili agli alcani Le reazioni tipiche sono Alogenazione Combustione 11

Alogenazione Reagiscono principalmente il cloro ed il bromo e in presenza di luce Tra metano e cloro possiamo rappresentare: luce CH 4 + Cl 2 CH 3 – Cl + H – Cl La reazione porta alla formazione di un alogenuro alchilico (cloruro di metile) Avviene in presenza della luce 12

Reazione radicalica Cl. -. Cl La reazione è di tipo radicalico e il processo avviene in 3 stadi Inizio Propagazione Terminazione Un radicale è una specie atomica o un gruppo molecolare che possiede un elettrone spaiato I radicali si ottengono per rottura omolitica di un legame 13

Inizio di reazione Avviene quando le radiazioni UV provocano una omolisi di un legame (apolare) Gli alogeni sono più sensibili di altri a questo tipo di azione (specie il cloro) Cl 2 2 Cl. (radicali liberi) Bastano pochi radicali per innescare la reazione poiché la fase di propagazione si autoalimenta 14

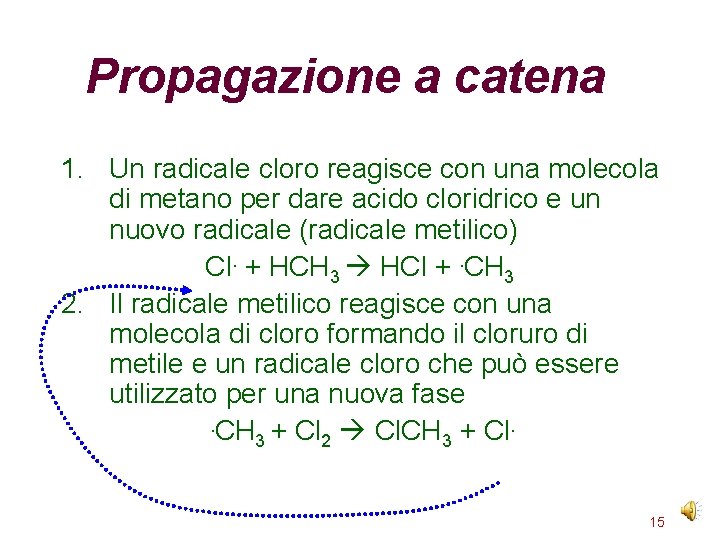
Propagazione a catena 1. Un radicale cloro reagisce con una molecola di metano per dare acido cloridrico e un nuovo radicale (radicale metilico) Cl. + HCH 3 HCl +. CH 3 2. Il radicale metilico reagisce con una molecola di cloro formando il cloruro di metile e un radicale cloro che può essere utilizzato per una nuova fase. CH + Cl Cl. CH + Cl. 3 2 3 15

Terminazione di catena Quando due radicali liberi di qualsiasi tipo si incontrano la catena di reazione si interrompe Cl. + Cl. Cl 2 Cl. +. CH 3 Cl. CH 3. CH +. CH CH 3 3 16

Considerazioni L’alogenazione non si ferma mai ad una monosostituzione ma prosegue fino a sostituire tutti gli idrogeni a disposizione CH 4 + Cl 2 CH 3 – Cl + CH 2 – Cl 2 + CH – Cl 3 + CCl 4 + H – Cl Cloruro di metile Dicloro metano Cloroformi o Tetraclorur o di carbonio 17

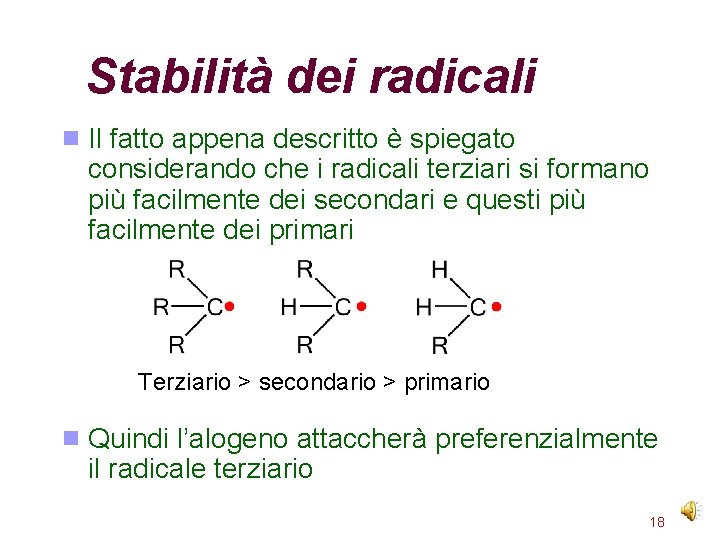
Stabilità dei radicali Il fatto appena descritto è spiegato considerando che i radicali terziari si formano più facilmente dei secondari e questi più facilmente dei primari Terziario > secondario > primario Quindi l’alogeno attaccherà preferenzialmente il radicale terziario 18

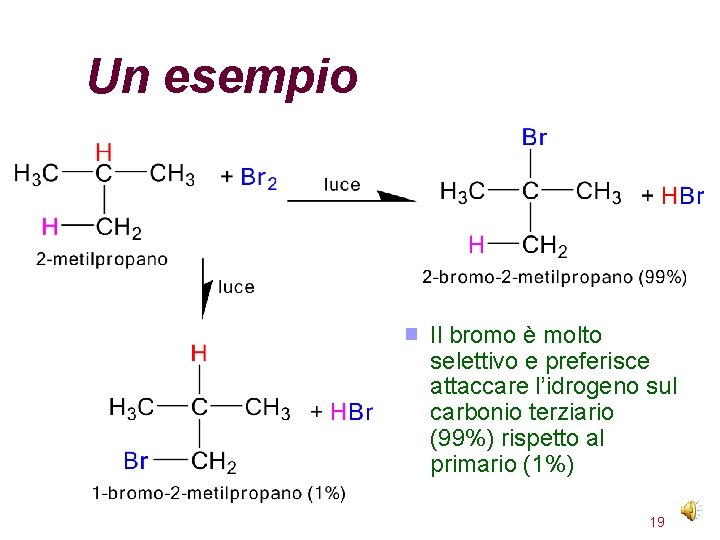
Un esempio Il bromo è molto selettivo e preferisce attaccare l’idrogeno sul carbonio terziario (99%) rispetto al primario (1%) 19

Combustione Alcani e cicloalcani sono combustibili La reazione è importante per la produzione di energia L’equazione generale per gli alcani è: Cn. H 2 n+2 + (3 n+1)/2 O 2 n. CO 2 + (n+1)H 2 O + Q L’equazione generale per i cicloalcani è: Cn. H 2 n + (3 n)/2 O 2 n. CO 2 + (n)H 2 O + Q 20

Fine Alcani, isomeria
 Alcani chimica organica
Alcani chimica organica Alchilammine
Alchilammine Formula di struttura alcani
Formula di struttura alcani Chimica organica
Chimica organica Acido 4 amminobutanoico
Acido 4 amminobutanoico Gruppo funzionale alcani
Gruppo funzionale alcani Fondamenti di chimica organica smith usato
Fondamenti di chimica organica smith usato Soluzioni capitolo a1 chimica organica
Soluzioni capitolo a1 chimica organica Chimica organica
Chimica organica Alcani alcheni alchini mappa concettuale
Alcani alcheni alchini mappa concettuale Classificazione dei composti inorganici
Classificazione dei composti inorganici Recupero di fatti numerici
Recupero di fatti numerici Recupero de gastos
Recupero de gastos Recupero di fatti numerici
Recupero di fatti numerici Recupero acque piovane normativa
Recupero acque piovane normativa Verrocchio soave
Verrocchio soave Ripasso letteratura italiana
Ripasso letteratura italiana Simboli matematici
Simboli matematici Ripasso grammatica latina
Ripasso grammatica latina Ripasso disequazioni
Ripasso disequazioni Ripasso promessi sposi
Ripasso promessi sposi Amplitudine ortiva
Amplitudine ortiva