Nama Mata Kuliah Kode MKA 121111063 TEORI DASAR















































![p kareana [H+] sangat kecil sehingga diabaikan, maka Nama Program Studi - UPNYK 55 p kareana [H+] sangat kecil sehingga diabaikan, maka Nama Program Studi - UPNYK 55](https://slidetodoc.com/presentation_image_h/e1fd69b9a1b030e75ff1e69f2f85b516/image-55.jpg)





![Karena [LOH] = [H+] dan [L+] = konsentrasi garam = G, maka pers (1) Karena [LOH] = [H+] dan [L+] = konsentrasi garam = G, maka pers (1)](https://slidetodoc.com/presentation_image_h/e1fd69b9a1b030e75ff1e69f2f85b516/image-61.jpg)

![p Dari persamaan 5 dan 6 diperoleh p Apabila pers (4) dikalikan [H+] dan p Dari persamaan 5 dan 6 diperoleh p Apabila pers (4) dikalikan [H+] dan](https://slidetodoc.com/presentation_image_h/e1fd69b9a1b030e75ff1e69f2f85b516/image-63.jpg)










- Slides: 73

Nama Mata Kuliah (Kode MKA 121111063 TEORI DASAR ANALISIS KUALITATIF Nama Program Studi - UPNYK 1

Deskripsi Bab pertama ini membahas tentang Teori Disosiasi Elektrolit, Teori asam-basa, Hukum Aksi massa, Hasil kali kelarutan, p. H larutan dan hidrolisa garam Nama Program Studi - UPNYK 2

Tujuan Instruksional Khusus (TIK) Setelah membaca bab I ini, mahasiswa mampu menjelaskan Disosiasi Elektrolit, Teori asam-basa, Hukum Aksi massa, Hasil kali kelarutan dan penerapannya untuk pengendapan serta dapat menghitung p. H larutan asam, basa dan garam Nama Program Studi - UPNYK 3

1. Teori disosiasi elektrolit p Larutan adalah suatu sistem homogen yang terdiri dari dua komponen atau lebih yang berada dalam satu fasa. Nama Program Studi - UPNYK 4

p Zat dapat dibedakan menjadi dua, yaitu : n zat elekrolit Yaitu suatu zat yang apabila dilarutkan, maka larutannya dapat menghantarkan arus listrik. Misalnya asam, basa dan garam anorganik. non elektrolit. Yaitu suatu zat yang apabila dilarutkan, maka larutannya tidak dapat menghantarkan arus listrik. Misalnya : glukosa, sukrosa, etanol, urea dan senyawa-senyawa organik lainnya. n zat Nama Program Studi - UPNYK 5

p suatu zat bersifat elektrolit dalam air, misal Na. Cl, mungkin tak menghasilkan larutan yang menghantarkan listrik dalam pelarut lain seperti eter atau heksana. p Dalam larutan, suatu zat elektrolit terurai menjadi bagian-bagian bermuatan listrik yang disebut ion. n ion bermuatan listrik positif disebut kation, n ion bermuatan listrik negatif disebut anion. p Proses peruraian suatu zat elektrolit menjadi ionion disebut disosiasi elektrolit atau lazim disebut ionisasi. Nama Program Studi - UPNYK 6

Elektrolisa p Air murni, hanya dapat menghantarkan arus listrik yang sangat lemah. Akan tetapi apabila ke dalam air tersebut dilarutkan asam, basa atau garam anorganik, maka larutan yang terbentuk menjadi penghantar arus listrik yang kuat, karena di dalam larutan terdapat ion-ion. Nama Program Studi - UPNYK 7

ELEKTROLISA p p p Apabila arus listrik dari suatu bateray dialirkan ke dalam larutan hidrogen klorida (HCl), maka HCl tersebut akan terionisasi menjadi hidrogen dan klor. Hidrogen terbebaskan pada elektroda negatif (katoda), sedang klor terbebaskan pada elektroda positif atau anoda. Jadi dalam larutan ion yang bermuatan positif menuju ke katoda, sedang ion bermuatan negatif menuju ke anoda. Nama Program Studi - UPNYK 8

Elektrolisa larutan HCl Reaksi : HCl H+ + Cl. H 2 O H+ + OHKatoda : 2 H+ + 2 e- H 2 (g) Anoda : 2 Cl- Cl 2 (g) + 2 e- Gambar 1. Elektrolisa larutan HCl Nama Program Studi - UPNYK 9

p p p Fenomena elektrolisis tidak selalu sederhana seperti pada larutan HCl. Elektron-elektron ditangkap oleh ion-ion pada katoda, dan elektron-elektron dilepas oleh ion pada anoda. Kation atau anion yang bereaksi pada elektroda tidak selalu dari zat terlarut. Dalam larutan air, ion hidrogen dan hidroksil selalu ada meskipun sangat sedikit, sesuai reaksi: H 2 O H+ + OH- Nama Program Studi - UPNYK 10

p Ion-ion dari zat terlarut dan ion hidrogen dan hidroksil bersaing untuk melepas muatan mereka pada elektroda. n Ion yang berhasil (menang) adalah ion yang memerlukan energi paling sedikit untuk melepaskan muatan. n Secara elektrokimia, ion yang memerlukan potensial elektroda negatif lebih rendah, akan terlebih dahulu melepas muatannya pada katoda; sedangkan p ion yang memerlukan potensial elektroda positif lebih rendah akan terlebih dahulu melepas muatannya pada anoda. p n Persaingan berbagai ion pada elektroda dalam melepaskan muatan dapat menimbulkan berbagai kombinasi. Nama Program Studi - UPNYK 11

Sebagai contoh: elektrolisa larutan Na. Cl Ion hidrogen dan ion klorida akan melepaskan muatannya membentuk gas hidrogen dan gas klor. Reaksinya adalah: Na. Cl Na+ + Cl. H 2 O H+ + OHKatoda : 2 H+ + 2 e- H 2 (g) Anoda : 2 Cl- Cl 2 (g) + 2 ep p Sehingga setelah elektrolisa selesai di dalam larutan akan tertinggal ion Na+ dan ion OH- dan larutan menjadi bersifat basa. Nama Program Studi - UPNYK 12

Elektrolisa larutan Cu. SO 4, Ion tembaga dan ion hidroksil akan melepaskan muatan mereka, sehingga katoda akan dilapisi oleh tembaga dan gas oksigen dibebaskan pada anoda. Reaksinya adalah: Cu. SO 4 Cu 2+ + SO 42 H 2 O H+ + OHKatoda : Cu 2+ + 2 e- Cu (s) Anoda : 4 OH- 2 H 2 O + O 2(g) + 4 ep p Ion hidrogen dan ion sulfat akan tersisa dalam larutan, dan larutan menjadi bersifat asam. Nama Program Studi - UPNYK 13

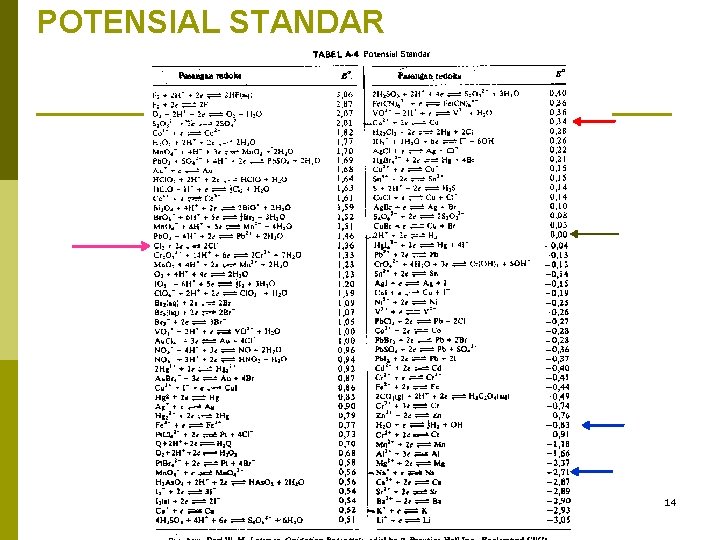
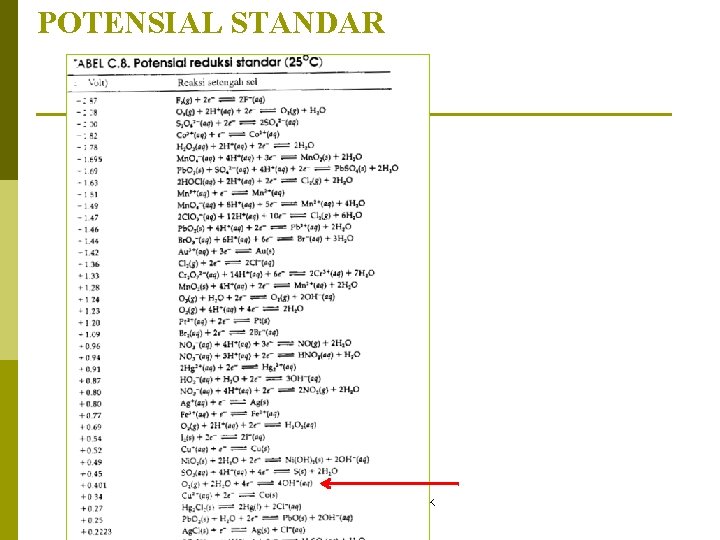
POTENSIAL STANDAR Nama Program Studi - UPNYK 14

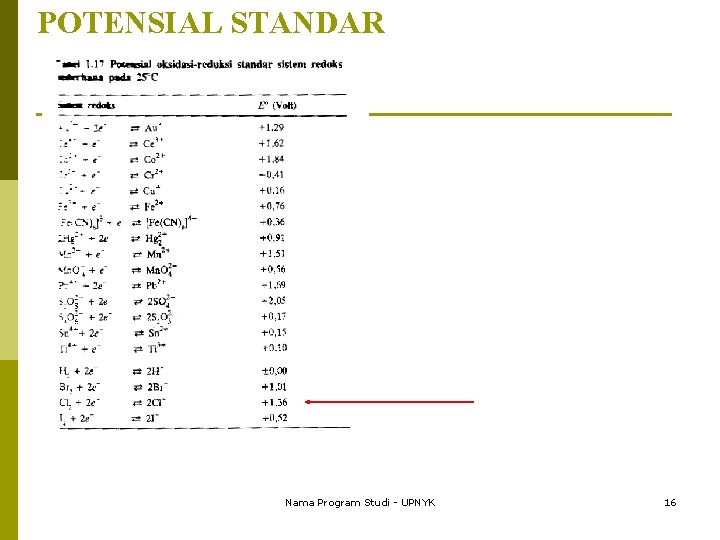
POTENSIAL STANDAR Nama Program Studi - UPNYK

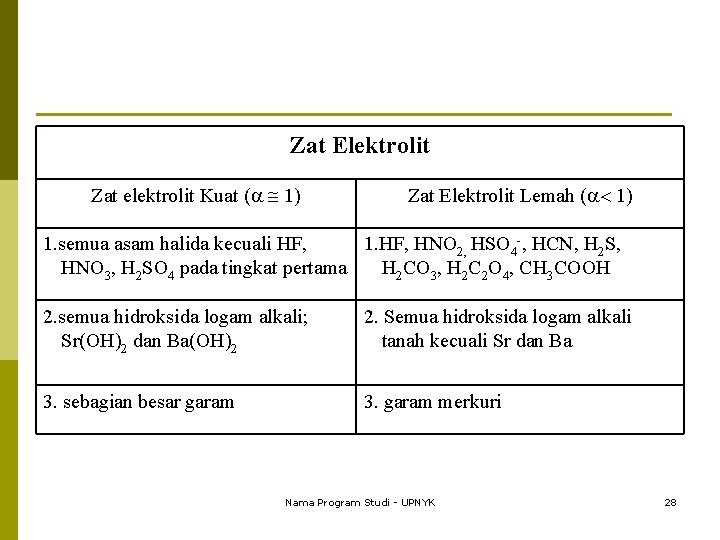
POTENSIAL STANDAR Nama Program Studi - UPNYK 16

Teori Disosiasi Elektrolit /Teori Ionisasi dari Arhenius (1887). Menurut teori disosiasi elektrolit, semua zat elektrolit apabila dilarutkan dalam air akan terionisasi menjadi gugusan atom yang bermuatan listrik yang disebut ion. p Proses ionisasi merupakan proses reversibel (dapat balik). p Ionisasi ini bertambah besar karena pengenceran, sehingga dalam larutan yang sangat encer, zat elektrolit tersebut praktis akan terionisasi sempurna. p Nama Program Studi - UPNYK 17

p p p Proses ionisasi beberapa senyawa elektrolit: Na. Cl Na+ + Cl. HCl H+ + Cl. Mg. SO 4 Mg 2+ + SO 42 Ca. Cl 2 Ca 2+ + 2 Cl. Na 2 SO 4 2 Na+ + SO 42 Ion-ion membawa muatan positif dan negatif. Karena larutan bersifat netral, maka jumlah muatan positif harus sama dengan jumlah muatan negatif. Banyaknya muatan pada masing-masing ion sama dengan valensi atom atau radikalnya. Nama Program Studi - UPNYK 18

2. Teori Asam Basa 2. 1 Teori Arhenius p Menurut Arhenius (1887), asam adalah suatu zat yang apabila dilarutkan dalam air akan terionisasi menghasilkan ion hidrogen (H+) yang merupakan satunya ion positif dalam larutan, misal: HCl H+ + Cl- HNO 3 H+ + NO 3 - p Tetapi ion H+ tersebut dalam larutan tidak terdapat dalam keadaan bebas, tetapi bergabung dengan satu molekul air melalui ikatan kovalen koordinat dengan sepasang elektron bebas yang terdapat pada oksigen dari air dan terbentuk ion hidronium (H 3 O+). H+ + H 2 O H 3 O+ (ion hidronium) Nama Program Studi - UPNYK 19

p p Maka proses ionisasi HCl dan HNO 3 di atas dalam larutan dinyatakan sebagai berikut : HCl + H 2 O H 3 O+ + Cl. HNO 3 + H 2 O H 3 O+ + NO 3 Asam-asam polibasis yaitu asam-asam yang bervalensi lebih dari satu, dalam larutan mengalami ionisasi beberapa tingkat. Misalnya asam sulfat (H 2 SO 4), mengalami dua tingkat ionisasi : H 2 SO 4 + H 2 O H 3 O+ + HSO 4 - + H 2 O H 3 O+ + SO 42 Nama Program Studi - UPNYK 20

p Ketiga tingkat ionisasi tersebut tidak sama besarnya, tingkat ionisasi pertama selalu lebih besar dari pada tingkat dua, dan tingkat ionisasi kedua selalu lebih besar daripada tingkat ketiga. Nama Program Studi - UPNYK 21

p p Asam-asam yang dalam larutan terionisasi sempurna atau hampir sempurna disebut asam kuat, misalnya HCl, HNO 3, HIO 3 dan H 2 SO 4 pada tingkat ionisasi pertama. Sedangkan asam-asam yang dalam larutan hanya terionisasi sedikit disebut asam lemah, misalnya : asam asetat (CH 3 COOH), asam karbonat (H 2 CO 3) dan hidrogen sulfida (H 2 S). Nama Program Studi - UPNYK 22

p p Basa adalah suatu zat yang apabila dilarutkan dalam air akan mengalami ionisasi menghasilkan ion hidroksil (OH-) sebagai satu-satunya ion negatif. misal: n n natrium hidroksida (Na. OH), kalium hidroksida (KOH) dan hidroksida-hidroksida logam lainnya yang terionisasi hampir sempurna. Hidroksida-hidroksida tersebut disebut basa kuat. Na. OH Na+ + OHKOH K+ + OH- Nama Program Studi - UPNYK 23

Tetapi amonium hidroksida (NH 4 OH) dalam larutan hanya terionisasi sebagian dan menghasilkan OH- sangat sedikit sehingga disebut basa lemah. p Pembentukan amonium hidroksida melalui hidrasi amoniak, sebagai berikut : NH 3 + H 2 O NH 4 OH + NH 4+ + OH- atau NH 3 + H 2 O NH 4 - + OH- p Nama Program Studi - UPNYK 24

2. 2 Teori Bronsted-Lowry p Menurut Bronsted dan Lowry: Ø asam adalah suatu zat (baik molekul maupun ion) yang dapat memberikan proton (H+) ; sedang Ø basa adalah suatu zat (baik molekul maupun ion) yang dapat menerima proton (H+). Jadi dapat dituliskan : A B + H+ n n A dan B disebut pasangan asam dan basa konjugasi. Dalam hal ini ion H+ (ion hidrogen) tidak tersolvasi (tidak terikat oleh air). Nama Program Studi - UPNYK 25

Jenis-jenis asam menurut Bronsted dan Lowry : n Molekul-molekul tidak bermuatan mis: HCl, HNO 3, H 2 SO 4, CH 3 COOH dll. n Anion-anion yang terdapat dalam garam asam mis: anion bisulfat (HSO 4 -) , anion bikarbonat (HCO-3), anion bifosfat (H 2 PO 4 -) dll. n Ion amonium dan ion hidronium, karena kedua ion tersebut mempunyai kecenderungan memberikan proton, yaitu : NH 4+ NH 3 + H+ H 3 O+ H 2 O + H+ n Kation-kation terhidrat mis: ion aluminium hidrat {Al(H 2 O)6}3+ {Al(H 2 O)5(OH)}2+ + H+ Nama Program Studi - UPNYK 26

Jenis-jenis basa menurut Bronsted dan Lowry : p p p Molekul-molekul tidak bermuatan, seperti misalnya amoniak dan amina-amina, sesuai persamaan reaksi : NH 3 + H+ NH 4+ RNH 2 + H+ RNH 3+ Hidroksida-hidroksida logam, karena dapat menghasilkan ion hidroksida yang dapat menerima proton. OH- + H+ H 2 O Anion-anion dari semua asam-asam lemah, seperti misalnya : ion sianida (CN-), ion asetat (CH 3 COO-), ion karbonat (CO 32 -) dll. Nama Program Studi - UPNYK 27

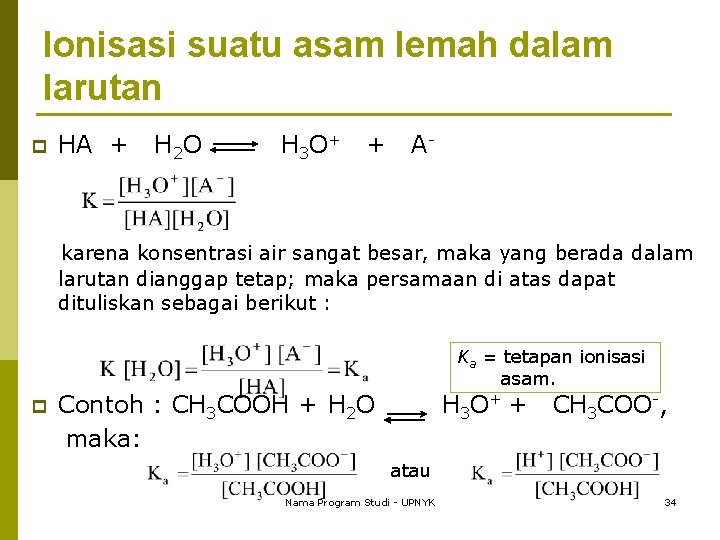
Zat Elektrolit Zat elektrolit Kuat ( 1) Zat Elektrolit Lemah ( 1) 1. semua asam halida kecuali HF, 1. HF, HNO 2, HSO 4 -, HCN, H 2 S, HNO 3, H 2 SO 4 pada tingkat pertama H 2 CO 3, H 2 C 2 O 4, CH 3 COOH 2. semua hidroksida logam alkali; Sr(OH)2 dan Ba(OH)2 2. Semua hidroksida logam alkali tanah kecuali Sr dan Ba 3. sebagian besar garam 3. garam merkuri Nama Program Studi - UPNYK 28

3. Hukum Aksi Massa p p Hukum aksi massa Gulberg dan Waage (1867): kecepatan reaksi kimia pada suhu tetap adalah sebanding dengan hasil kali konsentrasi zat-zat yang saling bereaksi Hukum ini digunakan dalam sistem homogen, yaitu suatu sistem dimana semua zat yang saling bereaksi berada dalam satu fasa, misalnya dalam larutan. A + B C + D k 1=konstanta kecepatan reaksi ke kanan Maka : v 1 = k 1 [A] [B] k 2=konstanta kecepatan reaksi ke kiri v 2 = k 2 [C] [D] [. . . ] = konsentrasi mol/L Pada kesetimbangan: v 1 = v 2, k 1 [A] [B] = k 2 [C] [D] K: tetapan/konstanta kesetimbangan, fungsi (T, P) p Nama Program Studi - UPNYK 29

1. 6. Hukum Aksi Massa p p Hukum aksi massa Gulberg dan Waage (1867): kecepatan reaksi kimia pada suhu tetap adalah sebanding dengan hasil kali konsentrasi zat-zat yang saling bereaksi. Konsentrasi: mol/liter. Hukum ini digunakan dalam sistem homogen, yaitu suatu sistem dimana semua zat yang saling bereaksi berada dalam satu fasa, misalnya dalam larutan. Nama Program Studi - UPNYK 30

H. Aksi Massa Tinjau Reaksi: A + B Maka : C + D v 1 = k 1 [A] [B] v 2 = k 2 [C] [D] [. . . ] = konsentrasi p Pada saat kesetimbangan, kecepatan reaksi v 1=v 2, maka k 1 [A] [B] = k 2 [C] [D] maka: K: tetapan kesetimbangan. Nama Program Studi - UPNYK 31

3. 1 Pemakaian Hukum Aksi Massa untuk Larutan Elektrolit p Hukum Aksi massa hanya berlaku untuk reaksi reversibel, apabila diterapkan untuk larutan elektrolit maka berlaku untuk elektrolit lemah. 3. 1. 1 Ionisasi suatu asam lemah dalam larutan HA + H 2 O H 3 O+ + A- Ka = tetapan/konstanta ionisasi asam. Nama Program Studi - UPNYK 32

Pemakaian Hukum Aksi Massa untuk Larutan Elektrolit p p Hukum Aksi massa hanya berlaku untuk reaksi reversibel, apabila diterapkan untuk larutan elektrolit maka berlaku untuk elektrolit lemah. Hukum aksi massa tidak dapat digunakan pada elektrolit kuat, karena elektrolit tersebut dalam larutan terionisasi sempurna, sehingga dalam larutan tidak terdapat kesetimbangan antara molekul yang tidak terionisasi dengan ion-ionnya. Nama Program Studi - UPNYK 33

Ionisasi suatu asam lemah dalam larutan p HA + H 2 O H 3 O+ + A- karena konsentrasi air sangat besar, maka yang berada dalam larutan dianggap tetap; maka persamaan di atas dapat dituliskan sebagai berikut : Ka = tetapan ionisasi asam. Contoh : CH 3 COOH + H 2 O H 3 O+ + CH 3 COO-, maka: p atau Nama Program Studi - UPNYK 34

p Secara umum untuk asam monobasa (monobasis): Nama Program Studi - UPNYK 35

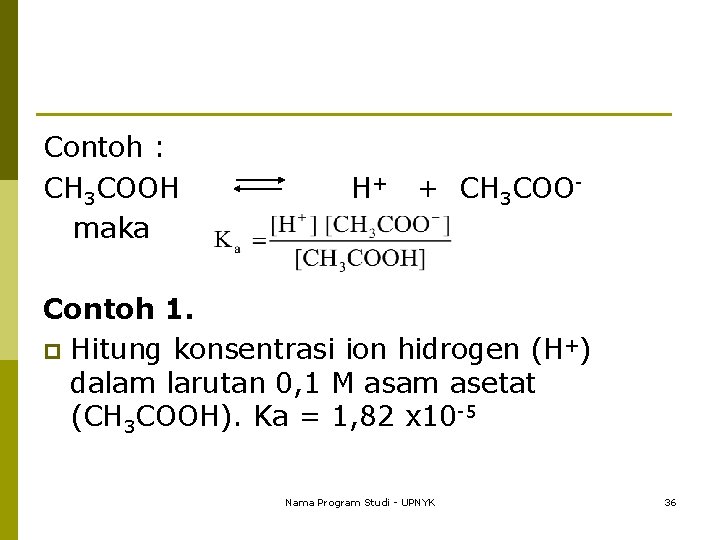
Contoh : CH 3 COOH maka H+ + CH 3 COO- Contoh 1. p Hitung konsentrasi ion hidrogen (H+) dalam larutan 0, 1 M asam asetat (CH 3 COOH). Ka = 1, 82 x 10 -5 Nama Program Studi - UPNYK 36

3. 1. 2 Ionisasi suatu basa lemah dalam larutan NH 3 + H 2 O NH 4+ + OH Kb = tetapan/konstanta ionisasi basa Nama Program Studi - UPNYK 37

Derajat ionisasi ( ) p derajat ionisasi ( ) = Contoh 2. p Hitung konsentrasi ion hidrogen dari larutan 0, 1 M asam asetat yang derajat ionisasinya 1, 35%. Nama Program Studi - UPNYK 38

Hubungan dengan Ka atau Kb p Misal 1 mol asam lemah HA dilarutkan dalam air hingga volume larutan = V liter mempunyai derajat ionisasi = . HA + H 2 O H 3 O+ + A[HA] mula-mula = 1/V HA yang terionisasi = mol HA sisa = a(1 - ) mol [HA] = H 3 O+ yang terbentuk = mol [H 3 O+]= A - yang terbentuk = mol [A-] = Nama Program Studi - UPNYK 39

Apabila <<<< (sangat kecil) maka Ka Ka= 2 C, dimana C = konsentrasi asam. Ø Ø = 2/V atau Dari persamaan tersebut terlihat: apabila V bertambah besar, maka harga makin bertambah besar. Rumus tersebut disebut Hukum Pengenceran Oswald. Nama Program Studi - UPNYK 40

Contoh 3. p Hitung derajat ionisasi larutan asam asetat 0, 1 M. p Diketahui Ka= 1, 82 x 10 -5. p α= 1, 35 x 10 -2 (selesai 30 Agustus 2017) p Nama Program Studi - UPNYK 41

5. Hasil Kali Kelarutan Menurut hasil penelitian: p elektrolit biner yang sukar larut (kelarutannya lebih kecil dari 10 -3 M, hasil kali konsentrasi ion -ionnya adalah tetap. p Hasil kali konsentrasi ion-ion tersebut dinamakan hasil kali kelarutan (atau solubility product) dan diberi simbol Ksp. p Misalnya suatu elektrolit biner AB, maka : AB A+ + BKsp = [A+] x [B-] Nama Program Studi - UPNYK 42

Cara menghitung Ksp Contoh 5. p Hitung besarnya tetapan hasil kali kelarutan (Ksp) garam perak klorida, apabila kelarutannya = 1, 5 x 10 -3 gram per liter. Diketahui berat atom Ag = 108 dan Cl = 35, 5. Contoh 6. p Hitung besarnya tetapan hasil kali kelarutan garam kromat (Ag 2 Cr. O 4), apabila kelarutannya = 2, 5 x 10 -2 gram per liter. Diketahui berat molekul Ag 2 Cr. O 4 = 332. Nama Program Studi - UPNYK 43

Contoh 7. p Hitung besarnya tetapan hasil kali kelarutan garam kalsium fluorida; apabila konsentrasi ion fluorida (F-) dalam larutan jenuh Ca. F 2 = 7, 8 x 10 -3 g/lt. Diketahui berat atom F = 19 Ca=40 Nama Program Studi - UPNYK 44

Cara Menghitung Kelarutan Contoh 8. p Hitunglah berapa gram per liter kelarutan garam Plumbum ortophospat, apabila diketahui harga hasil kali kelarutannya (Ksp) = 1, 5 x 10 -32 dan BM =811. Contoh 9. p Hitung berapa mol/lt besarnya konsentrasi ion OH- dalam larutan jenuh Mg(OH)2. Diket: Ksp Mg(OH)2 = 3, 4 x 10 -11. Nama Program Studi - UPNYK 45

Pemakaian Hasil Kali Kelarutan Contoh 10. p Berapa mol/lt besarnya konsentrasi ion Ag+ yang tinggal dalam larutan, setelah penambahan asam klorida (HCl) ke dalam larutan perak nitrat sedemikian sehingga diperoleh konsentrasi ion Cl- = 0, 05 mol/lt. Diketahui Ksp Ag. Cl = 1, 5 x 10 -10. Nama Program Studi - UPNYK 46

Hasil kali ion dari air p p Kohlrousch dan Heidweller (1894): Air yang kemurniannya tinggi masih bersifat menghantar listrik, meskipun sangat kecil. Ini menunjukkan bahwa air terionisasi. H 2 O H+ + OHDengan menggunakan Hukum Aksi Massa maka dapat dituliskan kesetimbangannya Nama Program Studi - UPNYK 47

Hasil eksperimen berdasar konduktan air menunjukkan K = 1, 2 x 10 -16 pada suhu 25 o. C. q Nilai yang sangat rendah ini menunjukkan bahwa derajat disosiasi air boleh diabaikan, maka dalam praktek air dianggap tak terdisosiasi. Jadi konsentrasi air dianggap tetap; sehingga : K. [H 2 O] = [H+] [OH-] ; Kw =[H+] [OH-] ; [H 2 O] =1000 gr/18 gr/mol= 55, 6 mol/L; sehingga Kw = K. [H 2 O] = 1, 2 x 10 -16 x 55, 6 = 1, 01 x 10 -14. Kw tetapan hasil kali ion-ion air, p p Larutan : netral : [H+] =[OH-] = 10 -7 M asam : [H+] >[OH-] ] dan [H+] > 10 -7 M basa : [H+] <[OH-] ] dan [H+] < 10 -7 M Nama Program Studi - UPNYK 48

Eksponen Ion Hidrogen Untuk menghindari konsentrasi-konsentrasi ion hidrogen yang rendah maka oleh Sorensen (1909) diperkenalkan eksponen ion hidrogen (p. H). p. H = -log [H+] atau [H+] =10 -p. H; p. H eksponen ion hidrogen. p Sehingga larutan netral : [H+] = 10 -7 M = maka p. H = 7, 0 Larutan asam : [H+] >10 -7 M maka p. H < 7, 0 Larutan basa : [H+] < 10 -7 M maka p. H > 7, 0 p p Korelasi : Kw = [H+] [OH-] sehingga – log Kw = -log [H+] [OH-] p. Kw = p. H + p. OH; 14 = p. H + p. OH Nama Program Studi - UPNYK 49

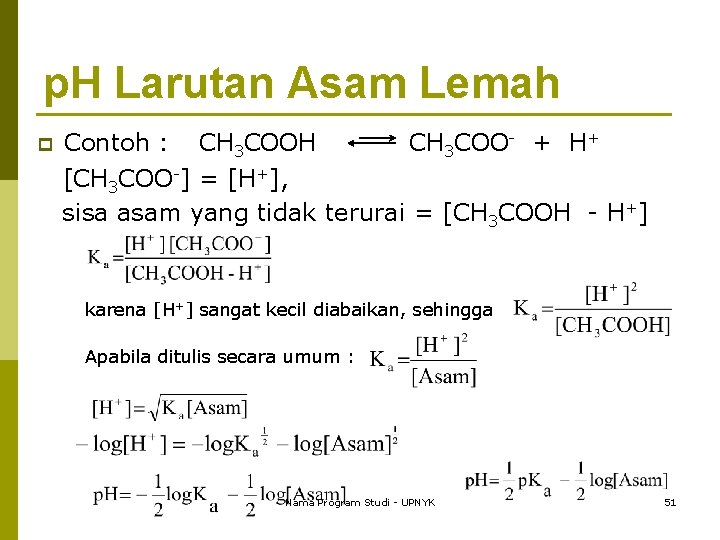
p. H larutan Asam Kuat dan Basa Kuat p p Asam kuat dan basa kuat terionisasi sempurna dalam larutan, maka konsentrasi ion H+ atau ion OH- sama dengan konsentrasi larutan yang bersangkutan. Contoh : n n larutan 0, 1 M HCl, maka [H+] = 0, 1 M; sehingga p. H = -log 0, 1 = 1 larutan 0, 1 M Na. OH, maka [OH-] = 0, 1 M; sehingga p. OH = -log 0, 1 = 1. p. H =14 - p. OH =14 -1=13 Nama Program Studi - UPNYK 50

p. H Larutan Asam Lemah Contoh : CH 3 COOH CH 3 COO- + H+ [CH 3 COO-] = [H+], sisa asam yang tidak terurai = [CH 3 COOH - H+] p karena [H+] sangat kecil diabaikan, sehingga Apabila ditulis secara umum : Nama Program Studi - UPNYK 51

p. H larutan Basa Lemah p Contoh : NH 4 OH NH 4+ + OH- p karena [OH-] sangat kecil maka diabaikan sehingga [NH 4+] = [OH-] sehingga Nama Program Studi - UPNYK 52

Larutan Buffer p Ada 2 macam larutan buffer atau penahan yaitu larutan : p yang mengandung asam lemah dengan garamnya disebut Larutan Buffer Asam. p yang mengandung basa lemah dengan garamnya disebut Larutan Buffer Basa. Nama Program Studi - UPNYK 53

p. H Larutan Buffer Asam Contoh : p Asam : sangat kecil (<<<<) CH 3 COOH CH 3 COO- + H+ p Garam : 1 (terionisasi sempurna) CH 3 COONa CH 3 COO- + Na+ CH COOH sisa = [CH COO- - H+] = [Asam – H+] 3 3 jumlah CH 3 COO- =[CH 3 COO- hasil ionisasi garam + CH 3 COO- hasil ionisasi Asam] Garam terionisasi sempurna sehingga konsentrasi CH 3 COO- hasil ionisasi garam dianggap sama dengan konsentrasi garam [Garam]. [CH 3 COO-] hasil ionisasi asam =[H+], maka p Nama Program Studi - UPNYK 54
![p kareana H sangat kecil sehingga diabaikan maka Nama Program Studi UPNYK 55 p kareana [H+] sangat kecil sehingga diabaikan, maka Nama Program Studi - UPNYK 55](https://slidetodoc.com/presentation_image_h/e1fd69b9a1b030e75ff1e69f2f85b516/image-55.jpg)
p kareana [H+] sangat kecil sehingga diabaikan, maka Nama Program Studi - UPNYK 55

p. H Larutan Buffer Basa Contoh : p p p Basa: sangat kecil (<<<<<) NH 4 OH NH 4+ + OHGaram: 1 (terionisasi sempurna) NH 4 Cl NH 4+ + Cl- arena [OH-] sangat kecil sehingga diabaikan, Nama Program Studi - UPNYK 56

Nama Program Studi - UPNYK 57

Hidrolisa Garam p p Apabila garam-garam dilarutkan dalam air, tidak selalu bereaksi netral. Kemungkinan sebagian garam berinteraksi dengan air, proses ini disebut hidrolisa. Garam-garam dibagi menjadi 4 golongan : n Garam yang berasal dari asam kuat dan basa kuat, misalnya : Na. Cl, KCl dan lain sebagainya. n Garam yang berasal dari asam kuat dan basa lemah, misalnya NH 4 Cl n Garam yang berasal dari asam lemah dan basa kuat, misalnya CH 3 COONa n Garam yang berasal dari asam lemah dan basa lemah, misalnya CH 3 COONH 4 Nama Program Studi - UPNYK 58

p. H larutan garam dari asam kuat dan basa kuat. p Bila dilarutkan dalam air reaksinya netral, hal ini disebabkan anion maupun kationnya masing tidak ada yang bergabung dengan ion hidrogen maupun ion hidroksil dari air. (tidak terhidrolisa) p Keseimbangan disosiasi air : H 2 O H+ + OH- tidak terganggu. Berarti p. H larutan = 7 Contoh : Na. Cl + H 2 O Na+ + Cl- + H+ + OH- tidak berinteraksi dengan air (p. H = 7) p Nama Program Studi - UPNYK 59

p. H larutan garam dari asam kuat dan basa lemah p p Bila dilarutkan dalam air, reaksinya asam. Hal ini disebabkan karena kation garam bergabung dengan ion hidroksil membentuk basa lemah. (hidrolisa partial/sebagian). Sehingga ion hidrogen tertinggal dalam larutan. Ini berarti p. H < 7. Contoh: NH 4 Cl + H 2 O NH 4 OH + HCl NH 4+ + Cl - + H 2 O NH 4 OH + H+ + Cl- atau secara umum : L+ + H 2 O LOH + H+ Nama Program Studi - UPNYK 60
![Karena LOH H dan L konsentrasi garam G maka pers 1 Karena [LOH] = [H+] dan [L+] = konsentrasi garam = G, maka pers (1)](https://slidetodoc.com/presentation_image_h/e1fd69b9a1b030e75ff1e69f2f85b516/image-61.jpg)
Karena [LOH] = [H+] dan [L+] = konsentrasi garam = G, maka pers (1) menjadi: . . . (3). Dari persamaan 2 dan 3 : Apabila pers (1) dikalikan [OH-] dan dibagi [OH-], maka : . . . (2) Nama Program Studi - UPNYK 61

p. H larutan garam dari asam lemah dan basa kuat p p Bila dilarutkan dalam air reaksinya basa, halini disebabkan anion garam bergabung dengan ion hidrogen membentuk asam lemah(hidrolisa partial). Sehingga ion hidroksil tertinggal dalam larutan. Maka p. H > 7. Contoh : CH 3 COONa + H 2 O CH 3 COOH + Na. OH CH 3 COO- + Na+ + H 2 O CH 3 COOH + Na+ + OH- atau secara umum A- + H 2 O HA + OHNama Program Studi - UPNYK 62
![p Dari persamaan 5 dan 6 diperoleh p Apabila pers 4 dikalikan H dan p Dari persamaan 5 dan 6 diperoleh p Apabila pers (4) dikalikan [H+] dan](https://slidetodoc.com/presentation_image_h/e1fd69b9a1b030e75ff1e69f2f85b516/image-63.jpg)
p Dari persamaan 5 dan 6 diperoleh p Apabila pers (4) dikalikan [H+] dan dibagi [H+], menjadi : . . (5) p Karena [HA] =[OH-] dan [A-] = konsentrasi garam =G, maka pers (1) menjadi : . . . (6) Nama Program Studi - UPNYK 63

p. H larutan garam dari asam lemah dan basa lemah p Garam golongan ini mengalami hidrolisa total. Sifat larutan garam ini, bisa netral, asam atau basa. Dipengaruhi oleh Ka dan Kb. Nama Program Studi - UPNYK 64

Derajad Hidrolisa (x) p Adalah bagian dari setiap mol ion yang mengalami hidrolisa dalam kesetimbangan. Kh = Konstanta hidrolisa c = konsentrasi garam x = derajat hidrolisa. Nama Program Studi - UPNYK 65

Contoh 16. p Larutan 0, 1 M Natrium asetat (CH 3 COONa) mempunyai harga Ka =1, 82 x 10 -5 Hitunglah : n Konstanta hidrolisa. n Derajat hidrolisa n p. H larutan Contoh 17. p Pada suhu 25 o. C, 2, 675 gram garam NH 4 Cl dilarutkan dalam 500 ml air. Hitunglah derajad hidrolisa dan p. H larutan garam tersebut. Diketahui Kb NH 4 OH = 1, 8 x 10 -5. BM NH 4 Cl = 53, 5 Nama Program Studi - UPNYK 66

Contoh 18. p Asam benzoat (C 6 H 5 COOH) adalah asam lemah monobasis. 6, 1 gram asam tersebut dilarutkan ke dalam 500 ml aquades, kemudian ke dalam larutan yang terjadi ditambahkan larutan Na. OH 0, 5 M. Hitunglah : p Berapa p. H larutan yang terjadi jika banyaknya larutan Na. OH yang ditambahkan = 75 ml p Berapa ml larutan Na. OH yang telah ditambahkan ke dalam larutan asam benzoat pada saat terjadi garam natrium benzoat, dan hitung pula tetapan, derajat hidrolisa dan PH larutan garam tersebut. Diketahui Ka asam benzoat = 6, 6 x 10 -5 Nama Program Studi - UPNYK 67

Contoh 19 p Suatu larutan buffer asetat mengandung campuran antara 0, 1 M CH 3 COOH dan 0, 1 M CH 3 COONa. Hitung berapa p. H larutan yang terjadi apabila ke dalam larutan buffer tersebut ditambahkan : a. 1 ml HCl 10 M b. 2 ml Ha. OH 5 M Diketahui volume larutan buffer mula-mula 1 liter dan perubahan volume larutan diabaikan. Ka = 1, 82 x 10 -5. Nama Program Studi - UPNYK 68

Soal Ke dalam larutan asam lemah HA ditambahkan sejumlah berat garam kaliumnya sehingga diperoleh larutan buffer yang p. H nya 6, 3979. Apabila harga tetapan ionisasi asam (Ka) = 1, 9 x 10 -5. Hitung perbandingan konsentrasi asam dan garamnya. Suatu larutan buffer basa yang p. H nya 9, 0 terdiri dari campuran antara larutan NH 4 OH dan NH 4 Cl. Apabila konsentrasi masing-masing larutan tersebut =0, 25 M dan Kb = 1, 8 x 10 -5. Hitung perbandingan volume kedua larutan tersebut. 1. 2. p Nama Program Studi - UPNYK 69

1. 2. Ke dalam larutan asam lemah HA ditambahkan sejumlah berat garam kaliumnya sehingga diperoleh larutan buffer yang p. H nya 6, 3979. Apabila harga tetapan ionisasi asam (Ka) = 1, 9 x 10 -5. Hitung perbandingan konsentrasi asam dan garamnya. Suatu larutan buffer basa yang p. H nya 9, 0 terdiri dari campuran antara larutan NH 4 OH dan NH 4 Cl. Apabila konsentrasi masing-masing larutan tersebut =0, 25 M dan Kb = 1, 8 x 10 -5. Hitung perbandingan volume kedua larutan tersebut. Nama Program Studi - UPNYK 70

3. Ke dalam suatu asam lemah HA 0, 1 M yang mempunyai p. H = 3, 0 ditambahkan 0, 28 gram KOH. Hitunglah : n konstanta hidrolisa (Kh) dan derajat hidrolisa garam KA n berapa p. H larutan yang terjadi. 4. Pada 100 ml larutan yang mengandung 8, 29 x 10 -3 gram ion timbel, ditambahkan 100 ml asam sulfat 10 -3 M. Berapa banyaknya timbel yang tidak diendapkan yang tertinggal di dalam larutan ? Diketahui Ksp Pb. SO 4 = 2, 2 x 10 -8, BA Pb = 207, 2 p Nama Program Studi - UPNYK 71

Ringkasan Materi p Berisi ringkasan materi dan latihan soal Nama Program Studi - UPNYK 72

Referensi q Vogel, A. I. , 1961, A Text Book of Qualitative Inorganic Analysis, Terjemahan oleh L. Setiono dan A. H. Pudjatmaka, Buku Teks Analisis Anorganik Kualitatif , Bagian I, edisi ke 5, Kalman Media Pustaka, Jakarta Nama Program Studi - UPNYK 73
 Mata kuliah ilmu alamiah dasar
Mata kuliah ilmu alamiah dasar Salat assessment
Salat assessment Laporan praktikum pengukuran dan ketidakpastian
Laporan praktikum pengukuran dan ketidakpastian Etika profesi mahasiswa
Etika profesi mahasiswa Materi pengembangan diri mahasiswa
Materi pengembangan diri mahasiswa Notanerd
Notanerd Matkul ekonomi pembangunan ub
Matkul ekonomi pembangunan ub Mata kuliah pelayanan prima
Mata kuliah pelayanan prima Contoh soal metode perputaran modal kerja
Contoh soal metode perputaran modal kerja Kurikulum teknik informatika gunadarma
Kurikulum teknik informatika gunadarma Silabus mata kuliah metodologi penelitian
Silabus mata kuliah metodologi penelitian Mata kuliah ilmu kelautan unpad
Mata kuliah ilmu kelautan unpad Deskripsi mata kuliah ekonomi mikro
Deskripsi mata kuliah ekonomi mikro Tujuan creative writing
Tujuan creative writing Cpmk
Cpmk Cjr mata kuliah kewirausahaan
Cjr mata kuliah kewirausahaan Mata kuliah testing dan implementasi sistem
Mata kuliah testing dan implementasi sistem Mata kuliah statistika dan probabilitas
Mata kuliah statistika dan probabilitas Deskripsi mata kuliah sejarah pendidikan islam
Deskripsi mata kuliah sejarah pendidikan islam Mata kuliah keamanan sistem informasi
Mata kuliah keamanan sistem informasi Taxonomy bloom
Taxonomy bloom Matkul ekonomi islam ub
Matkul ekonomi islam ub Tujuan pemrograman visual
Tujuan pemrograman visual Mata kuliah profesi keguruan
Mata kuliah profesi keguruan Jenis ancaman keamanan komputer
Jenis ancaman keamanan komputer Bahan ajar mata kuliah seminar
Bahan ajar mata kuliah seminar Mata kuliah penyuntingan
Mata kuliah penyuntingan Kurikulum 2002
Kurikulum 2002 Materi kuliah fisika lingkungan
Materi kuliah fisika lingkungan Pengantar aplikasi komputer (spss)
Pengantar aplikasi komputer (spss) Mata kuliah sistem produksi
Mata kuliah sistem produksi Materi sistem informasi manajemen semester 4
Materi sistem informasi manajemen semester 4 Deskripsi mata kuliah pengantar bisnis
Deskripsi mata kuliah pengantar bisnis Relevansi mata kuliah menyimak dengan berbicara
Relevansi mata kuliah menyimak dengan berbicara Modul manajemen keuangan
Modul manajemen keuangan Beton
Beton Mata kuliah struktur beton
Mata kuliah struktur beton Teori dan perilaku organisasi anggri puspita sari
Teori dan perilaku organisasi anggri puspita sari Mata kuliah manajemen proyek sistem informasi
Mata kuliah manajemen proyek sistem informasi Soal perkembangan peserta didik
Soal perkembangan peserta didik Bahan i
Bahan i Erd mahasiswa mengambil mata kuliah
Erd mahasiswa mengambil mata kuliah Mata kuliah mercu buana
Mata kuliah mercu buana Mata kuliah pengantar arsitektur
Mata kuliah pengantar arsitektur Mata kuliah sistem penghantaran obat
Mata kuliah sistem penghantaran obat Mata kuliah sik
Mata kuliah sik Silabus mata kuliah seminar proposal skripsi
Silabus mata kuliah seminar proposal skripsi Mata kuliah pengantar arsitektur
Mata kuliah pengantar arsitektur Mata kuliah perencanaan dan pengendalian produksi
Mata kuliah perencanaan dan pengendalian produksi Mata kuliah administrasi perpajakan ui
Mata kuliah administrasi perpajakan ui Materi pengantar ilmu pendidikan semester 1
Materi pengantar ilmu pendidikan semester 1 Abdul rohman ugm
Abdul rohman ugm Mata kuliah manajemen investasi dan pasar modal
Mata kuliah manajemen investasi dan pasar modal Erwin setyo kriswanto
Erwin setyo kriswanto Ticcit adalah
Ticcit adalah Mata kuliah manajemen resiko
Mata kuliah manajemen resiko Mata kuliah geografi ui
Mata kuliah geografi ui Kode pensil yang paling cocok untuk teknik dusel adalah
Kode pensil yang paling cocok untuk teknik dusel adalah Mata kuliah pengantar arsitektur
Mata kuliah pengantar arsitektur Mata kuliah analisis kebijakan pendidikan
Mata kuliah analisis kebijakan pendidikan Mata kuliah analisis jabatan
Mata kuliah analisis jabatan Sekjur psikologi gunadarma
Sekjur psikologi gunadarma Rekonstruksi mata kuliah
Rekonstruksi mata kuliah Mata kuliah teknik industri
Mata kuliah teknik industri Mata kuliah metode numerik
Mata kuliah metode numerik Administrasi publik upi
Administrasi publik upi Soal uas mata kuliah perencanaan pembelajaran
Soal uas mata kuliah perencanaan pembelajaran Mata kuliah geografi
Mata kuliah geografi Tugas mata kuliah metodologi penelitian
Tugas mata kuliah metodologi penelitian Sap universitas gunadarma
Sap universitas gunadarma Mata kuliah keamanan sistem informasi
Mata kuliah keamanan sistem informasi Materi kuliah geografi ekonomi
Materi kuliah geografi ekonomi Deskripsi mata kuliah pengantar bisnis
Deskripsi mata kuliah pengantar bisnis Pembiayaan risiko (risk financing)
Pembiayaan risiko (risk financing)