Matrice Extracellulare ECM Una parte sostanziale del volume
































- Slides: 54

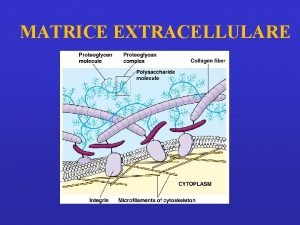
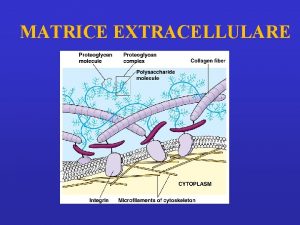
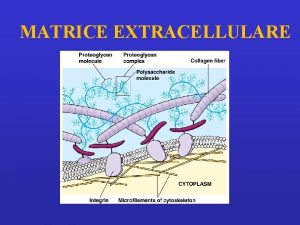
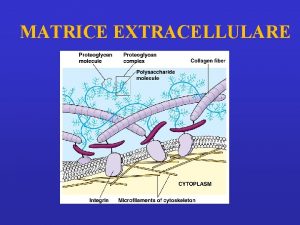
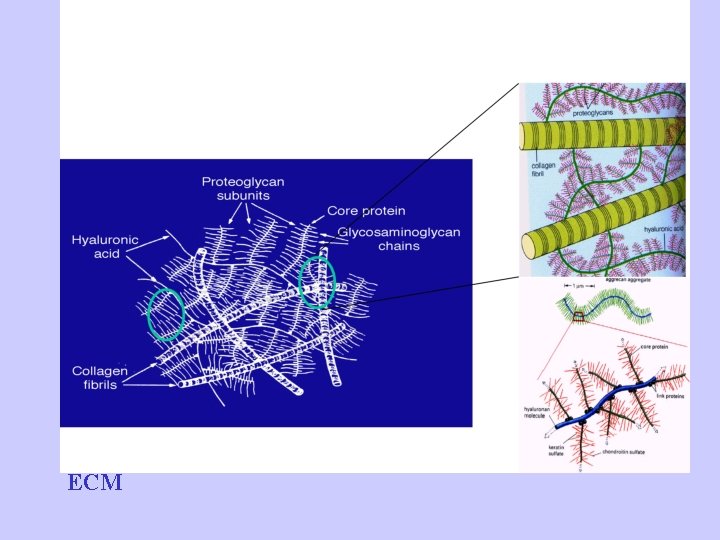
Matrice Extracellulare (ECM)

Una parte sostanziale del volume dei tessuti è costituita dallo spazio extracellulare, in lunga parte riempito da una intricata rete di macromolecole che costituiscono la matrice extracellulare. La matrice comprende una varietà di proteine e polisaccaridi, secreti localmente, che si aggregano in un reticolo organizzato in maniera compatta e connesso alla superficie della cellula che l'ha prodotto. A livello cellulare (10 µm) la cellula fa da protagonista ed è associata con un piccolo volume di controllo di matrice extracellulare. Ci sono particolari tessuti connettivi (tendine, derma, cartilagine) che possono essere modellati (sulla scala di circa 1 cm) come aggregati di ECM di composizione relativamente omogenea e specifica architettura.

FUNZIONI ECM Supporto meccanico per le funzioni biomeccaniche e l'ancoraggio di cellule Regolamentazione e controllo del "traffico" di fluidi, molecole e nutrienti Fornisce un substrato strutturale per la crescita e il rimodellamento delle cellule Riserva di regolatori solubili

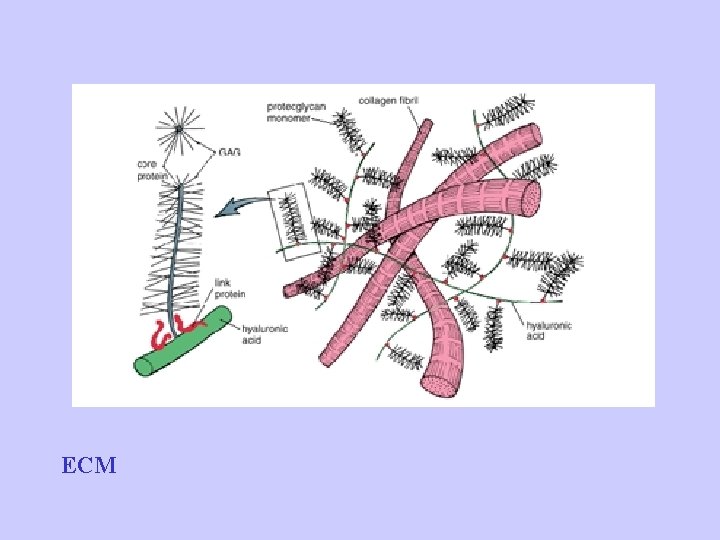
Componenti ECM • Proteine: Strutturali: collagene ed elastina Adesive: fibronettine e lamiline • Glicosamminoglicani • Acqua (60 -70%)

ECM

ECM

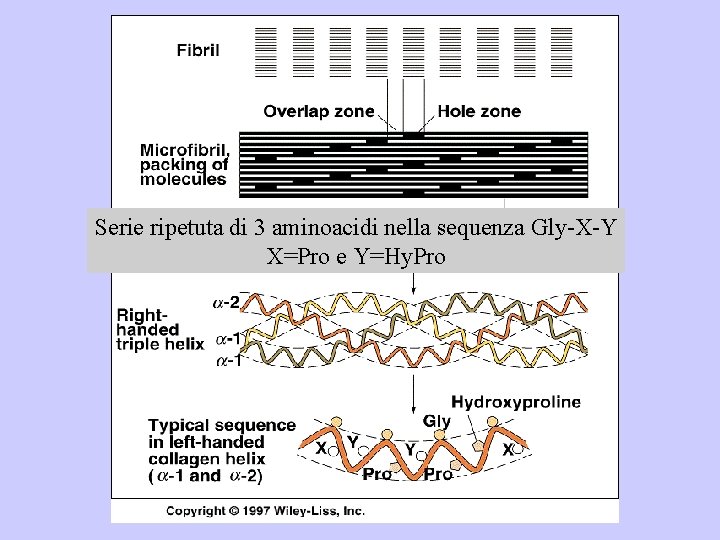
Collagene • Proteina strutturale 25% di tutte le proteine • Strutture primaria>1000 amminoacidi Triplette di sequenza: Gly-Pro-Hyp • Struttura secondaria α-elica • Struttura terziaria: elica sinistrorsa • Struttura quaternaria: superelica destrorsa

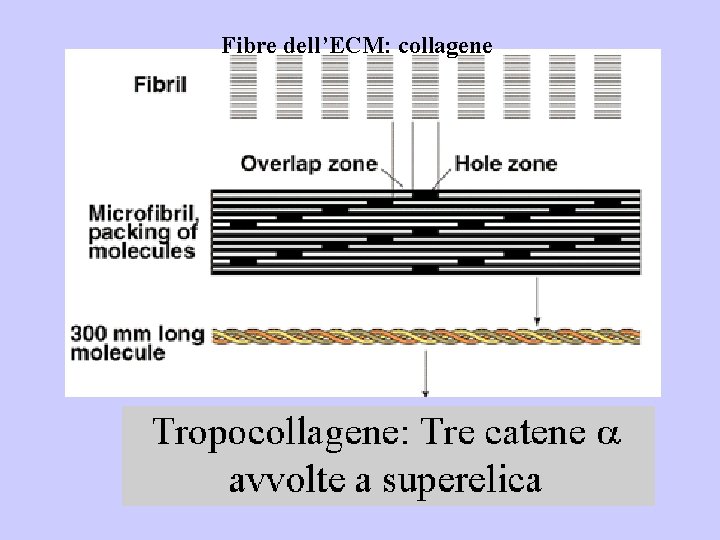
Fibre dell’ECM: collagene ECM – Collagene al TEM

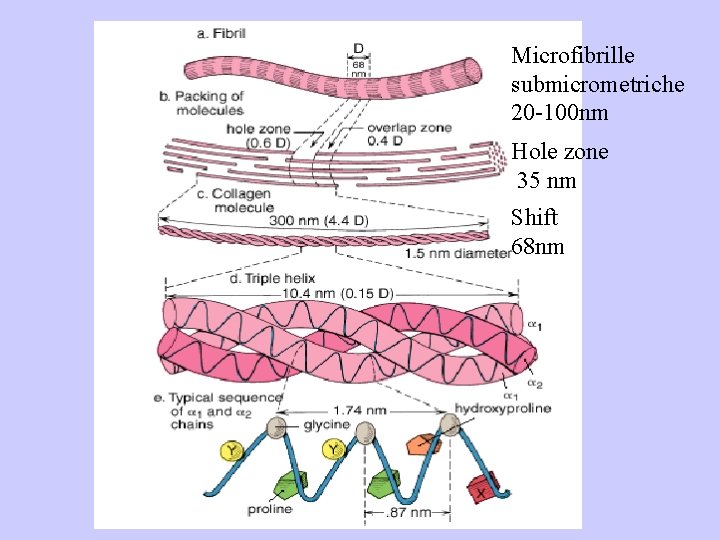
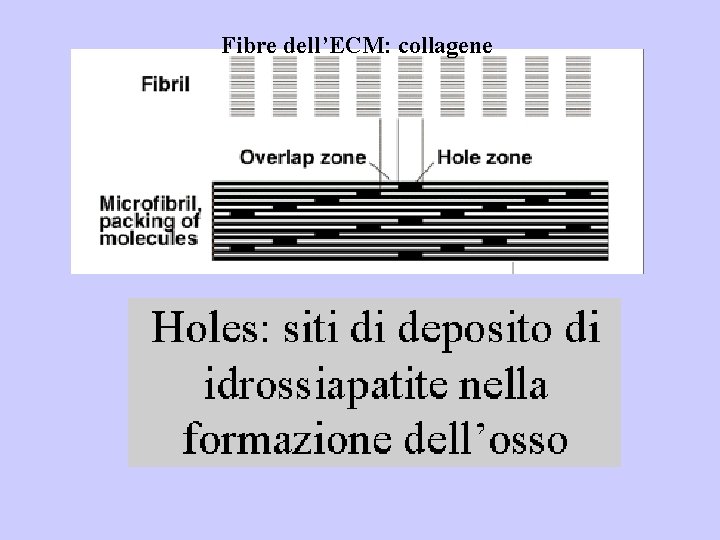
Microfibrille submicrometriche 20 -100 nm Hole zone 35 nm Shift 68 nm


Serie ripetuta di 3 aminoacidi nella sequenza Gly-X-Y X=Pro e Y=Hy. Pro

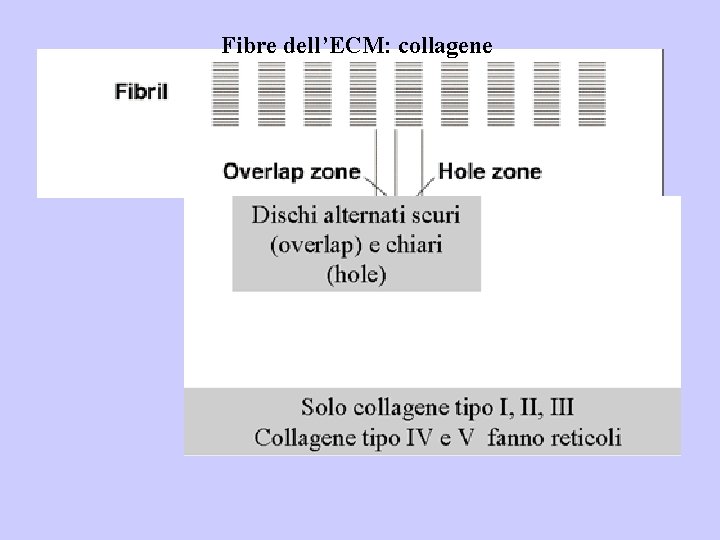
Fibre dell’ECM: collagene

Fibre dell’ECM: collagene

Fibre dell’ECM: collagene

Fibre dell’ECM: collagene

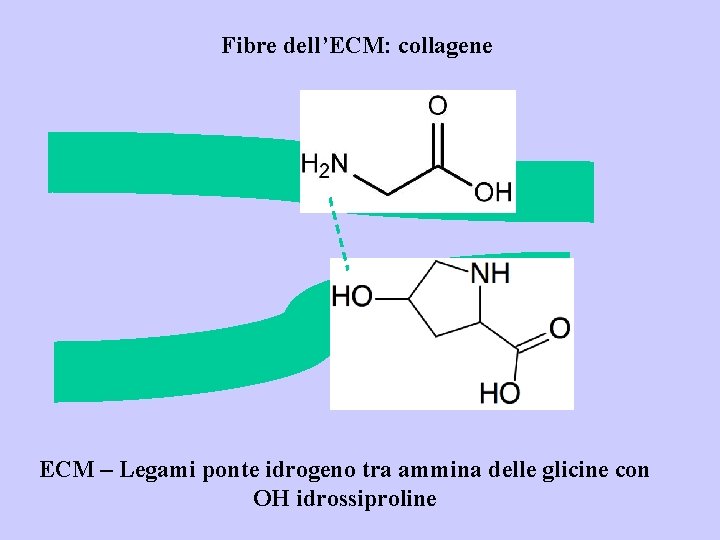
Fibre dell’ECM: collagene ECM – Legami ponte idrogeno tra ammina delle glicine con OH idrossiproline

Strutturazione gerarchica superiore Microfibrille submicrometriche 20100 nm Fibrille micrometriche 0. 2 -0. 3 μm Fibre micrometriche 1 -12 μm

Oltre 25 tipi di collagene

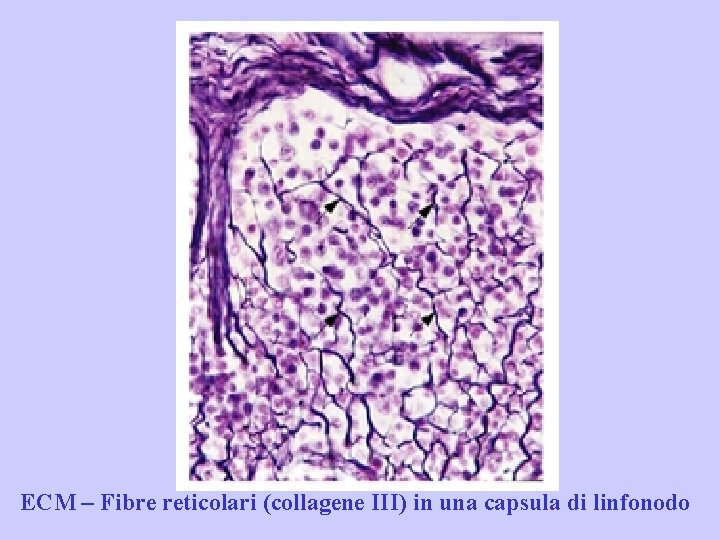
Collagene di tipo I: è stato trovato nei tessuti connettivi lassi e densi. Due delle catene( 1)sono identiche mentre 2 è differente cosi come la nomenclatura è [ 1( I )]2 2( I ). Collagene di tipo III: è presente nella cartilagine ialina ed elastica sotto forma di fini fibrille. Le molecole di collagene di tipo III sono composte da 3 catene uguali ma che differiscono da quelle degli altri collageni. Il collagene di tipo III si indica come [ 1(III)]3. Non solo i polipeptidi differiscono tra i diversi collagene ma anche l’organizzazione delle molecole entro la fibrilla. Collagene tipo I, III, V, XI si aggregano per formare fibrille striate (D = 68 nm). Collagene tipo IV e V si aggregano per formare reticoli Collagene tipo IX è non fibrillare, si lega e interagisce con collageni tipo II delle cartilagini all’intersezione con le fibrille

Collagene • Idrossiprolina • Prodotta attraverso idrossilazione della prolina grazie alla vitamina C • Patologie relative a mancanza di vitamina C (scorbuto) • Amminoacido diagnostico per il collagene

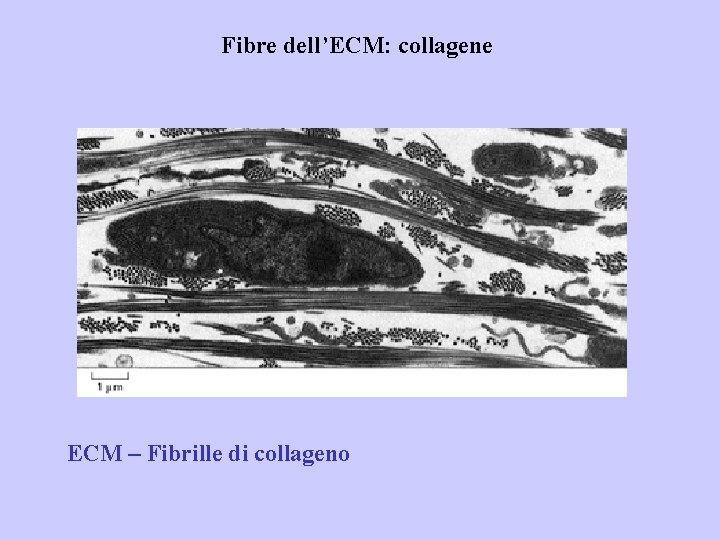
Fibre dell’ECM: collagene ECM – Fibrille di collageno

Altre fibre dell’ECM

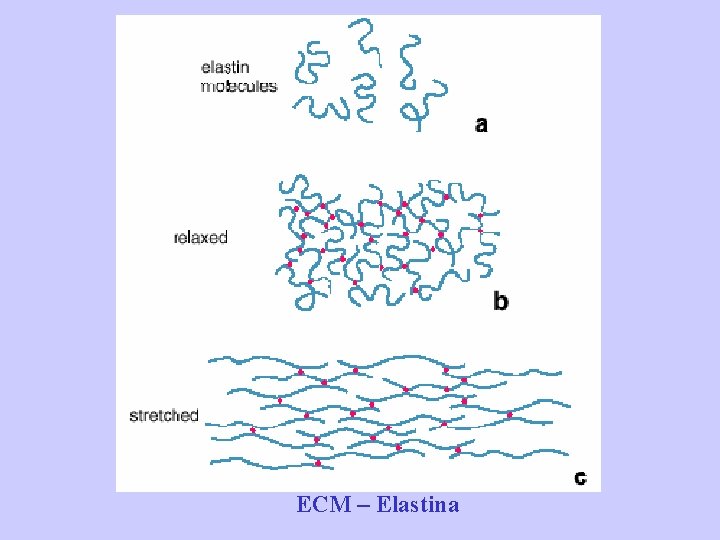
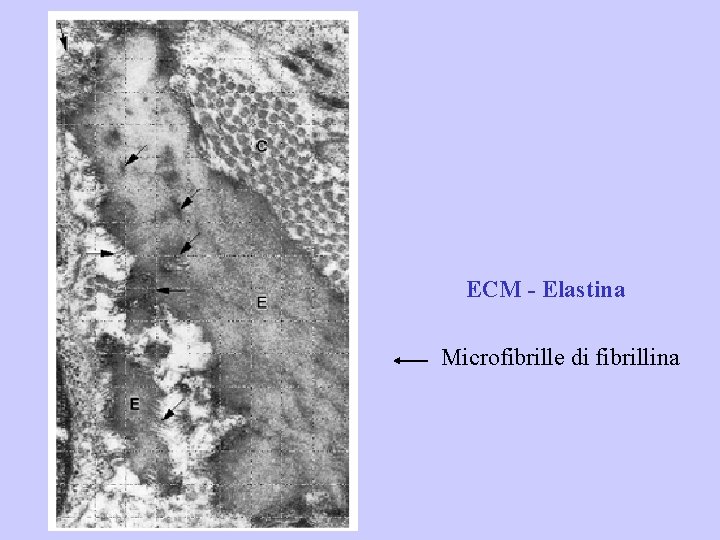
A differenza del collagene le fibre elastiche sono composte da due componenti strutturali: un cuore centrale di elastina e una parte circostante di microfibrille di fibrillina. ELASTINA: è una proteina che come il collagene è ricca in prolina e glicina. A differenza del collagene è povera in idrossipolina e manca completamente in idrossilisina. L’elastina forma fibre di spessore variabile o strati lamellari (come nelle arterie elastiche). FIBRILLINA: è una glicoproteina che forma fini microfibrille che misurano da 10 a 12 nm di diametro. Durante le fasi iniziali dell’elastogenesi, queste microfibrille si formano per prime; il materiale elastina si deposita successivamente sulla superficie delle microfibrille. Il complesso elastina-microfibrille di fibrillina gioca un ruolo fondamentale nell’organizzazione dell’elastina in fibre. L’assenza di fibrillina durante l’elastogenesi risulta nella formazione di fogli di elastina o lamelle come quelle che si trovano nelle vene.

Elastina • Proteina fibrosa (72 k. Da) • Non contiene idrossiprolina ma amminoacidi idrofobici (alanina, valina, leucina, glicina(random)) • Estesa reticolazione (desmosina, isodesmosina, lisino-norleucina) Random coil/Comportamento elastico

ECM – Elastina

ECM - Elastina Microfibrille di fibrillina

ECM – Fibre reticolari (collagene III) in una capsula di linfonodo

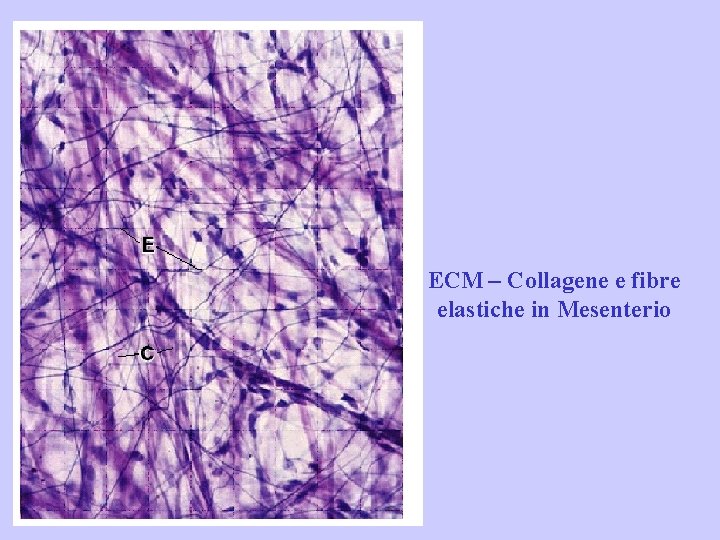
ECM – Collagene e fibre elastiche in Mesenterio

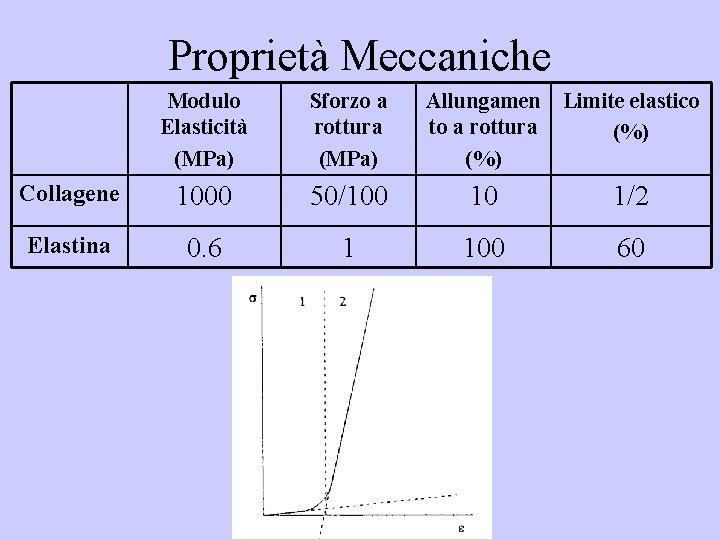
Proprietà Meccaniche Modulo Elasticità (MPa) Sforzo a rottura (MPa) Allungamen Limite elastico to a rottura (%) Collagene 1000 50/100 10 1/2 Elastina 0. 6 1 100 60

Altre proteine dell’ECM

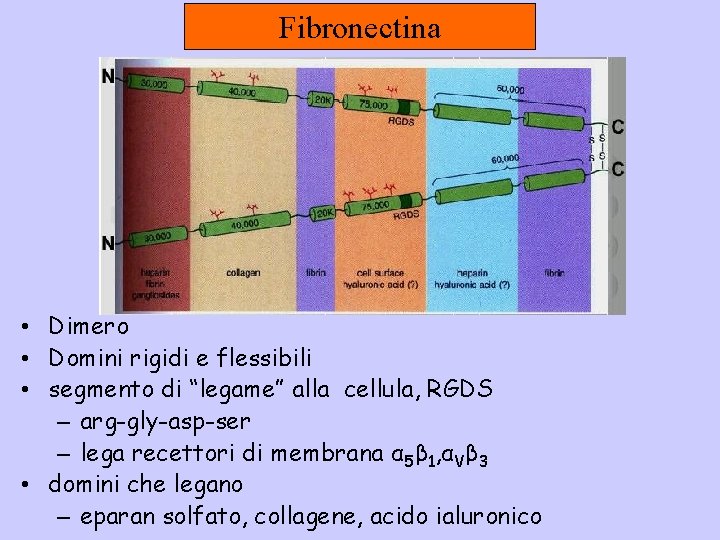
Fibronectina • Dimero • Domini rigidi e flessibili • segmento di “legame” alla cellula, RGDS – arg-gly-asp-ser – lega recettori di membrana α 5β 1, αVβ 3 • domini che legano – eparan solfato, collagene, acido ialuronico

Funzioni della fibronectina • adesione cellulare (α 5β 1, αvβ 3) • Traccia per la migrazione - bloccando la fibronectina vengono bloccati dei processi di migrazione che avvengono durante l’embriogenesi - traccia per assoni e dendriti • differenziamento • lamina basale – Sotto la pelle e tra gli organi • nel sangue – Per la coagulazione, legata alla fibrina

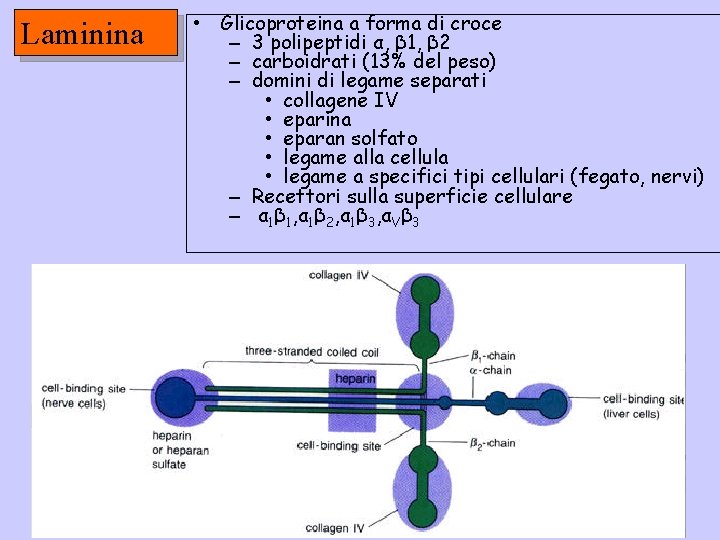
Laminina • Glicoproteina a forma di croce – 3 polipeptidi α, β 1, β 2 – carboidrati (13% del peso) – domini di legame separati • collagene IV • eparina • eparan solfato • legame alla cellula • legame a specifici tipi cellulari (fegato, nervi) – Recettori sulla superficie cellulare – α 1β 1, α 1β 2, α 1β 3, αVβ 3

FUNZIONI DELLA LAMININA • Adesione cellulare – Traccia per la migrazione – Stimola la crescita degli assoni – Sviluppo e rigenerazione • differenziamento • Lamina basale – È la glicoproteina di “legame” più abbondante La laminina interagisce con altre molecole per costituire la lamina basale. Può avere composizione diversa in tessuti differenti.

GAG

ECM

Glicosamminoglicani • Polisaccaridi (disaccaridi) non ramificati • Un residuo è un amminozucchero solfatato (N-Acetil glucosammina o galattosammina) • L’altro è un acido uronico (glucoronico o iduronico) • Gruppi solforici e carbossilici: carica negativa

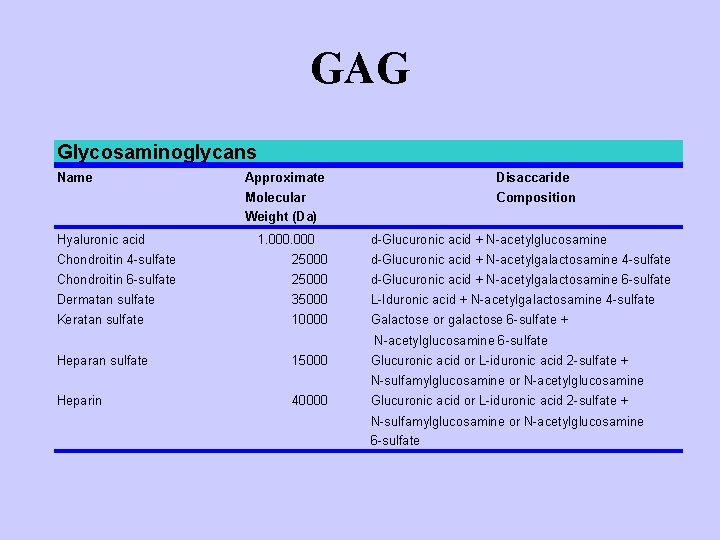
GAG Glycosaminoglycans Name Hyaluronic acid Approximate Disaccaride Molecular Weight (Da) Composition 1. 000 d-Glucuronic acid + N-acetylglucosamine Chondroitin 4 -sulfate 25000 d-Glucuronic acid + N-acetylgalactosamine 4 -sulfate Chondroitin 6 -sulfate 25000 d-Glucuronic acid + N-acetylgalactosamine 6 -sulfate Dermatan sulfate 35000 L-Iduronic acid + N-acetylgalactosamine 4 -sulfate Keratan sulfate 10000 Galactose or galactose 6 -sulfate + N-acetylglucosamine 6 -sulfate Heparan sulfate 15000 Glucuronic acid or L-iduronic acid 2 -sulfate + N-sulfamylglucosamine or N-acetylglucosamine Heparin 40000 Glucuronic acid or L-iduronic acid 2 -sulfate + N-sulfamylglucosamine or N-acetylglucosamine 6 -sulfate

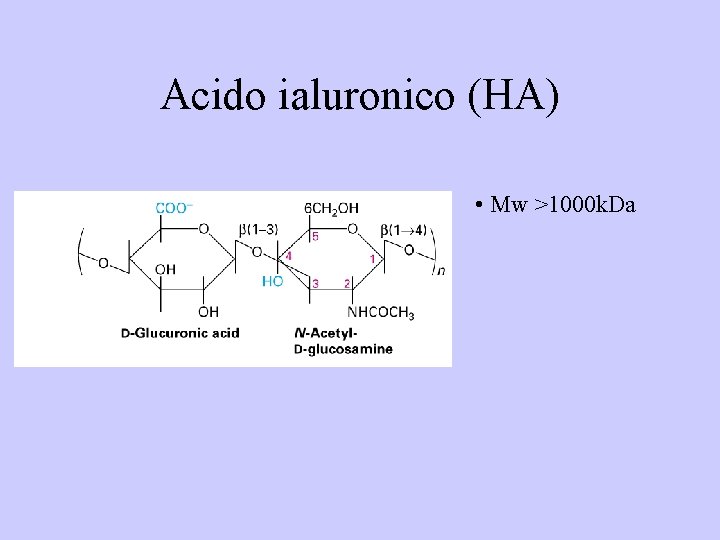
Acido ialuronico (HA) • Mw >1000 k. Da


GAG • HA: – Trattiene l’acqua – Regola i flussi – È il più “grande” GAG (più di 500 -migliaiaia di disaccaridi) – Struttura estesa in soluzione; ciò conferisce viscosità alla soluzione – presente in tutti i tessuti connettivi – 10%-20% dei GAGs nelle pelle e nell’aorta – 1% dei GAGs nella cartilagine

GAG • Condroitin Solfato: – 20 -60 unità di disaccaride – abbondante nella cartilagine e disco intervertebrale (10% ww) • Simile all’HA, resistente alla ialuronidasi • Dermatan Solfato : – Assente nella cartilage – Presente nel menisco, tendini, pelle

GAG • Cheratan Solfato: – 5%-20% dei GAGs nella cartilagine ialina – 30%-40% dei GAGs in nucleo pulposo (depends on age)

GAG • Eparina ─ È altamente solfatata ─ Possiede proprietà anticoagulanti ─ 6 -20 k. Da

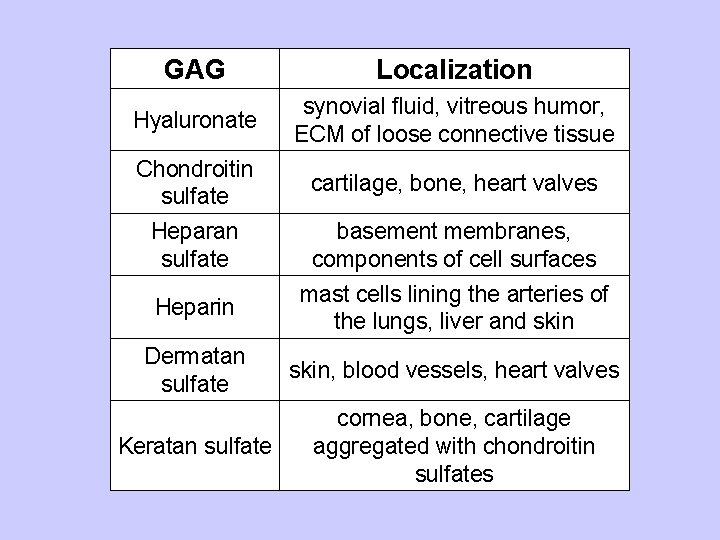
GAG Localization Hyaluronate synovial fluid, vitreous humor, ECM of loose connective tissue Chondroitin sulfate cartilage, bone, heart valves Heparan sulfate basement membranes, components of cell surfaces Heparin mast cells lining the arteries of the lungs, liver and skin Dermatan sulfate skin, blood vessels, heart valves Keratan sulfate cornea, bone, cartilage aggregated with chondroitin sulfates

GAG • GAG sono polimeri molto estesi (con pesi molecolari di circa 50, 000 - 10, 000) • Possono “incamerare” un considerevole volume d’acqua eccellente lubrificante e shock absorbers

GAG • Regola diffusione e flusso di macromolecole attraverso il tessuto connetivo • Fornisce “resilienza”: – Carica negativa non possono avvicinarsi in compressione – Carica negativa trattiene l’acqua – viscosità viscoelasticità

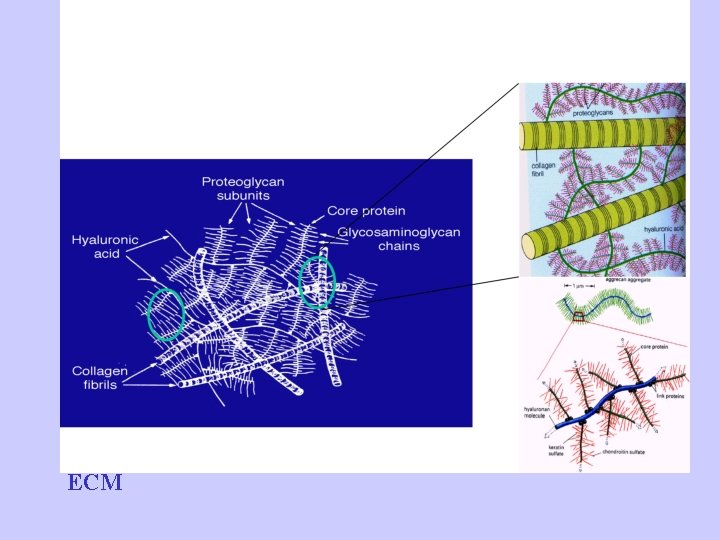
Proteoglicani(PG) • proteoglicani = “protein core” + GAG – Poche centinaia di catene di glicosamminoglicani covalemente legate ad un “protein core” – Sembra una spazzola! • La maggior parte dei GAGs sono legati a “core” proteici formando i proteoglicani (o mucopolisaccaridi) • cartilage proteoglycans: – average molecular weight 2, 500, 000 – ~250 nm long, ~40 nm wide

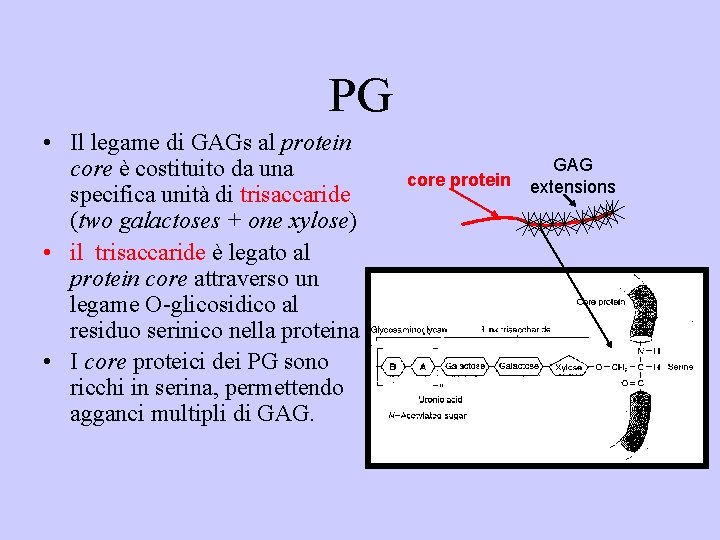
PG • Il legame di GAGs al protein core è costituito da una specifica unità di trisaccaride (two galactoses + one xylose) • il trisaccaride è legato al protein core attraverso un legame O-glicosidico al residuo serinico nella proteina • I core proteici dei PG sono ricchi in serina, permettendo agganci multipli di GAG. core protein GAG extensions

PG/Aggregati • Proteoglicani formano aggregati – PG legati a un backbone di HA – Può essere lungo 4000 nm con un diametro di 500 nm • Funzioni degli aggregati: – Aumenta la capacità di trattenere l’acqua – Aumenta la rigidezza – Regola la deposizione di fibrille di collagene • PG Aggregati: – Aggrecano – Versicano – -…. .



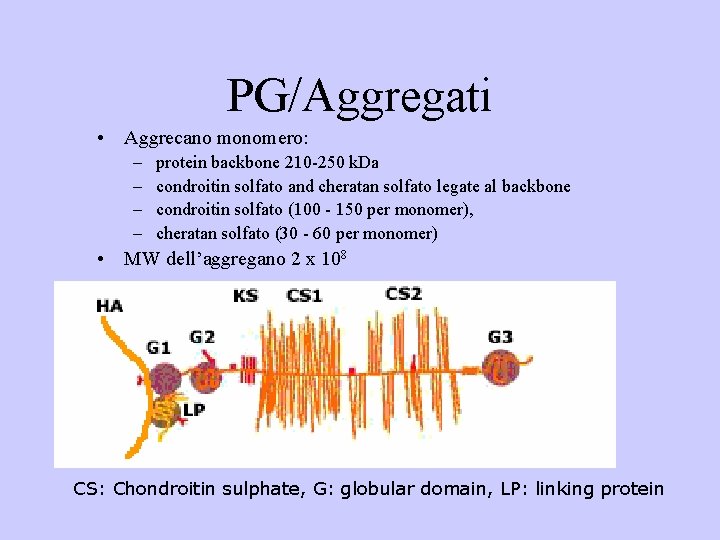
PG/Aggregati • Aggrecano monomero: – – protein backbone 210 -250 k. Da condroitin solfato and cheratan solfato legate al backbone condroitin solfato (100 - 150 per monomer), cheratan solfato (30 - 60 per monomer) • MW dell’aggregano 2 x 108 CS: Chondroitin sulphate, G: globular domain, LP: linking protein

 Missa parte por parte slide catequese
Missa parte por parte slide catequese Te invitamos a ser parte
Te invitamos a ser parte Este parte aquele parte
Este parte aquele parte Cómo se escribe 15 enteros 204 milésimos
Cómo se escribe 15 enteros 204 milésimos Una vagoneta de 1000 kg de peso parte del reposo
Una vagoneta de 1000 kg de peso parte del reposo Assioma di partizione del piano da parte di una retta
Assioma di partizione del piano da parte di una retta Ppt género dramático 6 básico
Ppt género dramático 6 básico Divergenza di una matrice
Divergenza di una matrice Trasposta di una matrice
Trasposta di una matrice Definizione di matrice
Definizione di matrice Gradiente in coordinate cilindriche
Gradiente in coordinate cilindriche Bluecielo ecm solutions bv
Bluecielo ecm solutions bv Aiim ecm specialist
Aiim ecm specialist Ecm motor troubleshooting
Ecm motor troubleshooting Ecm solutions group
Ecm solutions group Ecm leaders
Ecm leaders Ecm case management
Ecm case management Enterprise content management ibm
Enterprise content management ibm Ecm grobkonzept
Ecm grobkonzept Cloud based ecm
Cloud based ecm Enterprise content management rfp
Enterprise content management rfp Consulting auswahlverfahren ecm
Consulting auswahlverfahren ecm Ecm wiesbaden
Ecm wiesbaden Agenas sicilia
Agenas sicilia Ent rennes 1
Ent rennes 1 03022009
03022009 Ecm neutrale consulting
Ecm neutrale consulting Enterprise content management definition
Enterprise content management definition Los elementos de las ondas
Los elementos de las ondas Parte invariable de la oración
Parte invariable de la oración Un fiume è largo 200 m
Un fiume è largo 200 m Partes de una escalera
Partes de una escalera Son las partes intangibles de un sistema informático
Son las partes intangibles de un sistema informático Chasis simple cuna cerrado
Chasis simple cuna cerrado Que es una parte por millon
Que es una parte por millon Partes en la que se divide el entero
Partes en la que se divide el entero Partes de una estufa con horno
Partes de una estufa con horno Nif c13
Nif c13 Morfologia de semillas
Morfologia de semillas What is the volume of blood pumped per minute
What is the volume of blood pumped per minute Stroke volume
Stroke volume Solute
Solute Lung capacity
Lung capacity Volume kerucut = .....x volume tabung *
Volume kerucut = .....x volume tabung * Large volume parentrals
Large volume parentrals I prodotti marcati ce sono assolutamente sicuri
I prodotti marcati ce sono assolutamente sicuri Incision inguinal
Incision inguinal Parte frontal de la computadora
Parte frontal de la computadora Parte del olfato
Parte del olfato Parte del núcleo celular
Parte del núcleo celular Parte nominale del predicato
Parte nominale del predicato Monomios semejantes y opuestos
Monomios semejantes y opuestos Ecosistema pluviestacional
Ecosistema pluviestacional Que es el folklore espiritual
Que es el folklore espiritual Las partes de un texto instructivo
Las partes de un texto instructivo