MATRICE EXTRACELLULARE MATRICE EXTRACELLULARE insieme di proteine e




























































- Slides: 104

MATRICE EXTRACELLULARE

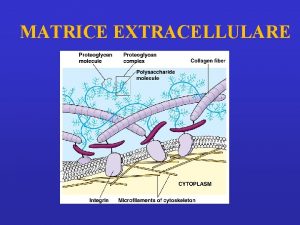
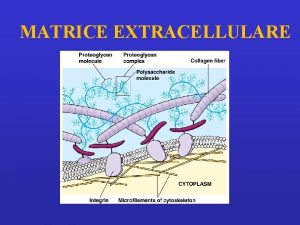
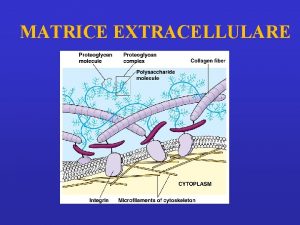
MATRICE EXTRACELLULARE • insieme di proteine e polisaccaridi, secrete da diversi tipi di cellule, che costituiscono strutture extracellulari in grado di svolgere diverse funzioni • diversa concentrazione delle diverse componenti della matrice dà origine a strutture molto diverse tra loro (es, tendini, cartilagini dell’osso…) • • le funzioni diverse dipendono dalle sostanze che la compongono e dalla loro particolare disposizione

Extracellular matrix – Building blocks • Glycosaminoglycans (GAG-s) Ø heparan sulfate - basal membr. , cell surface Ø keratan sulfate - cornea, bone Ø chondroitin sulfate – cartilage, bone, heart Ø hyaluronate - synovial fluid Ø dermatan sulfate - blood vessels, heart • „Core-proteins” aggrecan – decorin Ø collagen – elastin - structure Ø fibronectin – laminin - adhesion

Sizes of ECM Components • • Collagens - fiber (type I) and network (type IV) forming Multiadhesive proteins - laminin, nidogen, fibronectin GAGs - hyaluronan PGs - aggrecan, perlecan, decorin

FUNZIONI DELLA MATRICE EXTRACELLULARE Ø supporto tridimensionale Ø barriera che regola gli scambi sangue-cellula Ø deposito biologico di molecole con capacità di regolare la attività cellulare Ø complesso molecolare in grado di indurre e mantenere lo stato differenziato Øregolazione della divisione cellulare, adesione, motilità e migrazione cellulare (distruzione controllata della matrice ad opera di proteasi), differenziamento durante l’embriogenesi

LA MATRICE EXTRACELLULARE diversi aspetti d’interesse 1 - i suoi costituenti (identificazione strutturale e funzionale) 2 - la lamina basale ( sottile ma estremamente complessa) 3 - recettori di membrana per i costituenti della matrice 4 - segnali intracellulari attivati dal legame tra integrine e molecole della matrice 5 - le funzioni cellulari controllate dalla matrice 6 - il rimodellamento della matrice (fisiologico, patologico) 7 - il ruolo della matrice nello sviluppo embrionale

CELLULE E MATRICE INTERAGISCONO IN MODO DINAMICO INFLUENZANDOSI A VICENDA CELLULE MATRICE Le cellule sintetizzano la propria matrice extra-cellulare, la quale a sua volta influisce sulle cellule in modo che esse possano perfezionare e mantenere stabilmente il loro fenotipo differenziato.

Il mondo extracellulare • Le cellule aderiscono fisicamente alle matrici extracellulari mediante tutta una serie di recettori per: collageno, laminina, fibronectina, fibrina, proteoglicani, integrine e molte altre molecole • Questo permette la trasmissione dei segnali dalla matrice extracellulare alla cellula e viceversa • In tal modo, la matrice extracellulare, apparentemente “inerte”, può influenzare l’adesione, la forma, il movimento e perfino l’espressione genica della cellula


Le cellule che producono le molecole della matrice sono essenzialmente fibroblasti ; In certi tipi specializzati di tessuti connettivi (cartilagine e osso) tali molecole sono secrete da cellule della famiglia dei fibroblasti più specializzate (es, condroblasti e osteoblasti)

Due classi principali di macromolecole extracellulari compongono la matrice extracellulare: -proteine fibrose, fra cui collagene, elastina, fibronectina e laminina che hanno funzioni sia strutturali che adesive. -catene polisaccaridiche della classe chiamata glicosamminoglicani (GAG), che si trovano di solito uniti covalentemente a proteine sotto forma di proteoglicani • Glycosaminoglycans (GAG-s) Ø heparan sulfate - basal membr. , cell surface Ø keratan sulfate - cornea, bone Ø chondroitin sulfate – cartilage, bone, heart Ø hyaluronate - synovial fluid Ø dermatan sulfate - blood vessels, heart • „Core-proteins” aggrecan – decorin Ø collagen – elastin - structure

PROTEINE FIBROSE • organizzazione longitudinale • Un’unica struttura secondaria (a-elica, bfoglietto, elica collagenica) • Proteine di struttura intra- ed extra-cellulari • Insolubili in acqua • Formano strutture sopramolecolari • Legami covalenti crociati tra le catene collagene, elastina, fibronectina e la

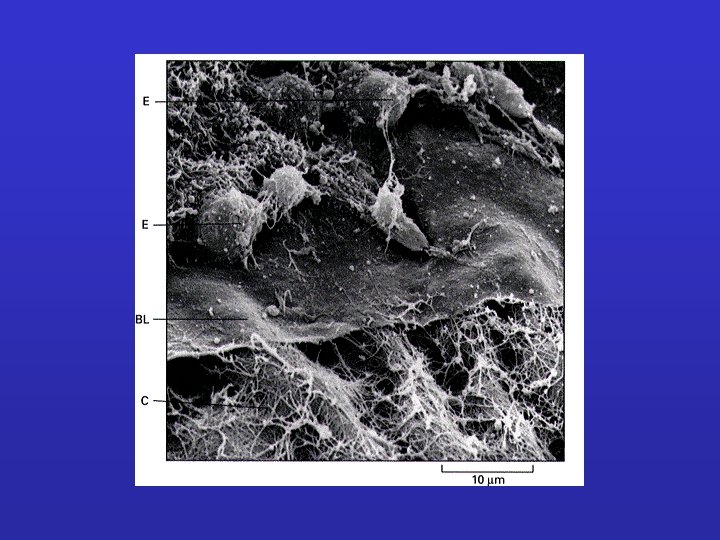
I componenti meglio osservabili a livello submicroscopico sono: • Le fibre collagene (non ramificate) • Le fibre elastiche (ramificate) • I proteoglicani (un gel) • Le membrane basali (lamine)

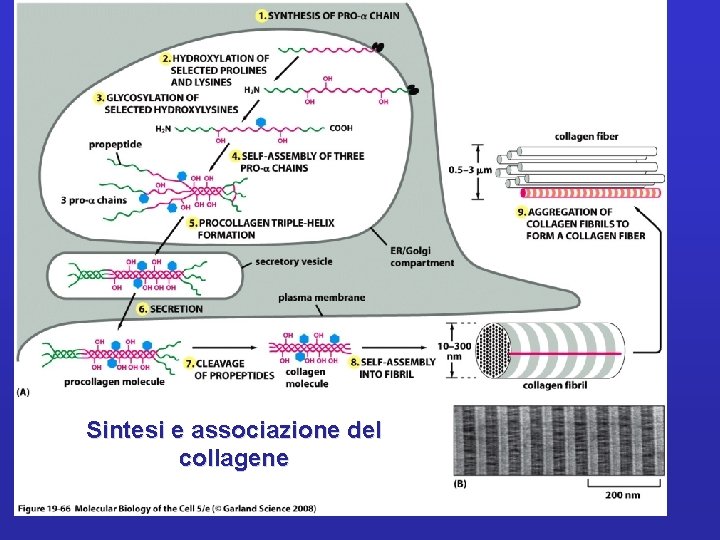
Collagene Famiglia di proteine fibrose secrete da cellule del tessuto connettivo e da una varietà di altri tipi cellulari. Sono le proteine più abbondanti nei mammiferi 1/3 rd of the total proteins Found abundantly in tendon, cartilage, bone and skin(costituiscono pelle ed osso). Danno origine a fibre semicristalline che tengono in posizione le cellule, conferiscono resistenza alla tensione ed elasticità alla matrice; svolgono funzioni importanti nell’ambito della mobilità e dello sviluppo delle cellule. Glicoproteine per lo più insolubili, caratterizzate da un contenuto elevato di Gly e di 2 aa modificati: idrossi-Lys e idrossi-Pro.

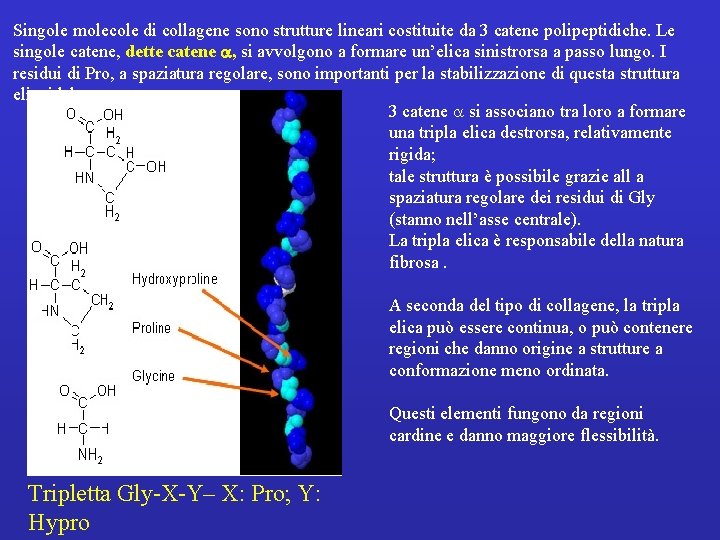
Singole molecole di collagene sono strutture lineari costituite da 3 catene polipeptidiche. Le singole catene, dette catene , si avvolgono a formare un’elica sinistrorsa a passo lungo. I residui di Pro, a spaziatura regolare, sono importanti per la stabilizzazione di questa struttura elicoidale. 3 catene a si associano tra loro a formare una tripla elica destrorsa, relativamente rigida; tale struttura è possibile grazie all a spaziatura regolare dei residui di Gly (stanno nell’asse centrale). La tripla elica è responsabile della natura fibrosa. A seconda del tipo di collagene, la tripla elica può essere continua, o può contenere regioni che danno origine a strutture a conformazione meno ordinata. Questi elementi fungono da regioni cardine e danno maggiore flessibilità. Tripletta Gly-X-Y– X: Pro; Y: Hypro

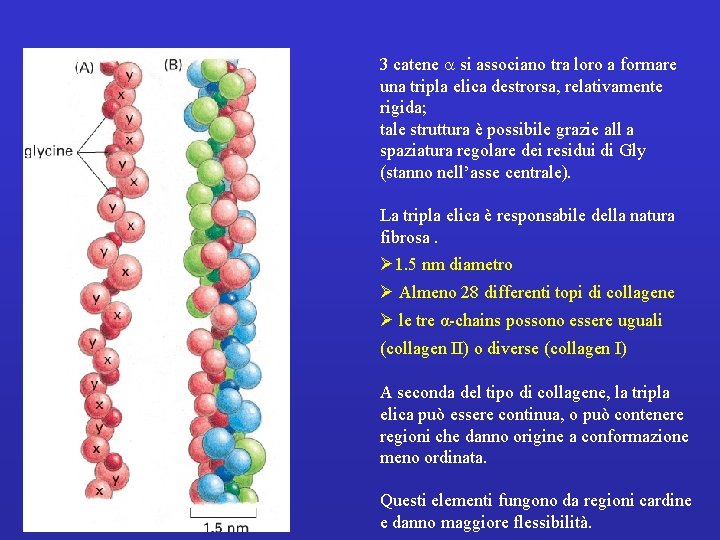
3 catene a si associano tra loro a formare una tripla elica destrorsa, relativamente rigida; tale struttura è possibile grazie all a spaziatura regolare dei residui di Gly (stanno nell’asse centrale). La tripla elica è responsabile della natura fibrosa. Ø 1. 5 nm diametro Ø Almeno 28 differenti topi di collagene Ø le tre α-chains possono essere uguali (collagen II) o diverse (collagen I) A seconda del tipo di collagene, la tripla elica può essere continua, o può contenere regioni che danno origine a conformazione meno ordinata. Questi elementi fungono da regioni cardine e danno maggiore flessibilità.



Sintesi e associazione del collagene

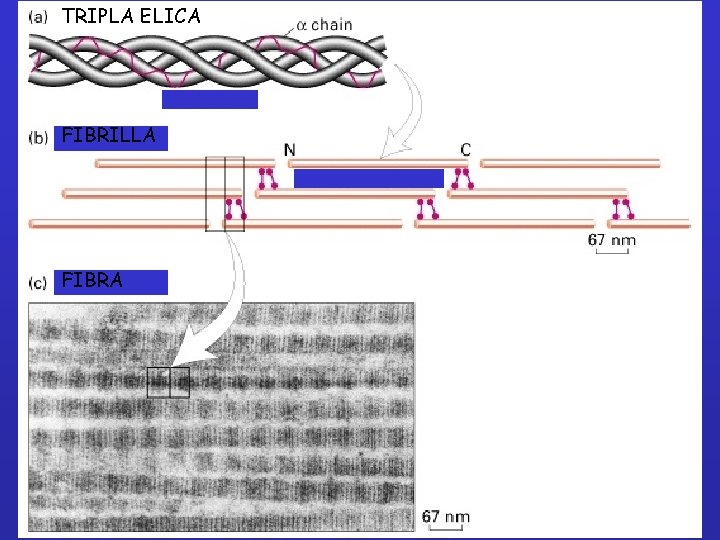
TRIPLA ELICA FIBRILLA FIBRA

Legami incrociati formati tra catene laterali di lisine modificate in una fibrilla di collagene Lisine ed idrossilisine possono essere deaminate dalla lisil ossidasi. Si producono gruppi aldeidici altamente reattivi

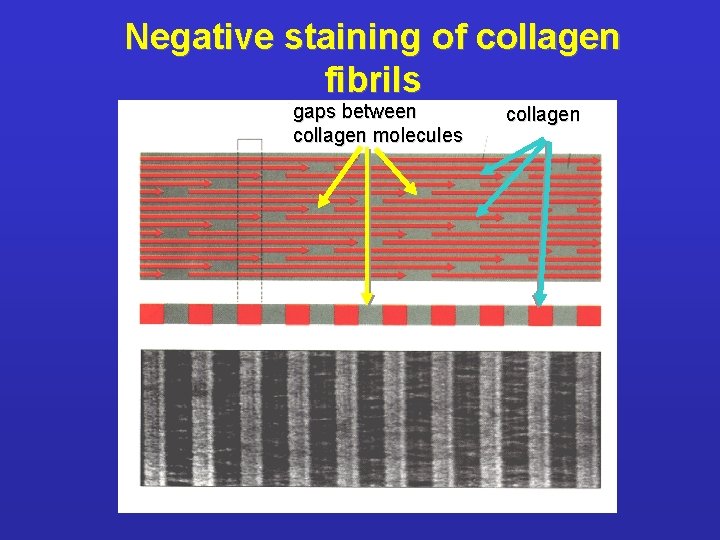
Negative staining of collagen fibrils gaps between collagen molecules collagen


Classificazione del collagene 1. Fibril-forming collagens Ø No interruptions in triple helix Ø Regular arrangement results in characteristic “D” period of 67 nm Ø Diameter : 50 -500 nm Ø Example : Types I, III, V, XI

Classificazione del collagene 2. Network-forming collagens Ø Forms network in basement (Collagen IV) and Descemet’s membrane (Collagen VIII) Ø Molecular filtration Ø Example : Types IV, VIII, X

Classificazione del collagene 3. Fibril-associated collagens with interrupted triple helices (FACITs) Ø Short collagens with interruptions Ø Linked to collagen II and carries a GAG chain Ø Found at the surface of fibril-forming collagens Ø Example : Types IX, XII, XIV


Classificazione del collagene 4. Anchoring collagens Ø Provides functional integrity by connecting epithelium to stroma Ø Example : Type VII 04/19/10

Classificazione del collagene 5. Beaded-filament-forming collagens Ø Form structural links with cells Ø Example : Type VI Ø Collagen VI crosslink into tetramers that assemble into long molecular chains (microfibrils) and have beaded repeat of 105 nm 04/19/10

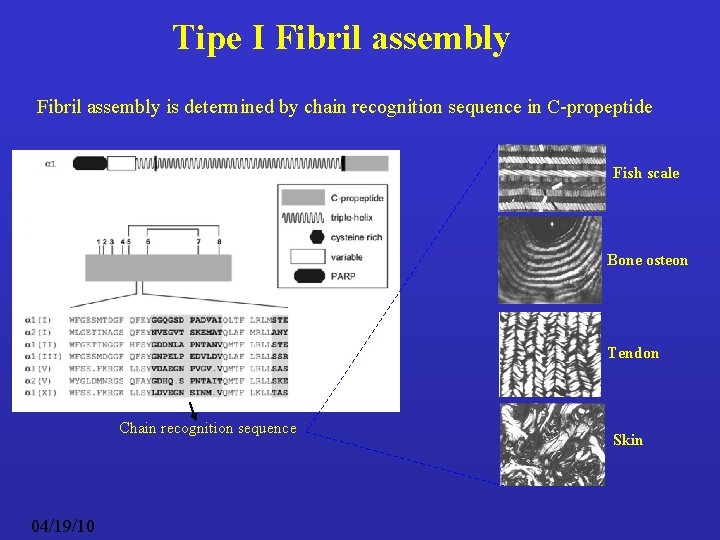
Tipe I Fibril assembly is determined by chain recognition sequence in C-propeptide Fish scale Bone osteon Tendon Chain recognition sequence 04/19/10 Skin


Clinical approaches Collagen hydroxy-Pro hydroxy-Lys cross-linking N-term. propeptide - poor wound healing - hyperextensibility - musculo-skeletal deformities

Malattie associate al collagene Diseases caused by mutations Ø Subtypes of osteogenesis imperfecta (collagen I) Ø Ehlers-Danlos syndrome (collagen I and V) Ø Alport syndrome (collagen IV) Ø Certain arterial aneurysms (collagen III) Ø Ullrich muscular dystrophy (collagen VI) Ø Certain chondrodysplasias (collagen IX and XI) Ø Kniest dysplasia (collagen II)

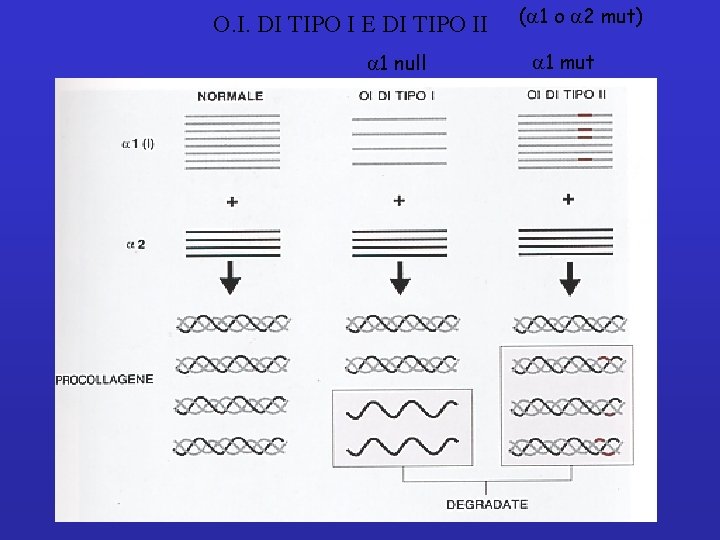
I DIFETTI EREDITARI DEL COLLAGENE Osteogenesi imperfetta tipo 1 Quadro clinico: Fratture frequenti alle ossa lunghe. braccia, gambe, costole Guarigione delle fratture Possibile perdita dell’udito Quadro biochimico: Molte mutazioni diverse a carico della catena 1 (I) del collagene 1 allele mutato = riduzione del 50% della sintesi di catene alfa Solo metà della quantità normale di collagene sintetizzato. L’eccesso di catene 2 viene degradato

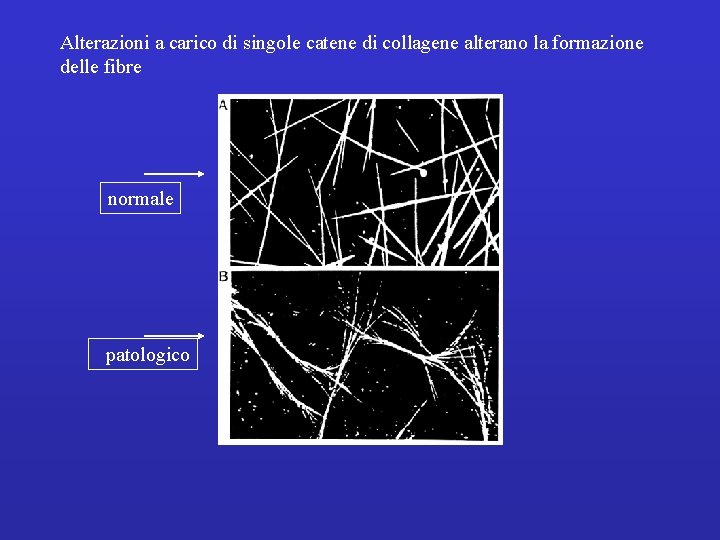
Alterazioni a carico di singole catene di collagene alterano la formazione delle fibre normale patologico

O. I. DI TIPO I E DI TIPO II a 1 null (a 1 o a 2 mut) a 1 mut

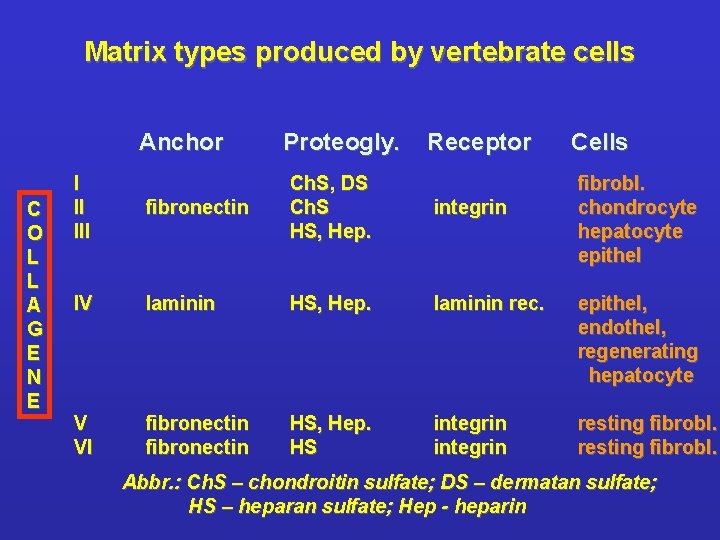
Matrix types produced by vertebrate cells Anchor C O L L A G E N E I II III Proteogly. Receptor Cells fibronectin Ch. S, DS Ch. S HS, Hep. fibrobl. chondrocyte hepatocyte epithel integrin IV laminin HS, Hep. laminin rec. epithel, endothel, regenerating hepatocyte V VI fibronectin HS, Hep. HS integrin resting fibrobl. Abbr. : Ch. S – chondroitin sulfate; DS – dermatan sulfate; HS – heparan sulfate; Hep - heparin

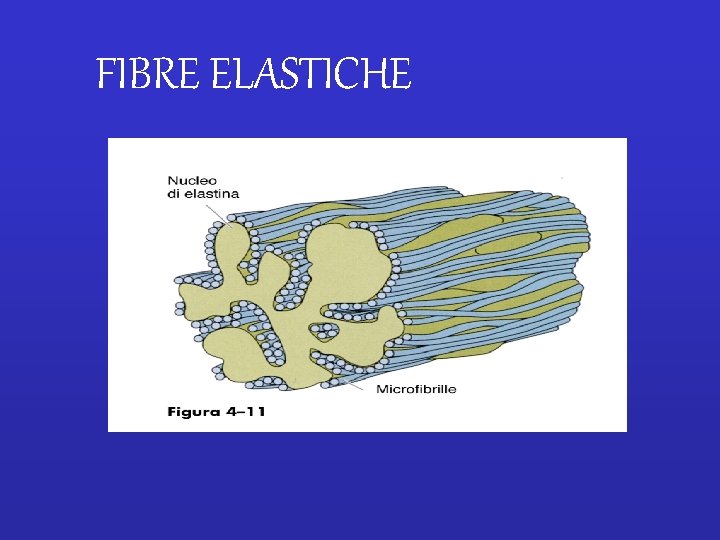
FIBRE ELASTICHE

Elastina: 750 aminoacidi, 72 k. Da, 33% Gly • Molti aminoacidi apolari, senza periodicità, non glicosilata – Senza Hy. Pro e Hy. Lys, ma con desmosina (gialla) • Sintesi come per collagene – Precursore solubile – Modificazioni posttranslazionali – Insolubilizzazione nello spazio extracellulare – Lys → desmosina ad opera di Lys ossidasi (Cu++) – Copertura con uno strato di microfibrille (fibrilline)

• Molti tessuti (ad es. pelle, vasi sanguigni, polmoni) hanno bisogno di essere sia resistenti che elastici per funzionare. • La resilienza è data da una rete di fibre elastiche permette il riavvolgimento dopo uno stiramento transitorio. FIBRE ELASTICHE Comuni nei tessuti che richiedono la capacità di deformarsi ripetutamente e reversibilmente. Hanno una zona centrale amorfa che consiste di elastina, circondata da piccoli filamenti a perline, le microfibrille. La componente principale delle microfibrille è la grande glicoproteina, fibrillina.

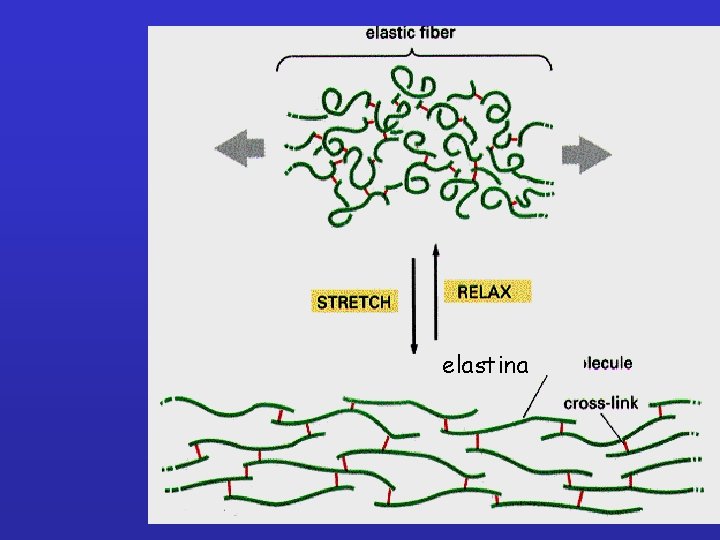
e. LASTINA Rete nella matrice, possono tenere insieme fibre di collagene. Componente principale è l’ELASTINA (proteina altamente idrofobica, ricca di Pro e Gly, non glicosilata). L’elastina è prodotta a partire da un precursore (TROPOELASTINA) solubile secreto nello spazio extracellulare.

L’elastina viene inizialmente sintetizzata come monomero solubile, la tropoelastina, che viene secreta dalle cellule. Dopo la secrezione, i monomeri di tropoelastina subiscono legami incrociati mediante l’azione dell’enzima lisil ossidasi. L’elastina con i legami incrociati è una proteina estremamente insolubile. Il gene umano contiene 36 esoni (27 - 165 coppie di basi). Il turnover dell’elastina è estremamente basso, con una emivita che si avvicina all’età dell’organismo. L’elastina è sintetizzata soprattutto durante lo sviluppo e qualsiasi elastina “danneggiata” o non viene sostituita oppure è sostituita da fibre non funzionali. Una eccessiva degradazione dell’elastina è osservata in malattie gravi, quali l’enfisema e l’aterosclerosi.

• Dopo la secrezione, le molecole di elastina vengono collegate da un gran numero di legami incrociati, generando una estesa rete di fibre e strati. I legami incrociati vengono formati fra residui di lisina, mediante un meccanismo simile a quello che produce i legami incrociati nelle molecole di collagene. • La proteina elastina è composta in gran parte da due tipi di segmenti corti, ciascuno codificato da un esone diverso, che si alternano lungo la catena polipeptidica: Segmenti idrofobici responsabili per le proprietà elastiche della molecola Segmenti ad -elica ricchi in lisina, che formano legami incrociati fra molecole adiacenti

elastina

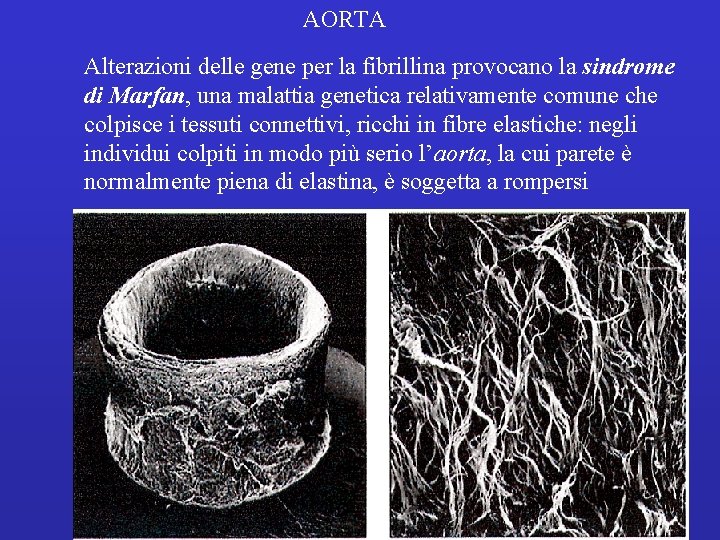
AORTA Alterazioni delle gene per la fibrillina provocano la sindrome di Marfan, una malattia genetica relativamente comune che colpisce i tessuti connettivi, ricchi in fibre elastiche: negli individui colpiti in modo più serio l’aorta, la cui parete è normalmente piena di elastina, è soggetta a rompersi

• Le fibre elastiche, tuttavia, non sono composte solo di elastina: la zona centrale di elastina è ricoperta da uno strato di microfibrille, ciascuna delle quali ha un diametro di circa 10 nm. • Microfibrille dello stesso tipo si possono trovare anche in MECs che non contengono elastina. • Le microfibrile sono composte da un gran numero di glicoproteine diverse, che inclusono la glicoproteina di grandi dimensioni fibrillina che sembra essere essenziale per l’integrità delle fibre elastiche. • Si pensa che le microfibrille giochino un ruolo importante per l’assemblamento delle fibre elastiche: compaiono prima dell’elastina durante lo sviluppo embrionale e sembrano formare una impalcatura su cui viene depositata l’elastina secreta. Mentre l’elastina viene depositata, le microfibrille vengono spostate verso la periferia della fibra in crescita.

SINDROME DI WILLIAMS MICRODELEZIONI Williams syndrome is a rare genetic disorder that affects a child's growth, physical appearance, and cognitive development. People who have Williams syndrome are missing genetic material from chromosome 7, including the gene elastin. This gene's protein product gives blood vessels the stretchiness and strength required to withstand a lifetime of use. The elastin protein is made only during embryonic development and childhood, when blood vessels are formed. Because they lack the elastin protein, people with Williams Syndrome have disorders of the circulatory system and heart defects.

Williams Deletion Region

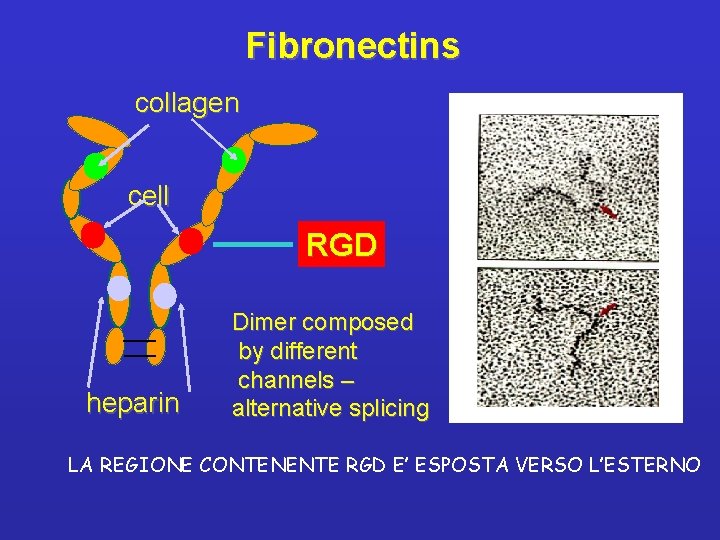
FIBRONECTINA • • Proteina multiadesiva: possibili molti tipi di interazioni con differenti molecole Ruolo nell’embriogenesi (controllo delle ondate migratorie e del differenziamento) Partecipa ai processi di coagulazione e riparo delle ferite DIVERSI GRADI DI SOLUBILITA’ - LA FIBRONECTINA EMATICA E’ SOLUBILE (è prodotta dal fegato e manca di EDA e EDB)

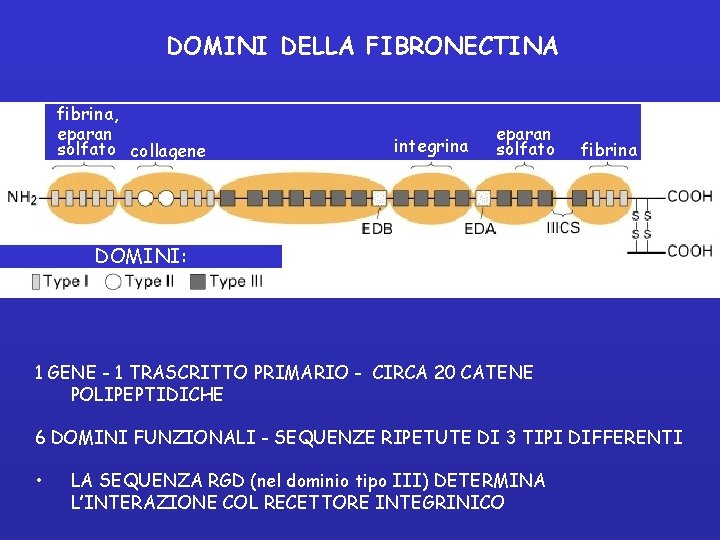
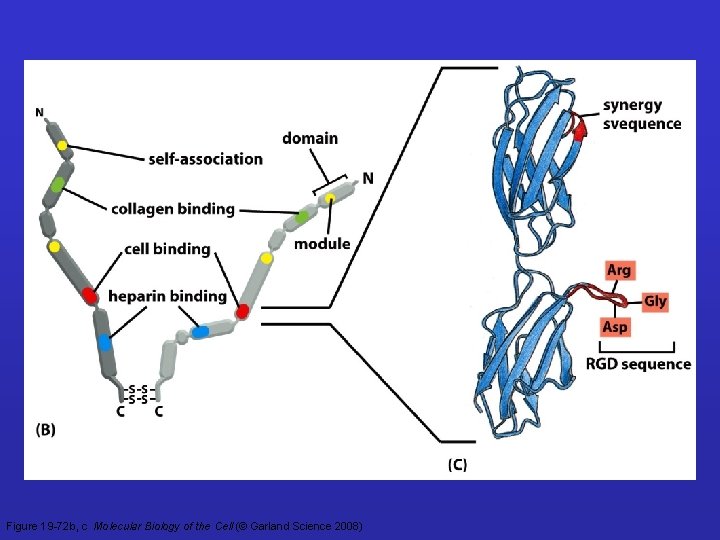
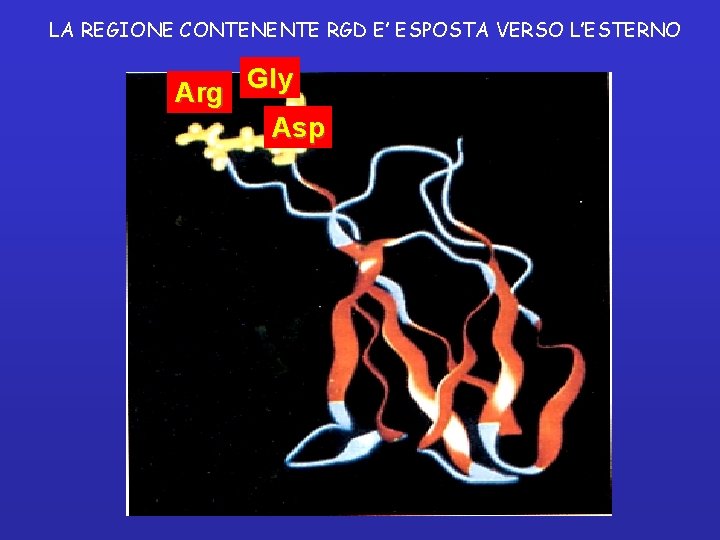
DOMINI DELLA FIBRONECTINA fibrina, eparan solfato collagene integrina eparan solfato fibrina DOMINI: 1 GENE - 1 TRASCRITTO PRIMARIO - CIRCA 20 CATENE POLIPEPTIDICHE 6 DOMINI FUNZIONALI - SEQUENZE RIPETUTE DI 3 TIPI DIFFERENTI • LA SEQUENZA RGD (nel dominio tipo III) DETERMINA L’INTERAZIONE COL RECETTORE INTEGRINICO

Fibronectins collagen cell RGD heparin Dimer composed by different channels – alternative splicing LA REGIONE CONTENENTE RGD E’ ESPOSTA VERSO L’ESTERNO

Figure 19 -72 b, c Molecular Biology of the Cell (© Garland Science 2008)

LA REGIONE CONTENENTE RGD E’ ESPOSTA VERSO L’ESTERNO Gly Arg Asp

GLICOSAMMINOGLICANI E PROTEOGLICANI

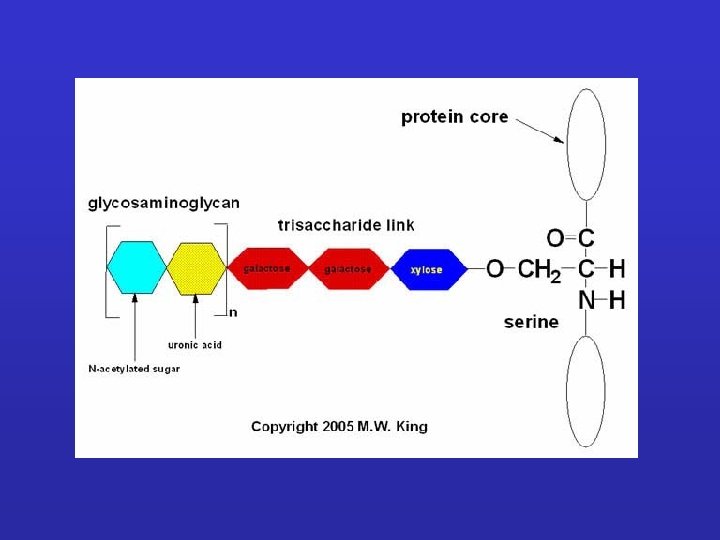
GLICOSAMMINOGLICANI: Sono catene polisaccaridiche non ramificate composte da unità ripetute di disaccaridi. Uno degli zuccheri è sempre uno zucchero amminico (nella maggior parte dei casi è solfato). Il secondo zucchero è di solito un acido uronico (glucuronico o iduronico) I GLICOSAMINOGLICANI OCCUPANO SPAZIO E FORMANO GEL IDRATATI. I GAG che spesso sono legati a proteine formando proteoglicani sono sintetizzati nell'apparato del Golgi dove in seguito a modifiche post-trascrizionali le unità disaccariche vengono aggiunte ai core proteici.






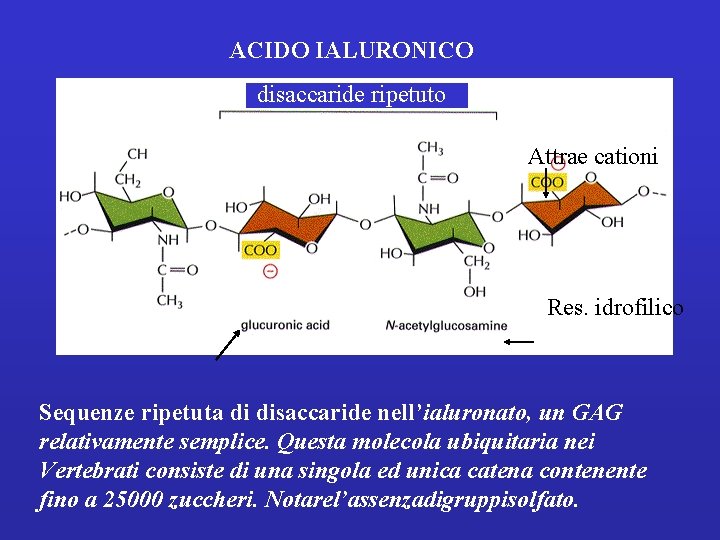
Glicosaminoglicano non legato covalentemente a proteine Acido ialuronico. N l'acido ialuronico, non è parte di proteoglicani viene prodotto da enzimi presenti sulla superficie esterna della membrana plasmatica direttamente in sede extracellulare. Conferisce consistenza e resistenza soprattutto alle forze di compressione Durante lo sviluppo embrionale: regola la migrazione cellulare controllata da ialuronidasi E’ presente nel fluido articolare Interviene nella riparazione delle ferite

ACIDO IALURONICO disaccaride ripetuto Attrae cationi Res. idrofilico Sequenze ripetuta di disaccaride nell’ialuronato, un GAG relativamente semplice. Questa molecola ubiquitaria nei Vertebrati consiste di una singola ed unica catena contenente fino a 25000 zuccheri. Notarel’assenzadigruppisolfato.

PROTEOGLICANI: Sono prodotti dalla maggior parte delle cellule animali. La catena polipeptidica, o nucleo proteico, è prodotta dai ribosomi del RER e introdotta nel lume. Le catene polisaccaridiche sono assemblate su questo nucleo principalmente nell’apparato del Golgi. Qui vengono anche aggiunti gli zuccheri. Le molecole di proteoglicano nel tessuto connettivo formano una “sostanza basale” simile a gel altamente idratata in cui le proteine fibrose sono immerse. Le fibre di collagene rafforzano e aiutano ad organizzare la matrice e fibre di elastina simili a gomma le danno elasticità. Grande varietà Variabilità di composizione della componente saccaridica dei GAG Grande numero di core protein

Proteoglicani Complesso di una“core protein”e glicosaminoglicani GAGs sonoripetizioni di disaccaridi lineari con modificazioni dei gruppi aminici Spesso solfatati Sempre negativi Perciò, i GAGs idrofilici si respingono uno con l’altro Formano un amatrice idratata capace di assorbire fino a 1000 Volte in loro volume in acqua.


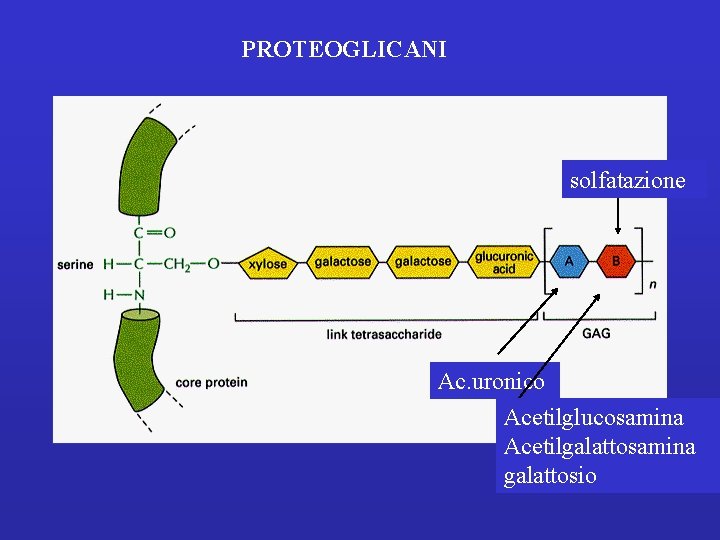
PROTEOGLICANI solfatazione Ac. uronico Acetilglucosamina Acetilgalattosamina galattosio


Proteoglycans consist of a protein core (brown) and one or more covalently attached glycosaminoglycan chains ([blue] HS; [yellow] CS/DS). Membrane proteoglycans either span the plasma membrane (type I membrane proteins) or are linked by a GPI anchor. ECM proteoglycans are usually secreted, but some proteoglycans can be proteolytically cleaved and shed from the cell surface (not shown).

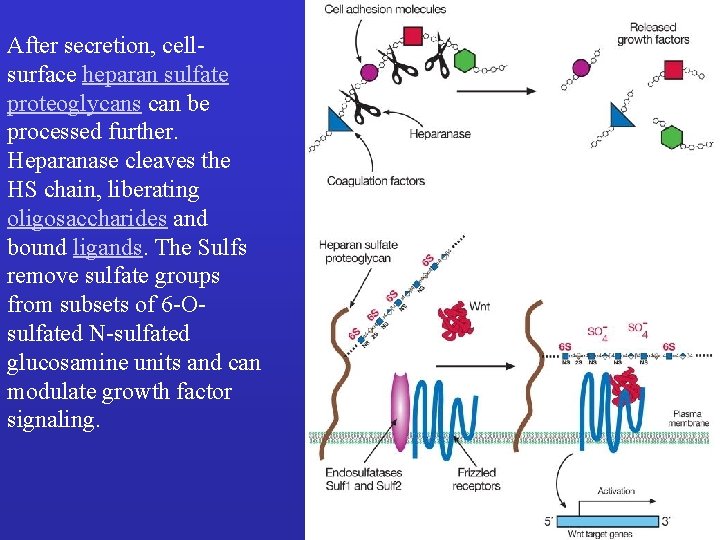
After secretion, cellsurface heparan sulfate proteoglycans can be processed further. Heparanase cleaves the HS chain, liberating oligosaccharides and bound ligands. The Sulfs remove sulfate groups from subsets of 6 -Osulfated N-sulfated glucosamine units and can modulate growth factor signaling.

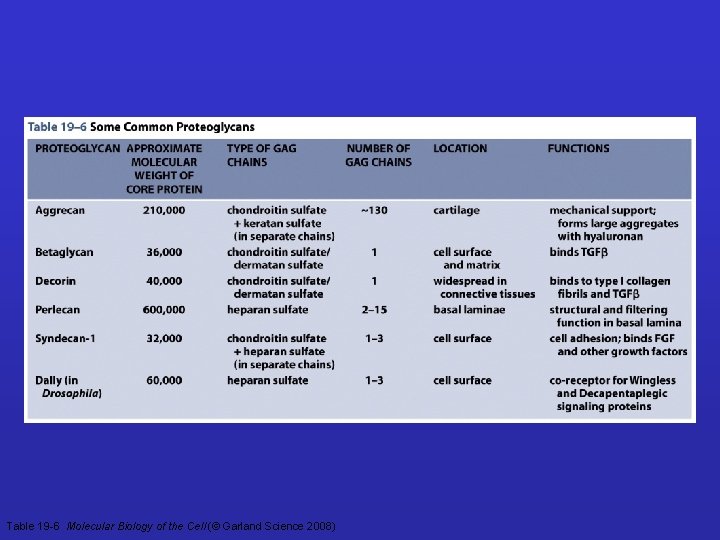
Table 19 -6 Molecular Biology of the Cell (© Garland Science 2008)

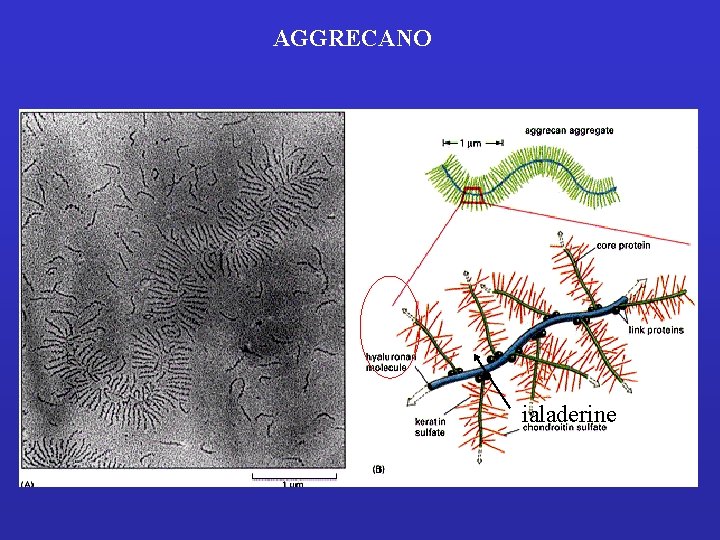
Aggrecan One complex of aggrecan: • • M. W. about 108 Volume 2 x 10 -12 ml (= bacterium)

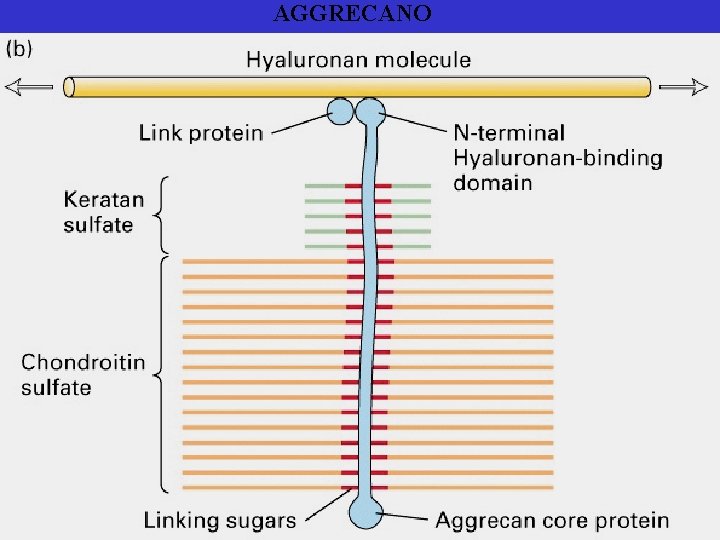
The large cartilage CS proteoglycan (aggrecan) forms an aggregate with hyaluronan and link protein Essentials of Glycobiology Second Edition Chapter 16, Figure 1


AGGRECANO ialaderine

AGGRECANO

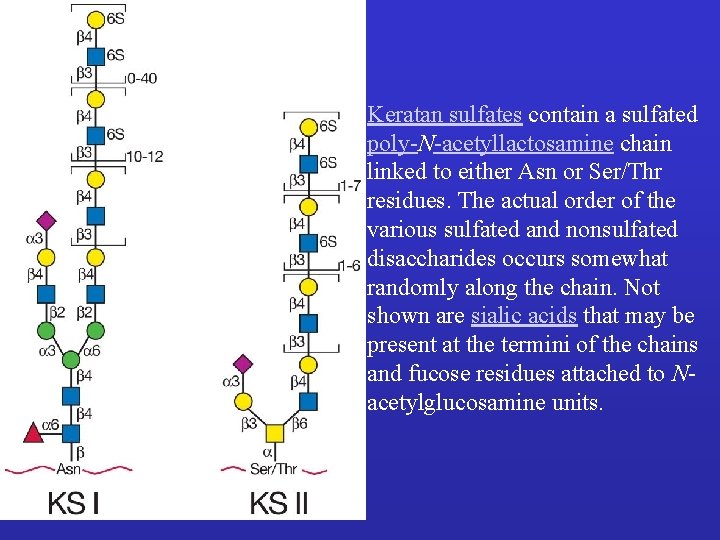
Keratan sulfates contain a sulfated poly-N-acetyllactosamine chain linked to either Asn or Ser/Thr residues. The actual order of the various sulfated and nonsulfated disaccharides occurs somewhat randomly along the chain. Not shown are sialic acids that may be present at the termini of the chains and fucose residues attached to Nacetylglucosamine units.

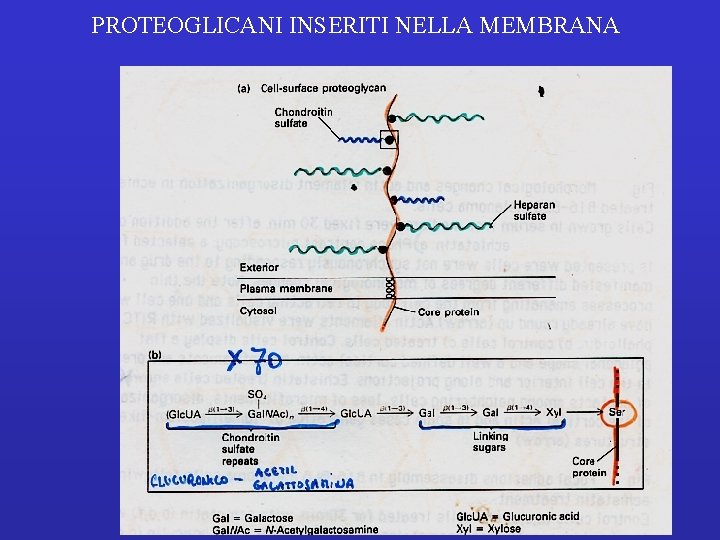
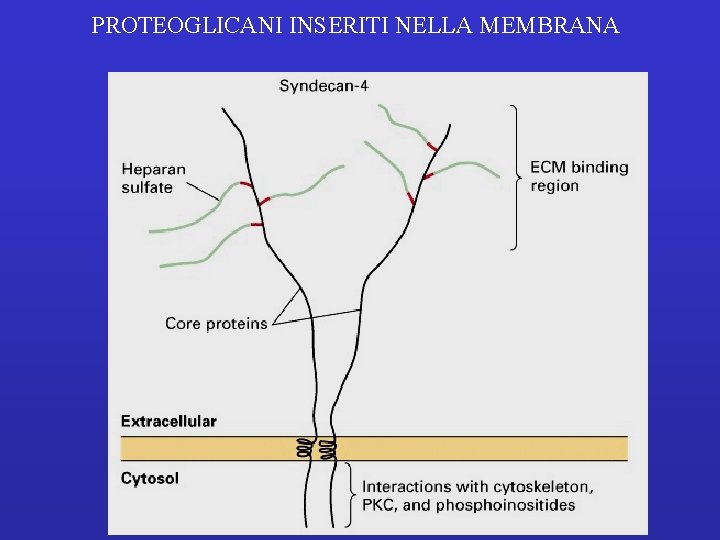
PROTEOGLICANI INSERITI NELLA MEMBRANA

PROTEOGLICANI INSERITI NELLA MEMBRANA


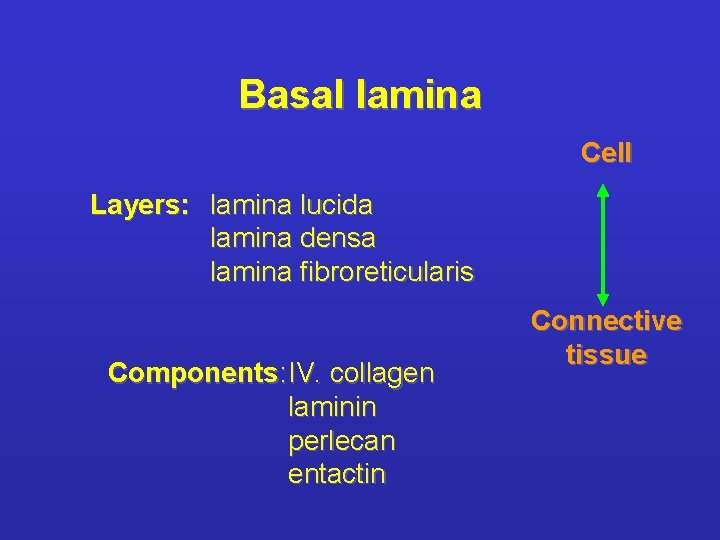
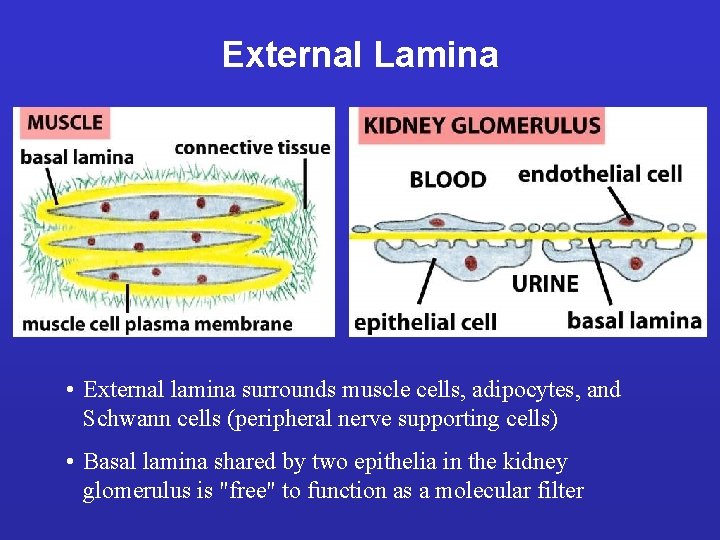
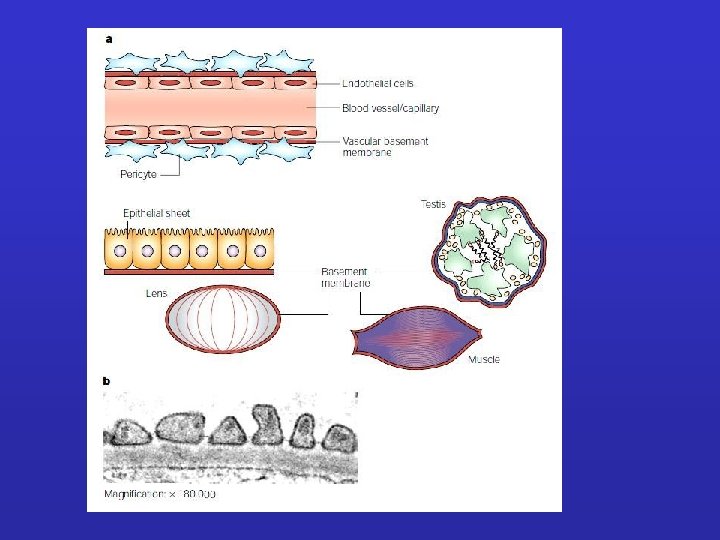
LAMINE BASALI: Sottili tappeti flessibili di matrice specializzata, sottostanti ai fogli e tubi di cellule epiteliali. Funzione di separazione e filtro (glomerulo); determinano la polarità cellulare , influenzano il metabolismo. Sintetizzata in gran parte dalle cellule che si trovano su di essa; fibrille di ancoraggio composte soprattutto da collagene di tipo IV. Ruolo ISTRUTTIVO nella rigenerazione (giunzione neuromuscolare).

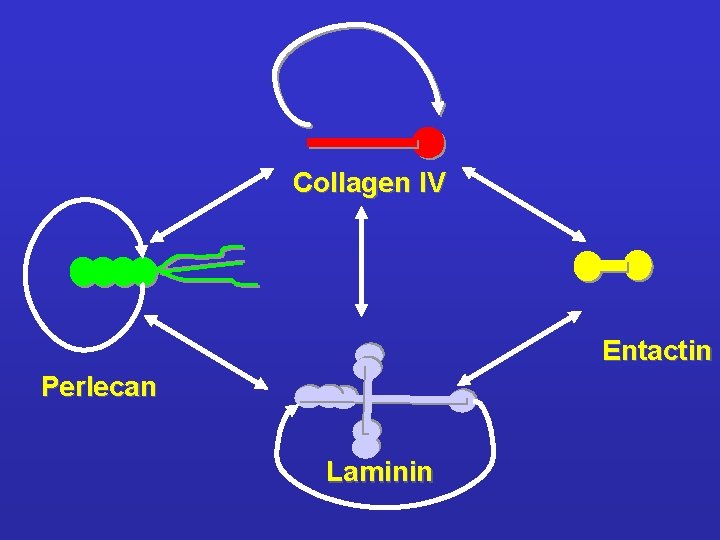
Basal lamina Cell Layers: lamina lucida lamina densa lamina fibroreticularis Components: IV. collagen laminin perlecan entactin Connective tissue


LA LAMINA BASALE ENTACTINA PERLECANO LAMININA COLLAGENE TIPO IV

External Lamina • External lamina surrounds muscle cells, adipocytes, and Schwann cells (peripheral nerve supporting cells) • Basal lamina shared by two epithelia in the kidney glomerulus is "free" to function as a molecular filter


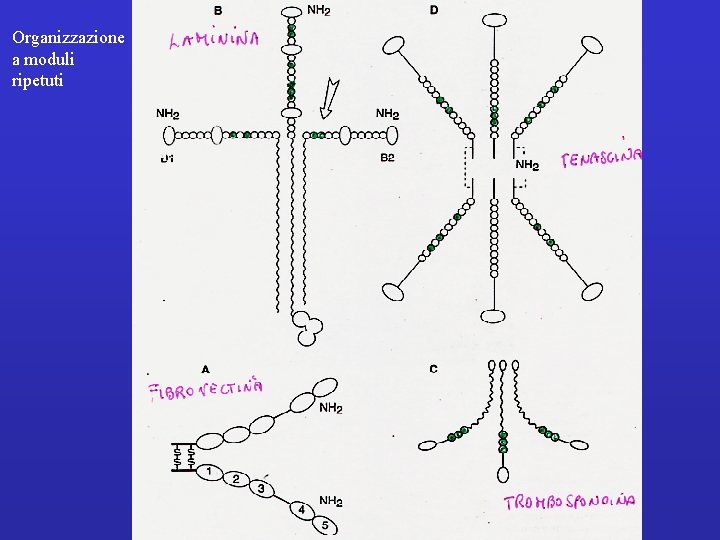
Organizzazione a moduli ripetuti

Collagen IV Entactin Perlecan Laminin

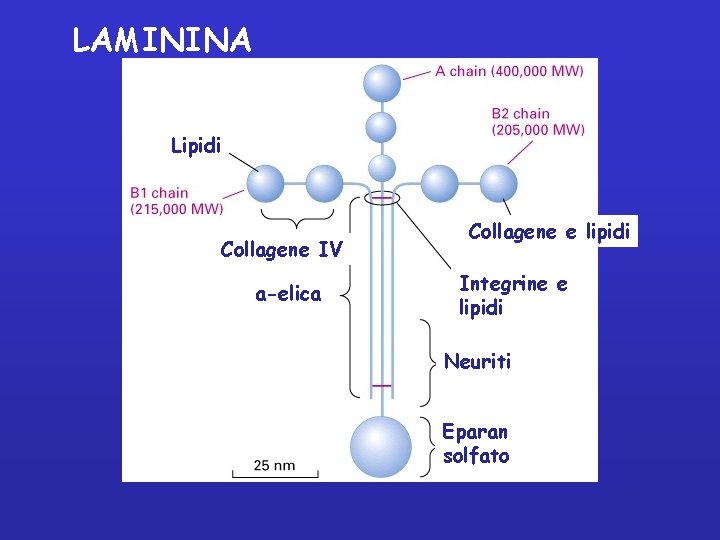
Laminin A chain Globular domains B 2 chain B 1 chain a-helix • each chain has more types • 18 isoforms of laminin • diversities in tissues

LAMININA Lipidi Collagene IV a-elica Collagene e lipidi Integrine e lipidi Neuriti Eparan solfato

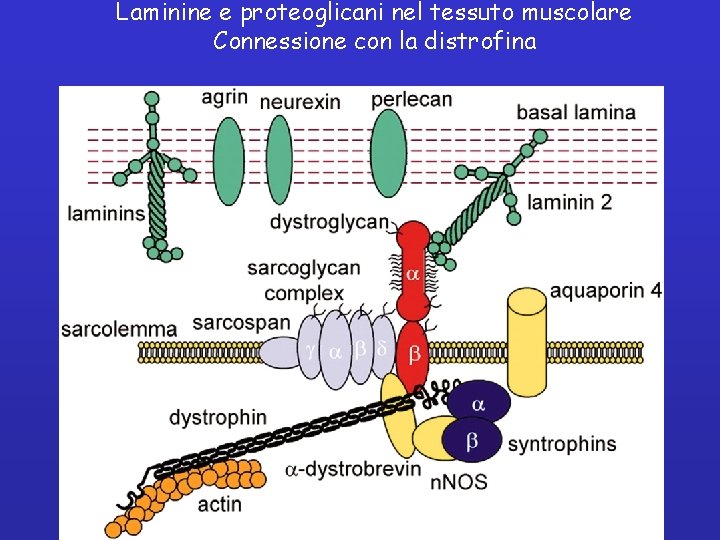
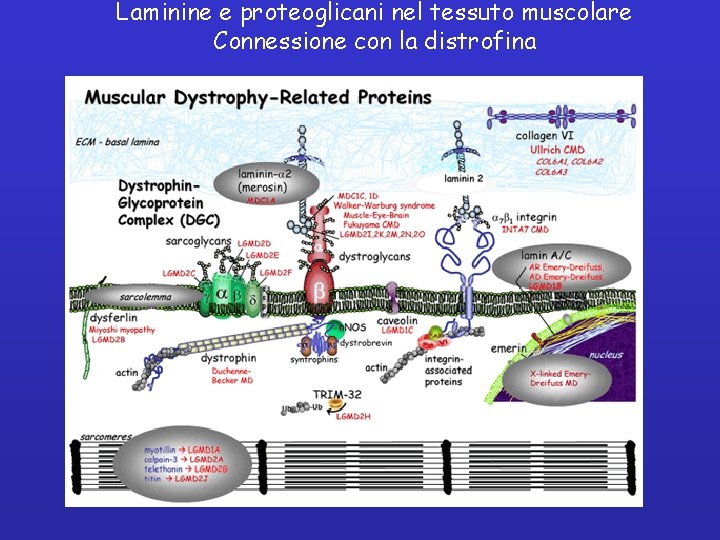
Laminine e proteoglicani nel tessuto muscolare Connessione con la distrofina

Laminine e proteoglicani nel tessuto muscolare Connessione con la distrofina


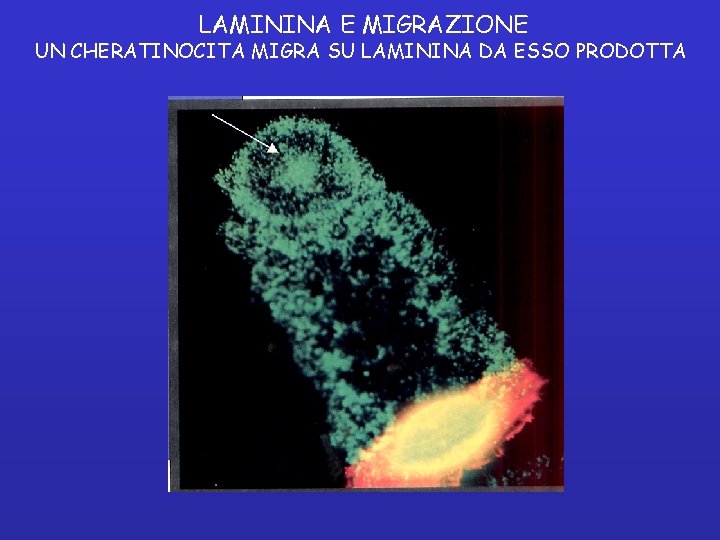
LAMININA E MIGRAZIONE UN CHERATINOCITA MIGRA SU LAMININA DA ESSO PRODOTTA


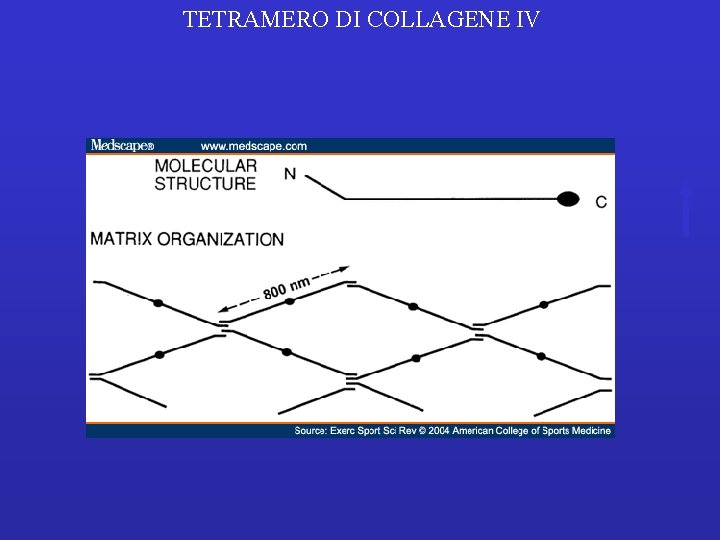
TETRAMERO DI COLLAGENE IV

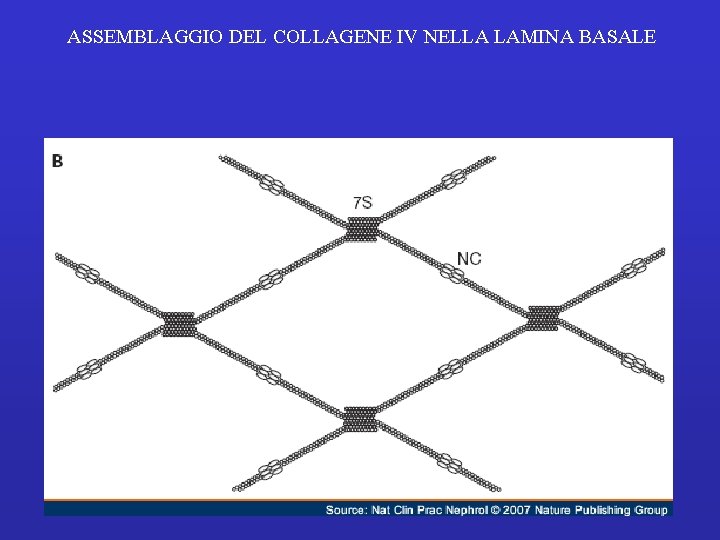
ASSEMBLAGGIO DEL COLLAGENE IV NELLA LAMINA BASALE


Cancer cells: (i) syndecans interact with various ECM macromolecules derived either from stromal cells or tumor cells. Such interactions lead to integrin-mediated altered functional properties such as cell proliferation, adhesion, migration, and invasion. On the other hand, transmembrane syndecans interact with growth factors (GFs) via their HS chains and subsequently act as co-receptors for the respective growth factor receptor (GF-R). In both cases, integrins can co-interact with these complexes and as a consequence to mediate different signaling pathways. (ii) Syndecan shedding is a process that involves the proteolytic cleavage of their ectodomain near the plasma membrane by sheddases. It is also reported that the shed syndecans compete with their transmembrane counterparts for soluble GFs. Shedding of syndecans contributes to cancer progression and especially to the crosstalk between the tumor cells and their host microenvironment. Exosomes, extracellular vesicles that are secreted in high amounts in tumors, retain both heparanase and syndecan-1 as cargo within exosomes and subsequently influence not only the behavior of the tumor microenvironment within the tumor niche and distant sites, but also the growth of the metastasizing cells. (B) Tumor microenvironment. Heparanase plays a distinct role in the shedding of syndecans by cleaving HS chains promoting the shedding via sheddases. This action results in induced tumor growth, angiogenesis and metastasis.

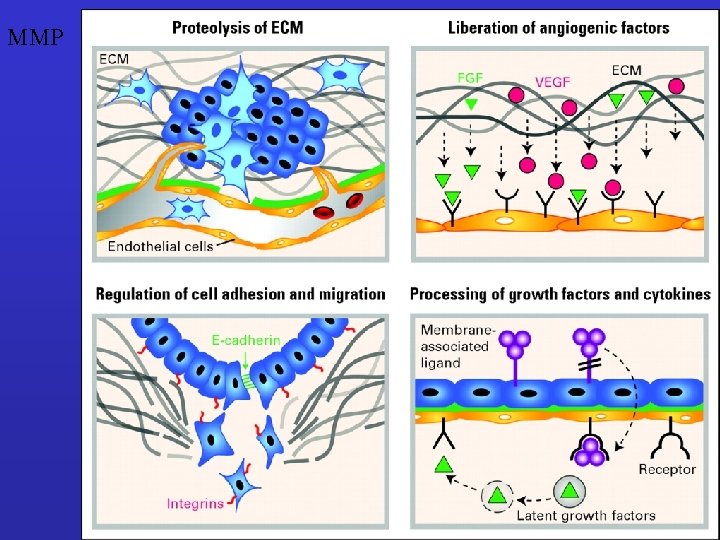
MMP

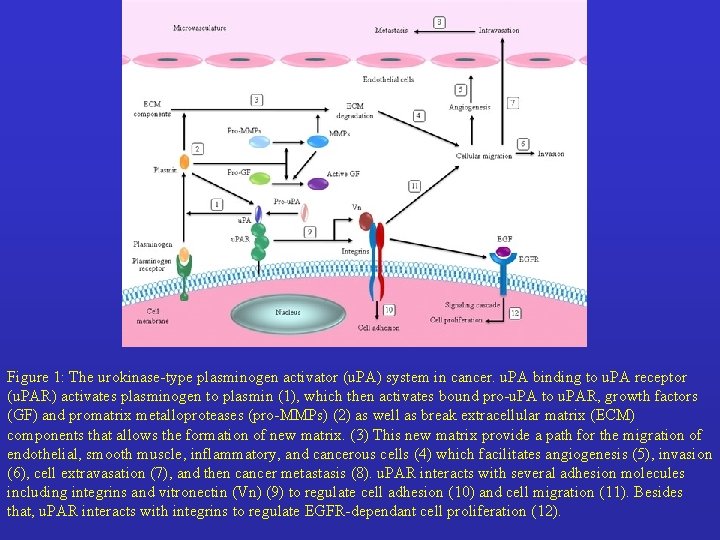
Figure 1: The urokinase-type plasminogen activator (u. PA) system in cancer. u. PA binding to u. PA receptor (u. PAR) activates plasminogen to plasmin (1), which then activates bound pro-u. PA to u. PAR, growth factors (GF) and promatrix metalloproteases (pro-MMPs) (2) as well as break extracellular matrix (ECM) components that allows the formation of new matrix. (3) This new matrix provide a path for the migration of endothelial, smooth muscle, inflammatory, and cancerous cells (4) which facilitates angiogenesis (5), invasion (6), cell extravasation (7), and then cancer metastasis (8). u. PAR interacts with several adhesion molecules including integrins and vitronectin (Vn) (9) to regulate cell adhesion (10) and cell migration (11). Besides that, u. PAR interacts with integrins to regulate EGFR-dependant cell proliferation (12).

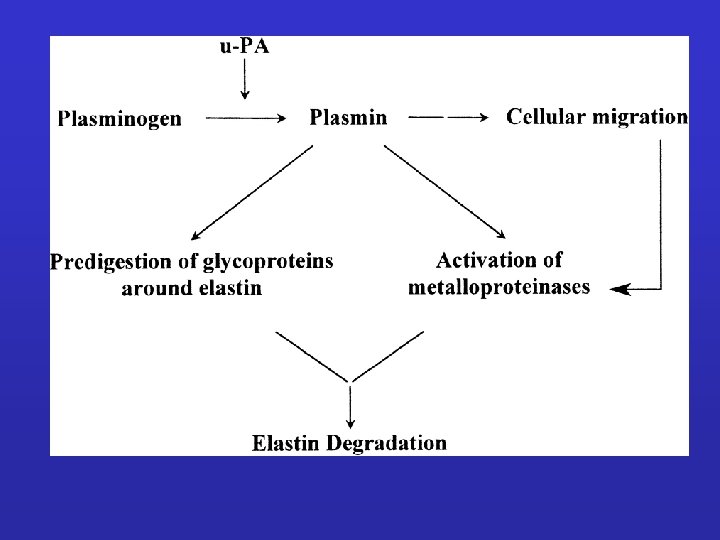
Figure 2: Diagram shows the functions of urokinase-type plasminogen activator (u. PA) system in cancer. The proteolytic activity of u. PA system causes degradation of extracellular matrix (ECM) and basement membrane (BM) as well as initiation of epithelial–mesenchymal transition (EMT) and activation of growth factors. In addition, members of u. PA system are implicated in signal transduction of cell proliferation, apoptosis, chemotaxis, adhesion, and migration. Moreover, u. PA system mediates tumor invasion of surrounding tissues, angiogenesis, and metastasis.


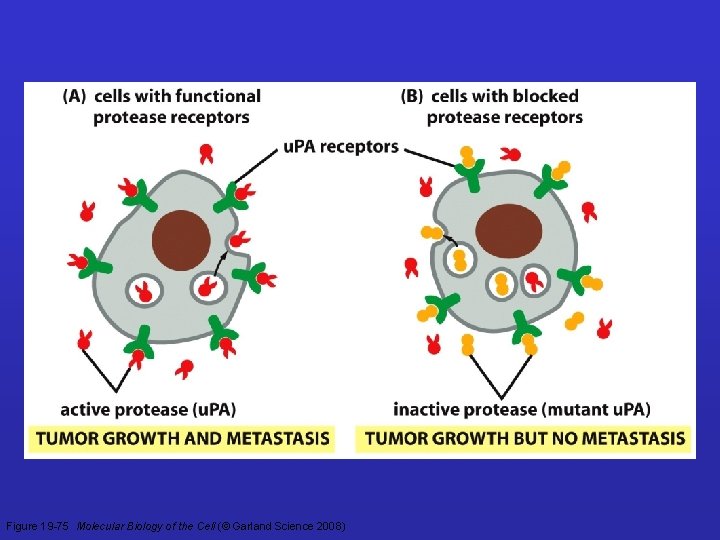
Figure 19 -75 Molecular Biology of the Cell (© Garland Science 2008)

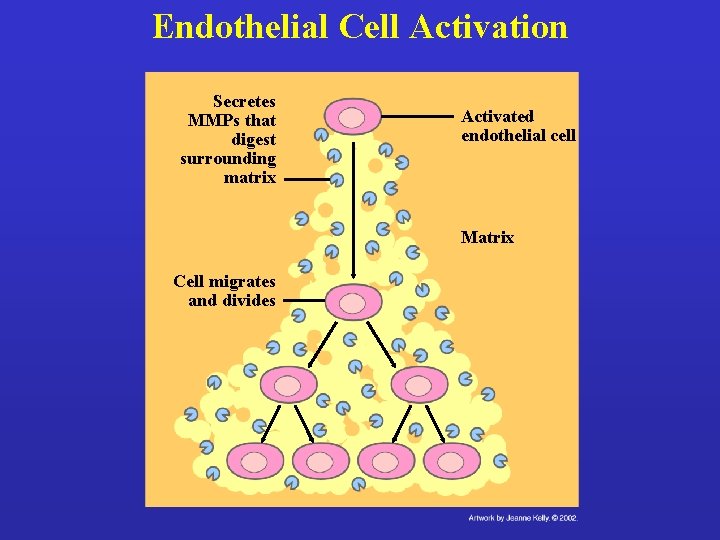
Endothelial Cell Activation Secretes MMPs that digest surrounding matrix Activated endothelial cell Matrix Cell migrates and divides
 Impariamo insieme matematica
Impariamo insieme matematica Insieme per viaggiare
Insieme per viaggiare Insiemi disgiunti
Insiemi disgiunti Due piroscafi a e b sono partiti insieme
Due piroscafi a e b sono partiti insieme Definizione di insieme matematico
Definizione di insieme matematico Retta dei numeri
Retta dei numeri Insieme di cromosomi
Insieme di cromosomi Che significa sintagmi
Che significa sintagmi Uova e pesce insieme
Uova e pesce insieme Michele partipilo
Michele partipilo Insieme delle acque presenti sulla terra
Insieme delle acque presenti sulla terra è tanto bello essere amici giocare insieme sentirsi felici
è tanto bello essere amici giocare insieme sentirsi felici Insieme parzialmente ordinato
Insieme parzialmente ordinato Tipi di strofa
Tipi di strofa Un programma è un insieme di
Un programma è un insieme di Rappresentazione intensiva di un insieme
Rappresentazione intensiva di un insieme Q insieme
Q insieme Insieme numeri interi
Insieme numeri interi Insieme q
Insieme q L'orchestra è un insieme di
L'orchestra è un insieme di Asse di un segmento perpendicolare nel punto medio
Asse di un segmento perpendicolare nel punto medio Jeremy bentham dottrina dei doveri
Jeremy bentham dottrina dei doveri Insieme di procedure
Insieme di procedure Insieme per un mondo migliore
Insieme per un mondo migliore 10 regole per stare bene in classe
10 regole per stare bene in classe Canto 27 inferno testo e parafrasi
Canto 27 inferno testo e parafrasi Insieme di cromosomi
Insieme di cromosomi Proteine g trimeriche
Proteine g trimeriche Degradazione proteine
Degradazione proteine Carbohidrati lista completa
Carbohidrati lista completa Giuseppe valitutti
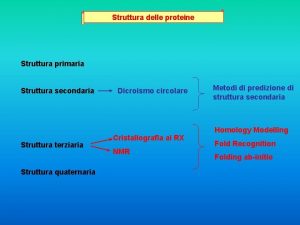
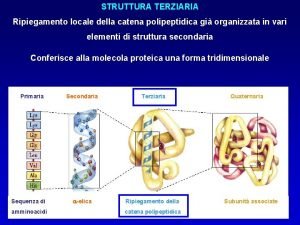
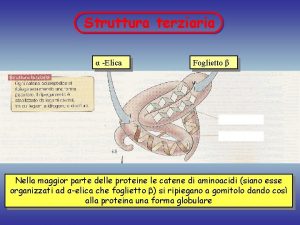
Giuseppe valitutti Struttura terziaria proteine
Struttura terziaria proteine Proteine prenilate
Proteine prenilate Obesità mappa concettuale
Obesità mappa concettuale Basi azotate numerazione
Basi azotate numerazione Fibrilläre proteine
Fibrilläre proteine Dicroismo circolare proteine
Dicroismo circolare proteine Proteine del latte
Proteine del latte Proteine anfotere
Proteine anfotere Totul despre proteine
Totul despre proteine Funzioni dei carboidrati
Funzioni dei carboidrati Proteine del latte
Proteine del latte Proteine g
Proteine g Carboidrati buoni
Carboidrati buoni Proteine ici
Proteine ici Denaturazione proteine
Denaturazione proteine Transaminarea aminoacizilor
Transaminarea aminoacizilor Basso valore biologico
Basso valore biologico Post translasyonel modifikasyonlar
Post translasyonel modifikasyonlar Matrice extracelulara
Matrice extracelulara Proteine
Proteine Pozitif nitrojen dengesi
Pozitif nitrojen dengesi Proteine intrinseche
Proteine intrinseche Proteine definitie
Proteine definitie Proteine di trasporto
Proteine di trasporto Mioglobina struttura secondaria
Mioglobina struttura secondaria Proteine
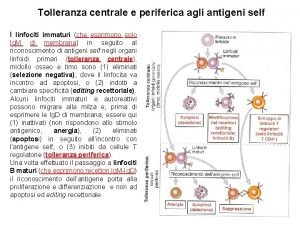
Proteine Tolleranza periferica
Tolleranza periferica Carboitrati
Carboitrati Proteine del latte
Proteine del latte Ciaperonine
Ciaperonine Proteine dna
Proteine dna Latte idrolisato spinto
Latte idrolisato spinto Proteine intrinseche
Proteine intrinseche Struttura terziaria proteine
Struttura terziaria proteine Come si forma il legame peptidico
Come si forma il legame peptidico Carboidrati proteine grassi vitamine sali minerali
Carboidrati proteine grassi vitamine sali minerali Struttura terziaria proteine
Struttura terziaria proteine Splicing zanichelli
Splicing zanichelli Metabolismo delle proteine
Metabolismo delle proteine Struttura terziaria proteine
Struttura terziaria proteine Membrana plasmatica doppio strato fosfolipidico
Membrana plasmatica doppio strato fosfolipidico Iperlipidemie
Iperlipidemie Polizaharida a este solubila in apa calda
Polizaharida a este solubila in apa calda Fibrilläre proteine
Fibrilläre proteine Modulatori allosterici emoglobina
Modulatori allosterici emoglobina Vindecarea prediabetului
Vindecarea prediabetului Proteine del latte
Proteine del latte Le proteine sono formate da
Le proteine sono formate da Violazione cp
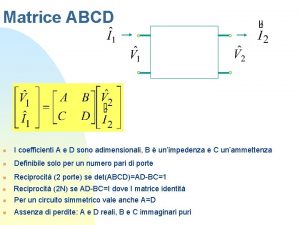
Violazione cp Matrice abcd
Matrice abcd Fcb matrix
Fcb matrix Matrice inverse
Matrice inverse Matrice des regrets
Matrice des regrets Matrice orthogonale
Matrice orthogonale X^5+y^5
X^5+y^5 Matrice de potentiel
Matrice de potentiel Les avantages et les inconvénients de la matrice adl
Les avantages et les inconvénients de la matrice adl Matrice jacobienne
Matrice jacobienne Matrice mmr
Matrice mmr Dividing matrices
Dividing matrices Ordine della matrice
Ordine della matrice Matrice di stacey
Matrice di stacey Matrice creuse
Matrice creuse La matrice adl
La matrice adl Matrice mactor
Matrice mactor Matrice d'abell
Matrice d'abell Matrice costi benefici
Matrice costi benefici Abcd n
Abcd n Matrice de fermeture transitive
Matrice de fermeture transitive Matrice di copione steiner
Matrice di copione steiner Matrice arthur d little
Matrice arthur d little Cynthia vallerand
Cynthia vallerand Glavna i sporedna dijagonala matrice
Glavna i sporedna dijagonala matrice Matrice jacobienne robotique
Matrice jacobienne robotique