Lenfant nest pas un adulte en miniature comment




























- Slides: 44

L’enfant n’est pas un adulte en miniature : comment s’intègre la physiologie de l’enfant et son développement dans les études cliniques. Dr B Kassaï Service de Pharmacologie Clinique Centre d’investigation Clinique EPICIME (Epidémiologie, Investigation Clinique, Information médicale, Mère-Enfant) HCL bk@upcl. univ-lyon 1. fr

Plan n n Introduction Différences entre l’adulte et l’enfant Utilisation hors AMM et hors indication Conclusion

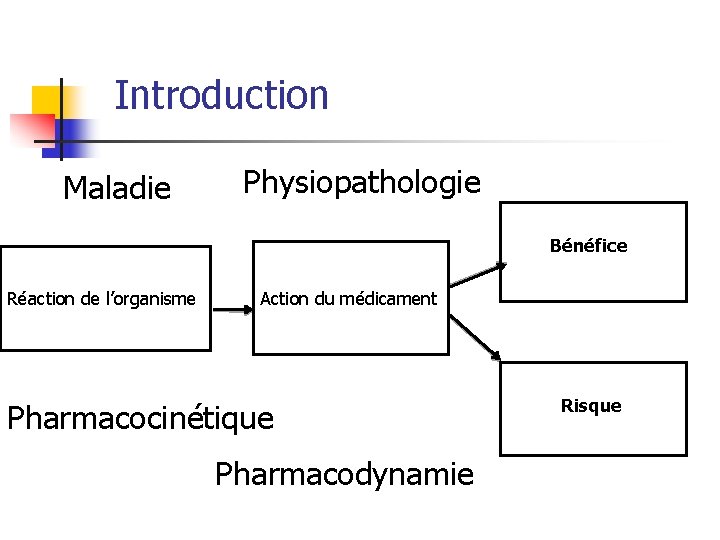
Introduction Maladie Physiopathologie Bénéfice Réaction de l’organisme Action du médicament Pharmacocinétique Pharmacodynamie Risque

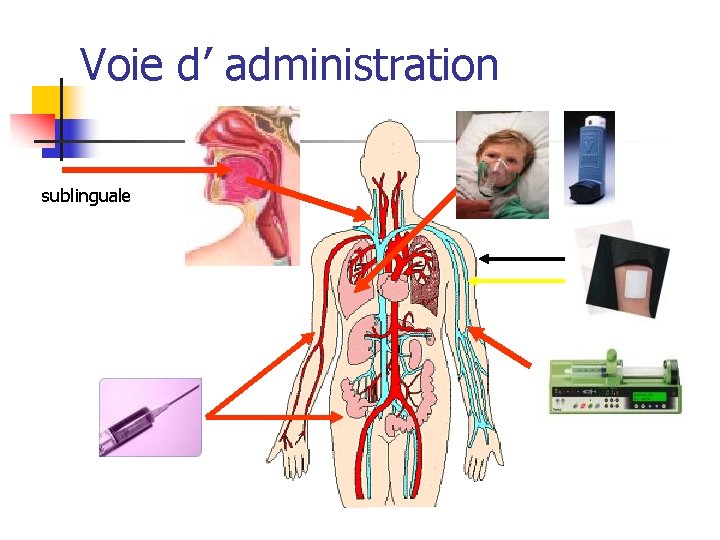
Voie d’ administration sublinguale

Élimination des substances

Les enfants ne sont pas de petits adultes! n Exemples : n n n Elixir de Sulfanilamide Tetracycline Chloramphenicol Verapamil Desflurane

Médicaments et grossesse n Thalidomide (un seul comprimé)

Distilbène Hormone de synthèse inventée en 1938, Commercialisée en 1946 aux Etats-Unis et prescrite en France à partir de 1948 pour prévenir les avortements spontanés et traiter les hémorragies gravidiques (relatives à la grossesse). 1953, une étude américaine conclut que ce médicament n'est pas plus efficace qu'un placebo pour éviter les fausses couches. 1971, d'autres études menées aux Etats-Unis mettent en cause le DES dans la recrudescence des cancers du vagin chez les jeunes filles dont les mères avaient pris du Distilbène pendant leur grossesse. Cette alerte, qui constitue une bombe à retardement pour l'enfant à naître, conduit la Food and Drug Administration américaine à interdire l'usage du DES pour ses indications obstétricales.

Distilbène n En France, c'est l'indifférence. Le produit continue à être prescrit aux femmes enceintes jusqu'en 1977, date à laquelle le Vidal mentionne enfin ses effets néfastes. En 1981, une troisième vague d'études américaines démontre que le risque de cancer dû au DES serait de 1 pour 1 000, mais que les femmes exposées à ce médicament pendant leur vie intra-utérine présentent un risque élevé d'accidents de la grossesse (fausses couches pendant les premier et deuxième trimestres, grossesses extra-utérines, accouchements prématurés). L'association de victimes DES France évalue à 160 000 le nombre d'enfants exposés dans le pays, dont 80 000 femmes, qui sont les plus vulnérables.

Distilbène n "il appartient à chacun des laboratoires de prouver que son produit n'était pas à l'origine du dommage"

Diethylstibestrol n La Cour de cassation a confirmé, jeudi 24 septembre, la responsabilité des laboratoires pharmaceutiques UCB Pharma et Novartis dans les maladies provoquées par le Distilbène, un médicament censé prévenir les fausses couches et distribué jusqu'en 1977 en France.

Excipients n Quatre accidents graves, dont trois d’évolution mortelle chez des nouveauxnés hospitalisés en réanimation à la suite de l’administration en perfusion veineuse de ceftriaxone (Rocéphine°) dans une solution contenant des sels de calcium n Explication : formation d’un précipité cristallin

Différence enfant-adulte : Une population hétérogène n n n Prématurés Enfants nés à terme (0 -27 J) Petits enfants (28 J- 23 M) Enfants (2 -11 ans) Adolescents (12 -18 ans)

Différence entre enfants et adultes n n Physiologique - Pharmacologique : Action de l’organisme sur le médicament (PK) n n n Absorption Distribution Métabolisme Elimination Action du médicament sur l’organisme (PD)

Physiologie n n Tête : Plus large Système Nerveux : Barrière plus perméable Cœur-Vaisseaux : Volume total de sang réduit Poumon : Voies aériennes de calibre réduit, besoin métabolique en O 2 x 2

Physiologie n n n Activité enzymatique : 20% à 70% des adults Extraction rénale : 30 à 40% adulte Peau : Perfusion sanguine plus élevée

Ontogénie n Développement de l’individu depuis l’oeuf jusqu’à l’âge adulte

Différence entre enfants et adultes n Absorption : n n Surface de la peau Surface et perméabilité de l’intestin Diminution de la fonction pancréatique (<1 an) Temps de transit plus important

Différence entre enfants et adultes n Distribution n Nouveau-né = 80% d’eau, 1 à 2 ans = 55 à 60% (= adulte) n n Tissus adipeux diminué n n La distribution des substances hydrosolubles augmente Surdosage des substance lipophiles Faible concentration et affinité des protéines plasmatiques (concentration du médicament au site récepteur)

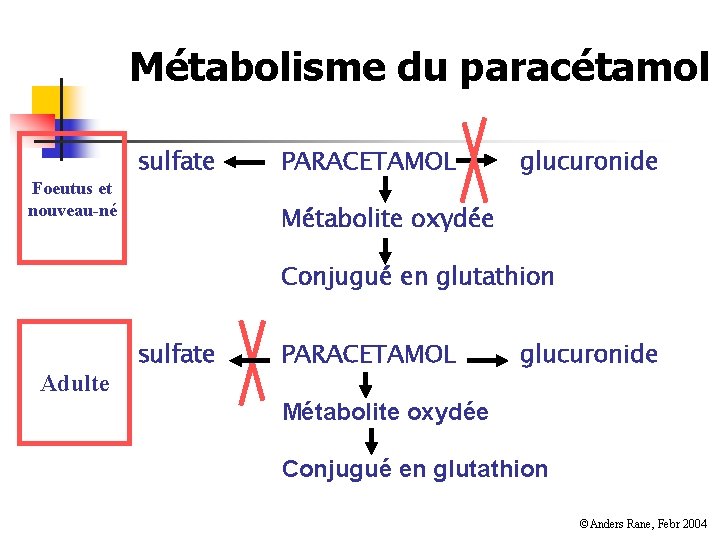
Différence entre enfants et adultes n Métabolisme n Maturation enzymatique, ontogénie n n Glucuronoconjugaison Déficience enzymatique Parfois protecteur (paracétamol) Clairance hépatique augmentée pour certains médicaments (théophylline)

Métabolisme du paracétamol Foeutus et nouveau-né sulfate PARACETAMOL glucuronide Métabolite oxydée Conjugué en glutathion Adulte sulfate PARACETAMOL glucuronide Métabolite oxydée Conjugué en glutathion ©Anders Rane, Febr 2004

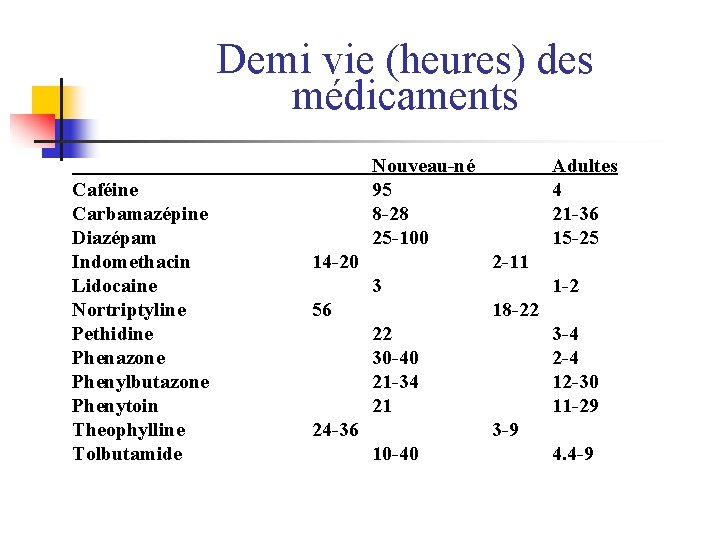
Demi vie (heures) des médicaments Caféine Carbamazépine Diazépam Indomethacin Lidocaine Nortriptyline Pethidine Phenazone Phenylbutazone Phenytoin Theophylline Tolbutamide Nouveau-né 95 8 -28 25 -100 14 -20 Adultes 4 21 -36 15 -25 2 -11 3 56 1 -2 18 -22 22 30 -40 21 -34 21 24 -36 3 -4 2 -4 12 -30 11 -29 3 -9 10 -40 4. 4 -9

Différence entre enfants et adultes n Élimination n n Filtration glomérulaire et sécrétion tubulaire diminuée Génétique? Sensibilité des récepteurs

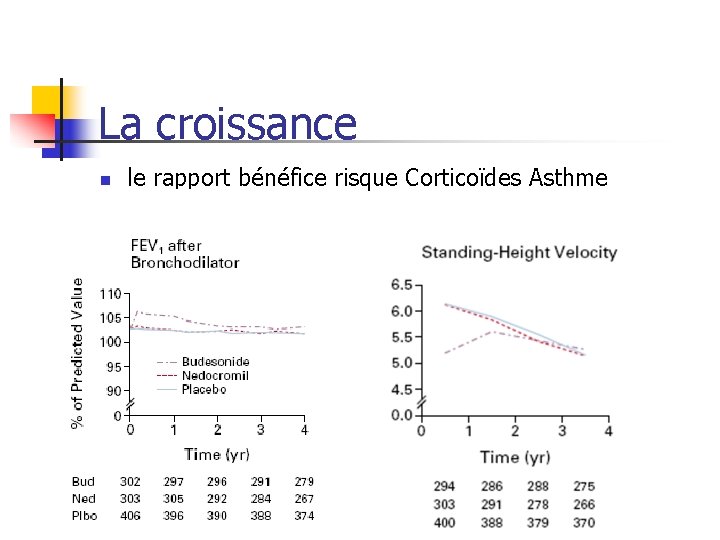
La croissance n le rapport bénéfice risque Corticoïdes Asthme

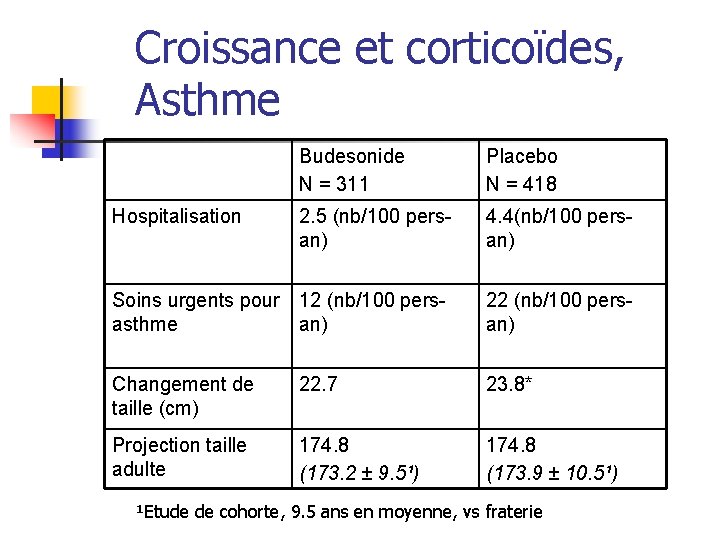
Croissance et corticoïdes, Asthme Budesonide N = 311 Placebo N = 418 2. 5 (nb/100 persan) 4. 4(nb/100 persan) Soins urgents pour 12 (nb/100 persasthme an) 22 (nb/100 persan) Changement de taille (cm) 22. 7 23. 8* Projection taille adulte 174. 8 (173. 2 ± 9. 5¹) 174. 8 (173. 9 ± 10. 5¹) Hospitalisation ¹Etude de cohorte, 9. 5 ans en moyenne, vs fraterie

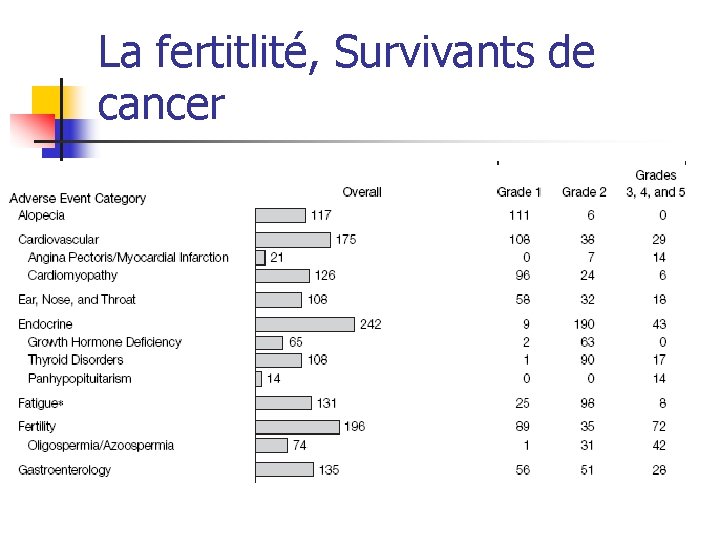
La fertitlité, Survivants de cancer


Les enfants ne sont pas de petits adultes! En résumé : q Immaturité enzymatique q Passage cutané +++ q Passage de la barrière hématoencéphalique q Élimination rénale + faible q Organisme en croissance

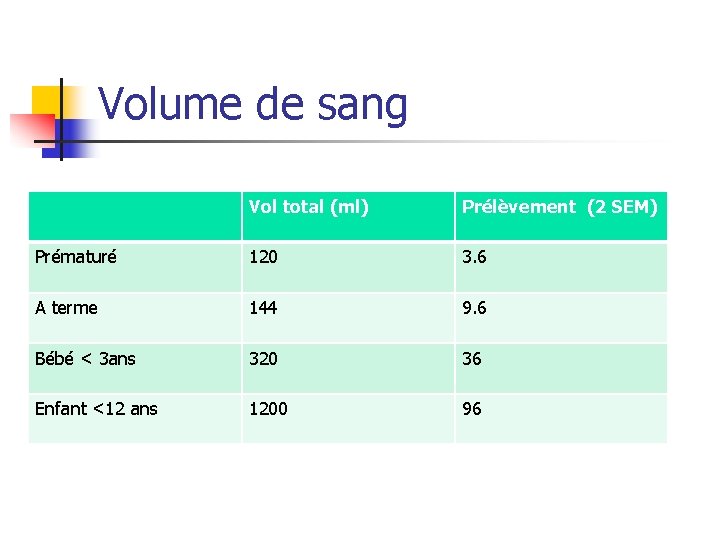
Volume de sang Vol total (ml) Prélèvement (2 SEM) Prématuré 120 3. 6 A terme 144 9. 6 Bébé < 3 ans 320 36 Enfant <12 ans 1200 96

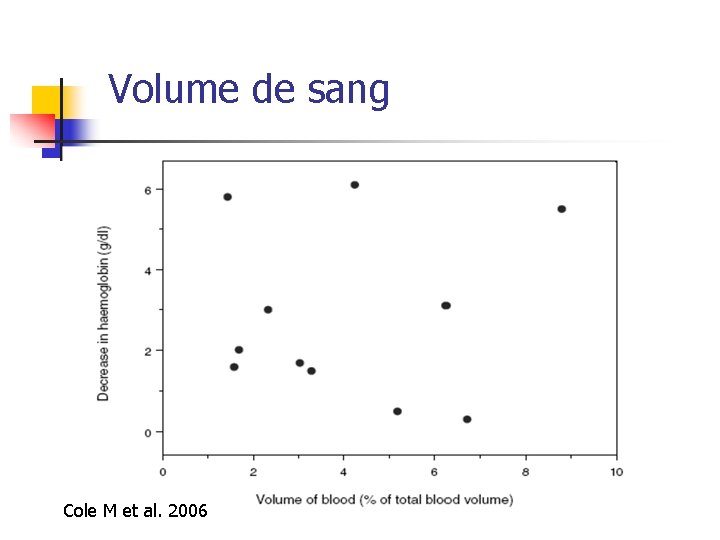
Volume de sang Cole M et al. 2006

Est il possible de prédire à partir des connaissances physio-pharmacologiques ? scanner IRM (source : Service de Neurologie, CHU de Grenoble)

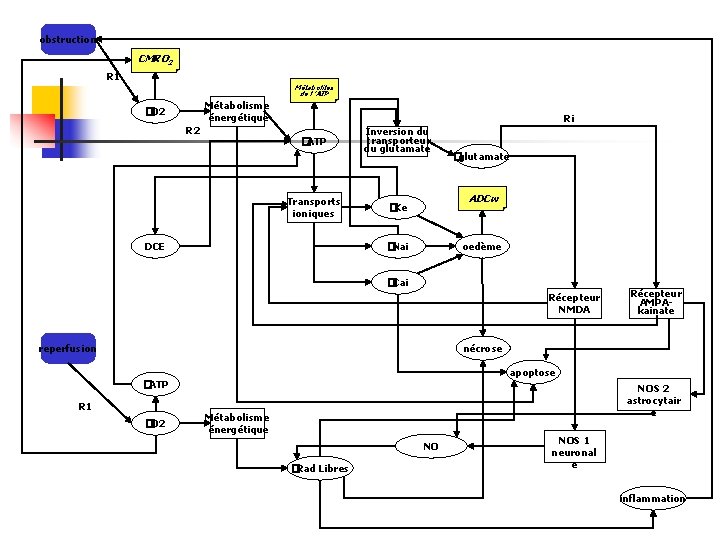
obstruction CMRO 2 R 1 Métabolites de l ’ATP Métabolisme énergétique �O 2 Ri �ATP Transports ioniques Inversion du transporteur du glutamate ADCw �Ke �Nai DCE �glutamate oedème �Cai Récepteur NMDA reperfusion Récepteur AMPAkainate nécrose apoptose �ATP R 1 �O 2 NOS 2 astrocytair e Métabolisme énergétique NO �Rad Libres NOS 1 neuronal e inflammation

La pratique actuelle? n AMM disponibles : n n Les anti-infectieux, antalgiques antipyrétiques, affections respiratoires et ORL Pas d’AMM : n Pathologies graves, rares

Utilisations hors AMM, en France Indication Nb de prescription (2522) Nb de médicaments hors indications (745) Vaccination 385 63 Fièvre 328 19 Rhinopharyngite 259 106 Chalumeau, Arch Disease in Child 2000, 83 (6); 502 -5

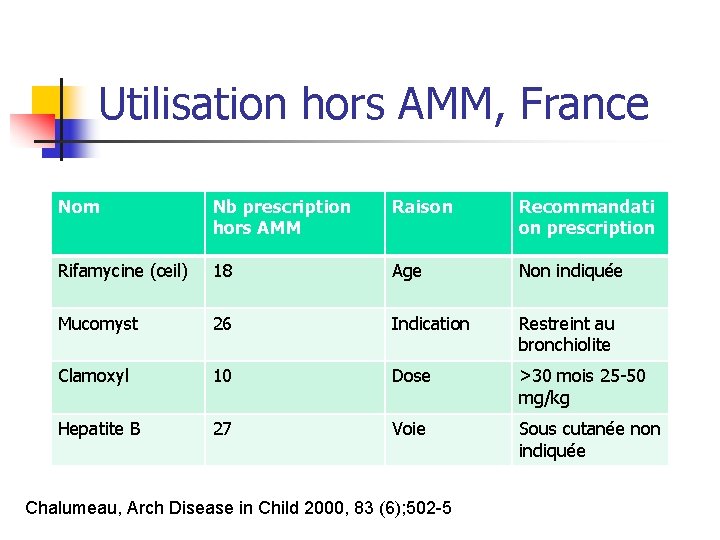
Utilisation hors AMM, France Nom Nb prescription hors AMM Raison Recommandati on prescription Rifamycine (œil) 18 Age Non indiquée Mucomyst 26 Indication Restreint au bronchiolite Clamoxyl 10 Dose >30 mois 25 -50 mg/kg Hepatite B 27 Voie Sous cutanée non indiquée Chalumeau, Arch Disease in Child 2000, 83 (6); 502 -5

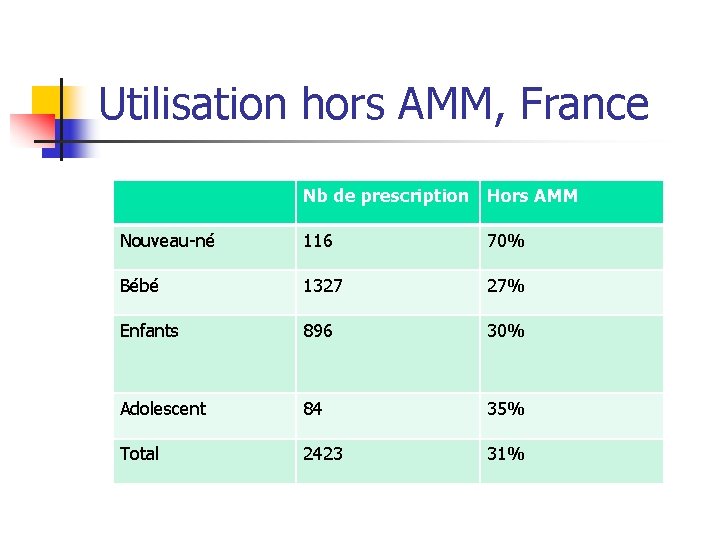
Utilisation hors AMM, France Nb de prescription Hors AMM Nouveau-né 116 70% Bébé 1327 27% Enfants 896 30% Adolescent 84 35% Total 2423 31%

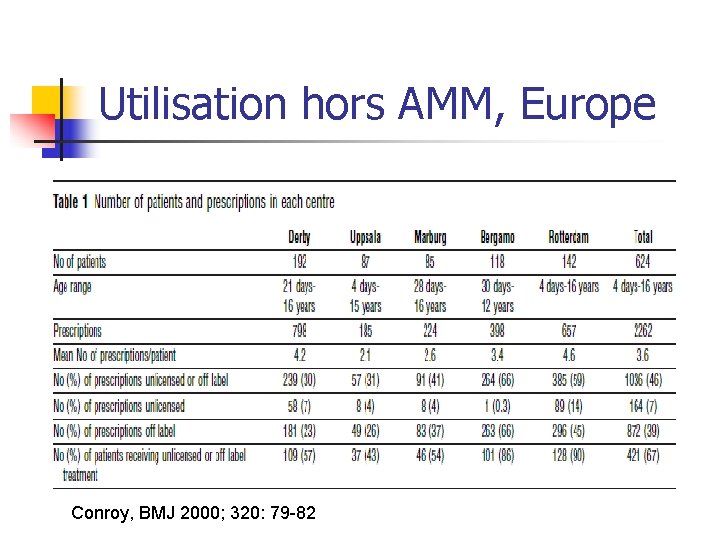
Utilisation hors AMM, Europe Conroy, BMJ 2000; 320: 79 -82

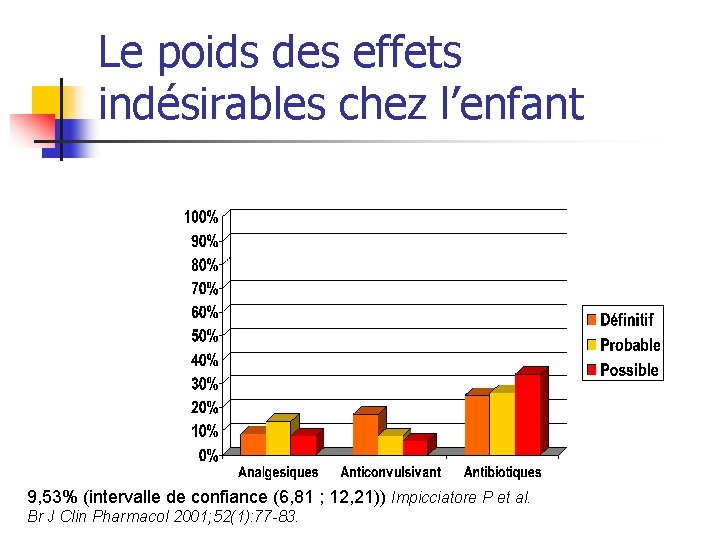
Le poids des effets indésirables chez l’enfant 9, 53% (intervalle de confiance (6, 81 ; 12, 21)) Impicciatore P et al. Br J Clin Pharmacol 2001; 52(1): 77 -83.

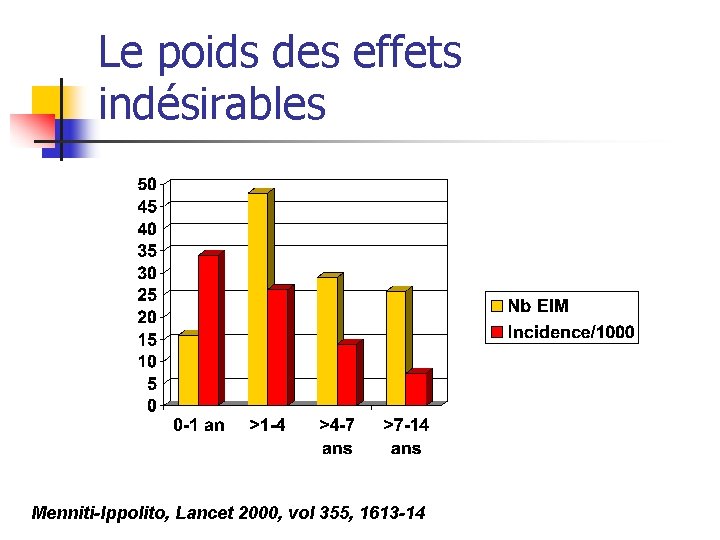
Le poids des effets indésirables Menniti-Ippolito, Lancet 2000, vol 355, 1613 -14

Conséquence de prescription hors indication n En ambulatoire: n n Multiplie de risque de survenue d’un EIM par 4 En hospitalisation: n 73 % des prescriptions associées à la survenue d’un EIM grave impliquent des médicaments ne possédant pas d’AMM ou d’indication dont plus de 71 % sont hors indication pour l’âge du patient. La fréquence des EIM a été plus importante avec les prescriptions hors AMM (6% vs 3, 9%).

Besoin d’information de haut niveau de preuve, essais cliniques n Effets bénéfiques n n Forme galénique adaptée La Cinétique Relation entre la Dose et l’effet Effets indésirables n Evaluation du rapport bénéfice risque

L’évaluation des médicaments chez l’enfant, domaines orphelins (Afssaps) Besoins Anticancéreux Étude sécurité à long terme Information RCP Formulation adaptée Étude Pharmacocinétique < 1 an HTA et Insuffisance Cardiaque Formes orales de présentation adaptée Absence d’AAII B Bloquants pour les tranches d’âge Douleur Étude pharmacocinétique

Absence d’information de haut niveau de preuve, essais cliniques n Les EC : n n n n Maladies souvent rares Difficulté de recrutement Méconnaissance de l’éthique des essais cliniques Problème des investigations invasives Nécessité de suivi à long terme Rôle des associations de parents Exemple de cancer

Conclusion n n Besoin d’études précliniques et cliniques spécifique à la population pédiatrique En attendant : n n Tenir comptes des particularités biologiques Nécessité d’une surveillance accrue
 Moda staropolska
Moda staropolska Lukisan
Lukisan Julien lenfant
Julien lenfant Ne pleure pas devant ma tombe mary elizabeth frye
Ne pleure pas devant ma tombe mary elizabeth frye Lecture pas à pas
Lecture pas à pas Moteur pas à pas à aimant permanent
Moteur pas à pas à aimant permanent On ne peut pas ne pas communiquer
On ne peut pas ne pas communiquer Poids paon adulte
Poids paon adulte Dictée cm1
Dictée cm1 Humour pps adulte
Humour pps adulte Comisia de evaluare a persoanelor adulte cu handicap arad
Comisia de evaluare a persoanelor adulte cu handicap arad Chryptorchidie
Chryptorchidie Fracture de l'épitrochlée chez l'adulte
Fracture de l'épitrochlée chez l'adulte Distance intercondylienne
Distance intercondylienne Dacryoscanner technique
Dacryoscanner technique Fracture supracondylienne coude
Fracture supracondylienne coude Angine
Angine Bateau paquebot
Bateau paquebot Jactatio capitis adulte
Jactatio capitis adulte Protocole dacryoscanner
Protocole dacryoscanner Orthophoniste begaiement herserange
Orthophoniste begaiement herserange Modèle lettre projet de vie mdph adulte
Modèle lettre projet de vie mdph adulte Sirénomélie adulte
Sirénomélie adulte Euillet
Euillet Elcb diagram
Elcb diagram Miniature daylilies
Miniature daylilies Miniature modular systems
Miniature modular systems Harvey mudd miniature machine
Harvey mudd miniature machine Hotel france miniature
Hotel france miniature La petite france paris
La petite france paris Miniature inertial measurement unit
Miniature inertial measurement unit France miniature tarif
France miniature tarif Richard paul and linda elder
Richard paul and linda elder Symbols in one flew over the cuckoo's nest
Symbols in one flew over the cuckoo's nest Mud nest of hyla faber
Mud nest of hyla faber George sorenson cuckoo's nest
George sorenson cuckoo's nest Trailing decision loop
Trailing decision loop Egg free falling from a nest in a tree
Egg free falling from a nest in a tree Levinson seasons of life theory
Levinson seasons of life theory The lark had made her nest in a
The lark had made her nest in a Solve these analogies by adding synonyms
Solve these analogies by adding synonyms Nest neighborhood watch
Nest neighborhood watch Paradijsvogel nest
Paradijsvogel nest One flew over the cuckoo's nest theme
One flew over the cuckoo's nest theme Consequence meaning
Consequence meaning