Kjemi forkurs Dag 5 Redoks og elektrokjemi Ml



















- Slides: 22

Kjemi forkurs Dag 5: Redoks- og elektrokjemi

Mål for dagen �Kunne sette oksidasjonstal på atom i sambindingar �Forstå cellepotensiale �Rekne på enkle elektrokjemiske celler �Vite litt om elektrolyse

Redoksreaksjonar �Reduksjon og oksidasjon �Eit atom som får tilført eit eller fleire elektron vert redusert �Eit atom som mister eit eller fleire elektron vert oksidert

Viktig å hugse �Eit oksidasjonsmiddel oksiderer noko anna og vert sjølv redusert �Eit reduksjonsmiddel reduserer noko anna og vert sjølv oksidert

Oksidasjonstal �Vert nytta for å avgjere kvar elektrona «er» �Atom som har fleir elektron enn i grunnstoffet er reduserte og har negativt oksidasjonstal �Omvendt for oksiderte atom �HUGS: Redusert atom, redusert oksidasjonstal

Reglar for oksidasjonstal:

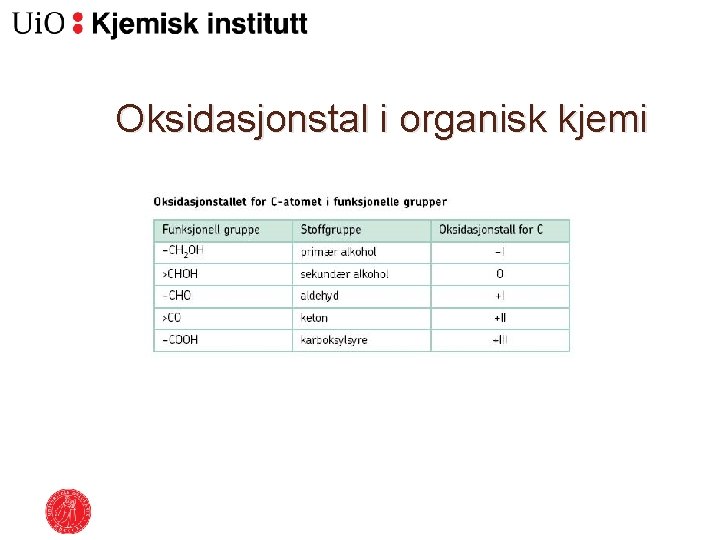
Oksidasjonstal i organisk kjemi

Eksempel oks. -tal �

Halvreaksjonar �Alle redoks-reaksjonar kan verte delt opp i halvreaksjonar, balansert med elektron

Balansering av redoksreaksjonar � Steg 1: skriv opp ubalansert reaksjonslikning 2: Del opp i halvreaksjonar 3: Balanser halvreaksjonar med rett mengde atom og med elektron for å balansere ladning � Steg 4: Legg saman reaksjonane og gang opp reaksjonane til elektron på kvar side nullar kvarandre ut � Steg 5: Sjekk at tal av atom på kvar side er rett og at summen av ladning på kvar side er rett

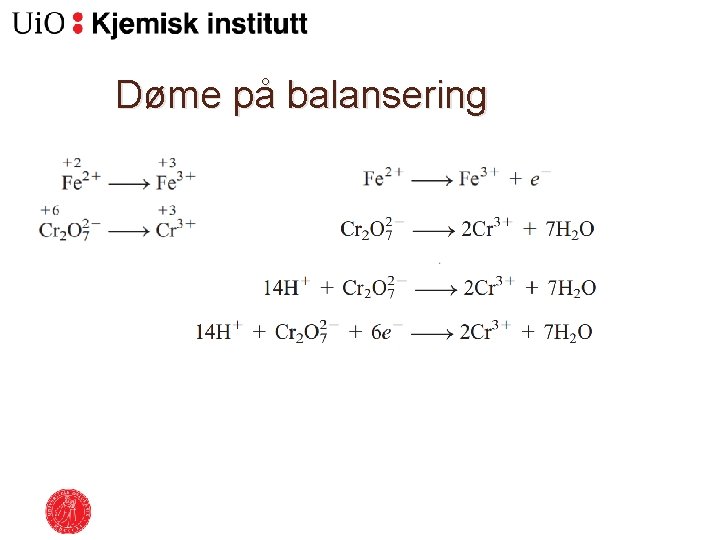
Døme på balansering Oksidasjon Reduksjon

Døme på balansering

Døme på balansering

Elektrokjemisk celle �Batteri! �Skile to halvreaksjonar og tvinge elektrona til å gå rundt �Reduksjon separat frå oksidasjon �Der oksidasjonen skjer er anoden, der reduksjonen skjer er katoden

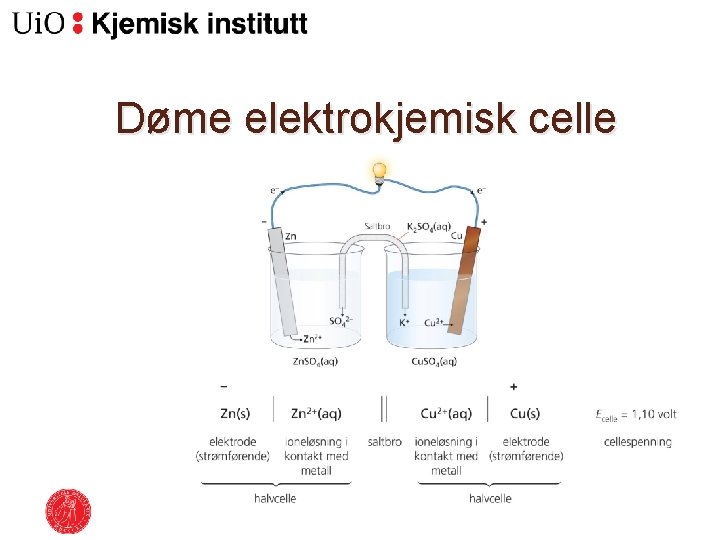
Døme elektrokjemisk celle

Standard elektrodepotensiale �E 0 ved STP og 1 mol/L �Relativ skala, alt definert frå ei halvcelle sett til E 0 = 0 V �Alle elektrokjemiske system kan verte målt mot ein standardelektrode for å finne E 0 for reaksjonen.

Finne potensiale i ei elektrokjemisk celle �Finne båe halvreaksjonar i tabellen �Snu reaksjonen som går andre vegen �Viss alt skjer ved 1 M og 1 atm: ◦ E 0 rxn = E 0 red – E 0 oks �Utanfor 1 M og 1 atm er pensum i KJM 1100 og KJM 1120

Døme elektrokjemisk celle Oksidasjon: Zn(s) → Zn 2+(aq) + 2 e. Reduksjon: Cu 2+ (aq) + 2 e- → Cu(s) E 0 = 0, 34 V Oksidasjon: Zn (s) → Zn 2+ (aq) + 2 e- - E 0 = -(-0, 76 V) = 0, 76 V Cellereaksjon: Cu 2+ (aq) + Zn (s) → Cu(s) + Zn 2+ (aq) E 0 celle = 0, 34 V + 0, 76 V = 1, 10 V

Korleis nytte tabellen �Halvreaksjonen som står øvst vil gå mot høgre, halvreakjsoner høgt opp han oksidere ting lengre ned, gode oksidasjonsmiddel �Halvreaksjonen lengre ned vil gå mot venstre, halvreaksjoner langt nede kan redusere ting høgt oppe, gode reduksjonsmiddel

Elektrolyse �Spenning i motsett retning av spenninga i cella, må vere større enn spenninga i cella. �Får reaksjonen til å gå andre vegen, altså får ikkje-spontane redoksreaksjonar til å gå.

Tilrådde oppgåver �Kap. 4: 39, 40, 41, 42, 43, 45, 46, (47 nitric acid = HNO 3) �Kap. 19: 1, 2, 11, 12, 13, 14, 16, 18,

Appendiks - Cellediagrammer � I et cellediagram symboliserer: ◦ en enkel loddrett strek grenseflaten mellom metallet og metallionene i en halvcelle ◦ en dobbel loddrett strek saltbroen � Vi skriver metallene i hver halvcelle lengst vekk fra saltbroen � Den halvcellen der det skjer en oksidasjon skriver vi til venstre. Dette er den negative elektroden � Den halvcellen der det skjer en reduksjon skriver vi til høyre. Dette er den positive elektroden
 Biloks cl
Biloks cl Forkurs ingeniør ntnu
Forkurs ingeniør ntnu Napoj otrzymano po tym jak
Napoj otrzymano po tym jak Heugelijke dag
Heugelijke dag Hvilken dag er det i dag sang
Hvilken dag er det i dag sang Hf elektronprikkmodell
Hf elektronprikkmodell Korrosjon forsøk kjemi 2
Korrosjon forsøk kjemi 2 Kuvvetli elektrolit örnekleri
Kuvvetli elektrolit örnekleri Malat aspartat mekiği
Malat aspartat mekiği Synproporcjonowania
Synproporcjonowania Notasi sel volta
Notasi sel volta Ocn yükseltgenme basamağı
Ocn yükseltgenme basamağı Contoh soal reaksi redoks
Contoh soal reaksi redoks Zn naoh tepkimesi
Zn naoh tepkimesi Penyetaraan reaksi redoks
Penyetaraan reaksi redoks Indikator difenilamin
Indikator difenilamin Algoritma yang merupakan gabungan dari beberapa rbm adalah
Algoritma yang merupakan gabungan dari beberapa rbm adalah Reaksi redoks
Reaksi redoks Redoks potansiyeli nedir
Redoks potansiyeli nedir Penyetaraan reaksi redoks kelas 12
Penyetaraan reaksi redoks kelas 12 Reakcje redoks
Reakcje redoks Oksidator adalah
Oksidator adalah Redoks tepkimeleri kendiliğinden gerçekleşen
Redoks tepkimeleri kendiliğinden gerçekleşen