KEM A 02 Allmn och oorganisk kemi SYROR





![Beräkning av p. H och deprotoneringsgrad 2(3) Beräkning av p. H: Ka = [Ac-][H Beräkning av p. H och deprotoneringsgrad 2(3) Beräkning av p. H: Ka = [Ac-][H](https://slidetodoc.com/presentation_image/41aaf4707fed28b3fe20def32b700374/image-8.jpg)
![Beräkning av p. H och deprotoneringsgrad 3(3) Beräkning av deprotoneringsgraden (D): [H 3 O+] Beräkning av p. H och deprotoneringsgrad 3(3) Beräkning av deprotoneringsgraden (D): [H 3 O+]](https://slidetodoc.com/presentation_image/41aaf4707fed28b3fe20def32b700374/image-9.jpg)











![TAKE-HOME MESSAGE Buffertar [som exempel på flerprotoniga system] är inget hokus-pokus! Buffertar är helt TAKE-HOME MESSAGE Buffertar [som exempel på flerprotoniga system] är inget hokus-pokus! Buffertar är helt](https://slidetodoc.com/presentation_image/41aaf4707fed28b3fe20def32b700374/image-21.jpg)












![11. 18 Mycket utspädda lösningar dvs tillsatta halter < [H 3 O+] eller [OH-] 11. 18 Mycket utspädda lösningar dvs tillsatta halter < [H 3 O+] eller [OH-]](https://slidetodoc.com/presentation_image/41aaf4707fed28b3fe20def32b700374/image-38.jpg)

![EXEMPEL: Utspädd HCl 2(2) 3. Uttrycket för autoprotolys: Kw = [H 3 O+] [OH-] EXEMPEL: Utspädd HCl 2(2) 3. Uttrycket för autoprotolys: Kw = [H 3 O+] [OH-]](https://slidetodoc.com/presentation_image/41aaf4707fed28b3fe20def32b700374/image-40.jpg)
- Slides: 40

KEM A 02 Allmän- och oorganisk kemi SYROR OCH BASER Atkins & Jones kap 11. 11 -11. 18 KEMMA 02/ © Sofi Elmroth 2011

ÖVERSIKT - Syror och baser – grundläggande egenskaper - Svaga syror och baser - p. H i lösningar av svaga syror och baser - Flerprotoniga syror - Autoprotolys och p. H KEMMA 02/ © Sofi Elmroth 2011

11. 1. Bronsted syror och baser (Johannes BrØnsted 1923) DEFINITIONER - SYRA – proton donator - BAS – proton acceptor - PROTON – vätejon H+ (H 3 O+ eller H+(aq)) , + H (aq) Hydroxoniumjon KEMMA 02/ © Sofi Elmroth 2011

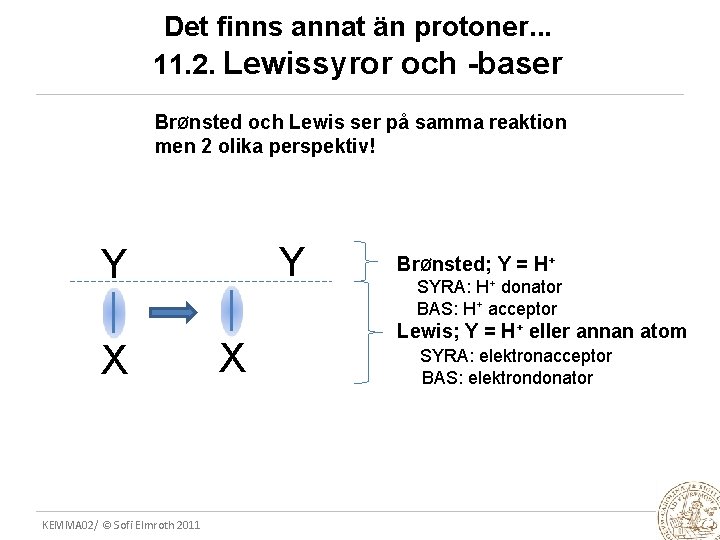
Det finns annat än protoner. . . 11. 2. Lewissyror och -baser BrØnsted och Lewis ser på samma reaktion men 2 olika perspektiv! Y Y X KEMMA 02/ © Sofi Elmroth 2011 X BrØnsted; Y = H+ SYRA: H+ donator BAS: H+ acceptor Lewis; Y = H+ eller annan atom SYRA: elektronacceptor BAS: elektrondonator

p. H i lösningar av svaga syror och baser TEMA: Användning av jämviktskonstanter för beräkning av jämviktsfördelning/p. H TYPISKA FRÅGOR: 1. Vad händer om jag blandar eller späder en syra/bas i vatten? - Vad blir p. H? - Vad finns mer i lösning HA, A-, B, HB? - Applikationer: riskbedömning 2. Om jag på förhand bestämmer ett p. H – vad finns då i lösningen? - Hur skall jag blanda för att få rätt p. H? - Applikationer: ställning av buffertar KEMMA 02/ © Sofi Elmroth 2011

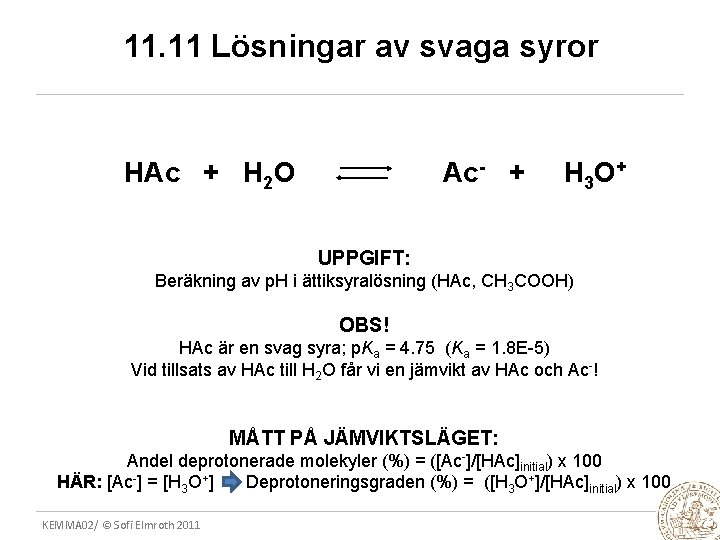
11. 11 Lösningar av svaga syror HAc + H 2 O Ac- + H 3 O + UPPGIFT: Beräkning av p. H i ättiksyralösning (HAc, CH 3 COOH) OBS! HAc är en svag syra; p. Ka = 4. 75 (Ka = 1. 8 E-5) Vid tillsats av HAc till H 2 O får vi en jämvikt av HAc och Ac-! MÅTT PÅ JÄMVIKTSLÄGET: Andel deprotonerade molekyler (%) = ([Ac-]/[HAc]initial) x 100 HÄR: [Ac-] = [H 3 O+] Deprotoneringsgraden (%) = ([H 3 O+]/[HAc]initial) x 100 KEMMA 02/ © Sofi Elmroth 2011

Beräkning av p. H och deprotoneringsgrad 1(3) EXEMPEL 11. 7: Beräkna p. H och deprotoneringsgraden i 0. 080 M HAc INGÅNGSPARAMETRAR: HAc(aq) + H 2 O(l) Ac-(aq) + H 3 O+ (aq) FB 0. 080 - VJ 0. 080 – x x KEMMA 02/ © Sofi Elmroth 2011 Ka = 1. 8 x 10 -5 M p. Ka = 4. 75
![Beräkning av p H och deprotoneringsgrad 23 Beräkning av p H Ka AcH Beräkning av p. H och deprotoneringsgrad 2(3) Beräkning av p. H: Ka = [Ac-][H](https://slidetodoc.com/presentation_image/41aaf4707fed28b3fe20def32b700374/image-8.jpg)
Beräkning av p. H och deprotoneringsgrad 2(3) Beräkning av p. H: Ka = [Ac-][H 3 O+]/[HAc] Ka = x 2/(0. 080 – x). . . lös 2: a-gradsekvationen och välj x > 0, eller utnyttja x << 0. 080 … lösning separat x = 1. 2 E-3 vilket ger p. H = 2. 98 SUMMERING HALTER: KEMMA 02/ © Sofi Elmroth 2011 [HAc] = 7. 9 E-2 M [Ac-] = [H 3 O+] = 1. 2 E-3 M
![Beräkning av p H och deprotoneringsgrad 33 Beräkning av deprotoneringsgraden D H 3 O Beräkning av p. H och deprotoneringsgrad 3(3) Beräkning av deprotoneringsgraden (D): [H 3 O+]](https://slidetodoc.com/presentation_image/41aaf4707fed28b3fe20def32b700374/image-9.jpg)
Beräkning av p. H och deprotoneringsgrad 3(3) Beräkning av deprotoneringsgraden (D): [H 3 O+] D = 100 D = (1. 2 E-3/0. 080) 100 = 1. 5% [HAc]i SLUTSATSER: - I princip all HAc föreligger som HAc - Det lilla som dissocierar påverkar p. H så att lösningen blir sur! BIORELEVANS: Karboxylsyror (p. Ka ca 4) - i vattenlösning är majoriteten protonerade KEMMA 02/ © Sofi Elmroth 2011

Beräkning av Ka och p. Ka EXEMPEL 11. 8 Beräkna Ka (p. Ka) för en svag syra då p. H är känt HÄR: Mandelsyra (C 6 H 5 CH(OH)COOH), 0. 10 M antiseptisk, hudvård p. H i vattenlösning: 2. 95 INGÅNGSPARAMETRAR: HA(aq) + H 2 O(l) A-(aq) + H 3 O+(aq) FB 0. 10 - VJ 0. 10 – 1 E(-2. 95) Ka = [A-][H 3 O+]/[HA] Ka = (1 E(-2. 95) 1 E(-2. 95)) / (0. 10 – 1 E(-2. 95)) Ka = 1. 4 E-4 M dvs p. Ka = 3. 85 d KEMMA 02/ © Sofi Elmroth 2011 TIPS! Skriv hela uttrycket tex på tentan!

11. 12 Lösningar av svaga baser REAKTION: B-(aq) + H 2 O(l) HB(aq) + OH-(aq) Protoneringsgrad (%): [OH -] P = 100 [B]i Jämför uttryck för deprotoneringsgrad! KEMMA 02/ © Sofi Elmroth 2011

Beräkna p. H och deprotoneringsgrad 1(2) EXEMPEL 11. 9: Beräkna p. H och protoneringsgraden i 0. 2 M metylamin HÄR: 0. 20 M metylamin (CH 3 NH 2; B) Ingångsparametrar: B(aq) + H 2 O(l) HB(aq) + OH-(aq) Kb = 3. 6 E-4 M (p. Kb = 3. 44) FB 0. 20 - VJ 0. 20 – x x Kb = [HB][OH-]/[B-] Kb = x 2/(0. 20 – x). . . lös 2: a gradsekvationen och välj x > 0 OBS! Kan förenklas genom vissa antaganden! KEMMA 02/ © Sofi Elmroth 2011

Beräkna p. H och deprotoneringsgrad 2(2) Kb = x 2/(0. 20 – x) Alternativ lösning: dvs gör begåvat antagande! Svag bas deprotoneringsgraden sannolikt liten, dvs x << 0. 2 isåfall: Kb = x 2/0. 20 x = 8. 5 E-3 Kontroll av antagande: VIKTIGT! 8. 5 E-3 << 0. 20 antagande OK p. OH = -log (8. 5 E-3) = 2. 07; p. H = 14 – p. OH = 11. 93 Protoneringsgraden = (8. 5 E-3/0. 2) 100 = 4. 2% SLUTSATS: Basformen (B) dominerar helt i lösning, 95. 8% KEMMA 02/ © Sofi Elmroth 2011

11. 13 Upplösning av salter och p. H påverkan 1(3) FRÅGA: Vad händer när man löser upp salter av svaga syror och baser i vatten? Hur påverkas p. H? Vattenlösning av Fe. Cl 3 KEMMA 02/ © Sofi Elmroth 2011 Murad E and Rojic P American Mineralogist, Volume 88, pages 1915– 1918, 2003

11. 13 Upplösning av salter… 2(3) KLASSIFICERING AV KATJONER - Katjoner som är konjugerade syror till svaga baser sura lösningar EXEMPEL: NH 4+, RNH 3+ dvs aminer generellt! - Små, högt laddade katjoner [Lewissyror] sura lösningar EXEMPEL: Fe 3+ Al 3+ p. Ka: 2. 46 4. 85 - Katjoner Grupp 1 (Na+, K+. . . ) och 2 (Mg 2+, Ca 2+. . . ) ingen (liten effekt) - Katjoner med +1 -laddning övriga grupper ändrar ej heller p. H! - Inga kajoner är basiska! KEMMA 02/ © Sofi Elmroth 2011

11. 13 Upplösning av salter… 3(3) KLASSIFICERING AV ANJONER - Anjoner som är konjugerade baser till svaga syror basiska lösningar EXEMPEL: CN-, CO 32 -, PO 43 -, S 2 -, karboxylatanjoner ex) Ac- Anjoner till starka syror neutrala lösningar (ingen p. H-påverkan) EXEMPEL: Cl-, Br-, I-, NO 3 -, Cl. O 4 - Anjoner som är konjugerade baser till flerprotoniga syror sura lösningar EXEMPEL: HSO 4 -, H 2 PO 3 - KEMMA 02/ © Sofi Elmroth 2011

Salmiak i vatten 1(2) EXEMPEL 11. 10: Beräkna p. H i en lösning av 0. 15 M NH 4 Cl (salt=surt? !) Ingångsparametrar: Joner: NH 4+ Cl- konjugerad syra till stark bas svag syra anjon till stark syra ingen p. H effekt Jämvikt att beakta: FLS 1 NH 4+ (aq) + H 2 O (l) NH 3(aq) + H 3 O+(aq) Ka (NH 4+)= Kw/Kb(NH 3) FB 0. 15 - Ka = 1 E-14/1. 8 E-5 VJ 0. 15 – x x Ka = 5. 6 E-10 M Ka = (x 2)/(0. 15 – x) KEMMA 02/ © Sofi Elmroth 2011

Salmiak i vatten 2(2) Ka = x 2/(0. 15 – x) salt = surt ? ! ANTAG: x << 0. 15 Isåfall: 5. 6 E-10 = x 2/0. 15 x 2 = 5. 6 E-10 0. 15 x = 9. 2 E-6 (= [H 3 O+] och [NH 3]) KONTROLLERA ANTAGANDE: 9. 2 E-6 << 0. 15 OK!! p. H = -log (9. 2 E-6) = 5. 04 SLUTSATS: En salmiaklösning är sur! KEMMA 02/ © Sofi Elmroth 2011

KEMMA 02/ © Sofi Elmroth 2011

11. 14 Flerprotoniga syror & baser FLERPROTONIG SYRA (polyprotolytic acid) En förening som kan donera mer än en proton EXEMPEL: H 2 SO 4, H 2 CO 3, H 3 PO 4 FLERPROTONIG BAS (polyprotolytic base) En förening som kan ta upp mer än en proton EXEMPEL: CO 32 -, PO 43 -, SO 32 - Biologiska buffertsystem KEMMA 02/ © Sofi Elmroth 2011 Industriella processer
![TAKEHOME MESSAGE Buffertar som exempel på flerprotoniga system är inget hokuspokus Buffertar är helt TAKE-HOME MESSAGE Buffertar [som exempel på flerprotoniga system] är inget hokus-pokus! Buffertar är helt](https://slidetodoc.com/presentation_image/41aaf4707fed28b3fe20def32b700374/image-21.jpg)
TAKE-HOME MESSAGE Buffertar [som exempel på flerprotoniga system] är inget hokus-pokus! Buffertar är helt vanliga jämvikter. Halter/p. H kan beräknas som alla andra jämvikter! BLANDNINGSRECEPT för stabil buffert: Lika mängder syra och konjugerad bas! Detta ger p. H = p. Ka KEMMA 02/ © Sofi Elmroth 2011

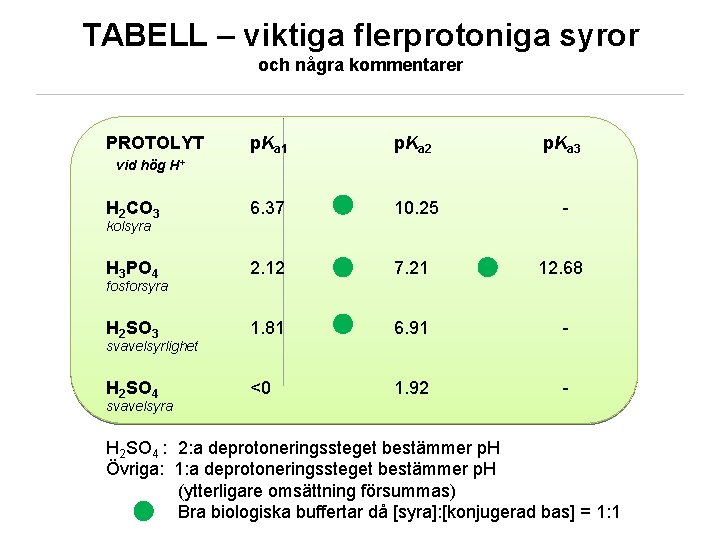
TABELL – viktiga flerprotoniga syror och några kommentarer PROTOLYT p. Ka 1 p. Ka 2 p. Ka 3 10. 25 - vid hög H+ H 2 CO 3 6. 37 kolsyra H 3 PO 4 2. 12 7. 21 12. 68 fosforsyra H 2 SO 3 1. 81 6. 91 - H 2 SO 4 <0 svavelsyrlighet 1. 92 - svavelsyra H 2 SO 4 : 2: a deprotoneringssteget bestämmer p. H Övriga: 1: a deprotoneringssteget bestämmer p. H (ytterligare omsättning försummas) Bra biologiska buffertar då [syra]: [konjugerad bas] = 1: 1 KEMMA 02/ © Sofi Elmroth 2011

. . . vi börjar dock med att titta på H 2 SO 4 ingen bra buffert EXEMPEL 1: 0. 010 M H 2 SO 4 i H 2 O 1: a deprotoneringssteget fullständigt; Ka mkt stort (p. Ka negativt! – listas ofta ej) 2: a deprotoneringssteget; Ka = 1. 2 E-2 p. Ka = 1. 92 Upplösning av H 2 SO 4 i vatten: Reaktion 1: H 2 SO 4(aq) + H 2 O(l) Reaktion 2: HSO 4 -(aq) + H 2 O(l) HSO 4 -(aq) + H 3 O+ fullständigt åt SO 42 - + H 3 O+ denna reaktion bestämmer p. H FB 0. 010 - 0. 010 VJ 0. 010 – x x 0. 010 + x Ka = (x(0. 010 + x)/(0. 010 – x) måste lösas som 2: a-gradsekvation x = 4. 3 E-3 p. H = - log (0. 010 + 4. 3 E-3) = 1. 9 dvs jämvikten lite ytterligare förskjuten åt KEMMA 02/ © Sofi Elmroth 2011

11. 15 SALTER till polyprotiska syror p. H i lösning EXEMPEL(11. 12 a): 0. 20 M Na. H 2 PO 4 (aq) – vad blir p. H? Ingångsparametrar: 0. 20 M Na+ 0. 20 M H 2 PO 4 - - påverkar ej p. H - kan reagera som både syra och bas Tänkbara reaktioner: (1) H 2 PO 4 - + H 2 O (2) H 2 PO 4 - + H 2 O HPO 42 - + H 3 O+ p. Ka 2 = 7. 21 H 3 PO 4 + OH- p. Kb 2 = p. Kw – p. Ka 1 = 14 – 2. 12 = 11. 88 p. H beräknas enl p. H = ½ (p. Ka 2 + p. Ka 1) = ½ (7. 21 + 2. 12) = 4. 66 uttrycket går att härleda men ej centralt just nu (A 02) KEMA 02: Uttrycket för p. H enl ovan skall kunna användas vid rätt tillfälle! KEMMA 02/ © Sofi Elmroth 2011

11. 16 Koncentrationsbestämningar samtliga komponenenter SVAR PÅ FRÅGA: Hur ser den totala produktbilden ut? EXEMPEL 11. 13: Speciering i 0. 10 M H 3 PO 4(aq) LÖSNINGSSTRATEGI: Behandla en jämvikt i taget (3 st) H 3 PO 4 H 2 PO 4 - HPO 42 - PO 43 - Reaktion 1 Dominerar; bestämmer p. H H 2 PO 4 - och H 3 PO 4 Reaktion 2 Beräknar HPO 42 - KEMMA 02/ © Sofi Elmroth 2011 Reaktion 3 Beräknar PO 43 -

11. 16 Koncentrationsbestämningar Reaktion 1 Ingångsparametrar: p. Ka 1 = 2. 12 Ka 1 = 7. 6 E-3 p. Ka 2 = 7. 21 p. Ka 3=12. 68 Ka 2 = 6. 2 E-8 Ka 3 = 2. 1 E-13 Antagande: 1: a deprotoneringssteget dominerar och bestämmer p. H REAKTION 1 FB VJ H 3 PO 4 + H 2 O 0. 10 0. 10 – x H 2 PO 4 - + H 3 O+ - x Ka 1 = (x 2)/(0. 10 – x) ; måste lösas exakt! Eftersom x inte är << 0. 10 KEMMA 02/ © Sofi Elmroth 2011

11. 16 Koncentrationsbestämningar Reaktion 1 forts Ka 1 = (x 2)/(0. 10 – x) EXAKT LÖSNING av 2: a-gradsekvation: 0. 1 Ka 1 – x. Ka 1 = x 2 0 = x 2 + Ka 1 x – 0. 1 Ka 1 x = - ½Ka 1 +/- SQRT( 0. 1 Ka 1 – Ka 1/4)) x = 2. 4 E-2 or (-3. 2 E-2) ( = [H 3 O+], [H 2 PO 3 -]) [H 3 PO 4] = 0. 10 – 0. 024 = 0. 76 M KEMMA 02/ © Sofi Elmroth 2011 K E M A 0 2

11. 16 Koncentrationsbestämningar Reaktion 2 REAKTION 2 – för beräkning av HPO 42 - och ev. ytterligare bidrag till H 3 O+ FB VJ H 2 PO 4 - + H 2 O HPO 42 - + H 3 O+ 2. 4 E-2 2. 4 E-2 – y - y 2. 4 E-2 + y Ka 2 = 6. 2 E-8 M Ka 2 = y(2. 4 E-2 + y)/(2. 4 E-2 – y) ; antag y << 2. 4 E-2 Ka 2 = y y = 6. 2 E-8 M antagande OK! OBS 1! Tillskottet till [H 3 O+] är försumbart, men bestämmer [HPO 42 - ] OBS 2! Minskningen av [H 2 PO 4 -] är också försumbar KEMMA 02/ © Sofi Elmroth 2011

11. 16 Koncentrationsbestämningar Reaktion 3 REAKTION 3 – för beräkning av PO 43 HPO 42 - + H 2 O PO 43 - + H 3 O+ FB 6. 2 E-8 VJ 6. 2 E-8 – z Ka 3 = 2. 1 E-13 M - 2. 4 E-2 z 2. 4 E-2 + z OBS 2! Halten bestäms här! Ka 3 = (z(2. 4 E-2 + z) /(6. 2 E-8 – z); antag z << 6. 2 E-8 Ka 3 6. 2 E-8 = z 2. 4 E-2 z = (Ka 3 6. 2 E-8)/2. 4 E-2 = 5. 4 E-19 KEMMA 02/ © Sofi Elmroth 2011 OBS 1! Tillskottet här helt försumbart!

11. 16 Summering av halter Speciering i 0. 10 M H 3 PO 4 SPECIES BERÄKNAD KONCENTRATION (M) Reaktion 1 Reaktion 2 H 3 PO 4 H 2 PO 4 HPO 42 PO 43 H 3 O+ 0. 076 0. 024 OH- 1 E-14/2. 4 E-2 = 4. 3 E-13 KEMMA 02/ © Sofi Elmroth 2011 2. 4 E-2 + 6. 5 E-8 6. 2 E-8 + 6. 2 E-8 Reaktion 3 5. 4 E-19 +5. 4 E-19

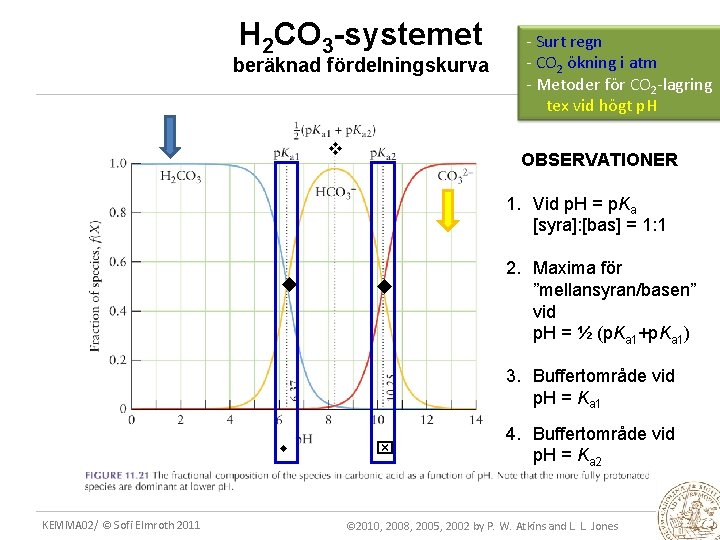
11. 17 Speciering som funktion av p. H Beräkning enl tidigare kan även göras vid FIXERAT p. H Om fördelningen beräknas vid ”alla” p. H fås FÖRDELNINGSKURVA dvs SPECIERING = f(p. H) 6. 37 p. Ka 1 = 6. 37 KEMMA 02/ © Sofi Elmroth 2011 CO 32 - 50 ? HCO 3 - 100 H 2 CO 3 Andel (%) EXEMPEL: System: H 2 CO 3 HCO 3 - CO 32 - 10. 25 p. Ka 2 = 10. 25 p. H

H 2 CO 3 -systemet beräknad fördelningskurva - Surt regn - CO 2 ökning i atm - Metoder för CO 2 -lagring tex vid högt p. H OBSERVATIONER 1. Vid p. H = p. Ka [syra]: [bas] = 1: 1 2. Maxima för ”mellansyran/basen” vid p. H = ½ (p. Ka 1+p. Ka 1) 3. Buffertområde vid p. H = Ka 1 KEMMA 02/ © Sofi Elmroth 2011 4. Buffertområde vid p. H = Ka 2 © 2010, 2008, 2005, 2002 by P. W. Atkins and L. L. Jones

KEMMA 02/ © Sofi Elmroth 2011

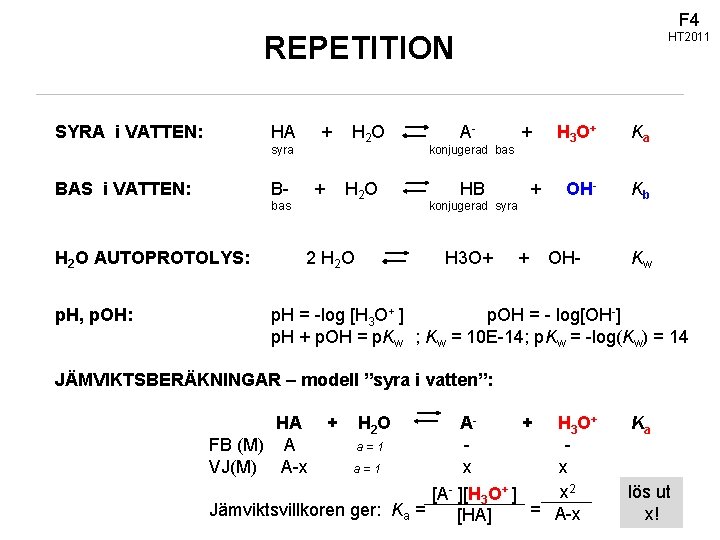
F 4 REPETITION SYRA i VATTEN: HT 2011 HA + H 2 O A- + H 3 O+ Ka B- + H 2 O HB + OH- bas konjugerad syra Kb H 2 O AUTOPROTOLYS: 2 H 2 O H 3 O+ + OH- p. H, p. OH: p. H = -log [H 3 O+ ] p. OH = - log[OH-] p. H + p. OH = p. Kw ; Kw = 10 E-14; p. Kw = -log(Kw) = 14 syra BAS i VATTEN: konjugerad bas Kw JÄMVIKTSBERÄKNINGAR – modell ”syra i vatten”: HA + H 2 O FB (M) A a = 1 VJ(M) A-x a=1 Ax + H 3 O+ x x 2 [A- ][H 3 O+ ] Jämviktsvillkoren ger: Ka = = A-x [HA] KEMMA 02/ © Sofi Elmroth 2011 Ka lös ut x!

TABELL – viktiga flerprotoniga syror och några kommentarer PROTOLYT p. Ka 1 p. Ka 2 p. Ka 3 10. 25 - vid hög H+ H 2 CO 3 6. 37 kolsyra H 3 PO 4 2. 12 7. 21 12. 68 fosforsyra H 2 SO 3 1. 81 6. 91 - H 2 SO 4 <0 svavelsyrlighet 1. 92 - svavelsyra H 2 SO 4 : 2: a deprotoneringssteget bestämmer p. H Övriga: 1: a deprotoneringssteget bestämmer p. H (ytterligare omsättning försummas) Bra biologiska buffertar då [syra]: [konjugerad bas] = 1: 1 KEMMA 02/ © Sofi Elmroth 2011

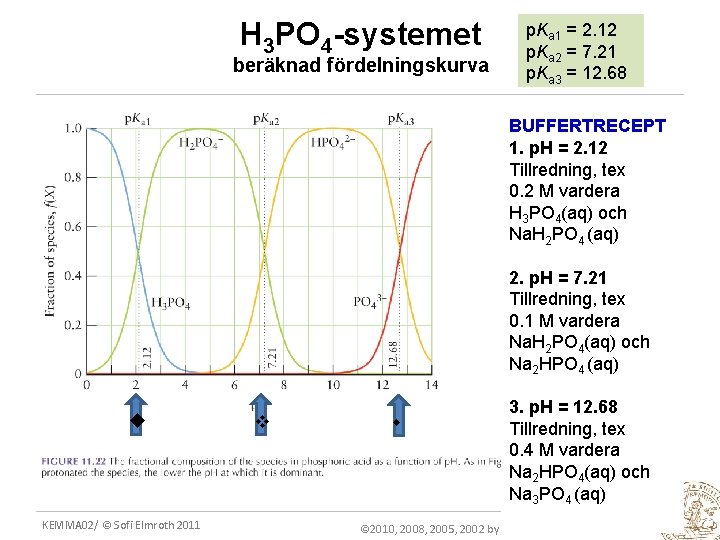
H 3 PO 4 -systemet beräknad fördelningskurva p. Ka 1 = 2. 12 p. Ka 2 = 7. 21 p. Ka 3 = 12. 68 BUFFERTRECEPT 1. p. H = 2. 12 Tillredning, tex 0. 2 M vardera H 3 PO 4(aq) och Na. H 2 PO 4 (aq) 2. p. H = 7. 21 Tillredning, tex 0. 1 M vardera Na. H 2 PO 4(aq) och Na 2 HPO 4 (aq) KEMMA 02/ © Sofi Elmroth 2011 3. p. H = 12. 68 Tillredning, tex 0. 4 M vardera Na 2 HPO 4(aq) och Na 3 PO 4 (aq) © 2010, 2008, 2005, 2002 by P. W. Atkins and L. L. Jones

Fördelningsdiagram FRÅGA: VAD SKALL KUNNAS? SVAR: - Skissa ett diagram för 3 -protonig (eller färre) syra mhja relevanta p. Ka-värden - Läsa ut ungefärliga halter av protolyter vid given totalhalt och p. H - Uppskatta p. H eller p. H intervall vid given totalhalt och dominerande protolyt KEMMA 02/ © Sofi Elmroth 2011
![11 18 Mycket utspädda lösningar dvs tillsatta halter H 3 O eller OH 11. 18 Mycket utspädda lösningar dvs tillsatta halter < [H 3 O+] eller [OH-]](https://slidetodoc.com/presentation_image/41aaf4707fed28b3fe20def32b700374/image-38.jpg)
11. 18 Mycket utspädda lösningar dvs tillsatta halter < [H 3 O+] eller [OH-] PROBLEM: I mycket utspädda lösningar, dvs där protolytkoncentrationerna är lägre än [H 3 O+] och/eller [OH-] bestämmer inte längre den tillsatta syran/basen p. H! LÖSNING: modifierad metod för p. H-beräkning i p. H intervallet ca 6. 5 – 7. 5 METOD: Följande ekvationer utnyttjas: 1. Laddningsbalans 2. Massbalans 3. Uttrycket för Kw KEMMA 02/ © Sofi Elmroth 2011

EXEMPEL: Utspädd HCl 1(2) FRÅGA: Vad är p. H i en 8. 0 E-8 M HCl? UPPSKATTNING (för kontroll!): Förväntat p. H strax under 7 (ej basiskt) 1. Laddningsbalans: antal katjoner = antal anjoner [H 3 O+]jv = [OH-]jv + [Cl-]jv (1) 2. Massbalans: allt vi har från början finns kvar vid jämvikt [HCl]start = [Cl-]jv (2) (stark syra, allt deprotoneras) Kombinera (1) och (2): [OH-]jv = [H 3 O+]jv - [HCl]start FORTSATT STRATEGI: överför uttrycket på en form där [H 3 O+] är enda okända variabeln KEMMA 02/ © Sofi Elmroth 2011
![EXEMPEL Utspädd HCl 22 3 Uttrycket för autoprotolys Kw H 3 O OH EXEMPEL: Utspädd HCl 2(2) 3. Uttrycket för autoprotolys: Kw = [H 3 O+] [OH-]](https://slidetodoc.com/presentation_image/41aaf4707fed28b3fe20def32b700374/image-40.jpg)
EXEMPEL: Utspädd HCl 2(2) 3. Uttrycket för autoprotolys: Kw = [H 3 O+] [OH-] = [H 3 O+]jv ([H 3 O+]jv - [HCl]start) (jfr förra sidan) [H 3 O+]2 – [H 3 O+] [HCl]start – Kw = 0 Lös ekvationen med: [H 3 O+] = x [HCl]start = 8. 0 E-8 Kw = 1. 0 E-14 Detta ger: x = 1. 5 E-7 och p. H = 6. 82 KONTROLL: 6. 82 är strax under 7; stämmer med vår uppskattning! KEMMA 02/ © Sofi Elmroth 2011
 Vad är joner
Vad är joner Allmn
Allmn Basisk vann
Basisk vann Hinduism och buddhism skillnader
Hinduism och buddhism skillnader Konkretia
Konkretia Sen doğru ol kem belasını bulur
Sen doğru ol kem belasını bulur Parsi prayers for good health
Parsi prayers for good health Rsa kem
Rsa kem Ngụy biện bằng cách diễn đạt mập mờ
Ngụy biện bằng cách diễn đạt mập mờ 11 giờ kém
11 giờ kém Cellulosa kemisk formel
Cellulosa kemisk formel Formelmassa
Formelmassa Mitstudie au
Mitstudie au Afstemning af reaktioner
Afstemning af reaktioner Nr 26 kemi
Nr 26 kemi Slamning kemi
Slamning kemi Kandidatkontrakt au
Kandidatkontrakt au Fjalia njekryegjymtyreshe emerore
Fjalia njekryegjymtyreshe emerore Kiros kemi
Kiros kemi Kotisairaanhoito kemi
Kotisairaanhoito kemi Svavel rapar
Svavel rapar Geokaivot
Geokaivot Isomerer
Isomerer Nr 25 kemi
Nr 25 kemi Kh kemi
Kh kemi Hac kemi
Hac kemi Eva och adam intro
Eva och adam intro Fall av 10 käglor
Fall av 10 käglor Risk och konsekvensanalys
Risk och konsekvensanalys Qaychidan foydalanish qoidalari
Qaychidan foydalanish qoidalari Eva och adam intro
Eva och adam intro Vad är motkraft
Vad är motkraft Exponent rules
Exponent rules Indefinita pronomen
Indefinita pronomen Bjorklund seminarieboken download
Bjorklund seminarieboken download Medvetna och omedvetna signaler np
Medvetna och omedvetna signaler np Textbindning och sambandsord
Textbindning och sambandsord Skillnad mellan stolp och stapeldiagram
Skillnad mellan stolp och stapeldiagram Krister bauer
Krister bauer Formella och informella roller
Formella och informella roller Ett rikt växt och djurliv
Ett rikt växt och djurliv