KEM A 02 Allmn och oorganisk kemi JMVIKT


![12. 9 ”The common ion effect” utsaltning[utfällning] genom tillsats av samma jonslag BAKGRUND Många 12. 9 ”The common ion effect” utsaltning[utfällning] genom tillsats av samma jonslag BAKGRUND Många](https://slidetodoc.com/presentation_image_h2/dc94675177845815081b03f2196e8ddd/image-3.jpg)






- Slides: 14

KEM A 02 Allmän- och oorganisk kemi JÄMVIKT i LÖSNING A: Kap 12 Föreläsning 3(3) mer löslighetsprodukt! KEMA 02/ © Sofi Elmroth 2011

Repetition Henderson-Hasselbach ekvationen för beräkning av p. H i ”buffert” - OK att använda - viktigast att förstå när den är applicerbar - egentligen helt onödig! Buffertkapacitet -bra p. H område ca ; p. Ka – 1 < p. H < p. Ka + 1 Utseende titrerkurva - Stark syra + stark bas; ekvivalenspunkt vid p. H = 7 - Svag syra + stark bas; ekvivalenspunkt vid p. H > 7 (stark bas genereras) - Svag bas + stark syra; ekvivalenspunkt vid p. H < 7 (stark syra genereras) - Titrerkurva polyprotolyter; H 2 SO 4, H 2 SO 3, H 2 CO 3, H 3 PO 4 + stark bas (OH-) Indikatorer - Funktion och använding (varför fungerar de? Matchning av indikator titrering) Löslighetsprodukt – mer om detta idag! KEMA 02/ © Sofi Elmroth 2011
![12 9 The common ion effect utsaltningutfällning genom tillsats av samma jonslag BAKGRUND Många 12. 9 ”The common ion effect” utsaltning[utfällning] genom tillsats av samma jonslag BAKGRUND Många](https://slidetodoc.com/presentation_image_h2/dc94675177845815081b03f2196e8ddd/image-3.jpg)
12. 9 ”The common ion effect” utsaltning[utfällning] genom tillsats av samma jonslag BAKGRUND Många metalljoner bildar hydroxider vid p. H 7 som faller ut. [jfr deponier!] Den fria metalljonhalten bestäms av löslighetsprodukten, Ksp REAKTION – exempel Al 3+(aq) + 3 H 2 O Al(OH)3(s) + 3 H+ Reaktion ger sur lösning! ÖVER p. H ca 7. 5 löses hydroxiden delvis upp: Al(OH)3(s) a=1 Al 3+(aq) + 3 OH-(aq) s Ksp= 1. 0 E-33 Tabell 12. 4 3 s Uppskattning av ungefärlig halt Al 3+ över Al(OH)3(s): s(3 s)3 = Ksp s = 2. 5 E-9 M ALLTSÅ: Mycket låg halt Al 3+(aq) FRÅGA: Kan man sänka halten Al 3+(aq) ytterligare? KEMA 02/ © Sofi Elmroth 2011

Strategi för sänkning av metalljonhalt TILLSATS AV MER OH- SKJUTER JÄMVIKTEN ÅT VÄNSTER dvs åt reaktanter BERÄKNING för olika [OH-] Al(OH)3(s) a=1 Al 3+(aq) + 3 OH-(aq) s Ksp= 1. 0 E-33 Tabell 12. 4 [OH-] HÄR: Ksp = s[OH-]3 [OH-] Ksp s = [Al 3+(aq)] 1 E-7 0. 1 1. 0 4. 0 s(1 E-7)3 s(0. 1)3 s(1. 0)3 s(4. 0)3 1. 0 E-12 1. 0 E-30 1. 0 E-33 1. 5 E-35 KEMA 02/ © Sofi Elmroth 2011 SLUTSATS: Förvaring i basisk miljö minimerar Al 3+(aq) MEN! Det blir problem då det läcker ut och p. H stiger!

Vad finns mer i rödslam? bildas vid framställing av Al(s) Bauxiten består av aluminiumoxid och aluminiumhydroxid, men även järnmineral*, titanoxider** och aluminiumsilikater***. [1] *Sannolikt Fe(OH)3(s) dvs rost! ** Tex Ti. O, – vitt pigment som används i färg *** Silikater Si. O 2 – vanlig sand VAD ÄR FARLIGT? ! OH-(aq) pga det höga koncentrationen Na. OH/KOH täcker sannolikt torra partiklar - Tungmetaller kan inte uteslutas; ex) Hg, Cr, As - Partiklar KEMA 02/ © Sofi Elmroth 2011 [1] KÄLLA: Jernkontorets forskning; Rapport nr D 182, 2004 -08 -16 U Lindunger & E Stark

Beräkna effekten av ”utsaltning” EXEMPEL 12. 9 Beräkna lösligheten av Ag. Cl(s) i Na. Cl(aq) VAD VÄNTAR VI OSS? ! KEMA 02/ © Sofi Elmroth 2011

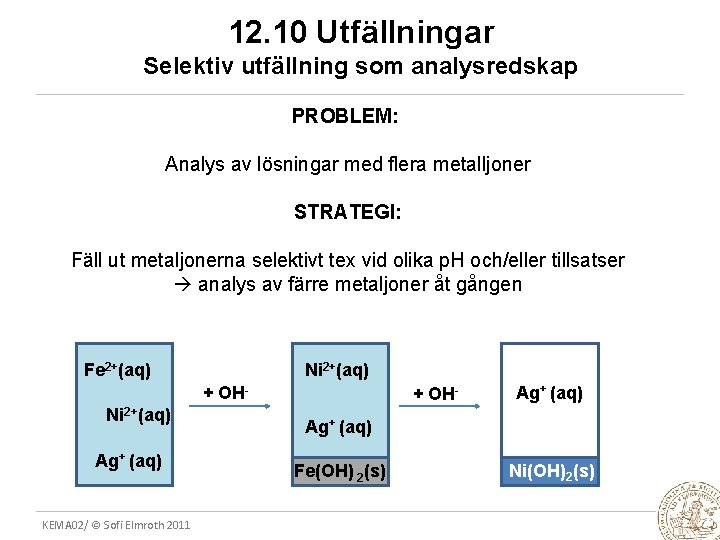
12. 10 Utfällningar Selektiv utfällning som analysredskap PROBLEM: Analys av lösningar med flera metalljoner STRATEGI: Fäll ut metaljonerna selektivt tex vid olika p. H och/eller tillsatser analys av färre metaljoner åt gången Fe 2+(aq) Ni 2+(aq) + OH- Ni 2+(aq) Ag+ (aq) KEMA 02/ © Sofi Elmroth 2011 + OH- Ag+ (aq) Fe(OH) 2(s) Ni(OH)2(s)

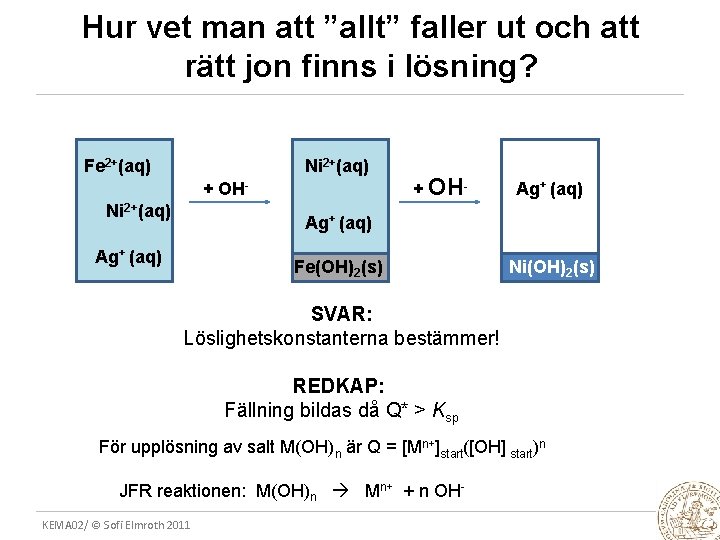
Hur vet man att ”allt” faller ut och att rätt jon finns i lösning? Fe 2+(aq) Ni 2+(aq) + OH- Ag+ (aq) Fe(OH)2(s) Ni(OH)2(s) SVAR: Löslighetskonstanterna bestämmer! REDKAP: Fällning bildas då Q* > Ksp För upplösning av salt M(OH)n är Q = [Mn+]start([OH] start)n JFR reaktionen: M(OH)n Mn+ + n OHKEMA 02/ © Sofi Elmroth 2011

Blandning av 2 lösningar – vad faller ut? EXEMPEL 12. 10 Faller något ut om lika volymer 0. 2 M Pb(NO 3)2(aq) och KI(aq) blandas? KEMA 02/ © Sofi Elmroth 2011

12. 11 Selektiv utfällning Användning av Ksp för att förutsäga i vilken ordning salter faller ut EXEMPEL 12. 11 Utfällning av Mg 2+ och Ca 2+ ur havsvatten m. hj. a. fast Na. OH(s) KEMA 02/ © Sofi Elmroth 2011

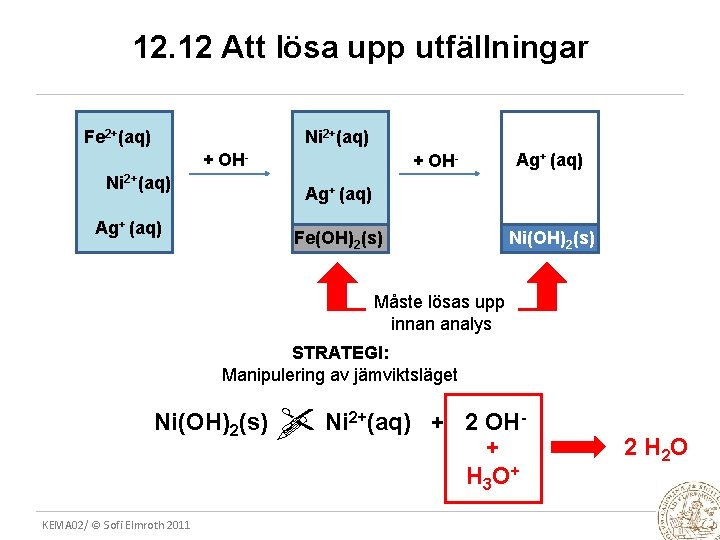
12. 12 Att lösa upp utfällningar Fe 2+(aq) Ni 2+(aq) + OH- Ag+ (aq) Ni(OH)2(s) Fe(OH)2(s) Måste lösas upp innan analys STRATEGI: Manipulering av jämviktsläget Ni(OH)2(s) KEMA 02/ © Sofi Elmroth 2011 2+(aq) Ni + 2 OH+ H 3 O + 2 H 2 O

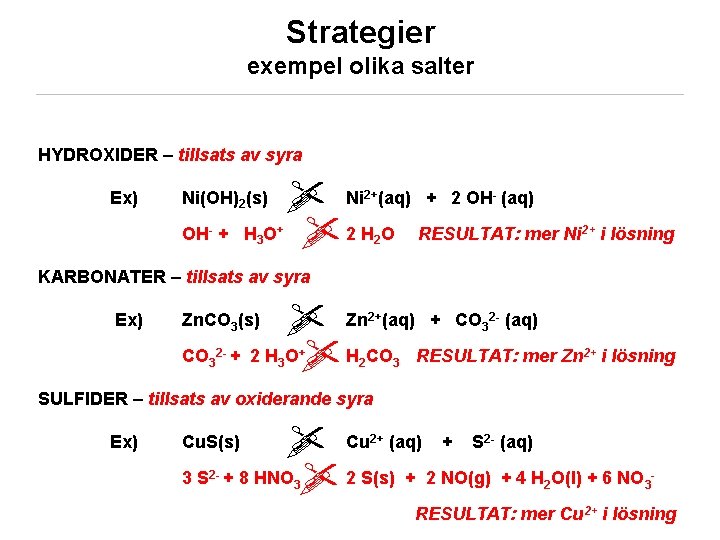
Strategier exempel olika salter HYDROXIDER – tillsats av syra Ex) Ni (aq) + 2 OH (aq) HO 2 H O RESULTAT: mer Ni Ni(OH)2(s) OH- + 3 2+ + - 2 2+ i lösning KARBONATER – tillsats av syra Ex) Zn (aq) + CO (aq) 2 H O H CO RESULTAT: mer Zn Zn. CO 3(s) CO 32 - + 2+ 3 + 2 3 2 - 3 2+ i lösning SULFIDER – tillsats av oxiderande syra Ex) Cu (aq) + S (aq) + 8 HNO 2 S(s) + 2 NO(g) + 4 H O(l) + 6 NO Cu. S(s) 3 S 2 - KEMA 02/ © Sofi Elmroth 2011 2+ 3 2 - 2 3 - RESULTAT: mer Cu 2+ i lösning

12. 13 Komplexbildning Ytterligare en strategi för upplösning av svårlösliga salter SPECIELLT LÄMPLIG FÖR ÖVERGÅNGSMETALLERNA! Fenomen: ”Maskering av metalljoner” Ag+ Ag. Cl(s) Ag+(aq) + Cl- (aq) Ag+(aq) + 2 NH 3 (aq) Ag(NH 3)2+(aq) EXEMPEL 12. 12: Hur mycket Ag. Cl(s) löses i 0. 1 M NH 3 ? KEMA 02/ © Sofi Elmroth 2011

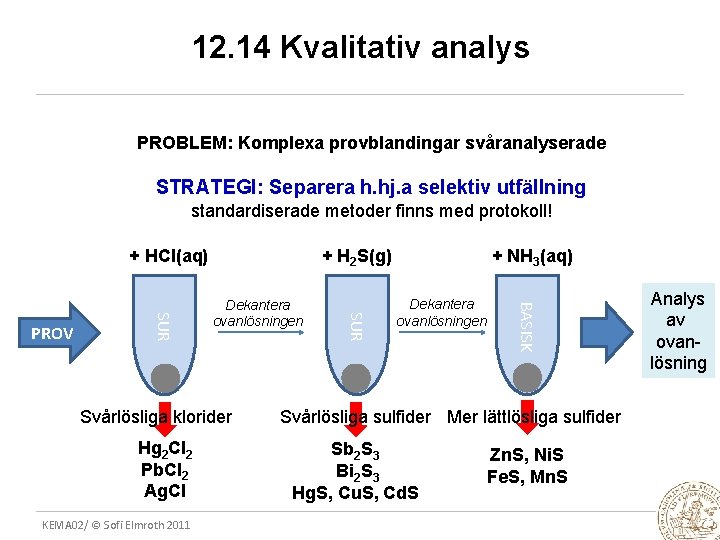
12. 14 Kvalitativ analys PROBLEM: Komplexa provblandingar svåranalyserade STRATEGI: Separera h. hj. a selektiv utfällning standardiserade metoder finns med protokoll! + HCl(aq) Svårlösliga klorider Hg 2 Cl 2 Pb. Cl 2 Ag. Cl KEMA 02/ © Sofi Elmroth 2011 + NH 3(aq) Dekantera ovanlösningen BASISK Dekantera ovanlösningen SUR PROV + H 2 S(g) Svårlösliga sulfider Mer lättlösliga sulfider Sb 2 S 3 Bi 2 S 3 Hg. S, Cu. S, Cd. S Zn. S, Ni. S Fe. S, Mn. S Analys av ovanlösning
 Allmn
Allmn Likheter och skillnader mellan hinduismen och buddhismen
Likheter och skillnader mellan hinduismen och buddhismen Tjock och smal liten och stor
Tjock och smal liten och stor Ngụy biện bằng cách diễn đạt mập mờ
Ngụy biện bằng cách diễn đạt mập mờ 11 giờ kém
11 giờ kém Salamization
Salamization Ahura mazda khodai prayer
Ahura mazda khodai prayer Rsa kem
Rsa kem Spektroskopiska metoder
Spektroskopiska metoder Väte i kemin
Väte i kemin Strösocker kemisk uppbyggnad
Strösocker kemisk uppbyggnad Kiros kemi
Kiros kemi Bachelorkontrakt
Bachelorkontrakt Afstemning af kemiske reaktioner
Afstemning af kemiske reaktioner Geokaivot
Geokaivot


























