KEM A 02 Allmn och oorganisk kemi SYROR


![TYPREAKTION BrØnsted bas Karaktäristiskt: En eller flera ensamma [obundna] elektronpar [som kan ta upp TYPREAKTION BrØnsted bas Karaktäristiskt: En eller flera ensamma [obundna] elektronpar [som kan ta upp](https://slidetodoc.com/presentation_image_h/f59378287ff256b036e40d2206d444cc/image-6.jpg)
![Begrepp: KONJUGERAD SYRA OCH BAS PRINCIP Syra Bas [tar upp H+] [donerar H+] Konjugerad Begrepp: KONJUGERAD SYRA OCH BAS PRINCIP Syra Bas [tar upp H+] [donerar H+] Konjugerad](https://slidetodoc.com/presentation_image_h/f59378287ff256b036e40d2206d444cc/image-7.jpg)








- Slides: 21

KEM A 02 Allmän- och oorganisk kemi SYROR OCH BASER Atkins & Jones kap 11. 1 -11. 10 KEMMA 02/ © Sofi Elmroth 2011

ÖVERSIKT - Syror och baser – grundläggande egenskaper - Svaga syror och baser - p. H i lösningar av svaga syror och baser - Flerprotoniga syror - Autoprotolys och p. H KEMMA 02/ © Sofi Elmroth 2011

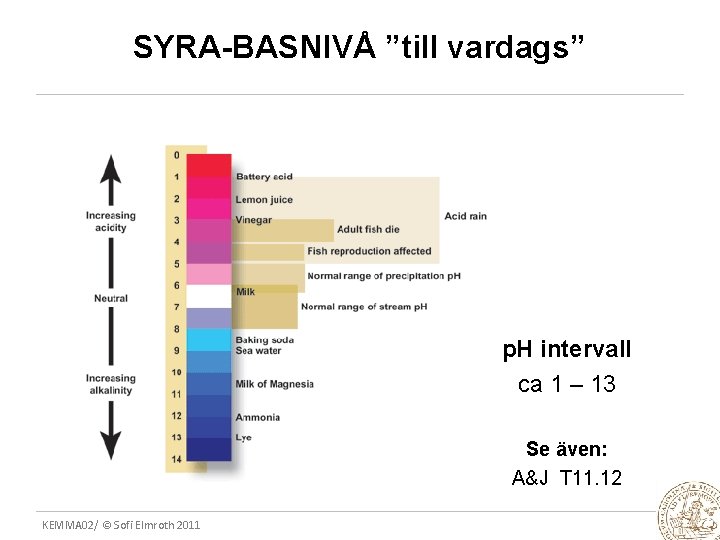
SYRA-BASNIVÅ ”till vardags” p. H intervall ca 1 – 13 Se även: A&J T 11. 12 KEMMA 02/ © Sofi Elmroth 2011

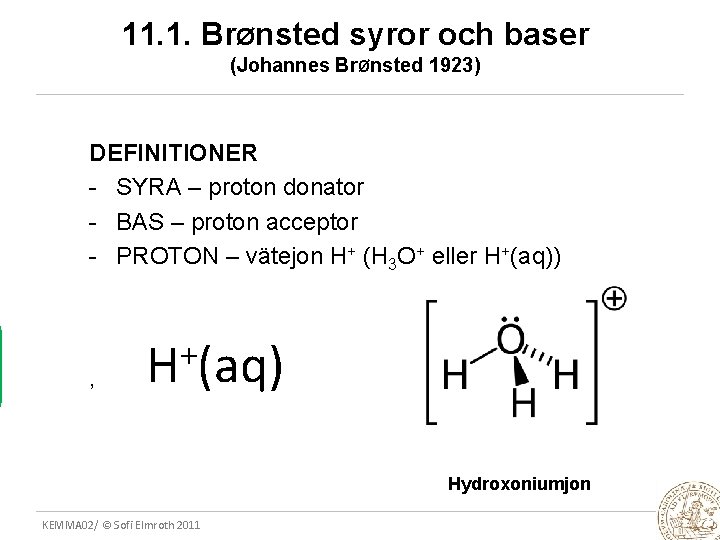
11. 1. BrØnsted syror och baser (Johannes BrØnsted 1923) DEFINITIONER - SYRA – proton donator - BAS – proton acceptor - PROTON – vätejon H+ (H 3 O+ eller H+(aq)) , + H (aq) Hydroxoniumjon KEMMA 02/ © Sofi Elmroth 2011

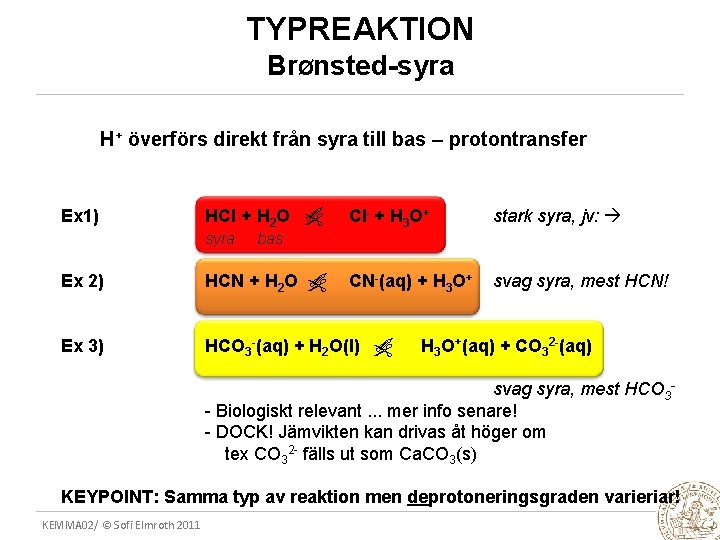
TYPREAKTION BrØnsted-syra H+ överförs direkt från syra till bas – protontransfer stark syra, jv: CN-(aq) + H 3 O+ svag syra, mest HCN! bas Ex 2) HCN + H 2 O Ex 3) HCO 3 -(aq) + H 2 O(l) syra Cl- + H 3 O+ HCl + H 2 O Ex 1) H 3 O+(aq) + CO 32 -(aq) svag syra, mest HCO 3 - Biologiskt relevant. . . mer info senare! - DOCK! Jämvikten kan drivas åt höger om tex CO 32 - fälls ut som Ca. CO 3(s) KEYPOINT: Samma typ av reaktion men deprotoneringsgraden varieriar! KEMMA 02/ © Sofi Elmroth 2011
![TYPREAKTION BrØnsted bas Karaktäristiskt En eller flera ensamma obundna elektronpar som kan ta upp TYPREAKTION BrØnsted bas Karaktäristiskt: En eller flera ensamma [obundna] elektronpar [som kan ta upp](https://slidetodoc.com/presentation_image_h/f59378287ff256b036e40d2206d444cc/image-6.jpg)
TYPREAKTION BrØnsted bas Karaktäristiskt: En eller flera ensamma [obundna] elektronpar [som kan ta upp H+] Ex 1) Ca. O (s) + H 2 O(l) Ca 2+(aq) + 2 OH- (aq) bas Ex 2) NH 3 (aq) + H 2 O (l) O 2 -: mkt stark bas oxidjon NH 4+ (aq) + OH- (aq) NH 3 – oladdad! svagare attraktion svagare bas KEYPOINT: Samma typ av reaktion men protoneringsgraden varieriar! KEMMA 02/ © Sofi Elmroth 2011
![Begrepp KONJUGERAD SYRA OCH BAS PRINCIP Syra Bas tar upp H donerar H Konjugerad Begrepp: KONJUGERAD SYRA OCH BAS PRINCIP Syra Bas [tar upp H+] [donerar H+] Konjugerad](https://slidetodoc.com/presentation_image_h/f59378287ff256b036e40d2206d444cc/image-7.jpg)
Begrepp: KONJUGERAD SYRA OCH BAS PRINCIP Syra Bas [tar upp H+] [donerar H+] Konjugerad syra Konjugerad bas EXEMPEL CN- Cyanidjon H 2 CO 3 Kolsyra H+ HCO 3 - Vätekarbonatjon KEMMA 02/ © Sofi Elmroth 2011 H+ HCN Vätecyanid

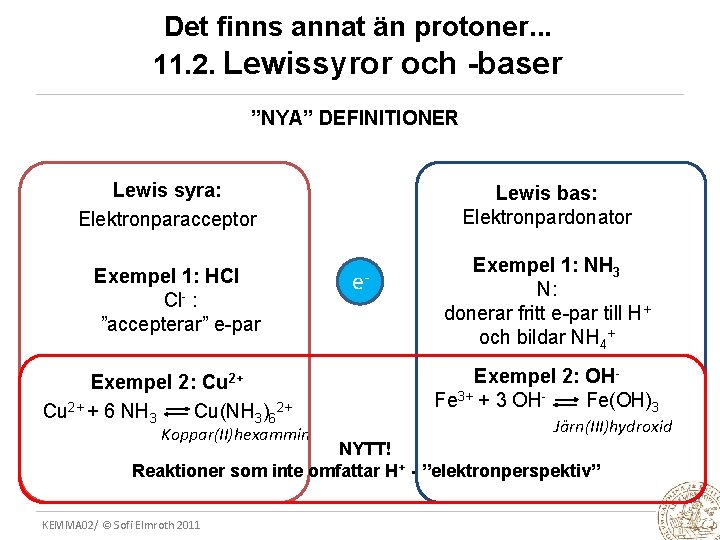
Det finns annat än protoner. . . 11. 2. Lewissyror och -baser ”NYA” DEFINITIONER Lewis syra: Elektronparacceptor Exempel 1: HCl Cl- : ”accepterar” e-par Exempel 2: Cu 2+ + 6 NH 3 Cu(NH 3)62+ Koppar(II)hexammin Lewis bas: Elektronpardonator e- Exempel 1: NH 3 N: donerar fritt e-par till H+ och bildar NH 4+ Exempel 2: OHFe 3+ + 3 OHFe(OH)3 Järn(III)hydroxid NYTT! Reaktioner som inte omfattar H+ - ”elektronperspektiv” KEMMA 02/ © Sofi Elmroth 2011

MILJÖKATASTROF!!! S-atmosfär KEMMA 02/ © Sofi Elmroth 2011 O-atmosfär

11. 3. Sura, basiska och amfotera oxider Vi lever i en oxiderande miljö! SUR OXID - Bildar Brönsted syra i vatten - Ickemetaller - Ex) CO 2 i vatten H 2 CO 3 BASISK OXID - Bildar OH- i vatten - Metaller - Ex) Ca. O i vatten Ca(OH)2 (s) AMFOTERA OXIDER - Reagerar både med syror och baser - Övergångsmetaller – tom ca Al/Pb diagonalen - Ex) Al 2 O 3 KEMMA 02/ © Sofi Elmroth 2011

11. 4. Protonutbyte mellan vattenmolekyler Nyckelfunktion för syra-bas beteende REAKTION Kw = 2 H 2 O a(H 3 O+) a(OH-) a(H 2 O)2 H 3 O+ + OH- ≈ Kw [H 3 O+][OH-] Kw = 1 x 10 -14 M 2 vid 25 o. C OBS 1! Mkt snabbt utbyte! Diffusionskontrollerat – OK för korta avstånd – dock ej långa OBS 2! Jämvikten förskjuten långt åt vänster dålig konduktivitet i rent vatten! KEMMA 02/ © Sofi Elmroth 2011

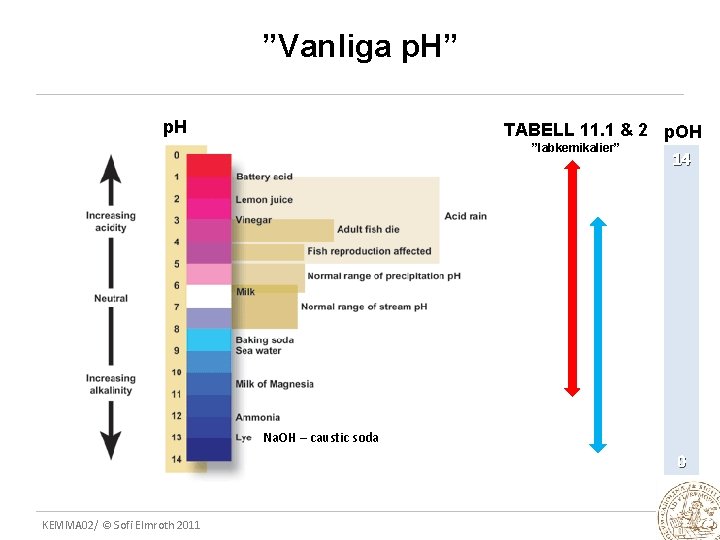
11. 5, 11. 6 p. H- skalan och p. OH DEFINITIONER p. H = - log(a(H 3 O+)) ≈ - log [H 3 O+] p. OH = - log(a(OH+)) ≈ - log [OH-] Anges lämpligen med 2 decimaler t. ex. p. H 5. 26 SAMBAND p. Kw = p. H + p. OH = p. Kw – p. H Härledning: läs själva! (A 11. 6) KEMMA 02/ © Sofi Elmroth 2011

SVAGA SYROR OCH BASER 11. 7 Syra- och baskonstanter VAD FINNS I EN VATTENLÖSNING AV EN SVAG SYRA? - Syran själv; HA HA + H 2 O A- + H 3 O+ - Lite av den konjugerade basen; AKa = [A-][H 3 O+]/[HA] - Liten mängd H 3 O+ - lika mycket tillskott som bildat A- VAD FINNS I EN VATTENLÖSNING AV EN SVAG BAS? - Basen själv; B - Lite av den konjugerade syran; HB - Liten mängd OH- - lika mycket tillskott som bildat HB B + H 2 O HB + OHKb = [HB][OH-]/[B] NOTERA! p. H = p. Ka då [HA]=[A-] och p. OH = p. Kb då [HB]=[B] KEMMA 02/ © Sofi Elmroth 2011

Hur vet man vad som är den starkaste syran/basen? EXEMPEL 11. 5 a) b) Jämför HF (vätefluorid) med HIO 3 (jodsyra, vätejodat) Jämför NO 2 - (nitritjon) med CN- (cyanidjon) LÖSNING: Jämför p. Ka eller p. Kb-värden! UR TABELL 11. 1 och 11. 2 Förening HF HIO 3 NO 2 CN- p. Ka 3. 45 0. 77 - p. Kb Lägst värde starkast syra! 14 – 3. 37 (p. Ka för HN 02) = 10. 63 14 – 9. 31 (p. Ka för HCN) = 4. 69 Lägst värde starkast bas! KEMMA 02/ © Sofi Elmroth 2011

”Vanliga p. H” p. H TABELL 11. 1 & 2 p. OH ”labkemikalier” 14 Na. OH – caustic soda 0 KEMMA 02/ © Sofi Elmroth 2011

Fråga: Hur sur kan en syra vara? Exempel på SUPERSYRA Triflourometansulfonsyra ”Triflic acid” Ka ca 1015 p. Ka ca -15 Användning: kraftfullt protoneringsreagens OBS! 3 starkt elektronegativa grupper KEMMA 02/ © Sofi Elmroth 2011

11. 9. Koppling - struktur och syrastyrka Table 7: H-X Bond Strengths and p. Ka H-X p. Ka Bond Energy [k. J/mol] HF 3. 1 567. 7 Minskande H-X bindningsstyrka HCl -6. 0 431. 6 HBr -9. 0 365. 9 Minskande p. Ka dvs surare syra! HI -9. 5 298. 0 STARK SYRA: H+ ”trillar lätt av” http: //www. vias. org/genchem/acidbase_equ_ 12591_06. html KEMMA 02/ © Sofi Elmroth 2011

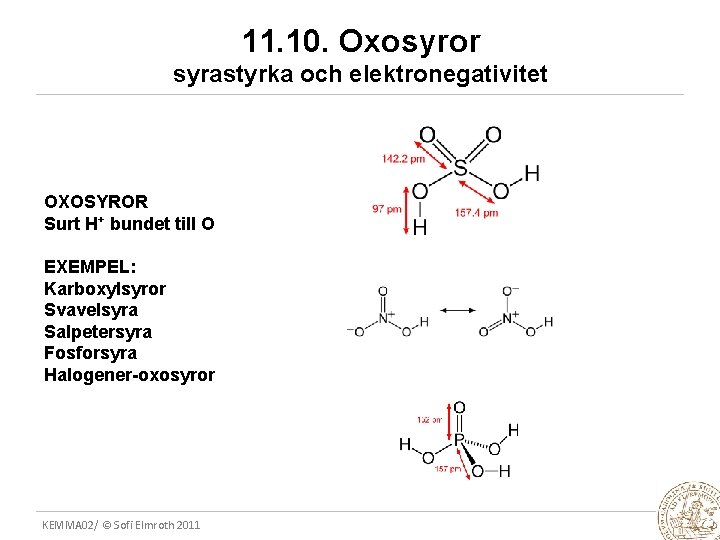
11. 10. Oxosyror syrastyrka och elektronegativitet OXOSYROR Surt H+ bundet till O EXEMPEL: Karboxylsyror Svavelsyra Salpetersyra Fosforsyra Halogener-oxosyror KEMMA 02/ © Sofi Elmroth 2011

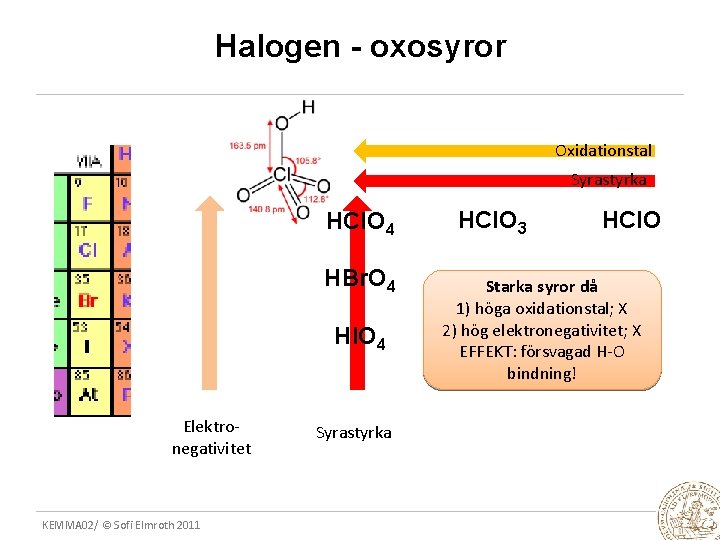
Halogen - oxosyror Oxidationstal Syrastyrka HCl. O 4 HBr. O 4 HIO 4 Elektronegativitet KEMMA 02/ © Sofi Elmroth 2011 Syrastyrka HCl. O 3 HCl. O Starka syror då 1) höga oxidationstal; X 2) hög elektronegativitet; X EFFEKT: försvagad H-O bindning!

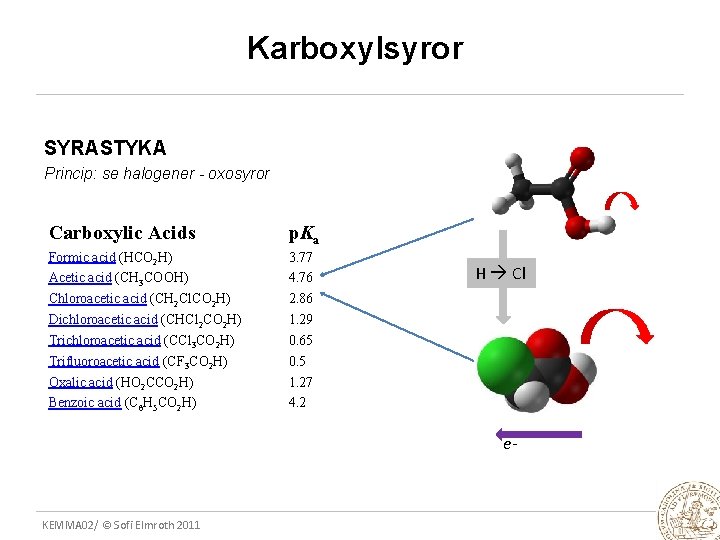
Karboxylsyror SYRASTYKA Princip: se halogener - oxosyror Carboxylic Acids p. Ka Formic acid (HCO 2 H) Acetic acid (CH 3 COOH) Chloroacetic acid (CH 2 Cl. CO 2 H) Dichloroacetic acid (CHCl 2 CO 2 H) Trichloroacetic acid (CCl 3 CO 2 H) Trifluoroacetic acid (CF 3 CO 2 H) Oxalic acid (HO 2 CCO 2 H) Benzoic acid (C 6 H 5 CO 2 H) 3. 77 4. 76 2. 86 1. 29 0. 65 0. 5 1. 27 4. 2 H Cl e- KEMMA 02/ © Sofi Elmroth 2011

Summering TYPREAKTION p. H skalan Syror deprotoneras HA + H 2 O A- + H 3 O+ Baser protoneras B- + H 2 O HB + OH- EXEMPEL Svavelsyra Saltsyra Perklor/bromsyra Klor/bromsyra Hypoklorit/bromitsyra Fluorättiksyra Ättiksyra H 2 SO 4 HCl. O 4 HBr. O 4 HCl. O 3 HBr. O 3 HCl. O HBr. O CH 2 Cl. CO 2 H CH 3 CO 2 H (HAc) Ammoniak Natriumhyroxid Magnesiumhydroxid Kalciumoxid Natriumhydrid NH 3 Na. OH Mg(OH)2 Ca. O Na. H* (*H 2 avgår) KEMMA 02/ © Sofi Elmroth 2011
 Vad är joner
Vad är joner Allmn
Allmn Egenskaper hos syror
Egenskaper hos syror Buddhism och hinduism likheter och skillnader
Buddhism och hinduism likheter och skillnader Konkretia
Konkretia Rsa kem
Rsa kem Ví dụ ngụy biện dựa vào sự kém cỏi
Ví dụ ngụy biện dựa vào sự kém cỏi 11 giờ kém
11 giờ kém Salamization
Salamization Kusti prayers in english
Kusti prayers in english Exempel på estrar
Exempel på estrar Spektroskopiska metoder
Spektroskopiska metoder Slamning kemi
Slamning kemi Flerprotonig syra
Flerprotonig syra Druvsocker formel
Druvsocker formel Kiros au
Kiros au Medicinal kemi au
Medicinal kemi au Maalämpö kemi
Maalämpö kemi Afstemning kemi
Afstemning kemi Nr 26 kemi
Nr 26 kemi Nr 25 kemi
Nr 25 kemi Kemi au bachelor
Kemi au bachelor






































