Importancia del potencial redox de la pulpa en









- Slides: 20

“Importancia del potencial redox de la pulpa en los procesos de flotación”

INDICE DE LA PRESENTACION 1. Introducción Potencial redox Potencial de reposo Potenciales de semiceldas 2. 3. 4. 5. 6. 7. 8. Reacciones sulfuro - colector Concentración de colectores y dimerización Tipo de colector y dimerización Modificación del potencial de pulpa Minerales con pirita y pirrotita Mecanismos de activación y desactivación Inferencia de especies hidrofóbicas

1. - Introducción: Potencial redox Electrodo sensible / inerte / trabajo Au, Pt -11 10 - 10 Junta porosa KCl sl´n Potenciometro de alta impedancia -13 ohms Electrodo Referencia Ag/Ag. Cl, Hg/Hg 2 Cl 2

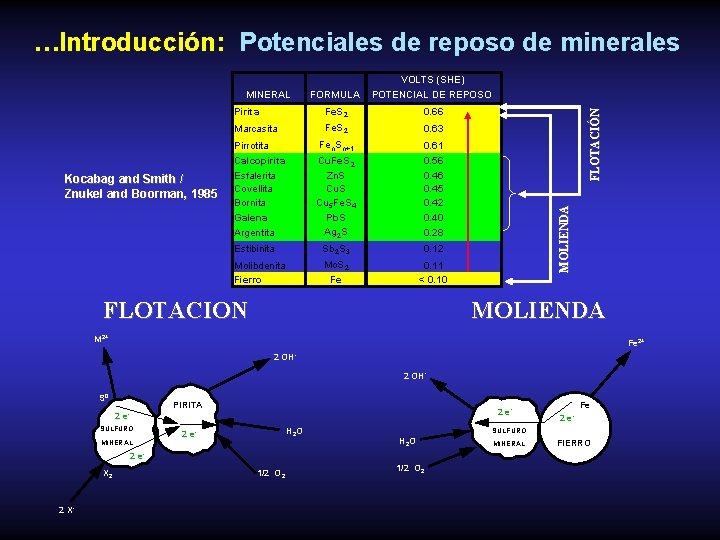
…Introducción: Potenciales de reposo de minerales Pirita Fe. S 2 0. 66 Marcasita Fe. S 2 0. 63 Pirrotita Fe n. S n+1 0. 61 Calcopirita Esfalerita Covellita Bornita Galena Cu. Fe. S 2 0. 56 0. 45 0. 42 0. 40 Kocabag and Smith / Znukel and Boorman, 1985 Argentita Zn. S Cu 5 Fe. S 4 Pb. S Ag 2 S Estibinita Sb 2 S 3 0. 12 Molibdenita Fierro Mo. S 2 Fe 0. 11 < 0. 10 MOLIENDA MINERAL FLOTACIÓN FORMULA VOLTS (SHE) POTENCIAL DE REPOSO 0. 28 FLOTACION MOLIENDA M 2+ Fe 2+ 2 OH - S 0 PIRITA 2 e- 2 e. SULFURO MINERAL H 2 O 2 e- SULFURO H 2 O 2 e. X 2 2 X- 1/2 O 2 Fe 2 e- 1/2 O 2 MINERAL FIERRO

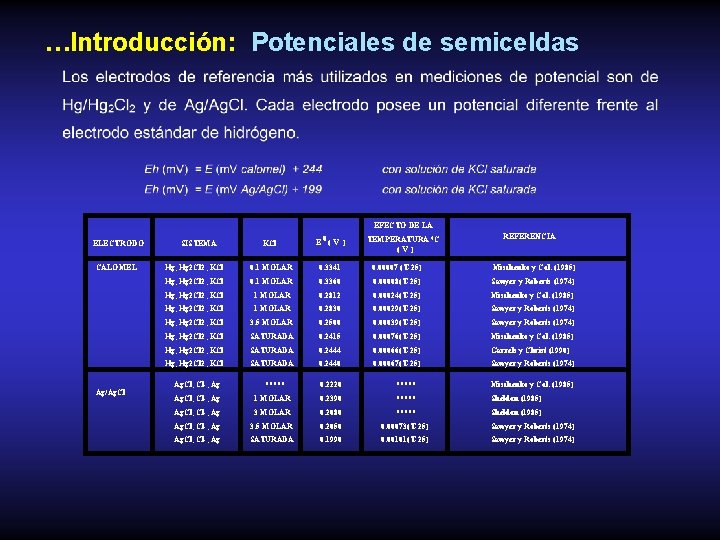
…Introducción: Potenciales de semiceldas EFECTO DE LA ELECTRODO CALOMEL Ag/Ag. Cl REFERENCIA KCl E 0( V ) Hg, Hg 2 Cl 2, KCl 0. 1 MOLAR 0. 3341 0. 00007 (T-25) Hg, Hg 2 Cl 2, KCl 0. 1 MOLAR 0. 3360 0. 00008(T-25) Sawyer y Roberts (1974) Hg, Hg 2 Cl 2, KCl 1 MOLAR 0. 2812 0. 00024(T-25) Mischenko y Col. (1985) Hg, Hg 2 Cl 2, KCl 1 MOLAR 0. 2830 0. 00029(T-25) Sawyer y Roberts (1974) Hg, Hg 2 Cl 2, KCl 3. 5 MOLAR 0. 2500 0. 00039(T-25) Sawyer y Roberts (1974) Hg, Hg 2 Cl 2, KCl SATURADA 0. 2415 0. 00076(T-25) Mischenko y Col. (1985) Hg, Hg 2 Cl 2, KCl SATURADA 0. 2444 0. 00066(T-25) Garrels y Christ (1990) Hg, Hg 2 Cl 2, KCl SATURADA 0. 2440 0. 00067(T-25) Sawyer y Roberts (1974) SISTEMA Ag. Cl, Cl-, Ag ***** TEMPERATURA °C (V ) Mischenko y Col. (1985) 0. 2220 ***** Mischenko y Col. (1985) Ag. Cl, Cl-, Ag 1 MOLAR 0. 2390 ***** Sheldon (1985) Ag. Cl, Cl-, Ag 3 MOLAR 0. 2080 ***** Sheldon (1985) Ag. Cl, Cl-, Ag 3. 5 MOLAR 0. 2050 0. 00073(T-25) Sawyer y Roberts (1974) Ag. Cl, Cl-, Ag SATURADA 0. 1990 0. 00101(T-25) Sawyer y Roberts (1974)

2. - Reacciones sulfuro-colector Para Xantatos: Formación de dixantógeno adsorbido: MS + 2 X- + 1/2 O 2 + 2 H+ = MS(X 2) + H 2 O reacción anódica: reacción catódica: MS + 2 X- = MS(X 2) + 2 e 1/2 O 2 + 2 H+ + 2 e- = H 2 O Formación de xantato metálico: MS + 2 X- + 1/2 O 2 + 2 H+ = MX 2 + So + H 2 O reacción anódica: reacción catódica: MS + 2 X- = MX 2 + So + 2 e 1/2 O 2 + 2 H+ + 2 e- = H 2 O

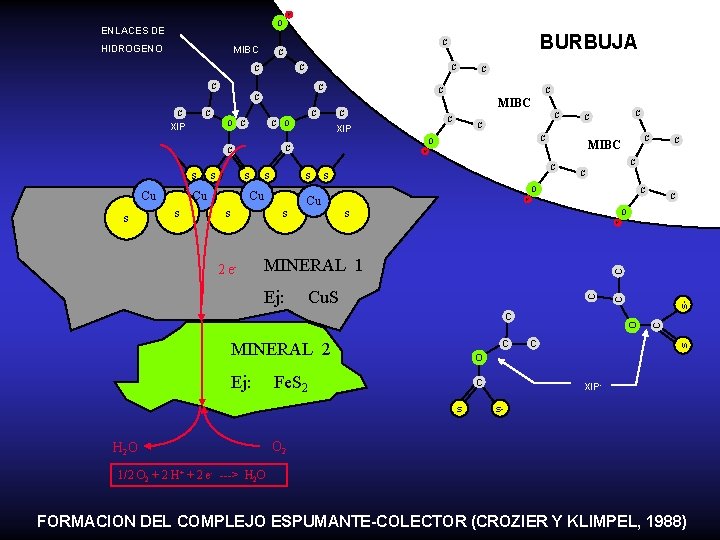
H O ENLACES DE HIDROGENO C C C Cu s C MIBC H C C O Cu s s Cu C C C H s O H MINERAL 1 Ej: Cu. S O Ej: C Fe. S 2 s H 2 O C s C MINERAL 2 O C s- 2 e- C s s C O C C C s s C C Cu s C C XIP C C s O C XIP C MIBC C O C C C BURBUJA C MIBC XIPs- O 2 1/2 O 2 + 2 H+ + 2 e- ---> H 2 O FORMACION DEL COMPLEJO ESPUMANTE-COLECTOR (CROZIER Y KLIMPEL, 1988)

3. - Concentración de colector y dimerización El potencial estándar de un par electroquímico, se determina en un medio inerte (N 2). Por ej: E 0 = X-/X 2 = - 60 m. V (etílico) E 0 = X-/X 2 = - 100 m. V (iso-propílico) E 0 = X-/X 2 = - 150 m. V (amílico) a Donde: [ X-] a = 1, [ X 2] = 1, PN 2 = 1 atm. En el caso de que las condiciones de actividad y/o temperatura sean diferentes a las estándar, el potencial del par se le conoce como potencial reversible o de Nernst, Er, y se expresa de acuerdo con la ecuación de Nernst. n. Oi üï ì P ï RT a Er = E 0 + ln í Oin. Rj ý n. F ïî Pa Rj ïþ

……Concentración de colector y dimerización Ejemplo: Una pulpa con un Eh de pulpa en el banco primario = 150 m. V y 100 ppm de xantato etílico de sodio: n RT ìï Pa. Oi Oi üï E =E + lní n. Rj ý n. F ïî Pa Rj ïþ r 0 ü 1. 98 ´ 298 ì 1 E r = -0. 06 + lní -4 2 ý ´ ´ 2 23060 î(6. 25 10 ) þ Er = 130 m. V A esta concentración de xantato, predomina el dímero, por lo que la pirita y pirrotita se activarían muy fácilmente, por lo tanto será necesario: a) Reducir la concentración del xantato. b) Utilizar otro colector de mayor E 0, por ej. un ditiofosfato. c) Reducir el potencial de pulpa, vía reactivos catódicos.

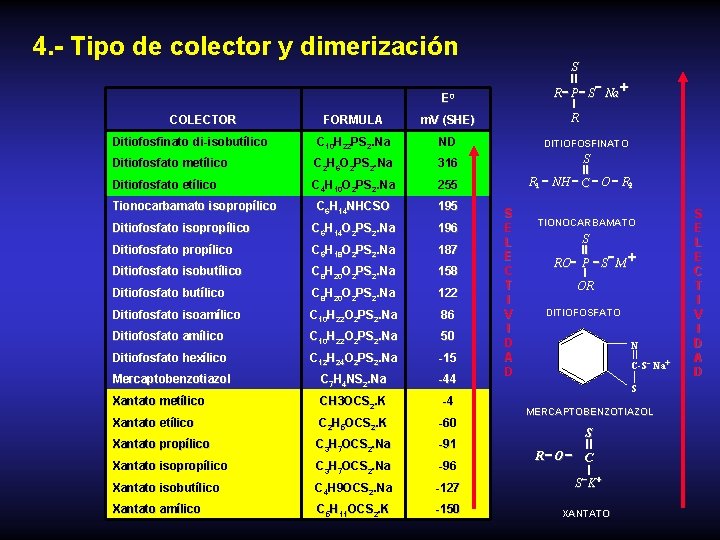
4. - Tipo de colector y dimerización S II + R P - S Na I R E 0 COLECTOR FORMULA m. V (SHE) Ditiofosfinato di-isobutílico C 10 H 22 PS 2. Na ND Ditiofosfato metílico C 2 H 6 O 2 PS 2. Na 316 Ditiofosfato etílico C 4 H 10 O 2 PS 2. Na 255 C 6 H 14 NHCSO 195 Tionocarbamato isopropílico Ditiofosfato isopropílico C 6 H 14 O 2 PS 2. Na 196 Ditiofosfato propílico C 6 H 18 O 2 PS 2. Na 187 Ditiofosfato isobutílico C 8 H 20 O 2 PS 2. Na 158 Ditiofosfato butílico C 8 H 20 O 2 PS 2. Na 122 Ditiofosfato isoamílico C 10 H 22 O 2 PS 2. Na 86 Ditiofosfato amílico C 10 H 22 O 2 PS 2. Na 50 Ditiofosfato hexílico C 12 H 24 O 2 PS 2. Na -15 Mercaptobenzotiazol C 7 H 4 NS 2. Na -44 Xantato metílico CH 3 OCS 2. K -4 Xantato etílico C 2 H 5 OCS 2. K -60 Xantato propílico C 3 H 7 OCS 2. Na -91 Xantato isopropílico C 3 H 7 OCS 2. Na -96 Xantato isobutílico C 4 H 9 OCS 2. Na -127 Xantato amílico C 5 H 11 OCS 2. K -150 DITIOFOSFINATO S II R 1 - NH - C - O - R 2 S E L E C T I V I D A D TIONOCARBAMATO S II - + RO- P - S M I OR DITIOFOSFATO N C-S - Na+ S MERCAPTOBENZOTIAZOL S II R-O - C I - S K + XANTATO S E L E C T I V I D A D

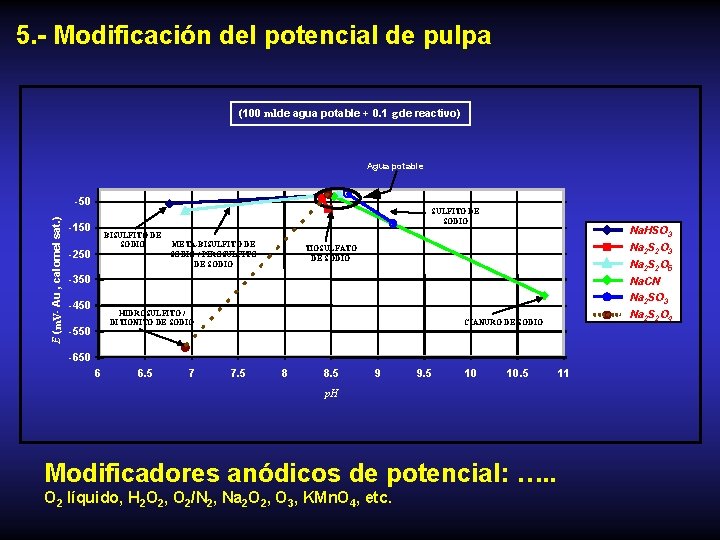
5. - Modificación del potencial de pulpa (100 ml de agua potable + 0. 1 g de reactivo) Agua potable E (m. V- Au , calomel sat. ) -50 SULFITO DE SODIO -150 BISULFITO DE SODIO -250 META-BISULFITO DE SODIO / PIROSULFITO DE SODIO Na. HSO 3 Na 2 S 2 O 5 TIOSULFATO DE SODIO -350 Na. CN Na 2 SO 3 -450 HIDROSULFITO / DITIONITO DE SODIO -550 Na 2 S 2 O 4 CIANURO DE SODIO -650 6 6. 5 7 7. 5 8 8. 5 9 9. 5 10 10. 5 p. H Modificadores anódicos de potencial: …. . O 2 líquido, H 2 O 2, O 2/N 2, Na 2 O 2, O 3, KMn. O 4, etc. 11

6. - Minerales en Peñoles con pirita y pirrotita MINERALES EN PEÑOLES: MINERAL COMPOSICION MINERALOGICA (%) Cu. Fe. S 2 Si. O 2 Pb. S Zn. S TIZAPA 2. 06 12. 80 0. 75 80. 57 3. 82 SABINAS 1. 60 9. 00 3. 00 21. 70 64. 70 PROBLEMAS DE SELECTIVIDAD EN MINERALES DE ALTO CONTENIDO DE PIRITA: 1. - ALTO CONSUMO DE BOLAS DE ACERO EN MOLIENDA 2. - FORMACION DE AZUFRE ELEMENTAL 3. - FORMACION DE DIXANTOGENOS Y XANTATOS METALICOS NO SELECTIVOS

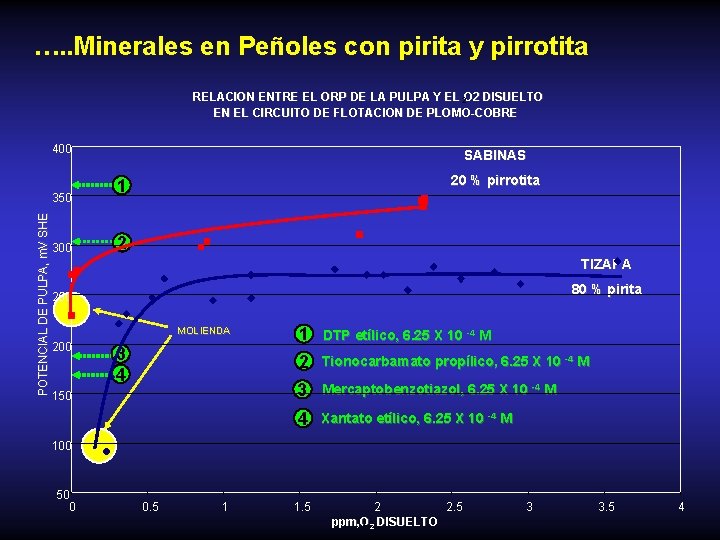
…. . Minerales en Peñoles con pirita y pirrotita RELACION ENTRE EL ORP DE LA PULPA Y EL 2 O 2 DISUELTO EN EL CIRCUITO DE FLOTACION DE PLOMO-COBRE 400 POTENCIAL DE PULPA, m. V SHE 350 300 SABINAS 20 % pirrotita 1 2 TIZAPA 80 % pirita 250 MOLIENDA 200 3 4 150 1 2 Tionocarbamato propílico, 6. 25 X 10 -4 M 3 Mercaptobenzotiazol, 6. 25 X 10 -4 M 4 Xantato etílico, 6. 25 X 10 -4 M DTP etílico, 6. 25 X 10 -4 M 100 50 0 0. 5 1 1. 5 2 2. 5 ppm, O 2 2 DISUELTO 3 3. 5 4

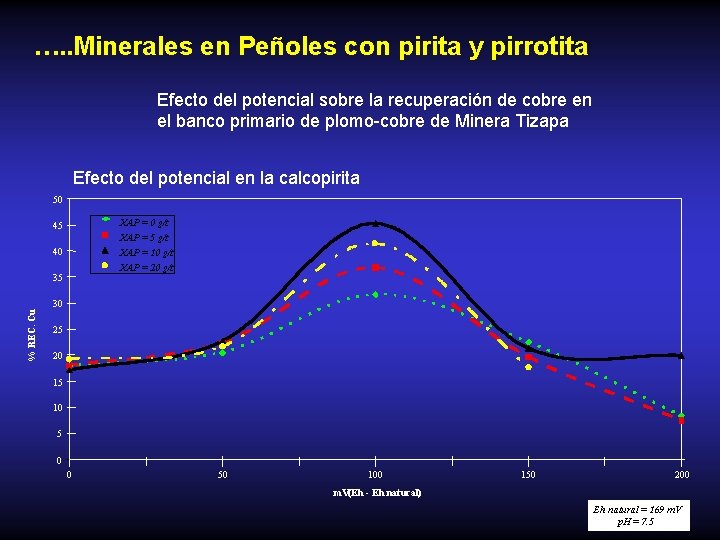
…. . Minerales en Peñoles con pirita y pirrotita Efecto del potencial sobre la recuperación de cobre en el banco primario de plomo-cobre de Minera Tizapa Efecto del potencial en la calcopirita 50 45 XAP = 0 g/t XAP = 5 g/t 40 XAP = 10 g/t XAP = 20 g/t % REC. Cu 35 30 25 20 15 10 5 0 0 50 100 150 200 m. V(Eh - Eh natural) Eh natural = 169 m. V p. H = 7. 5

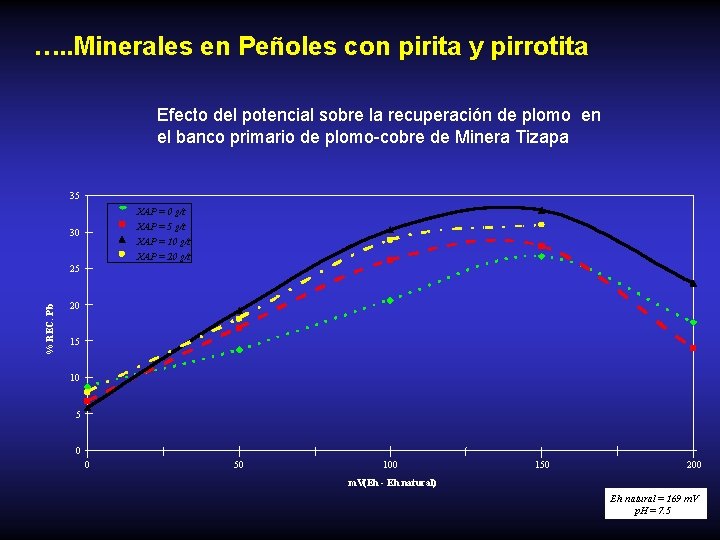
…. . Minerales en Peñoles con pirita y pirrotita Efecto del potencial sobre la recuperación de plomo en el banco primario de plomo-cobre de Minera Tizapa 35 XAP = 0 g/t XAP = 5 g/t 30 XAP = 10 g/t XAP = 20 g/t % REC. Pb 25 20 15 10 5 0 0 50 100 150 200 m. V(Eh - Eh natural) Eh natural = 169 m. V p. H = 7. 5

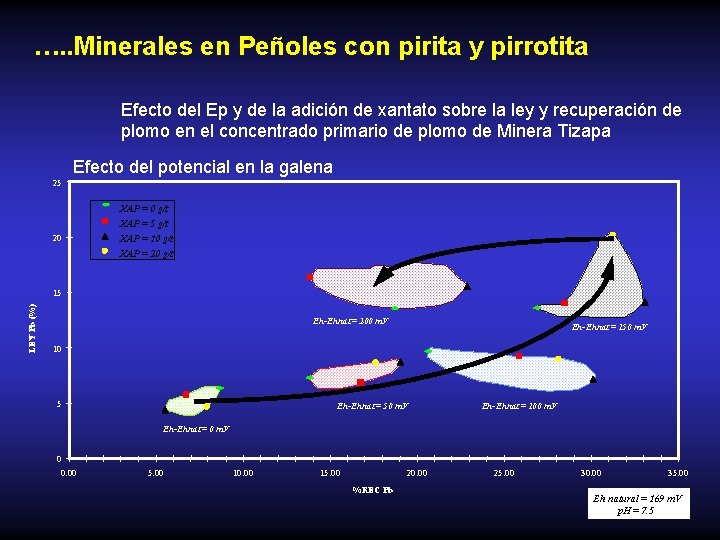
…. . Minerales en Peñoles con pirita y pirrotita Efecto del Ep y de la adición de xantato sobre la ley y recuperación de plomo en el concentrado primario de plomo de Minera Tizapa Efecto del potencial en la galena 25 XAP = 0 g/t XAP = 5 g/t 20 XAP = 10 g/t XAP = 20 g/t LEY Pb (%) 15 Eh-Ehnat Eh. Ehnat = 200 m. V Eh-Ehnat Eh. Ehnat = 150 m. V 10 5 Eh-Ehnat Eh. Ehnat = 50 m. V Eh-Ehnat Eh. Ehnat = 100 m. V Eh-Ehnat Eh. Ehnat = 0 m. V 0 0. 00 5. 00 10. 00 15. 00 20. 00 %REC Pb 25. 00 30. 00 35. 00 Eh natural = 169 m. V p. H = 7. 5

7. - Mecanismos de activación y desactivación de minerales… a) Oxidación de la superficie de la calcopirita para formar covelita y azufre elemental, (Cheng e Iwasaki, 1992): Cu. Fe. S 2 + 3 H 2 O Cu. S + Fe(OH)3 + S 0 + 3 H + + 3 e b) Reacción electroquímica entre el colector y la calcopirita o la covelita formada en la reacción previa, generando Cu(DTP)2. Cu. Fe. S 2 + 2 DTP - + 3 H 2 O Cu(DTP)2 + Fe(OH)3 + 2 S 0 +3 H + + 5 e Cu. S + 2 DTP - Cu(DTP)2 + S 0 + 2 e c) Descomposición de los colectores en la solución o de los productos hidrofóbicos en la superficie del mineral (azufre, dímeros de los colectores o colectores metálicos). Cu(DTP)2 + H 2 O Cu. O + 2 DTP - + 2 H + Cu(DTP)2 + H 2 O Cu. O + (DTP)2 + 2 H + + 2 e 2 S 0 + 3 H 2 O S 2 O 3 -2 + 6 H + + 4 e -

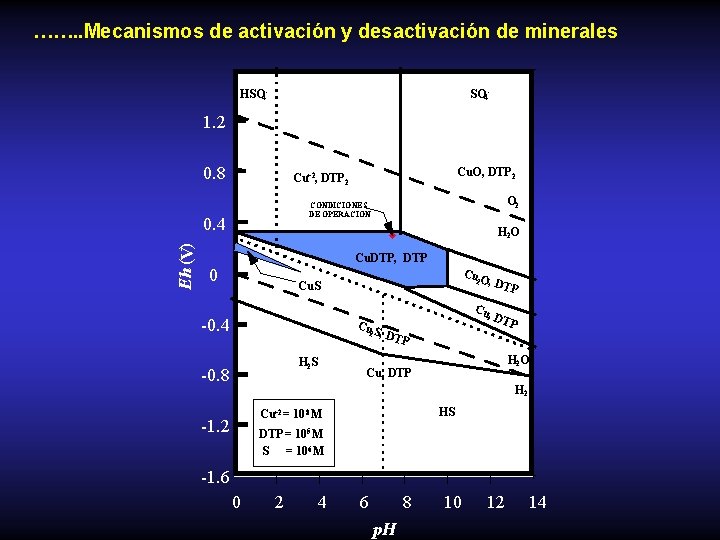
……. . Mecanismos de activación y desactivación de minerales HSO 4 - 1. 2 0. 8 O 2 CONDICIONES DE OPERACION 0. 4 Eh (V) Cu. O, DTP- 2 Cu+2, DTP- 2 H 2 O Cu. DTP, DTP 0 Cu O 2 , Cu. S -0. 4 Cu S 2 , H 2 S -0. 8 Cu, DTPDT DTP- P- H 2 O DTP- H 2 HS- Cu+2 = 10 -8 M -1. 2 DTP- = 10 -5 M S = 10 -6 M -1. 6 0 2 4 6 8 p. H 10 12 14

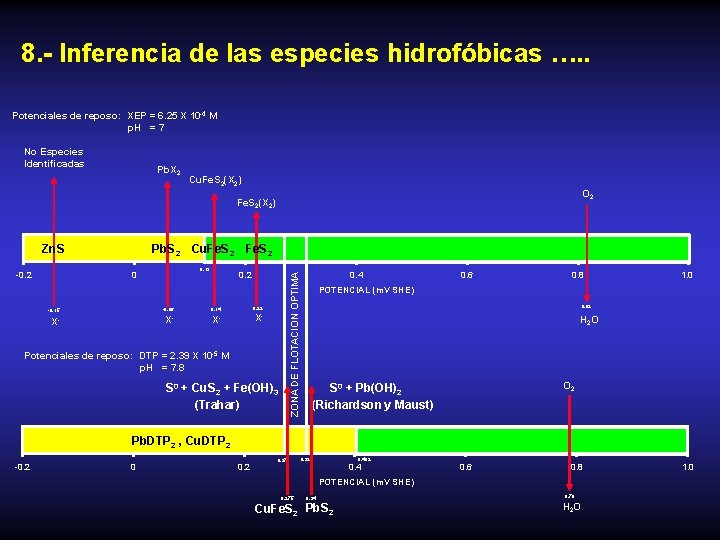
8. - Inferencia de las especies hidrofóbicas …. . Potenciales de reposo: XEP = 6. 25 X 10 -4 M p. H = 7 No Especies Identificadas Pb. X 2 Cu. Fe. S 2(X 2) O 2 Fe. S 2(X 2) -0. 2 Pb. S 2 Cu. Fe. S 2 0. 13 0 0. 2 -0. 15 -0. 06 0. 14 X- X- X- 0. 4 ZONA DE FLOTACION OPTIMA Zn. S 0. 22 X- Potenciales de reposo: DTP = 2. 39 X 10 -5 M p. H = 7. 8 S 0 + Cu. S 2 + Fe(OH)3 (Trahar) 0. 6 0. 8 1. 0 POTENCIAL (m. V SHE) 0. 82 H 2 O O 2 S 0 + Pb(OH)2 (Richardson y Maust) Pb. DTP 2 , Cu. DTP 2 -0. 2 0 0. 27 0. 32 0. 402 0. 4 0. 6 0. 8 POTENCIAL (m. V SHE) 0. 275 Cu. Fe. S 2 0. 34 Pb. S 2 0. 79 H 2 O 1. 0

CONCLUSIONES: • Las interacciones galvánicas entre los sulfuros minerales (y en especial la pirita) y el acero generan potenciales de pulpa muy reductores, y muy bajos niveles de oxígeno disuelto, totalmente inadecuados para la formación de productos hidrofóbicos sobre los minerales de interés. • El control del potencial de pulpa en el acondicionamiento químico previo a la flotación primaria en un valor de 250 m. V SHE permite activar selectivamente a la calcopirita y a 300 m. V SHE la galena presenta su activación máxima. • Se sugiere que las especies responsables del incremento en la recuperación de los minerales de interés sean los ditiofosfatos metálicos (i. e. , Me(DTP)2 ) y azufre elemental.
 Reacciones redox ejemplos
Reacciones redox ejemplos ülseratif pulpitis
ülseratif pulpitis Sekonder organlar
Sekonder organlar üst lateral giriş kavitesi
üst lateral giriş kavitesi Zona odontoblastica de la pulpa
Zona odontoblastica de la pulpa Parsiyel pulpotomi
Parsiyel pulpotomi Pulpa boynuzu
Pulpa boynuzu Sormen pulpa
Sormen pulpa Pulpitis polipoza
Pulpitis polipoza Fibras a delta y c pulpa
Fibras a delta y c pulpa Degeneración pulpar calcificante progresiva
Degeneración pulpar calcificante progresiva Organe limfoide periferice
Organe limfoide periferice Primer endodontik lezyon
Primer endodontik lezyon Gll. parathyroideae
Gll. parathyroideae Analisis del mercado potencial
Analisis del mercado potencial Descripcion de mercado
Descripcion de mercado Dr carlos morales
Dr carlos morales Postpotencial
Postpotencial Cadena de valor publico
Cadena de valor publico Tacto importancia
Tacto importancia Pib potencial colombia
Pib potencial colombia