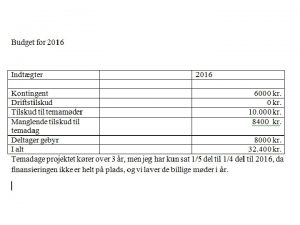
Hvad er redoxreaktioner Definition hvad er Spndingsrkke hvad
























- Slides: 29

Hvad er redoxreaktioner Definition – hvad er Spændingsrække – hvad er det Oxidationstal http: //www. fysik 7. dk/index. php/840 -metaller-ogkorrosion Tradium – Randers Malerskole

En redox reaktion er, når der sker en flytning af elektroner fra et atom til et andet. Det er en helt naturlig proces der sker overalt omkring os. Ruster jern, så er der i virkeligheden tale om, at elektroner flyttes og materialet (atomet) forringes. Her ses en rusten jernplade Tradium – Randers Malerskole

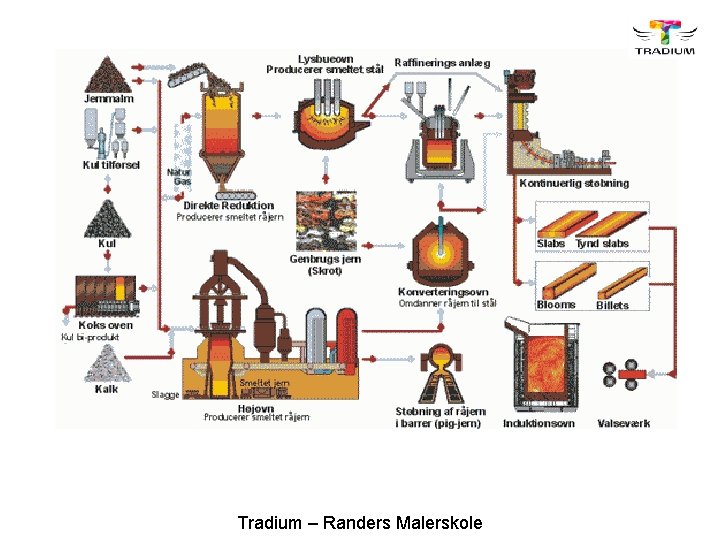
Jern er ikke et rent metal man kan finde i naturen. Det findes typisk som malm der brydes fra bjerge. Malmen varmes op til en temperatur hvor jernet kan smelte fra, og det bliver herefter samlet til hele stykker rå-jern. Rå-jernet bliver typisk tilsat forskellige stoffer/metaller for at lave det om til det som vi så skal bruge. Noget er hårdt – drejning/fræsning Noget er blødt – formgives Noget kan svejses – OSV. Tradium – Randers Malerskole

Tradium – Randers Malerskole

Jern i metervis. Når jernet er forarbejdet vil jernet gerne vende tilbage til sit udgangspunkt. Dette er jernmalm eller rust. Jern atomet er ustabilt og påvirkes let af andre atomer. Dette kaldes for en redox reaktion. Tradium – Randers Malerskole

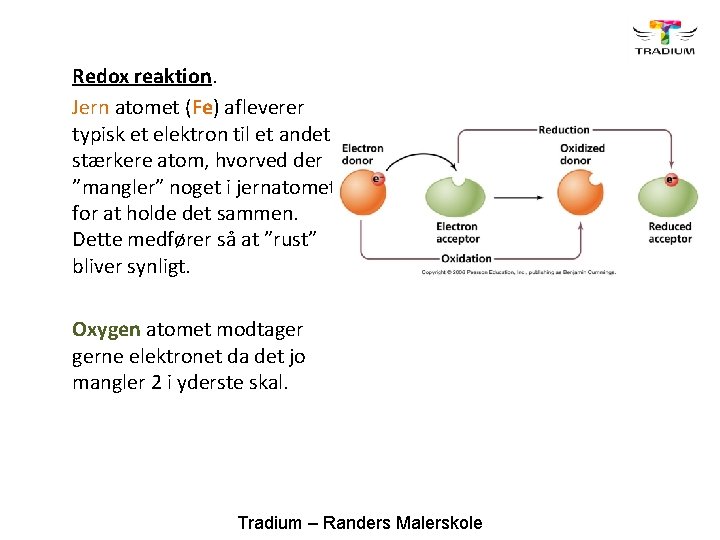
Redox reaktion. En redox reaktion er et sammensat ord af REDuktion og OXidation. Dette forklares ved den måde hvor atomerne afleverer eller modtager elektroner på. Tradium – Randers Malerskole

Redox reaktion. Jern atomet (Fe) afleverer typisk et elektron til et andet stærkere atom, hvorved der ”mangler” noget i jernatomet for at holde det sammen. Dette medfører så at ”rust” bliver synligt. Oxygen atomet modtager gerne elektronet da det jo mangler 2 i yderste skal. Tradium – Randers Malerskole

Redox reaktion. Dette er et stort problem for os i hverdagen, men et problem vi kan gøre noget ved. Vi kan f. eks. Overflade behandle jern så denne flytning af elektroner ophører, og dette er grunden til at vi galvaniserer eller maler jern. Tradium – Randers Malerskole

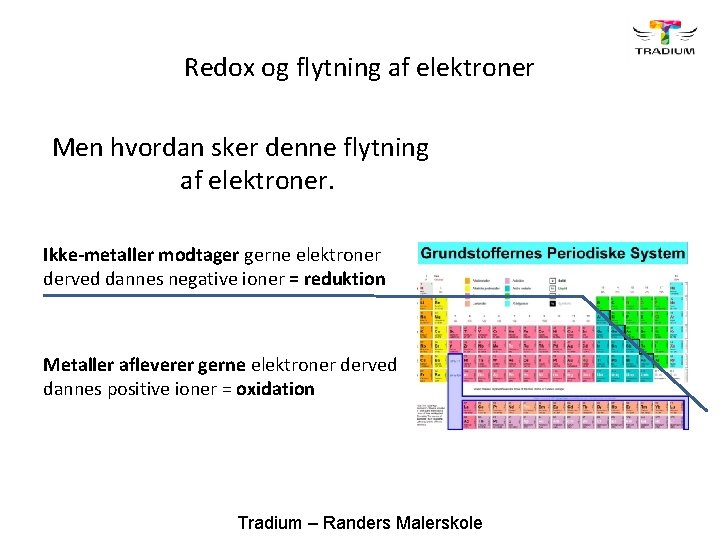
Redox og flytning af elektroner Men hvordan sker denne flytning af elektroner. Ikke-metaller modtager gerne elektroner derved dannes negative ioner = reduktion Metaller afleverer gerne elektroner derved dannes positive ioner = oxidation Tradium – Randers Malerskole

Oxidation og reduktion Metaller afleverer gerne elektroner derved dannes positive ioner = oxidation Et jern atom (Fe) har 2 elektroner i yderste skal, og mister det et af disse elektroner, så bliver atomet samlet set positivt, da det negative elektron forsvinder. Jern atomet skrives derfor som Jern+ eller Fe+ (Fe plus) Ikke-metaller som oxygen, der jo mangler 2 elektroner i yderste skal, modtager gerne elektroner derved dannes negative ioner = reduktion Dette gør så at oxygen atomet (O) bliver negativt ladet, da det jo nu har flere negative end positive ladninger. Så skrives oxygen atomet som O- (O minus) Tradium – Randers Malerskole

Oxidation og reduktion Det er det samme der sker når man brænder f. eks. Flaskegas eller lightergas af. Så sker der også en redox reaktion. F. eks. Kan en forbrændingsreaktion skrives således: CH 4 + O 2 → CO 2 + H 2 O Methan gas bliver brændt af sammen med oxygen og bliver til kuldioxid (gas) og vand damp (gas). Her er der også bare tale om flytning af elektroner. Tradium – Randers Malerskole

Redoxreaktion Når jern ruster: Herved reagerer oxygen med jern (Fe) og danner jernoxid) (Jern) Fe + O (oxygen) → Fe. O (jernoxid = rust) Tradium – Randers Malerskole

Reaktion mellem metal og ikke-metal Hvad kan vi så gøre ved det: Vi kan gennem vores viden omkring metallers ”lyst” til at aflevere og ikke metaller ”lyst” til at modtage elektroner, prøve om vi kan forhindre dette. Det kan vi f. eks. Gøre ved at overfladebehandle jernet, så oxygen atomerne ikke kan nå ind til jernet og stjæle elektroner. Eller ved f. eks. At behandle jernet med et offer metal som f. eks. Zink. Dette kaldes typisk for en galvanisering. Herved bliver zinken angrebet før jernet, og jernet forbliver uskadt længere. Tradium – Randers Malerskole

skibsindustri • Skibsskrog med zinkklodser: Tradium – Randers Malerskole

Frihedsgudinden • Opført: 1875 -1884 Hun er lavet af jern og kobber, hvor skelettet er lavet af jern, og hendes ydre er kobber. Kobberbeklædningen er 2, 37 cm tyk og vejer 31 tons Tradium – Randers Malerskole

Reaktion mellem metal og ikke-metal Maling med rust beskyttende maling = korrosionshindrende maling. Skal man male jern (metaller generelt) så skal man selvfølgelig sørge for at metallet er rent. Dette gøres ved slibning/rensning, hvor metallet umiddelbart efter grundes med en maling med masser af zink støv i. Zinken modvirker at metallet afleverer elektroner, så her virker zink beskyttende/offermetal. Der findes mange forskellige producenter af korrosionshindrende malinger. Læs etiketten før du maler. Tradium – Randers Malerskole

Reaktion mellem metal og ikke-metal Galvanisering af metal: Vælger man at galvanisere metal, så sker dette på en fabrik, før montage. Her ”dyppes” metal emnet i en zink rig væske og der sættes ”strøm/spænding” til. Dette medfører at zinken bliver tiltrukket til metallet hvorefter zinken danner et fladedækkende lag ovenpå. Tradium – Randers Malerskole

Reaktion mellem metal og ikke-metal Galvanisering af metal: Når det galvaniserede metal så kommer ud i luften reagerer zinken med oxygen hvorved der dannes en slags sæbe. Denne zink sæbe beskytter nu metallet. Tradium – Randers Malerskole

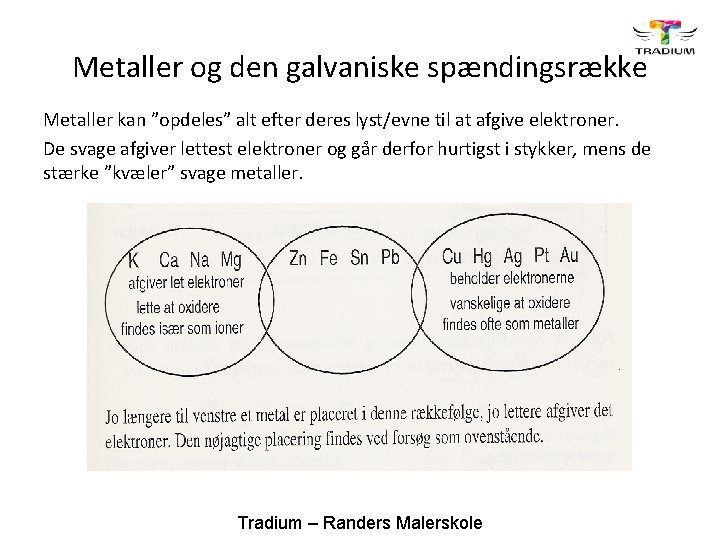
Metaller og den galvaniske spændingsrække Metaller kan ”opdeles” alt efter deres lyst/evne til at afgive elektroner. De svage afgiver lettest elektroner og går derfor hurtigst i stykker, mens de stærke ”kvæler” svage metaller. Tradium – Randers Malerskole

Spændingsrækken Tradium – Randers Malerskole

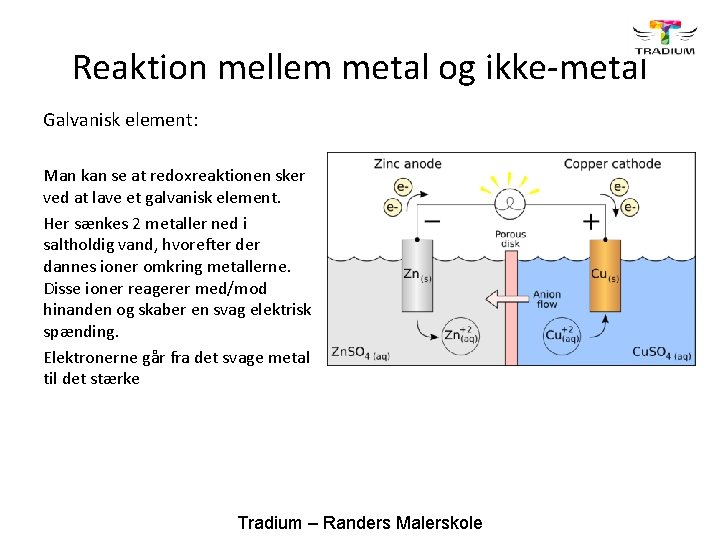
Reaktion mellem metal og ikke-metal Galvanisk element: Man kan se at redoxreaktionen sker ved at lave et galvanisk element. Her sænkes 2 metaller ned i saltholdig vand, hvorefter dannes ioner omkring metallerne. Disse ioner reagerer med/mod hinanden og skaber en svag elektrisk spænding. Elektronerne går fra det svage metal til det stærke Tradium – Randers Malerskole

Oxidation • Der afgives elektroner Derved øges ionladning og/eller oxidationstal (OT) Tradium – Randers Malerskole

Reduktion • Der optages elektroner derved mindskes Ionens ladning og/eller der er fald i oxidationstal (OT) Tradium – Randers Malerskole

Overførsel af elektroner: • misfarvning af sølv (½ min) • Elektronoverførsler (½ min) Tradium – Randers Malerskole

Tildelingen af oxidationstal: Alle metaller i det periodiske system har et tal for deres evne til at afgive eller modtage elektroner. Dette kaldes for et oxidationstal. De ”rene” grundstoffer som Na, Cl 2, O 2, Fe, C har alle et oxidationstal på 0 Her er der ikke sket noget. Tradium – Randers Malerskole

Eksempler på tildeling af oxidationstal: Bliver atomerne sat sammen og der dannes ioner, så opstår der forskelle. Det atom der modtager elektronet bliver negativt ladet = flere elektroner. Det atom der afleverer bliver mere positivt ladet = færre elektroner. • Man siger at - atom-ioner har alle OT = ionens ladning • Na+, Cl-, Mg 2+ , O 2 - , Al 3+ , Fe 2+ , Fe 3+ , Cu 1+ , Cu 2+ • (Natrium har her Na+ hvilket betyder at det har afleveret et elektron – Cl- har modtaget) Tradium – Randers Malerskole

Tildeling af oxidationstal • Regler for tildeling af oxidationstal: • Når H er bundet til et mere elektronegativt grundstof, har H atomet oxidationstallet +I (pr. stk). • Når O er bundet til et mindre elektronegative grundstoffer, har O-atomet oxidationstallet –II (pr. stk). • Summen af oxidationstallene er lig med formelenhedens ladning. Her er sulfat valgt som eksempel. Svovl atomet får her oxidationstallet 6+ da oxygen har 8 - og den totale ladning er -2 Tradium – Randers Malerskole

Eksempler på tildeling af oxidationstal: • For sammensatte ioner og molekyler gælder: Summen af oxidationstallene er lig med formelenhedens ladning Ex: Tradium – Randers Malerskole

spændingsrækken • første eksempel spændingsrækken • Kobber og zink (varer ca. 7 min) • Kartoffel batteri: (varer ca. 6 min) Tradium – Randers Malerskole
 Oxidationstal regler
Oxidationstal regler Lad os tale om det frit
Lad os tale om det frit Sop problemformulering hhx
Sop problemformulering hhx Interaktionsdesign definition
Interaktionsdesign definition Hvad hedder de tre lag i 3-lags arkitekturen?
Hvad hedder de tre lag i 3-lags arkitekturen? Problemløsningsmodel
Problemløsningsmodel Vehikelbåren smitte
Vehikelbåren smitte Københavnervæg
Københavnervæg Hvad er samarbejde
Hvad er samarbejde Kvasitekniske
Kvasitekniske Jeg-støttende sygepleje 12 principper
Jeg-støttende sygepleje 12 principper Hvad render du og laver
Hvad render du og laver Organisationskultur
Organisationskultur Oee måling
Oee måling Fordybelsesområder dansk eksempler
Fordybelsesområder dansk eksempler Asymmetrisk kommunikation
Asymmetrisk kommunikation Hvad er et undersøgelsesdesign
Hvad er et undersøgelsesdesign Gammastråling bølgelængde
Gammastråling bølgelængde Lille guds barn tekst
Lille guds barn tekst Hvad er tredjepartslogistikk
Hvad er tredjepartslogistikk Porters generiske strategier
Porters generiske strategier Distributionskæde
Distributionskæde Kundetyper systime
Kundetyper systime Hvad er speditionsomkostninger
Hvad er speditionsomkostninger Hvad er iso 27001
Hvad er iso 27001 Hvad menes der med et handicapresultat?
Hvad menes der med et handicapresultat? Indfak au
Indfak au Ics skema
Ics skema Hvad er epos
Hvad er epos Hvad er retorik
Hvad er retorik