Redoxreaktioner Sid 313 323 I hftet Elektrisk strm



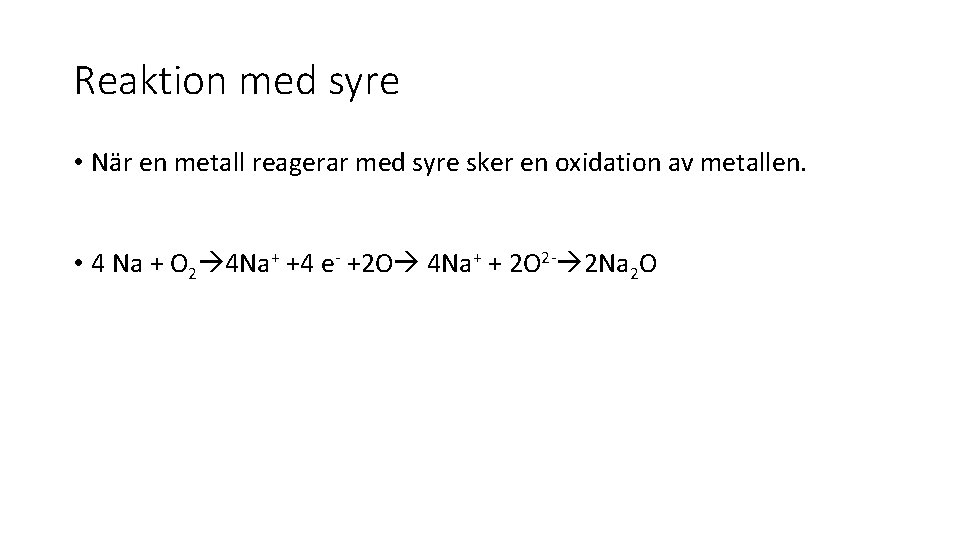













- Slides: 21

Redoxreaktioner Sid 313 -323 I häftet

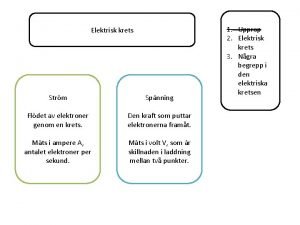
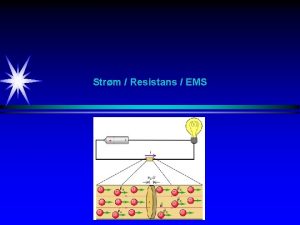
Elektrisk ström • Elektrisk ström är elektroner i rörelse • Denna fördjupningskurs handlar bland annat om hur batterier fungerar. • Ett galvaniskt element är ett batteri • Nästa föreläsning kommer att handla om hur man kan driva reaktioner med hjälp av elektricitet, sk elektrolys. • I grunden handlar det om hur vissa ämnen gärna lämnar ifrån sig elektroner medan andra hellre tar emot dem.

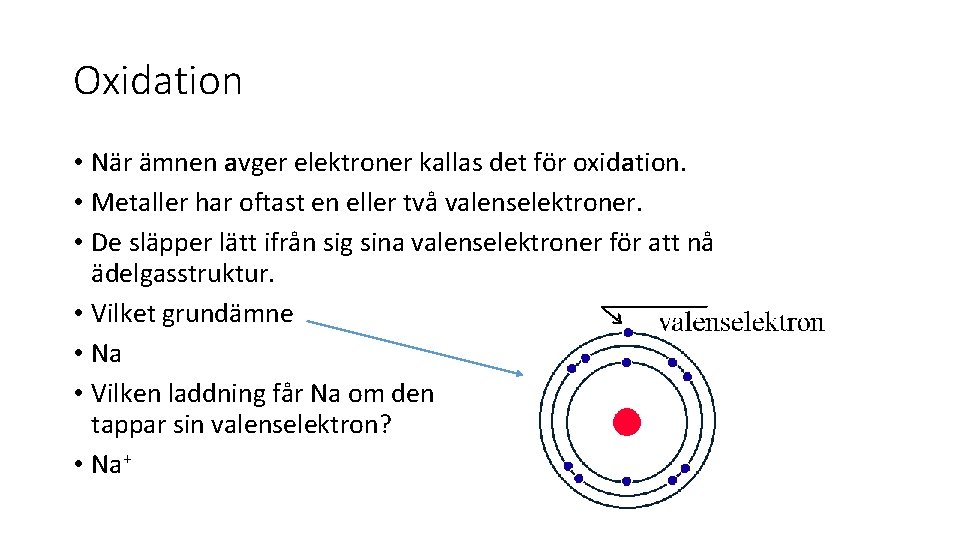
Oxidation • När ämnen avger elektroner kallas det för oxidation. • Metaller har oftast en eller två valenselektroner. • De släpper lätt ifrån sig sina valenselektroner för att nå ädelgasstruktur. • Vilket grundämne • Na • Vilken laddning får Na om den tappar sin valenselektron? • Na+

Syreatomen
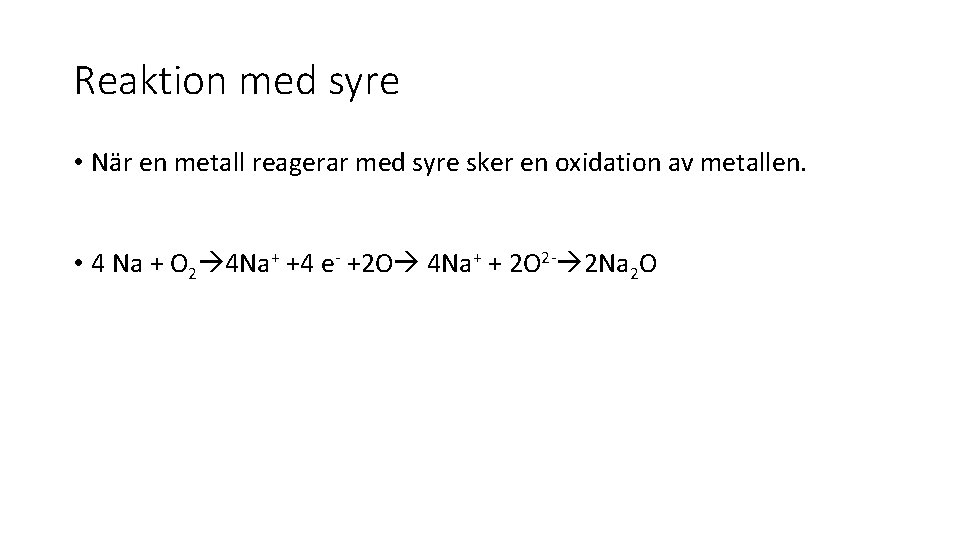
Reaktion med syre • När en metall reagerar med syre sker en oxidation av metallen. • 4 Na + O 2 4 Na+ +4 e- +2 O 4 Na+ + 2 O 2 - 2 Na 2 O

Reduktion • När en atom upptar elektroner kallas det för reduktion • T. ex. när syremolekylen O 2 tar upp fyra elektroner och bildar 2 syrejoner. • O 2 + 4 e- 2 O 2 • Syre har reducerats • Dvs syret har tagit emot elektroner • Ordet reduktion betyder ”minska” • Syrets laddning har minskat från 0 ( neutralt ) till -2

Oxidation + Reduktion = REDOX • För att ett ämne ska lämna ifrån sig elektroner förutsätter det att något annat ämne tar emot elektronerna. • För att ett ämne ska oxideras måste ett annat ämne reduceras. • Därför sker alltid dessa reaktioner samtidigt. • Reaktionen kallas därför REDOX • REDOX reaktion

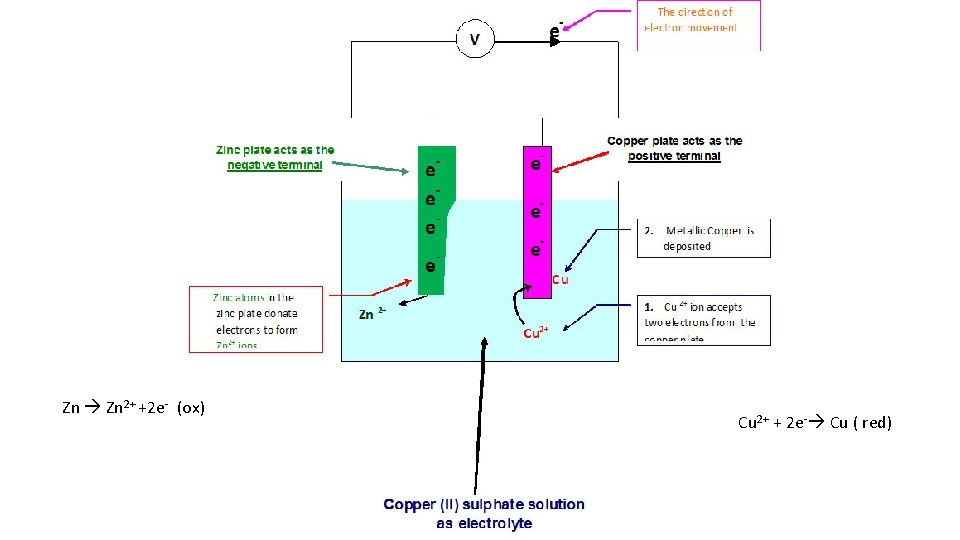
REDOX mellan zink och koppar • Ett zinkbleck sätts ned i en lösning med kopparjoner. • Zinkmetallen släpper ifrån sig elektroner som tas upp av kopparjonerna. • Zinkblecket får en beläggning av koppar • Zink oxideras och kopparjonerna reduceras • REDOX

Ädlare metaller tar elektroner från oädlare metaller • Väte är ingen metall • En metall som befinner sig till vänster om väte kommer att släppa ifrån sig elektroner om vi sätter ned metallen i en syra. • Metallen oxideras • Väte i syran reduceras • Det bildas vätgas • Ämnen långt till vänster är starka reduktionsmedel

Förutsäga en reaktion • Aluminiummetall och silverjoner • Silver är ädlare än Aluminium • Al + 3 Ag+ Al 3+ +3 Ag • Aluminium oxideras • Silverjoner reduceras • REDOX • Aluminiumjoner och silvermetall • Al 3+ +Ag • I denna situation är silver redan i metallform. ( grundämne) • Silver kommer inte att bli en negativ jon. • Det händer ingenting

Oädel metall + ädelmetall i jonform= REDOX • Det krävs alltså en oädel metall och en ädlare metall. • Den ädla metallen måste vara i jonform för att en reaktion ska ske • Fe + Cu 2+ Fe 2+ + Cu • Men • Fe 2+ + Cu ger ingen reaktion

Galvanisk korrosion och offeranoder • Vi har redan berört dessa ämnen tidigare i kursen. • Använd elektrokemiska spänningsserien och förklara • Ge ett exempel på galvanisk korrosion. • Ge ett exempel på en offeranod.

Batterier Redoxreaktioner som ger ström • Principen för ett galvaniskt element: • Två metaller som ligger långt ifrån varandra på elektrokemiska spänningsserien. • En jonlösning som elektronerna kan röra sig igenom. • Sladdar och en lampa

Ett alkaliskt batteri • Det kallas alkaliskt batteri eftersom elektrolyten är basisk. • Pluspolen är en kolstav med ett tunt lager mangandioxid. • Minuspol är zink • Zn Zn 2+ +2 e- ( ox) • Mn 2+ +2 e- Mn ( red) • Batteriet slutar leverera ström när manganjonerna tar slut.

Zn Zn 2+ +2 e- (ox) Cu 2+ + 2 e- Cu ( red)

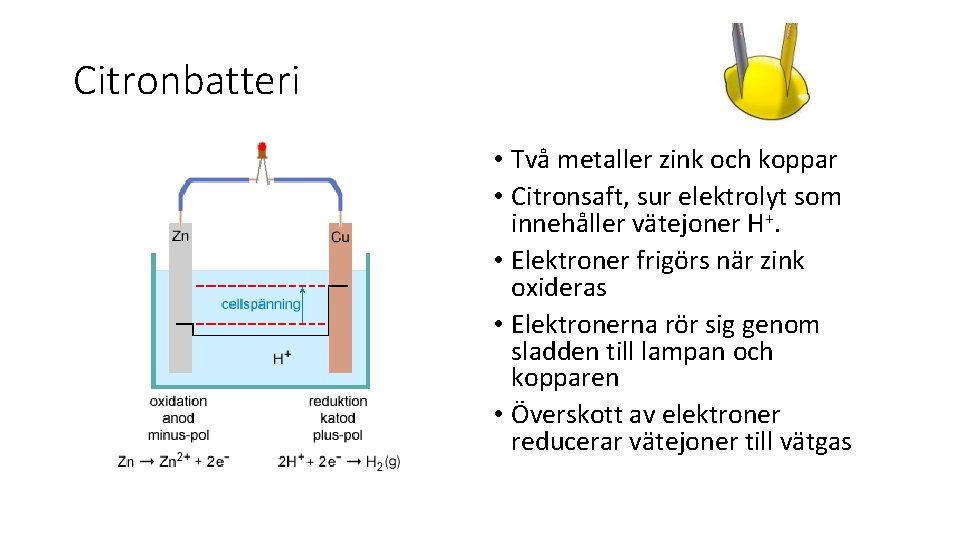
Citronbatteri • Två metaller zink och koppar • Citronsaft, sur elektrolyt som innehåller vätejoner H+. • Elektroner frigörs när zink oxideras • Elektronerna rör sig genom sladden till lampan och kopparen • Överskott av elektroner reducerar vätejoner till vätgas

Forskning pågår • Ett problem med dagens energiförsörjning är svårigheten att lagra energi. • Vi använder i allmänhet mer energi på dagen än på natten. • Den energi vi får från vattenkraft eller kärnkraft går för fullt dygnet runt. • Vi skulle kunna spara energi om vi kunde lagra den bättre. • Forskning för att framställa bättre batterier pågår för fullt. • Ett effektivt batteri är t. ex. lithium-jon batterier (Li-jon-cell) som t. ex. finns i mobiltelefoner. • Man forskar särskilt på hur snabbt man kan ladda t. ex. ett batteri till en elbil

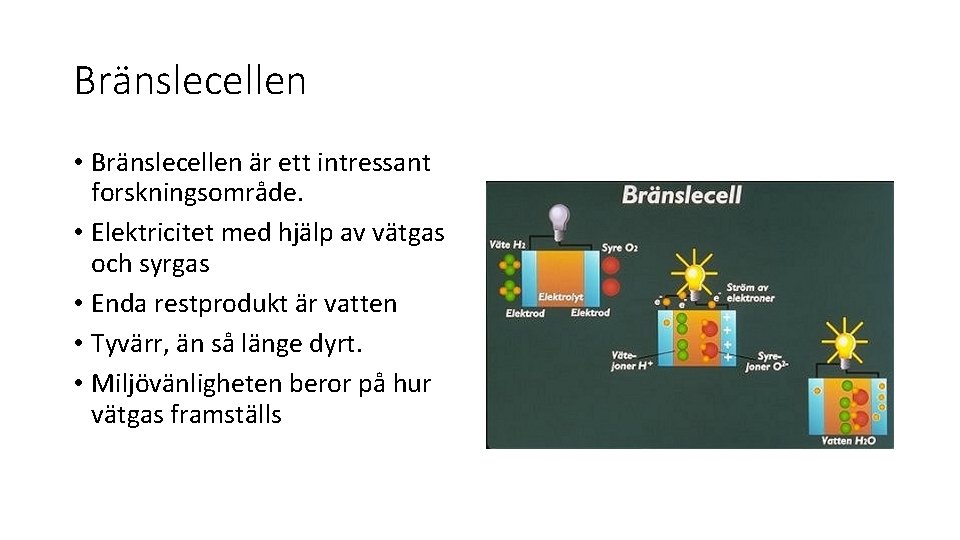
Bränslecellen • Bränslecellen är ett intressant forskningsområde. • Elektricitet med hjälp av vätgas och syrgas • Enda restprodukt är vatten • Tyvärr, än så länge dyrt. • Miljövänligheten beror på hur vätgas framställs

Primär- och sekundärbatteri • Ett primärbatteri kan inte laddas upp på nytt. • Ett sekundärbatteri är laddningsbart. • Ett annat ord som används för ett laddningsbart batteri är ackumulator. • Bilbatterier kallas även ackumulatorer. • Traditionella bilbatterier sk blyackumulatorer använder Bly och blyoxid som minus och pluspol. Elektrolyten består av H 2 SO 4 • Därför är återvinning av blyackumulatorer särskilt viktig.

Luigi Galvani och Alessandro Volta • Luigi Galvani upptäckte att om man vidrörde en nerv på en död groda med ett instrument av järn och mässing så rykte en muskel till. • Alessandro Volta byggde vidare på Galvanis forskning och presenterade det första batteriet omkring år 1800 • Voltas stapel • Forskningsmetoderna kunde vara direkt livsfarliga.

Voltas stapel • Runda skivor av koppar • Rund skivor av zink • Papper indränkt med en syra