Grundlagen der Elektrochemie Wiederholung 1 Elektrochemische Thermodynamik Was














- Slides: 24

Grundlagen der Elektrochemie Wiederholung 1. Elektrochemische Thermodynamik: Was ist erlaubt? 2. Elektrochemische Doppelschicht: Der Ort des Geschehens! Später, im Laufe der Vorlesung: 3. Elektrochemische Kinetik: Ist der Prozess schnell oder gehemmt? 4. Transportprozesse: Wie kommen die Ionen zur Grenzfläche? FU Berlin Constanze Donner / Ludwig Pohlmann 2017 1

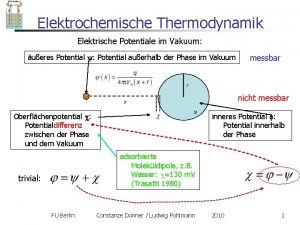
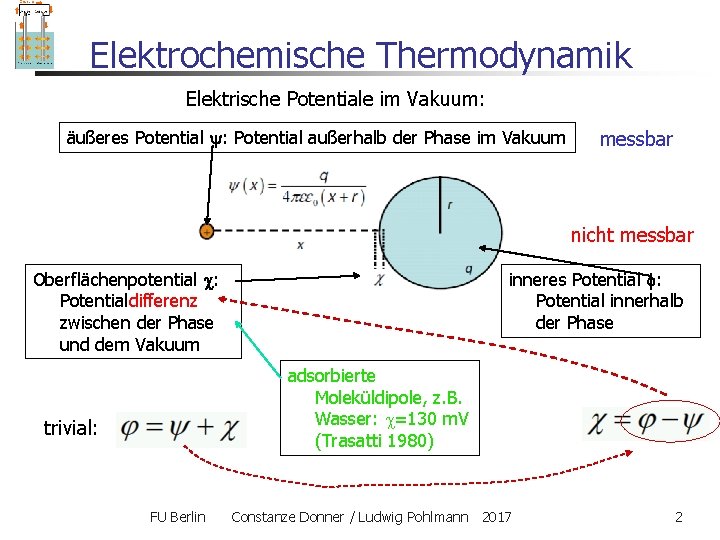
Elektrochemische Thermodynamik Elektrische Potentiale im Vakuum: äußeres Potential : Potential außerhalb der Phase im Vakuum messbar nicht messbar Oberflächenpotential : Potentialdifferenz zwischen der Phase und dem Vakuum inneres Potential : Potential innerhalb der Phase adsorbierte Moleküldipole, z. B. Wasser: =130 m. V (Trasatti 1980) trivial: FU Berlin Constanze Donner / Ludwig Pohlmann 2017 2

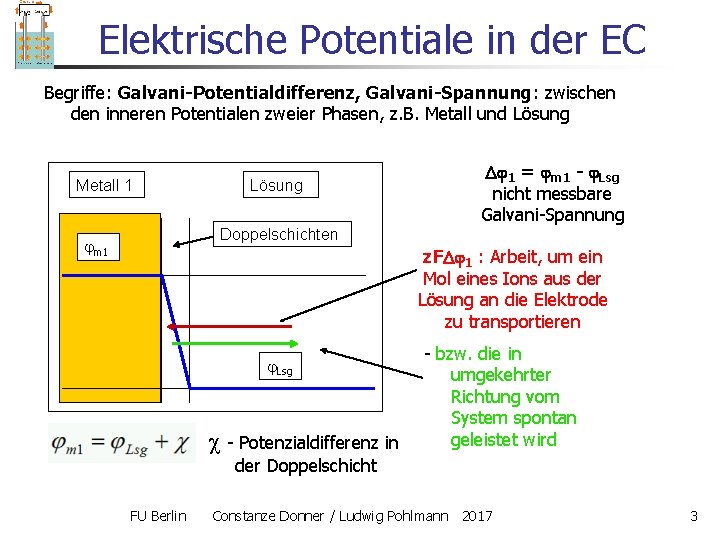
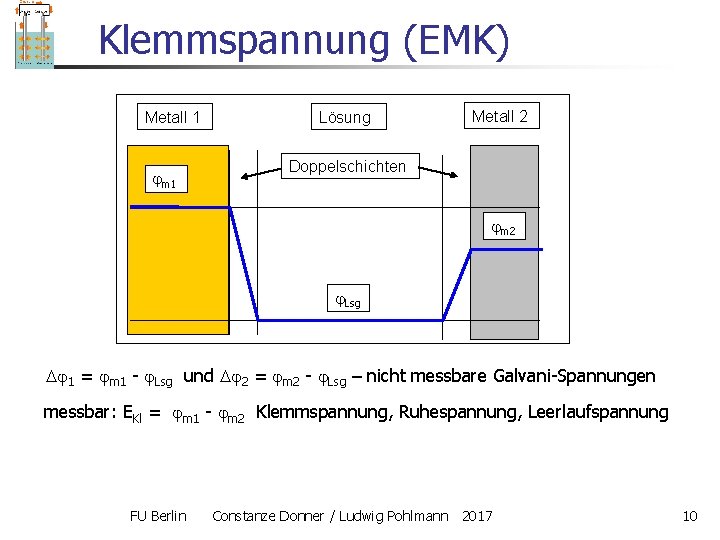
Elektrische Potentiale in der EC Begriffe: Galvani-Potentialdifferenz, Galvani-Spannung: zwischen den inneren Potentialen zweier Phasen, z. B. Metall und Lösung Metall 1 Lösung 1 = m 1 - Lsg nicht messbare Galvani-Spannung Doppelschichten m 1 z. F 1 : Arbeit, um ein Mol eines Ions aus der Lösung an die Elektrode zu transportieren Lsg - Potenzialdifferenz in - bzw. die in umgekehrter Richtung vom System spontan geleistet wird der Doppelschicht FU Berlin Constanze Donner / Ludwig Pohlmann 2017 3

Chemisches Potential Das chemische Potential ist das thermodynamische Maß für die „Neigung“ eines Stoffes (Ions, Elektrons), sich: - mit anderen Stoffen umzusetzen - gleichmäßig zu verteilen - in eine andere Phase umzuwandeln Jeder spontan ablaufende Prozess verläuft immer vom höheren chemische Potential zum niedrigeren – die Änderung der freien Enthalpie G (Gibbssche freie Energie) ist also immer negativ: Einheit: J/mol z. B. : H 2 , O 2 : 0 H 2 O: -237 C 6 H 6: 125 J. W. Gibbs (1839 -1909) spontan! FU Berlin Constanze Donner / Ludwig Pohlmann 2017 4

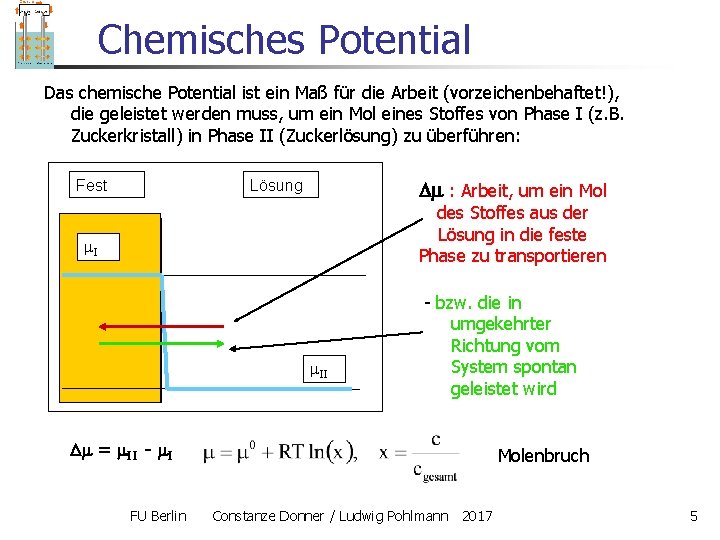
Chemisches Potential Das chemische Potential ist ein Maß für die Arbeit (vorzeichenbehaftet!), die geleistet werden muss, um ein Mol eines Stoffes von Phase I (z. B. Zuckerkristall) in Phase II (Zuckerlösung) zu überführen: Fest Lösung : Arbeit, um ein Mol des Stoffes aus der Lösung in die feste Phase zu transportieren I II - bzw. die in umgekehrter Richtung vom System spontan geleistet wird = II - I FU Berlin Molenbruch Constanze Donner / Ludwig Pohlmann 2017 5

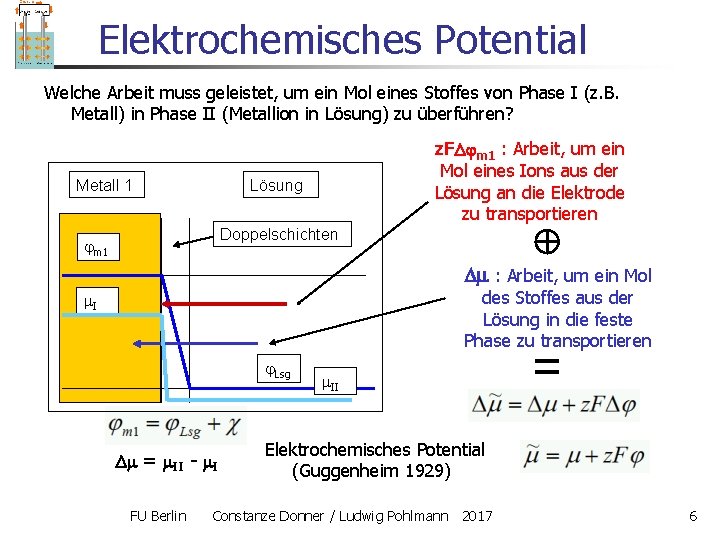
Elektrochemisches Potential Welche Arbeit muss geleistet, um ein Mol eines Stoffes von Phase I (z. B. Metall) in Phase II (Metallion in Lösung) zu überführen? Metall 1 z. F m 1 : Arbeit, um ein Mol eines Ions aus der Lösung an die Elektrode zu transportieren Lösung Doppelschichten m 1 : Arbeit, um ein Mol des Stoffes aus der Lösung in die feste Phase zu transportieren I Lsg = II - I FU Berlin II Elektrochemisches Potential (Guggenheim 1929) Constanze Donner / Ludwig Pohlmann 2017 6

Nernst-Gleichung Welches Potential stellt sich im Gleichgewicht an der Phasengrenze ein? Bedingung für das thermodynamische Gleichgewicht bei p, T = const. : Die freie Enthalpie G befindet sich im Minimum, d. h. G = 0 Beispiel: monomolekulare Reaktion Gleichheit der chemischen Potentiale von Ausgangsstoff und Reaktionsprodukt MWG FU Berlin Constanze Donner / Ludwig Pohlmann 2017 7

Nernst-Gleichung Welches Potential stellt sich im Gleichgewicht an der Phasengrenze ein? . Beispiel: Metallabscheidung: Gleichheit der chemischen Potentiale von Ausgangsstoff und Reaktionsprodukt also: Umstellung nach der Galvanispannung: Standard-Galvanispannung und Nernst-Gleichung für das Gleichgewichts. Galvani-Potential einer Metallionenelektrode bzw. FU Berlin Constanze Donner / Ludwig Pohlmann 2017 8

Nernst-Gleichung Welches Potential stellt sich im Gleichgewicht an der Phasengrenze ein? . Beispiel: Redoxreaktion an inerter Elektrode : ergibt eine Nernst-Gleichung der Form: Achtung: Die so ermittelten Gleichgewichtspotentiale beziehen sich auf eine Halbzelle und sind deshalb nicht messbar! Messbar ist die Klemmspannung einer elektrochemischen Zelle, d. h. die Differenz der Gleichgewichtspotentiale der beiden Halbzellen! FU Berlin Constanze Donner / Ludwig Pohlmann 2017 9

Klemmspannung (EMK) Metall 1 m 1 Lösung Metall 2 Doppelschichten m 2 Lsg 1 = m 1 - Lsg und 2 = m 2 - Lsg – nicht messbare Galvani-Spannungen messbar: EKl = m 1 - m 2 Klemmspannung, Ruhespannung, Leerlaufspannung FU Berlin Constanze Donner / Ludwig Pohlmann 2017 10

Geschichte galvanischer Zellen Volta 1800 eine Reihe von hintereinander geschalteten galvanischen Zellen. 1838 Daniell Element Batterie Voltasche Säule Vorläufer heutiger Batterien Grove Brennstoffzelle 1838 FU Berlin Constanze Donner / Ludwig Pohlmann 2017 11

Gleichgewicht ≠ Gleichgewicht Das elektrochemische Gleichgewicht ist nicht das chemische Gleichgewicht! Wenn G < 0, dann bewegt sich das System spontan zum Gleichgewicht Bewegungsrichtung: immer so, dass die Triebkraft der Bewegung verringert wird (1) Chemisches Gleichgewicht: • Auflösung von Zucker: solange, bis die Lösung gesättigt ist, also die Differenz der chemischen Potentiale Null wird • rein hypothetisch vergessen wir mal die Ladungen bei der Auflösung eines einzelnen Kupferblechs: läuft solange, bis die Lösung mit Cu. SO 4 gesättigt ist FU Berlin Constanze Donner / Ludwig Pohlmann 2017 12

Gleichgewicht ≠ Gleichgewicht (1) Elektrochemisches Gleichgewicht: • elektrochemische Auflösung von Kupfer: mit jedem Ion Cu 2+, welches in Lösung geht, lädt sich die Metalloberfläche um zwei Elektronen negativer auf: • -> Prozess läuft solange, bis der wachsende Potentialabfall in der Doppelschicht eine weitere Auflösung verhindert, d. h. die elektrochemische Potentialdifferenz Null wird • da ist aber noch lange nicht die Sättigungskonzentration erreicht! die freie Enthalpie des Systems im elektrochemischen GG liegt weit über dem Enthalpieminimum im Falle des chemischen GG! das chemische GG kann nur erreicht werde, wenn es gelingt, die Potentialdifferenz durch Kurzschließen der beiden Seiten der Grenzschicht zu beseitigen: das gelingt aber nur mit einer zweiten Elektrode: das aber ist ein galvanisches Element, die Energiedifferenz zwischen elektrochemischem und chemischen GG ist gleich der elektrischen Nutzenergie, die der Batterie entnommen werden kann!! FU Berlin Constanze Donner / Ludwig Pohlmann 2017 13

Alternative Ableitung des elektrochemischen Potentials Gibbsche Fundamentalgleichung (erweitert für den Term des Phasentransfers geladener Teilchen) für eine Phase: chemisches Potential FU Berlin Galvanipotential Constanze Donner / Ludwig Pohlmann 2017 14

Alternative Ableitung… Gibbsche Fundamentalgleichung (erweitert für den Term des Phasentransfers geladener Teilchen) für eine Phase: Elektrische Arbeit Ladungsänderungen sind stets mit Stoffmengen Änderungen verbunden! Elektrochemisches Potential: FU Berlin Constanze Donner / Ludwig Pohlmann 2017 15

Nernstsche Gleichung GGW Kriterien: dg < 0 : freiwilliger Prozess , z. B. Batterie dg > 0 : erzwungener Prozess , z. B. Metallabscheidung FU Berlin Constanze Donner / Ludwig Pohlmann 2017 16

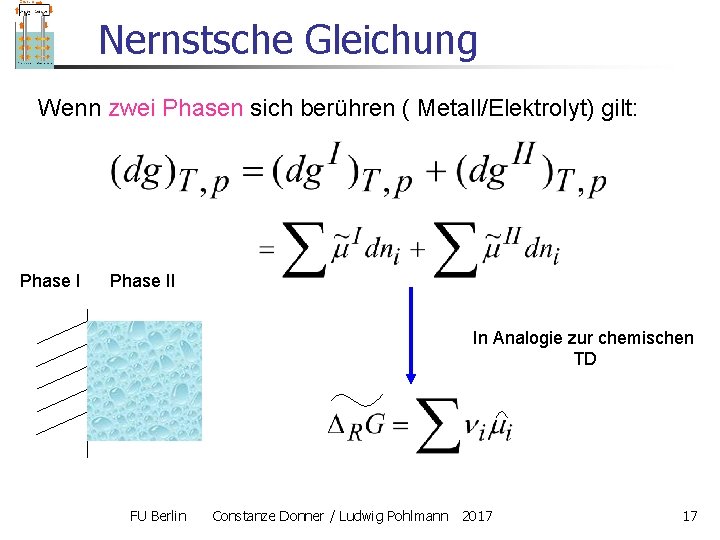
Nernstsche Gleichung Wenn zwei Phasen sich berühren ( Metall/Elektrolyt) gilt: Phase II In Analogie zur chemischen TD FU Berlin Constanze Donner / Ludwig Pohlmann 2017 17

Nernstsche Gleichung Im elektrochemischen Gleichgewicht gilt: bzw: Dies bedeutet für zwei aneinandergrenzende Phasen im GGW: und FU Berlin Constanze Donner / Ludwig Pohlmann 2017 18

Nernstsche Gleichung z ist positiv für Red Ox Per Konvention Gleichgewichtsgalvanispannung Nernstsche Gleichung für eine Halbzelle bzw. Elektrode/Elektrolyt FU Berlin Constanze Donner / Ludwig Pohlmann 2017 19

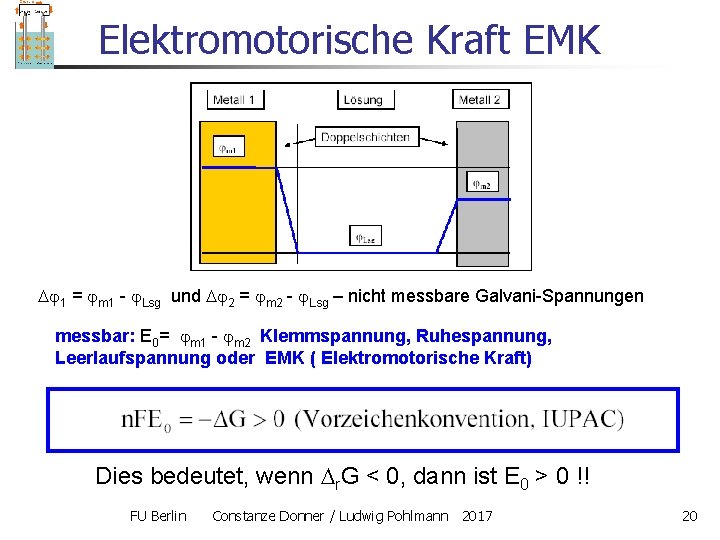
Elektromotorische Kraft EMK 1 = m 1 - Lsg und 2 = m 2 - Lsg – nicht messbare Galvani-Spannungen messbar: E 0= m 1 - m 2 Klemmspannung, Ruhespannung, Leerlaufspannung oder EMK ( Elektromotorische Kraft) Dies bedeutet, wenn r. G < 0, dann ist E 0 > 0 !! FU Berlin Constanze Donner / Ludwig Pohlmann 2017 20

Elektromotorische Kraft EMK Merksatz: Formulierung: E 0 = K – A Positiv für freiwillige Reaktionen Batterie Korrosion Stromlose Prozesse z. FE = - r. G FU Berlin Constanze Donner / Ludwig Pohlmann 2017 21

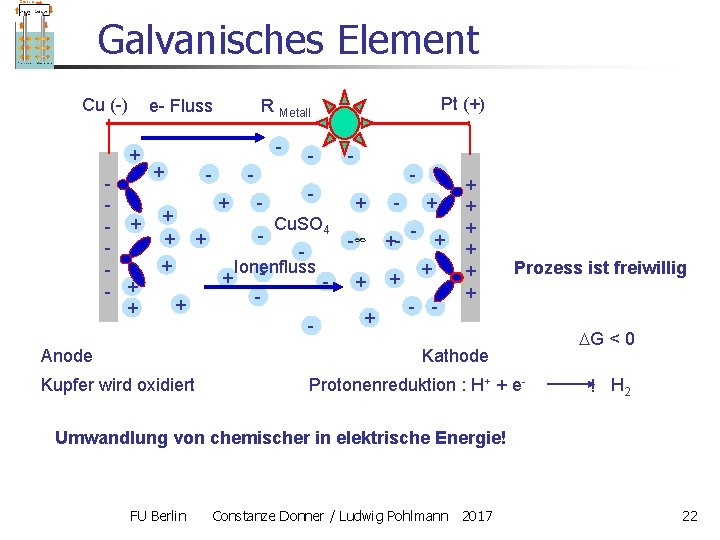
Galvanisches Element Cu (-) + - + + + Anode Pt (+) R Metall e- Fluss - - - Cu. SO 4 Ionenfluss + - - + + - +- + + - - + + + Prozess ist freiwillig Kathode Kupfer wird oxidiert Protonenreduktion : H+ + e- G < 0 ! H 2 Umwandlung von chemischer in elektrische Energie! FU Berlin Constanze Donner / Ludwig Pohlmann 2017 22

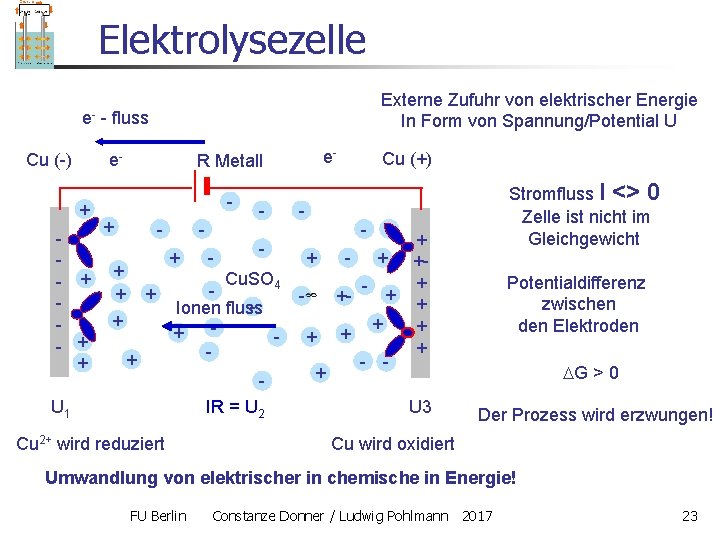
Elektrolysezelle e. Cu (-) - fluss e- + - + + U 1 Externe Zufuhr von elektrischer Energie In Form von Spannung/Potential U + e- R Metall - + + + - - - Stromfluss I <> 0 Zelle ist nicht im Gleichgewicht - + + Cu. SO 4 + Ionen fluss + + - + + + IR = U 2 Cu 2+ wird reduziert Cu (+) + - + ++ + + - U 3 Potentialdifferenz zwischen den Elektroden G > 0 Der Prozess wird erzwungen! Cu wird oxidiert Umwandlung von elektrischer in chemische in Energie! FU Berlin Constanze Donner / Ludwig Pohlmann 2017 23

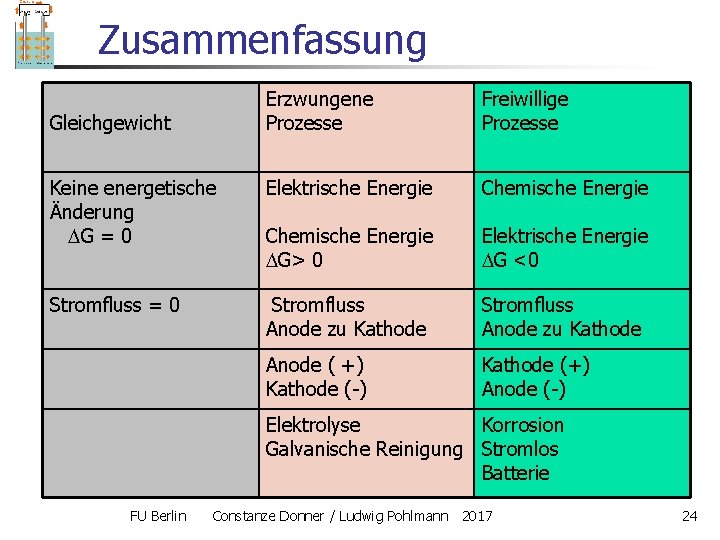
Zusammenfassung Erzwungene Prozesse Freiwillige Prozesse Keine energetische Änderung G = 0 Elektrische Energie Chemische Energie G> 0 Elektrische Energie G <0 Stromfluss = 0 Stromfluss Anode zu Kathode Anode ( +) Kathode (-) Kathode (+) Anode (-) Gleichgewicht Elektrolyse Korrosion Galvanische Reinigung Stromlos Batterie FU Berlin Constanze Donner / Ludwig Pohlmann 2017 24
 Elektrochemisches gleichgewicht
Elektrochemisches gleichgewicht Erster hauptsatz der thermodynamik
Erster hauptsatz der thermodynamik 2ter hauptsatz der thermodynamik
2ter hauptsatz der thermodynamik Erster hauptsatz der thermodynamik
Erster hauptsatz der thermodynamik 2ter hauptsatz der thermodynamik
2ter hauptsatz der thermodynamik 2 hauptsatz der thermodynamik
2 hauptsatz der thermodynamik Leifi physik transistor
Leifi physik transistor Konstanze donner
Konstanze donner Elektrochemie graad 12
Elektrochemie graad 12 Elektromotorische kraft bio
Elektromotorische kraft bio Magisches dreieck der preispolitik
Magisches dreieck der preispolitik Cook & chill grundlagen und erfahrungen aus der praxis
Cook & chill grundlagen und erfahrungen aus der praxis Inventar und bilanzbuch
Inventar und bilanzbuch Soziale einzelfallhilfe phasen
Soziale einzelfallhilfe phasen Grundlagen der systemtheorie
Grundlagen der systemtheorie Solche adjektivdeklination
Solche adjektivdeklination Wiederholung adjektivdeklination
Wiederholung adjektivdeklination 5+5+5=950 lösung
5+5+5=950 lösung Thema wiederholung
Thema wiederholung Elektrochemische cel
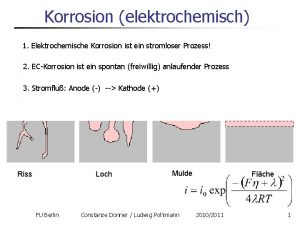
Elektrochemische cel Elektrochemische korrosion beispiele
Elektrochemische korrosion beispiele Galvanispannung
Galvanispannung Zinkchlorid elektrolyse
Zinkchlorid elektrolyse Elektrochemische doppelschicht animation
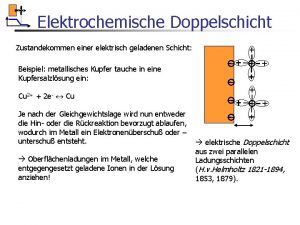
Elektrochemische doppelschicht animation Elektrochemische doppelschicht definition
Elektrochemische doppelschicht definition