Korrosion elektrochemisch 1 Elektrochemische Korrosion ist ein stromloser


- Slides: 13

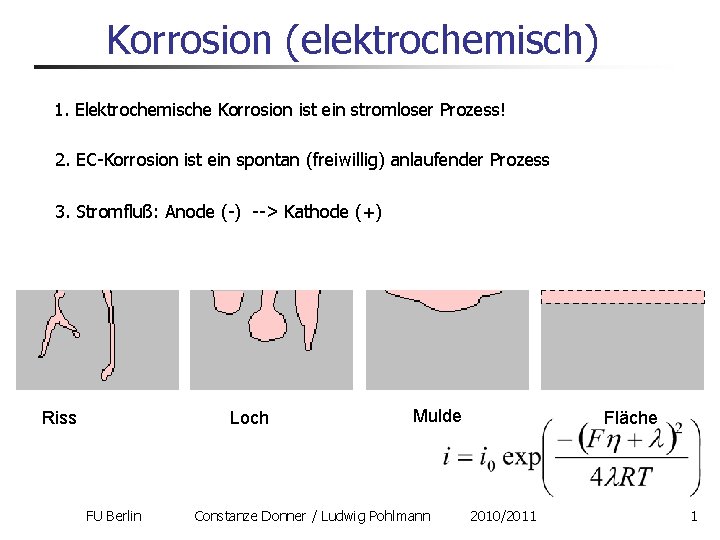
Korrosion (elektrochemisch) 1. Elektrochemische Korrosion ist ein stromloser Prozess! 2. EC-Korrosion ist ein spontan (freiwillig) anlaufender Prozess 3. Stromfluß: Anode (-) --> Kathode (+) Riss Loch FU Berlin Mulde Constanze Donner / Ludwig Pohlmann Fläche 2010/2011 1

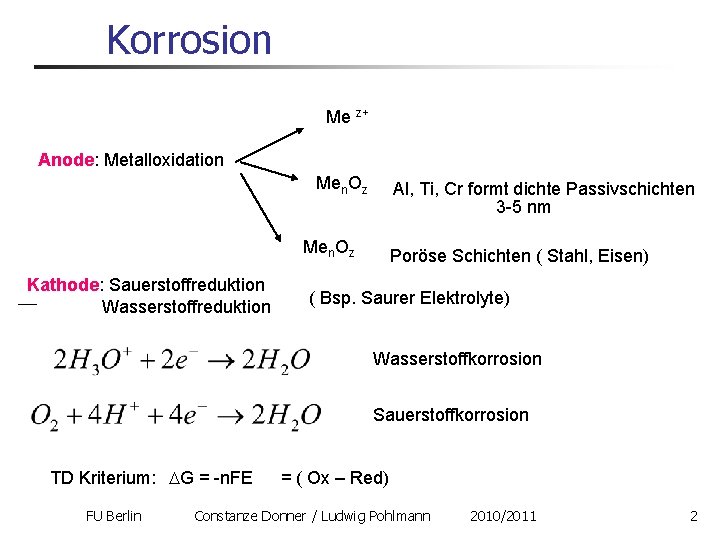
Korrosion Me z+ Anode: Metalloxidation Men. Oz Al, Ti, Cr formt dichte Passivschichten 3 -5 nm Men. Oz Kathode: Sauerstoffreduktion Wasserstoffreduktion Poröse Schichten ( Stahl, Eisen) ( Bsp. Saurer Elektrolyte) Wasserstoffkorrosion Sauerstoffkorrosion TD Kriterium: DG = -n. FE FU Berlin = ( Ox – Red) Constanze Donner / Ludwig Pohlmann 2010/2011 2

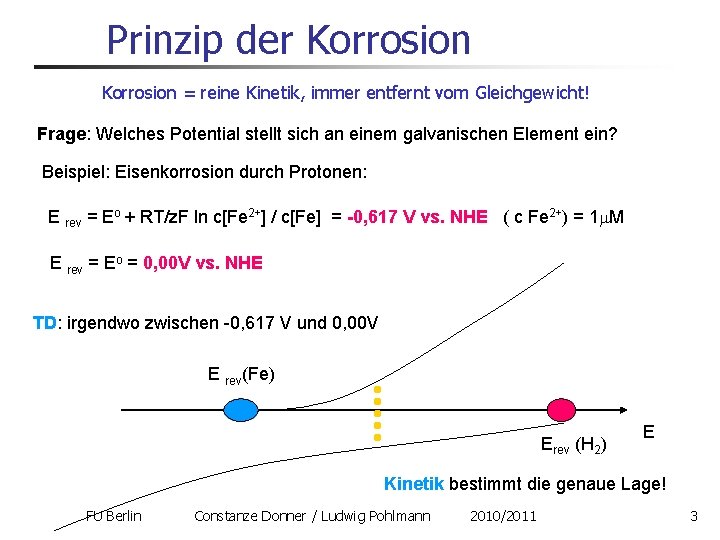
Prinzip der Korrosion = reine Kinetik, immer entfernt vom Gleichgewicht! Frage: Welches Potential stellt sich an einem galvanischen Element ein? Beispiel: Eisenkorrosion durch Protonen: E rev = Eo + RT/z. F ln c[Fe 2+] / c[Fe] = -0, 617 V vs. NHE ( c Fe 2+) = 1 m. M E rev = Eo = 0, 00 V vs. NHE TD: irgendwo zwischen -0, 617 V und 0, 00 V E rev(Fe) Erev (H 2) E Kinetik bestimmt die genaue Lage! FU Berlin Constanze Donner / Ludwig Pohlmann 2010/2011 3

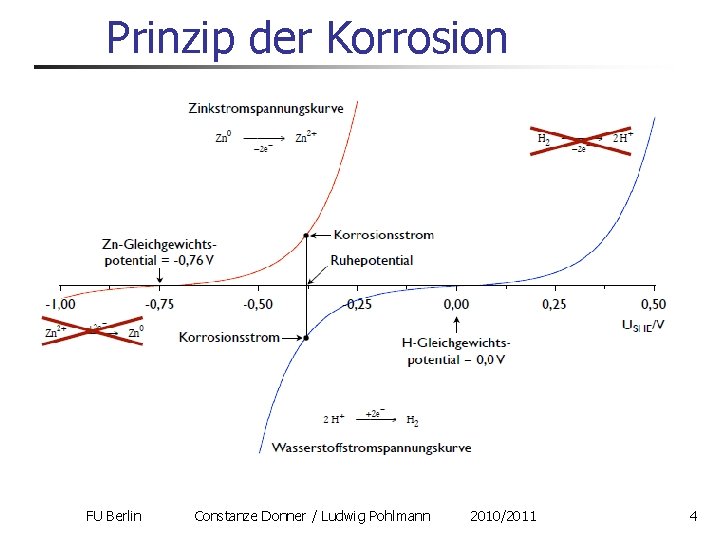
Prinzip der Korrosion FU Berlin Constanze Donner / Ludwig Pohlmann 2010/2011 4

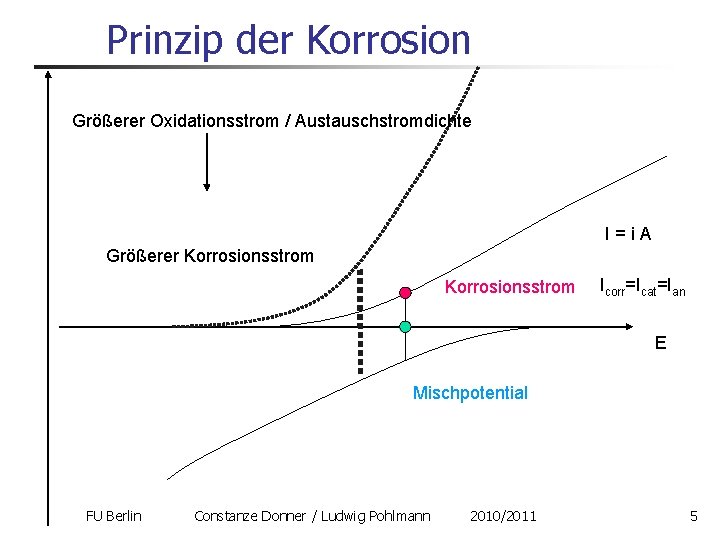
Prinzip der Korrosion Größerer Oxidationsstrom / Austauschstromdichte I=i. A Größerer Korrosionsstrom Icorr=Icat=Ian E Mischpotential FU Berlin Constanze Donner / Ludwig Pohlmann 2010/2011 5

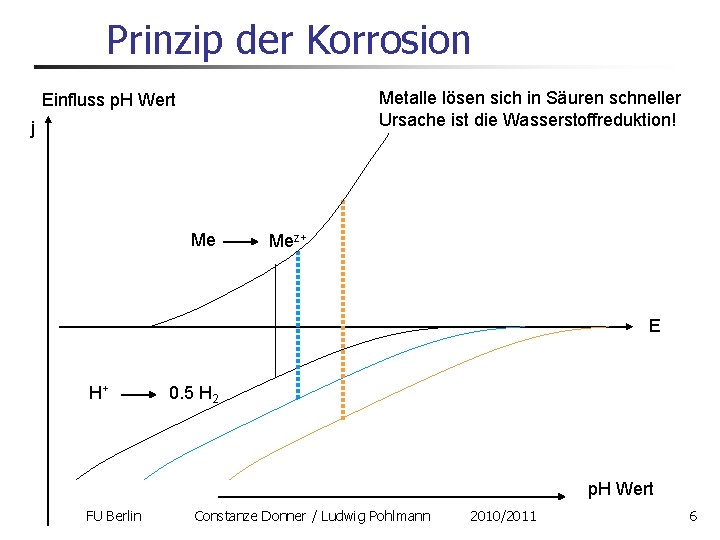
Prinzip der Korrosion Metalle lösen sich in Säuren schneller Ursache ist die Wasserstoffreduktion! Einfluss p. H Wert j Me Mez+ E H+ 0. 5 H 2 p. H Wert FU Berlin Constanze Donner / Ludwig Pohlmann 2010/2011 6

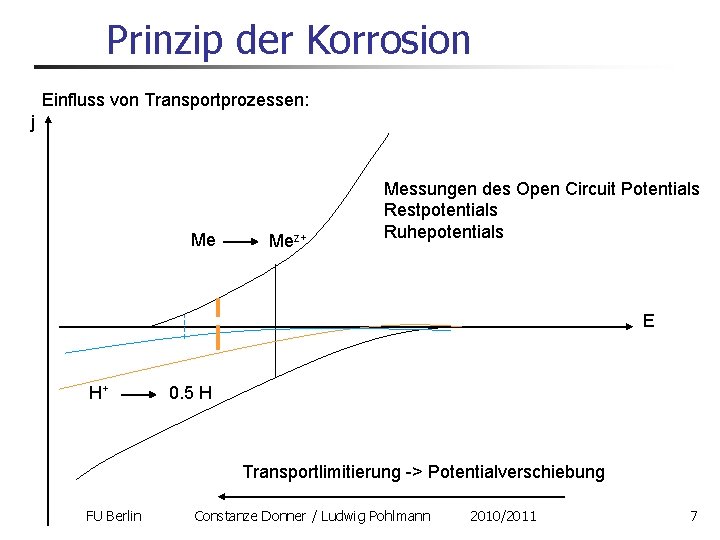
Prinzip der Korrosion Einfluss von Transportprozessen: j Me Mez+ Messungen des Open Circuit Potentials Restpotentials Ruhepotentials E H+ 0. 5 H Transportlimitierung -> Potentialverschiebung FU Berlin Constanze Donner / Ludwig Pohlmann 2010/2011 7

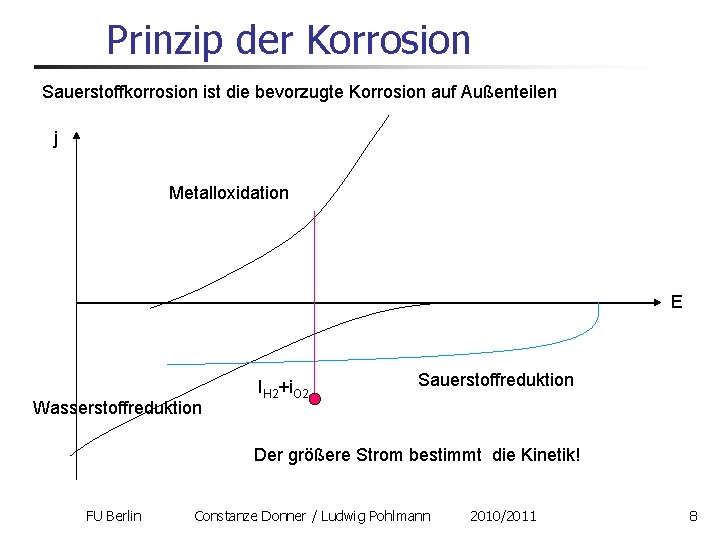
Prinzip der Korrosion Sauerstoffkorrosion ist die bevorzugte Korrosion auf Außenteilen j Metalloxidation E Wasserstoffreduktion IH 2+i. O 2 Sauerstoffreduktion Der größere Strom bestimmt die Kinetik! FU Berlin Constanze Donner / Ludwig Pohlmann 2010/2011 8

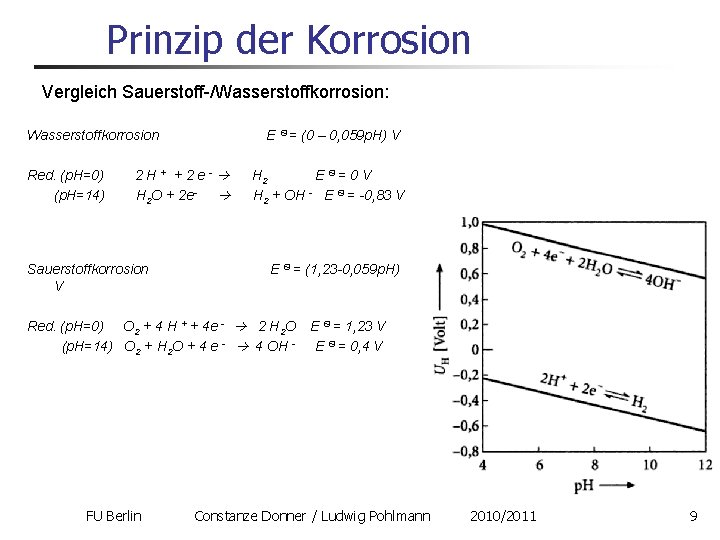
Prinzip der Korrosion Vergleich Sauerstoff-/Wasserstoffkorrosion: Wasserstoffkorrosion Red. (p. H=0) (p. H=14) E Ѳ = (0 – 0, 059 p. H) V 2 H + + 2 e H 2 O + 2 e Sauerstoffkorrosion V H 2 E Ѳ= 0 V H 2 + OH E Ѳ = 0, 83 V E Ѳ = (1, 23 0, 059 p. H) Red. (p. H=0) O 2 + 4 H + + 4 e 2 H 2 O (p. H=14) O 2 + H 2 O + 4 e 4 OH FU Berlin E Ѳ = 1, 23 V E Ѳ = 0, 4 V Constanze Donner / Ludwig Pohlmann 2010/2011 9

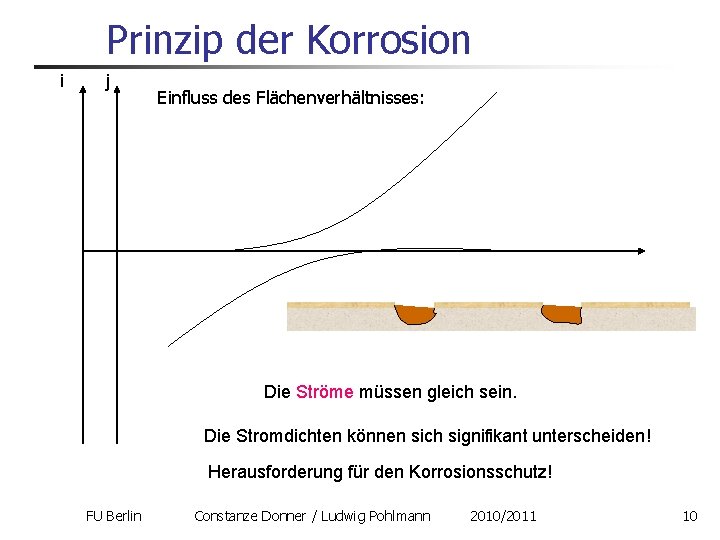
Prinzip der Korrosion i j Einfluss des Flächenverhältnisses: Die Ströme müssen gleich sein. Die Stromdichten können sich signifikant unterscheiden! Herausforderung für den Korrosionsschutz! FU Berlin Constanze Donner / Ludwig Pohlmann 2010/2011 10

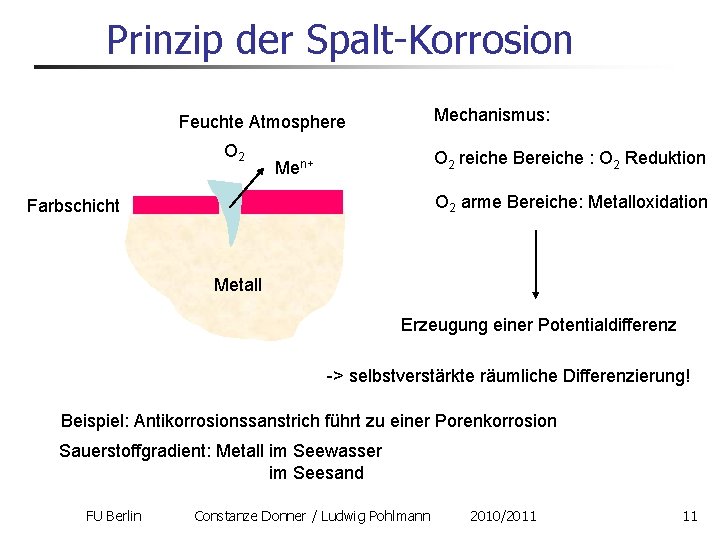
Prinzip der Spalt-Korrosion Mechanismus: Feuchte Atmosphere O 2 reiche Bereiche : O 2 Reduktion Men+ O 2 arme Bereiche: Metalloxidation Farbschicht Metall Erzeugung einer Potentialdifferenz -> selbstverstärkte räumliche Differenzierung! Beispiel: Antikorrosionssanstrich führt zu einer Porenkorrosion Sauerstoffgradient: Metall im Seewasser im Seesand FU Berlin Constanze Donner / Ludwig Pohlmann 2010/2011 11

Prinzip der Spalt-Korrosion 4 Stadien der Spaltkorrosion nach Fontana und Greene (1967): 1. Startphase: schwache homogene Korrosion gleichermaßen innen und außen a) M -> Mn+ + n eb) O 2 + 2 H 2 O + 4 e- -> 4 OH 2. Der Sauerstoff im Spalt verarmt durch die kathodische Reaktion (Diffusionslimitierung!) 3. Cl- und OH- diffundieren in den Spalt, Metallchlorid bildet sich und hydrolysiert teilweise: MCln + n H 2 O -> M(OH)n + n. HCl; in Folge sinkt der p. H-Wert 4. Die Metallauflösung im Spalt beschleunigt sich, außerhalb findet durch das entstehende p. H-Gefälle nur noch die Sauerstoffreduktion statt Mars G. Fontana (1910 -1988), University of Michigan FU Berlin Constanze Donner / Ludwig Pohlmann 2010/2011 12

Prinzip der Spalt-Korrosion FU Berlin Constanze Donner / Ludwig Pohlmann 2010/2011 13
 Elektrochemische korrosion beispiele
Elektrochemische korrosion beispiele Ein volk ein reich ein führer
Ein volk ein reich ein führer Männer herbert grönemeyer analyse
Männer herbert grönemeyer analyse Ist ein widerstand ein verbraucher
Ist ein widerstand ein verbraucher Trapez drachenviereck
Trapez drachenviereck Ein hund ist ein herz auf vier pfoten
Ein hund ist ein herz auf vier pfoten Spaltkorrosion
Spaltkorrosion Ein tag der sagts dem anderen mein leben sei ein wandern
Ein tag der sagts dem anderen mein leben sei ein wandern Jeden morgen beginnt ein neuer tag
Jeden morgen beginnt ein neuer tag Das veilchen goethe interpretation
Das veilchen goethe interpretation Ein geschäftsmann sendet ein fax an seine frau
Ein geschäftsmann sendet ein fax an seine frau Ein neuer tag und ein neuer morgen
Ein neuer tag und ein neuer morgen Serisen
Serisen Elektromotorische kraft bio
Elektromotorische kraft bio