Elektrochemie Nachweis der Konzentration geladener Teilchen physikalische Grundlagen









- Slides: 16

Elektrochemie (Nachweis der Konzentration geladener Teilchen) physikalische Grundlagen Zusammenhang: Konzentration, elektrische Spannungsreihe, Referenzelektroden, Membranpotential Halbleitertechnik Praxis Spannungsmessung p. H-Messung, aktuelle Acidität Titration, potentielle Acidität, Gesamtkationen Ionensensitive Elektroden Elektrochemische Detektoren bei HPLC Flammenionisations- Detectoren (GC)

Elektrochemisches Element mit 2 Konzentrationsstufen eines Metalles Ag+ RG Meßgerät RL RS RI Leitungssystem Spezifischer Widerstand (Materialkonstante) Induktiver Widerstand


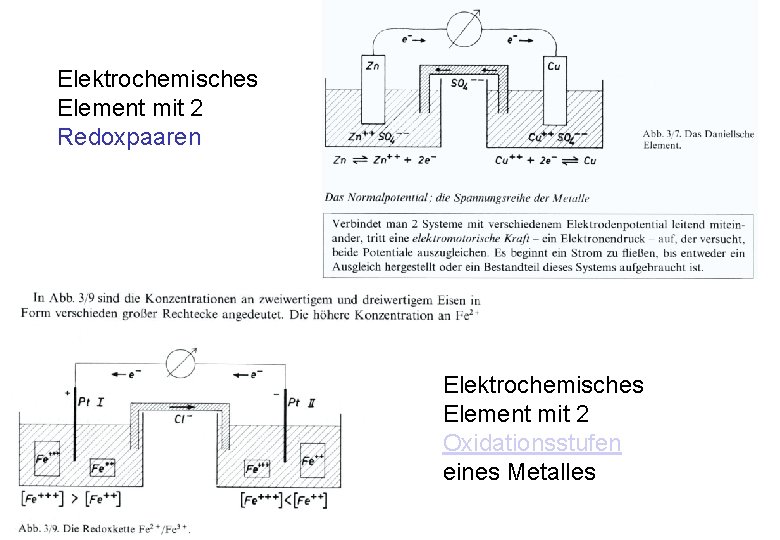
Elektrochemisches Element mit 2 Redoxpaaren Elektrochemisches Element mit 2 Oxidationsstufen eines Metalles


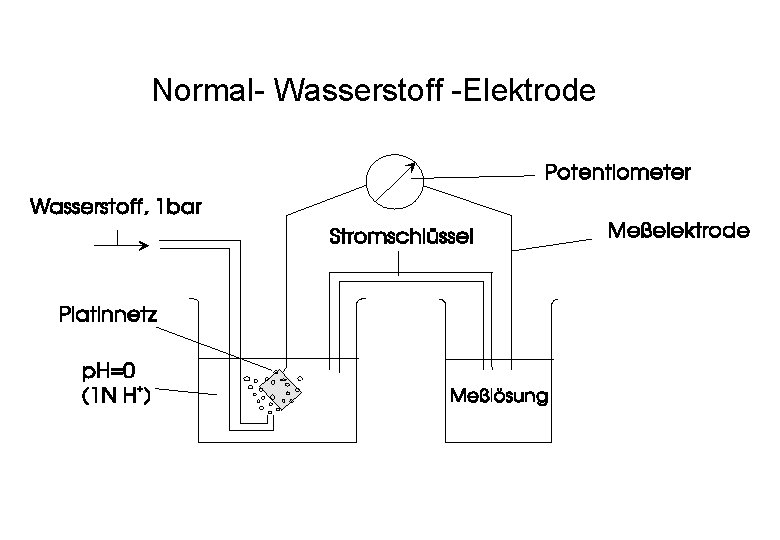
Normal- Wasserstoff -Elektrode


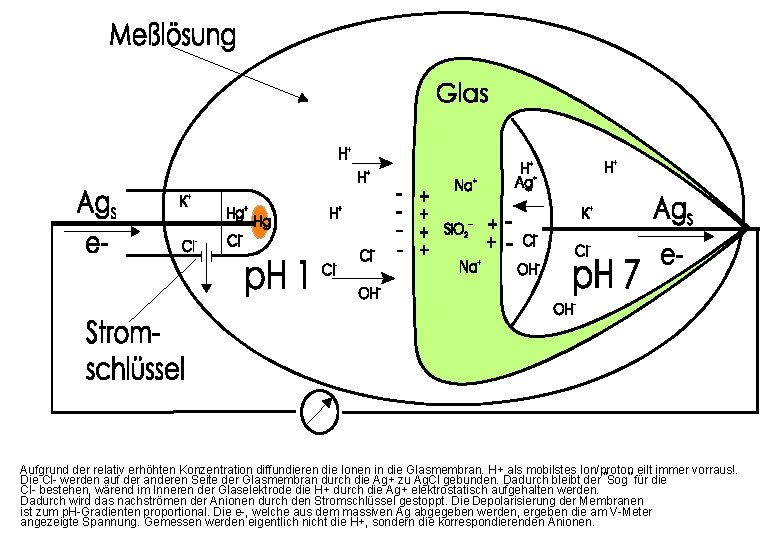
Aufgrund der relativ erhöhten Konzentration diffundieren die Ionen in die Glasmembran. H+ als mobilstes Ion/proton eilt immer vorraus!. Die Cl- werden auf der anderen Seite der Glasmembran durch die Ag+ zu Ag. Cl gebunden. Dadurch bleibt der “Sog” für die Cl- bestehen, wärend im Inneren der Glaselektrode die H+ durch die Ag+ elektrostatisch aufgehalten werden. Dadurch wird das nachströmen der Anionen durch den Stromschlüssel gestoppt. Die Depolarisierung der Membranen ist zum p. H-Gradienten proportional. Die e-, welche aus dem massiven Ag abgegeben werden, ergeben die am V-Meter angezeigte Spannung. Gemessen werden eigentlich nicht die H+, sondern die korrespondierenden Anionen.

Aufgrund der relativ erhöhten Konzentration diffundieren die Ionen in die Glasmembran. H+ als mobilstes Ion/proton eilt immer vorraus! Die Cl- werden auf der anderen Seite der Glasmembran durch die Ag+ zu Ag. Cl gebunden. Dadurch bleibt der “Sog” für die Cl- bestehen, wärend im Inneren der Glaselektrode die H+ durch die Ag+ elektrostatisch aufgehalten werden. Dadurch wird das nachströmen der Anionen durch den Stromschlüssel gestoppt. Die Depolarisierung der Membranen ist zum p. H-Gradienten proportional. Die e-, welche aus dem massiven Ag abgegeben werden, ergeben die am V-Meter angezeigte Spannung. Gemessen werden eigentlich nicht die [H+], sondern die Konzentration der korrespondierenden Anionen.

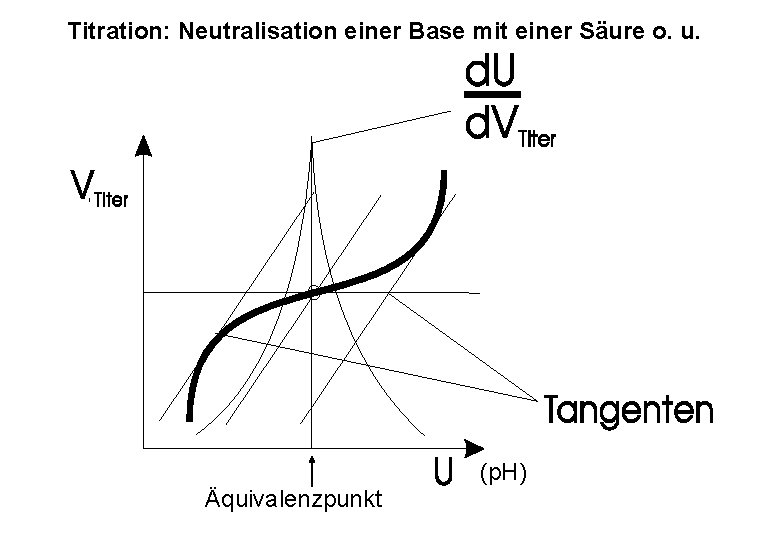
Titration: Neutralisation einer Base mit einer Säure o. u. (p. H) Äquivalenzpunkt


Berechnung einer Titration: Prinzip: m. L Titerverbrauch = µval Titer = µval Probe Titer: z. B. : 0, 02 N Na. OH 1 ml = 20 µval Na. OH Kalibration: gestellte Lösung (Titrisol) gegen Titer Testlösung: 0, 01 N HCl 5 ml einer 0, 01 N HCl = 50 µval HCl projektierter Titerverbrauch: 2, 5 m. L effektiver Titerverbrauch: 2, 4 m. L (Beispiel) --> 1 m. L Titer = 20*2, 4/2, 5 µval = 19, 3 µval Berechnung: 19, 3 µval : 1 m. L = x µval : m. L Titer x = (19, 3 * ml Titer) µval

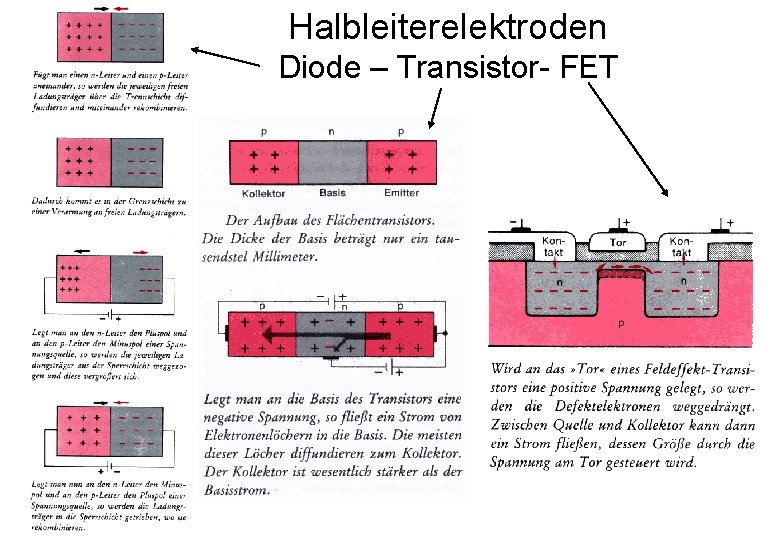
Halbleiterelektroden Diode – Transistor- FET

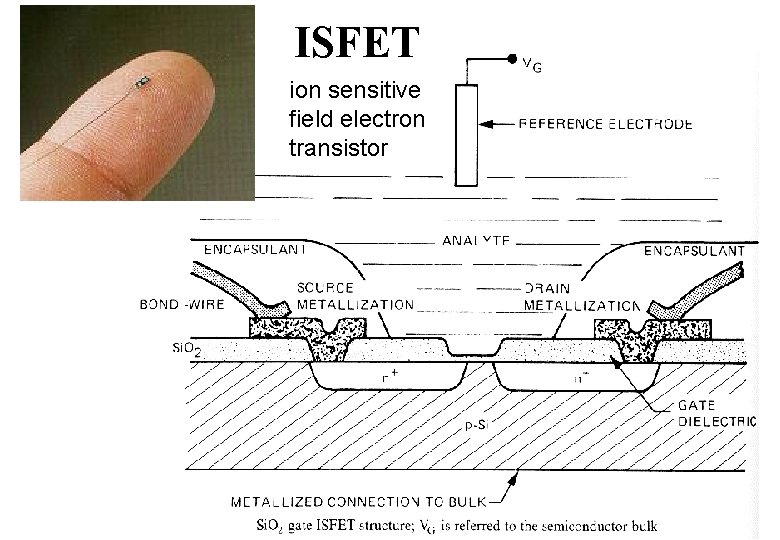
ISFET ion sensitive field electron transistor

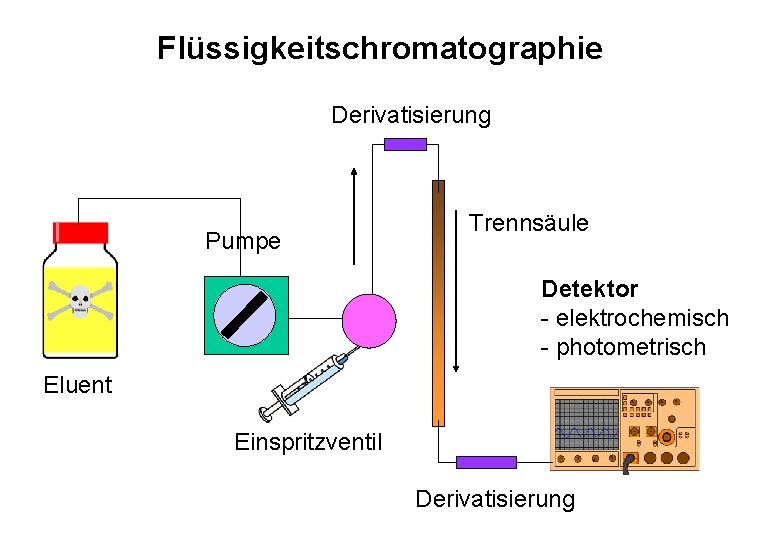
Flüssigkeitschromatographie Derivatisierung Pumpe Trennsäule Detektor - elektrochemisch - photometrisch Eluent Einspritzventil Derivatisierung

Elektrochemischer Detektor Messküvette (Conductivity Cell) 1µL Messelektroden Referenzelektroden. Kette Ag/Ag. Cl
 Elektrochemisches gleichgewicht
Elektrochemisches gleichgewicht Physikalische größen
Physikalische größen Horizontale vertikale diagonale zusammenschlüsse
Horizontale vertikale diagonale zusammenschlüsse Unternehmenszusammenschlüsse kooperation und konzentration
Unternehmenszusammenschlüsse kooperation und konzentration Aus was bestehen quarks
Aus was bestehen quarks Pomeranchuk
Pomeranchuk Elektrochemie graad 12
Elektrochemie graad 12 Galvanische zelle
Galvanische zelle Constanze donner
Constanze donner Mmu informatik
Mmu informatik Physikalische lockerungsmittel
Physikalische lockerungsmittel Geleisteter schadensersatz buchen skr 03
Geleisteter schadensersatz buchen skr 03 Preisschwelle
Preisschwelle Garverfahren kochen definition
Garverfahren kochen definition Wissenschaftliche grundlagen der sozialen arbeit
Wissenschaftliche grundlagen der sozialen arbeit Grundlagen der systemtheorie
Grundlagen der systemtheorie Konzentration und kooperation
Konzentration und kooperation






























