Estequiometra y Modelos de Crecimiento Estequiometra y Cintica


















![donde: D: velocidad de dilución S: [sustrato limitante] del crecimiento para las células huésped, donde: D: velocidad de dilución S: [sustrato limitante] del crecimiento para las células huésped,](https://slidetodoc.com/presentation_image_h2/757bba0cae0c8dbb62457ed1fa3ec0de/image-25.jpg)



![puesto que: Xn: [masa celular] de la especie n-th del organismo μn: velocidad específica puesto que: Xn: [masa celular] de la especie n-th del organismo μn: velocidad específica](https://slidetodoc.com/presentation_image_h2/757bba0cae0c8dbb62457ed1fa3ec0de/image-30.jpg)
- Slides: 30

Estequiometría y Modelos de Crecimiento

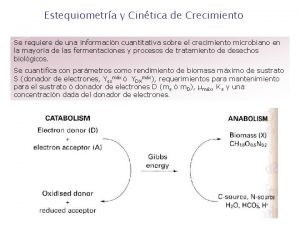
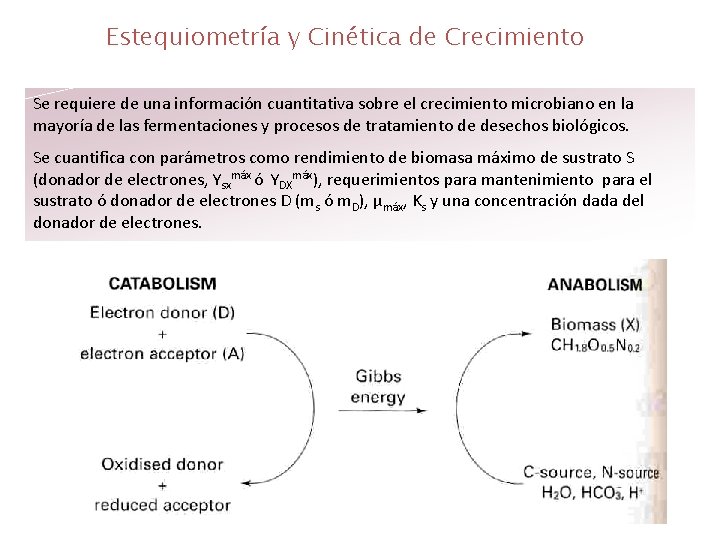
Estequiometría y Cinética de Crecimiento Se requiere de una información cuantitativa sobre el crecimiento microbiano en la mayoría de las fermentaciones y procesos de tratamiento de desechos biológicos. Se cuantifica con parámetros como rendimiento de biomasa máximo de sustrato S (donador de electrones, Ysxmáx ó YDXmáx), requerimientos para mantenimiento para el sustrato ó donador de electrones D (ms ó m. D), μmáx, Ks y una concentración dada del donador de electrones.

Los valores de estos parámetros varíanen uno ó dos órdenes de magnitud, dependiendo del sistema de crecimiento que se van a caracterizar por el donador y el aceptor de electrones, su fuente de C y de N. (Figura anterior). Además en cada sistema de crecimiento están involucrados HCO 3 - , H 2 O, y H+. Como la mayoría de los microorganismos tienen composiciones similares, se puede usar una composición de biomasa standard, en el caso de que la información no esté disponible. Pero siempre es preferible determinarla usando un análisis elemental. Para propósitos prácticos es importante conocer la estequiometría completa del crecimiento. En procesos de fermentación además de Ysx ó YDX también es importante conocer el requerimiento de oxígeno, la producción de CO 2, y la producción de calor para diseñar un proceso óptimo. Por tanto, métodos de cálculo estequiométrico son de un valor fundamental. Cálculos Estequiométricos Definición del Sistema de Crecimiento Un sistema de crecimiento microbiano se representa como una ecuación de reacción total, donde se forma 1 C – mol de biomasa, y además se tiene en cuenta el papel de la fuente de nitrógeno, H 2 O, HCO 3 - , H+, acoplamiento de donadores de electrones y aceptores de electrones.

Además se indican el calor y la energía de Gibbs. Un C – mol de biomasa es la cantidad que contienen 12 gr de carbono. Para el crecimiento microbiano la energía generada debe permitir la construcción de moléculas complejas de biomasa, a partir de compuestos simples de carbono. La energía se genera en una reacción redox entre el donador y el aceptor de electrones. La energía en un proceso de crecimiento no es la que libera calor como la energía de Gibbs ∆G, que combina (el calor entálpico liberado, ∆H, y las contribuciones de entropía, ∆S, tal que: ∆G = ∆H - T ∆S. Los coeficientes estequiométricos en la ecuación de la reacción anterior son: YDX , YAX, YHX, e y GX que son los rendimientos de biomasa (en C – mol X) para el donador de electrones (por C – mol para compuestos orgánicos y por mol para compuestos inorgánicos). Para el aceptor de electrones (por mol de aceptor). Para el calor, (por k. J) respectivamente la energía de Gibbs (por k. J). Para biomasa, se usa la composición de 1 C – mol. El signo menos indica consumo.

Los Yi. Xsimbolizan el rendimiento de 1 C - mol de X, sobre 1 C – mol del compuesto i. Medidas de Rendimiento Los coeficientes estequiométricos son relaciones de velocidades de conversión ( rx está dado como C – mol X / m 3 hr de reactor ri en mol de i / m 3 hr Yi. X = rx / ri Estas velocidades se calculan a partir de medidas en experimentos batch por ej, continuo, ó cultivos fed – batch, usando los balances de masa apropiados. El coeficiente estequiométrico más usado frecuentemente es el rendimiento de biomasa sobre sustrato, YSX, ó donador de electrones, YDx. En un cultivo batch de volumen constante, para tiempo 0, YSX será: En un quimiostato, donde las velocidades de flujo de entrada y salida son iguales, se mantienen ecuaciones similares, donde CX 0 es 0, y CS 0 es reemplazada por la concentración CSi del sustrato que está ingresando. Si hay variaciones en el volumen, las relaciones obtenidas de los balances de masa se hacen mucho más complejas.

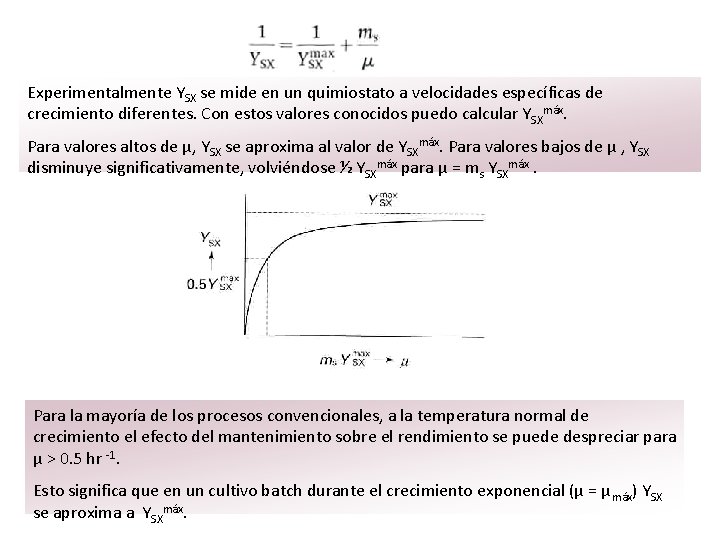
Para un reactor batch con volumen variable, se obtiene: Efecto de mantenimiento Inicialmente Monod introdujo YSX como una constante. Sin embargo con el quimiostato, el cultivo de microorganismos a velocidades de crecimiento diferentes mostró que Y SX depende de la velocidad de crecimiento μ. La explicación se basa en el concepto de mantenimiento (Herbert – Pirt). Este concepto supone que el mantenimiento de las funciones celulares requiere de la energía de Gibbs (para restaurar gradientes rotos, degradación de proteínas, etc. Esta energía de Gibbs se produce en el catabolismo de una cierta cantidad de donadores de electrones (sustrato). Si la velocidad de mantenimiento es m. S ó m. D C – mol de sustrato / C – mol de X hr , se mantiene la ecuación siguiente:

Experimentalmente YSX se mide en un quimiostato a velocidades específicas de crecimiento diferentes. Con estos valores conocidos puedo calcular YSXmáx. Para valores altos de μ, YSX se aproxima al valor de YSXmáx. Para valores bajos de μ , YSX disminuye significativamente, volviéndose ½ YSXmáx para μ = ms YSXmáx. Para la mayoría de los procesos convencionales, a la temperatura normal de crecimiento el efecto del mantenimiento sobre el rendimiento se puede despreciar para μ > 0. 5 hr -1. Esto significa que en un cultivo batch durante el crecimiento exponencial (μ = μ máx) YSX se aproxima a YSXmáx.

Sin embargo en procesos fed batch, donde μ < 0. 05 hr -1, el mantenimiento domina el rendimiento de la biomasa. Principios de conservación para calcular la estequiometría completa del crecimiento La mayoría de los coeficientes estequiométricos son YSX e YDX, no es necesario determinarlos experimentalmente. La aplicación de los principios de conservación a menudo permiten que todos los coeficientes puedan ser calculados, midiendo un coeficiente simple YSX. Ejemplo: Para un microorganismo aeróbico que crece sobre oxalato usando NH 4+ como fuente de nitrógeno, se tiene la ecuación general de la reacción, basándonos en que se produce 1 C – mol de biomasa con un rendimiento de biomasa sobre oxalato de YDX = 1 / 5. 815 C – mol de biomasa por mol de oxalato. Hay 5 coeficientes estequiométricos desconocidos, para los cuales se plantean las ecuaciones de conservación correspondientes:

La solución da la estequiometría completa: Así vemos que: YAX = 1 / 1. 857 C – mol X / mol O 2 YCX = 1 / 10. 63 C – mol X / mol HCO 3 Además de tablas termodinámicas se pueden obtener los valores de ∆H 0 y ∆G 0 (298 º K, p. H 7, 1 bar, 1 mol), y calcular el ∆HR y ∆GR que nos permitirán conocer 1 / YHX y 1 / YGX.

Modelos de Cinética de Crecimiento Dos parámetros importantes como son el rendimiento y la productividad pueden obtenerse de datos experimentales, Ej de medidas de consumo de sustrato y formación de producto. Además con medidas de velocidades ó flujos en estado estacionario a la entrada y a la salida de la célula, se pueden calcular los flujos a través de diferentes ramificaciones de una ruta metabólica que funciona en una célula dada. Para establecer una relación cuantitativa entre los flujos y las variables (concentraciones, etc) que caracterizan el entorno de la célula. Ej: la respuesta a un cambio en la composición del medio ó la temperatura, es necesario definir expresiones cinéticas para las reacciones claves y procesos considerados en el modelo, ó establecer un modelo matemático que pueda simular los procesos estudiados. Cuando usamos expresiones cinéticas nos referimos a modelos cinéticos, de correlaciones matemáticas entre velocidades y concentraciones de reactivo – producto, que insertadas en los balances de masa, permiten predecir el grado de conversión del sustrato y el rendimiento de los productos en forma individual en otras condiciones de operación. Si las expresiones de velocidad son correctas, es posible expresar el curso de una fermentación basándose en valores iniciales (a la entrada) para el componente del vector establecido, ej: concentración de sustrato. Esto conduce a simulaciones que finalmente resultan en un diseño óptimo del equipo, ó en un modo óptimo de operación para un sistema dado.

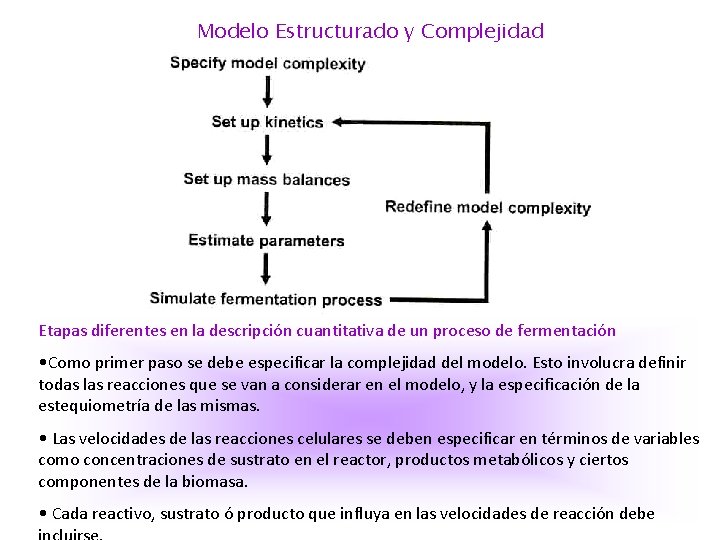
Independiente de la estructura del modelo el proceso de descripción cuantitativa de un proceso de fermentación, a menudo involucra un proceso iterativo donde el modelo es revisado continuamente cuando se obtiene información nueva del proceso. Los modelos son usados por todos los investigadores en ciencias de la vida, cuando se interpretan resultados de experimentos individuales, y cuando los resultados de diversos experimentos se comparan entre sí. Los biólogos usan mucho modelos en experimentos de regulación de genes. La mayoría de los modelos biológicos son únicamente cualitativos, y no permiten un análisis cuantitativo. El obstáculo mayor de un modelo cuantitativo es la estimación de los parámetros del modelo, lo que implica tener medidas precisas de variables diferentes del sistema, y preferentemente a condiciones experimentales muy distintas. Se deben conocer balances de carbono y nitrógeno como primera medida para evaluar los datos experimentales que van a ser usados en un modelo cuantitativo de un sistema dado. Errores en los balances de masa conducirán a inseguridad en la estimación de los flujos a la entrada y a la salida de la célula, y en general no es posible desarrollar una cinética acertada. Actualmente la disponibilidad de computadoras poderosas que permiten resolver problemas numéricos complejos a un tiempo razonable, hacen que sea posible modelar con mucha precisión.

Los modelos mecanísticos (modelos matemáticos complejos para procesos biológicos) a menudo son de poco uso en el diseño de bioprocesos, ellos son fundamentalmente para la investigación de fenómenos biológicos. Nosotros enfocaremos los modelos que son útiles para el diseño de bioprocesos.

Modelo Estructurado y Complejidad Etapas diferentes en la descripción cuantitativa de un proceso de fermentación • Como primer paso se debe especificar la complejidad del modelo. Esto involucra definir todas las reacciones que se van a considerar en el modelo, y la especificación de la estequiometría de las mismas. • Las velocidades de las reacciones celulares se deben especificar en términos de variables como concentraciones de sustrato en el reactor, productos metabólicos y ciertos componentes de la biomasa. • Cada reactivo, sustrato ó producto que influya en las velocidades de reacción debe

En modelos simples los balances de masa para la mayoría de las variables, se expresan en términos de otras variables usando suposiciones como, coeficientes de rendimiento constantes. Las expresiones que relacionan las velocidades con las variables se llaman expresiones cinéticas, ya que ellas especifican las reacciones consideradas en el modelo en función de un conjunto de variables seleccionadas. • El paso siguiente en un proceso de modelado, es combinar la cinética de las reacciones celulares con un modelo para el reactor, en el cual ocurre el proceso celular. • Tal modelo especifica como las concentraciones de sustrato, biomasa, y productos metabólicos cambian con el tiempo, y cuales son los flujos a la entrada y salida del reactor. Cuando no hay variaciones espaciales en el reactor se habla de modelos para bioreactores ideales, que se representan con balances de masa simples para todo el reactor. En caso de no homogeneidad del medio en el reactor, se aplican modelos más detallados. La combinación de balances de masa , incluyendo ecuaciones cinéticas de velocidad y el modelo del reactor, todo es una descripción matemática del proceso de fermentación, que se usa para simular como las variables de salida dependen de las variables de entrada. El modelo en estado estacionario consiste de un conjunto de ecuaciones algebraicas que relacionan las variables de salida con las de entrada.

Los modelos dinámicos ó transientes consisten de un conjunto de ecuaciones diferenciales. Para un bioreactor ideal las variables de salida son una función del tiempo para cualquier conjunto de variables de entrada, y der los valores iniciales de las variables de salida. Estimación de parámetros: antes de esto es necesario asignar valores a los parámetros del modelo, se comparan simulaciones del modelo con los datos experimentales, y estimamos un conjunto de parámetros que se ajusten mejor al modelo con los datos experimentales. La evaluación del ajuste del modelo a los datos experimentales se puede hacer por una inspección visual simple, pero generalmente se prefiere usar un procedimiento más racional como: minimizar la suma de cuadrados de los errores entre el modelo y los datos experimentales. Si las simulaciones del modelo representan los datos experimentales lo suficientemente bien, entonces el modelo es aceptado. Si no es así, se revisa el modelo cinético y se va a un ciclo de modelado nuevo. Los procesos biológicos son en extremo complicados: el crecimiento y formación de metabolitos son el resultado de un nº grande de reacciones celulares y eventos tales como: expresión de genes, traslación del RNAm en proteínas funcionales, procesamiento de las proteínas en enzimas funcionales ó proteínas estructurales, y secuencias largas de reacciones bioquímicas que conducen a la síntesis de los componentes celulares.

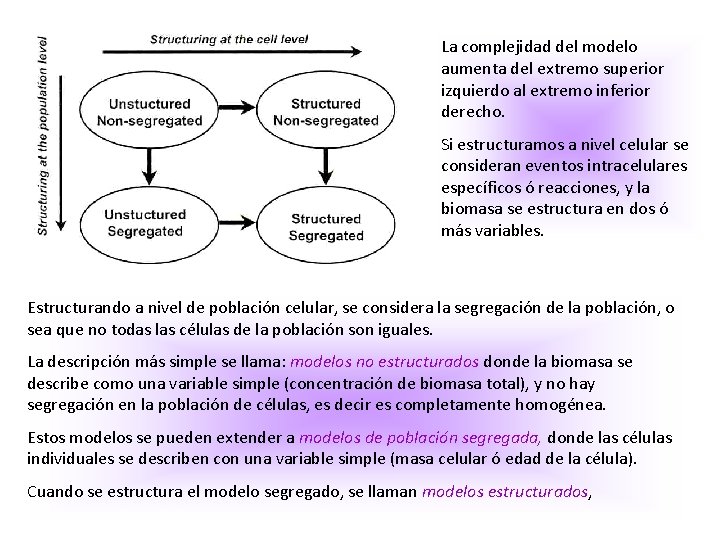
Todo esto no puede incluirse en un modelo matemático, a menos que se tenga un conocimiento previo de eventos moleculares, y además disponer de una computadora poderosa para procesar los datos. En un proceso de fermentación la población de células se caracteriza por una distribución estocástica de propiedades como la actividad celular, composición celular, además de la complejidad que se incluyen en el modelo. Los modelos de fermentación se dividen en 4 grupos dependiendo del nivel de detalle del modelo.

La complejidad del modelo aumenta del extremo superior izquierdo al extremo inferior derecho. Si estructuramos a nivel celular se consideran eventos intracelulares específicos ó reacciones, y la biomasa se estructura en dos ó más variables. Estructurando a nivel de población celular, se considera la segregación de la población, o sea que no todas las células de la población son iguales. La descripción más simple se llama: modelos no estructurados donde la biomasa se describe como una variable simple (concentración de biomasa total), y no hay segregación en la población de células, es decir es completamente homogénea. Estos modelos se pueden extender a modelos de población segregada, donde las células individuales se describen con una variable simple (masa celular ó edad de la célula). Cuando se estructura el modelo segregado, se llaman modelos estructurados,

la biomasa se consideras con más de una variable, Ej: se considera estructura en la biomasa, se la divide en unos pocos compartimentos desde un punto de vista microscópico: enzimas individuales y un pool macromolecular. • Se establece como regla general: un modelo tan simple como sea posible sin ser el más simple. Los modelos son completamente empíricos, para el diseño simple de problemas, y para extraer parámetros cinéticos claves de la cinética de crecimiento. • Se pueden simular las condiciones de crecimiento y llegar a modelos estructurados simples, ej: modelos compartamentalizados, que son útiles para ilustrar el concepto de modelos estructurados. • Si el objetivo es analizar un sistema dado en más detalle es necesario incluir más estructura en el modelo, y así se describen únicamente procesos seleccionados dentro de la célula, ej: una ruta en particular ó transcripción de genes de un promotor en particular. • Si el objetivo es investigar la interacción entre diferentes procesos celulares, ej: la influencia de un nº de copias de un plámido ó la replicación del DNA cromosomal, un modelo single celular se debe aplicar. • Si el objetivo es ver la distribución de la población, que puede influir sobre el crecimiento ó la cinética de producción se debe aplicar ya sea, un modelo segregado un modelo estructurado morfologicamente.

Cinéticas de Crecimiento No Estructuradas En modelos no estructurados, todos los componentes celulares se consideran como un pool representados por un componente de biomasa único, x. Inicialmente estos modelos se basaron en una sola reacción que describe la conversión total de sustrato en biomasa, y se representó la cinética de la reacción total por la velocidad específica de crecimiento de la biomasa μ. Modelo de la Caja Negra Es la representación matemática más simple del crecimiento celular, todas las reacciones celulares se consideran en una sola reacción total. Esto implica que el rendimiento de la biomasa con respecto al sustrato (como así también el rendimiento de todos los otros componentes consumidos y producidos por la célula) es constante. Por consiguiente la velocidad de consumo de sustrato es proporcional a la velocidad específica de crecimiento de la biomasa: rs: vector de velocidad específica de consumo de sustrato (kg / kg peso seco hr) Se encuentran relaciones similares para el consumo de otros sustratos como el oxígeno, velocidades de formación de productos metabólicos.

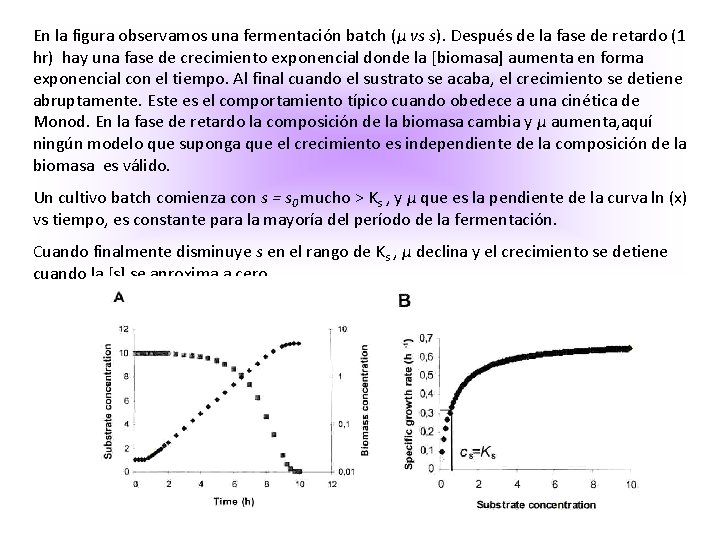
En este modelo μ es una función de las variables en el sistema. Se considera únicamente un sustrato limitante (la fuente de carbono, glucosa), y no hay influencia de otros sustratos sobre rs. Por lo tanto μ depende solamente de la concentración del sustrato. El consumo de otros sustratos y la producción de productos metabólicos como de biomasa, se encuentran por balances de masa usando los coeficientes de rendimiento. μ es proporcional a s a [s] bajas, pero si aumento los valores de s, μ se aproxima a un límite superior. La expresión matemática que más se adapta a este modelo es:

En la figura observamos una fermentación batch (μ vs s). Después de la fase de retardo (1 hr) hay una fase de crecimiento exponencial donde la [biomasa] aumenta en forma exponencial con el tiempo. Al final cuando el sustrato se acaba, el crecimiento se detiene abruptamente. Este es el comportamiento típico cuando obedece a una cinética de Monod. En la fase de retardo la composición de la biomasa cambia y μ aumenta, aquí ningún modelo que suponga que el crecimiento es independiente de la composición de la biomasa es válido. Un cultivo batch comienza con s = s 0 mucho > Ks , y μ que es la pendiente de la curva ln (x) vs tiempo, es constante para la mayoría del período de la fermentación. Cuando finalmente disminuye s en el rango de Ks , μ declina y el crecimiento se detiene cuando la [s] se aproxima a cero.

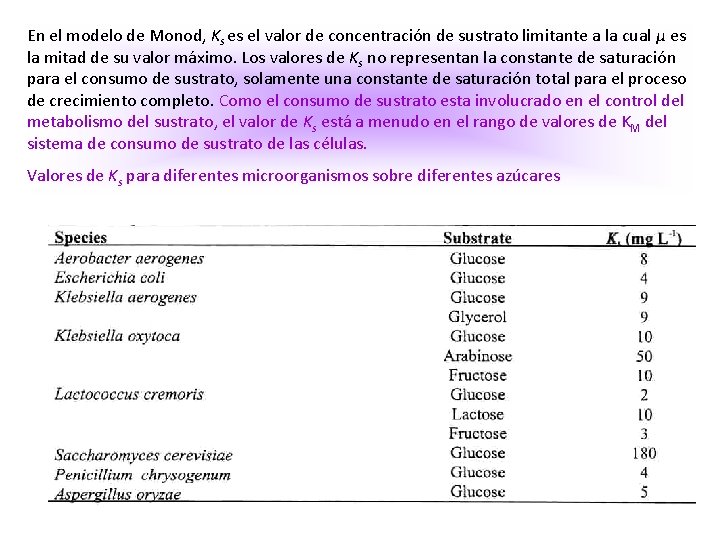
En el modelo de Monod, Ks es el valor de concentración de sustrato limitante a la cual μ es la mitad de su valor máximo. Los valores de Ks no representan la constante de saturación para el consumo de sustrato, solamente una constante de saturación total para el proceso de crecimiento completo. Como el consumo de sustrato esta involucrado en el control del metabolismo del sustrato, el valor de Ks está a menudo en el rango de valores de KM del sistema de consumo de sustrato de las células. Valores de Ks para diferentes microorganismos sobre diferentes azúcares

Ks es un parámetro empírico usado para ajustar el promedio de la influencia del sustrato en todas las reacciones celulares, englobadas en una única reacción en la cual el sustrato es convertido a biomasa. Todas las reacciones responden a una cinética de primer orden, cuando la concentración de reactivo tiende a cero. No todas las fermentaciones se ajustan al modelo de Monod. Otros autores mejoraron el modelo de Monod. Ejemplos de modelos cinéticos no estructurados

Cinética de Sistemas Oscilatorios Los sistemas de cultivos mezclados son de atención considerable porque causan problemas en el control de desechos biológicos, donde ocurren normalmente sistemas de cultivos mezclados. También en la microflora de los estuarios y en la micro fauna hay sistemas de presa – predador. El sistema presa – predador se puede describir bajo condiciones de cultivo continuo, por el siguiente conjunto de ecuaciones: (1) (2) (3) (4)
![donde D velocidad de dilución S sustrato limitante del crecimiento para las células huésped donde: D: velocidad de dilución S: [sustrato limitante] del crecimiento para las células huésped,](https://slidetodoc.com/presentation_image_h2/757bba0cae0c8dbb62457ed1fa3ec0de/image-25.jpg)
donde: D: velocidad de dilución S: [sustrato limitante] del crecimiento para las células huésped, presa. S 0: [sustrato limitante] del crecimiento en un medio fresco X 1: [masa celular seca] de la población del huésped, presa X 2: [masa celular seca] de la población del predador Y 1: factor de rendimiento total para el crecimiento de la presa Y 2: factor de rendimiento total para el crecimiento del predador μ 1: velocidad específica de crecimiento para la población de la presa μ 2: velocidad específica de crecimiento para la población del predador Además de la suposición de mezclado completo en las ecuaciones 1 a 5, debe hacerse otra suposición, que los organismos huésped tomen nutrientes solubles representados por el sustrato limitante del crecimiento, mientras que los predadores tomen sólo los organismos huésped como alimento, sin metabolismo directo del sustrato soluble – fundamento de las ecuaciones anteriores.

Si μ 2 es proporcional a X 1 en la ecuación (5), ej: (6) puesto que: α´ es una constante de proporcionalidad Las ecuaciones (2 y 3) se reducen a: (7) (8) El análisis en fase plana de las ecuaciones (7 y 8) muestra que las poblaciones de X 1 y X 2 oscilan alrededor de un punto vortex (D / α´ para X 1, Y 2 (μ 1 - D / α´ para X 2), puesto que α´ e Y 2 son constantes, respectivamente. Este es el modelo clásico de Lotka – Volterra. Una desventaja de este modelo, es que la oscilación depende exclusivamente de las condiciones iniciales del sistema. Canale presentó su análisis en fase plana usando relaciones tipo a las de Monod entre, μ 1 y S, y μ 2 y X 1, respectivamente, en vez de la suposición lineal de la ecuación (6), ej:

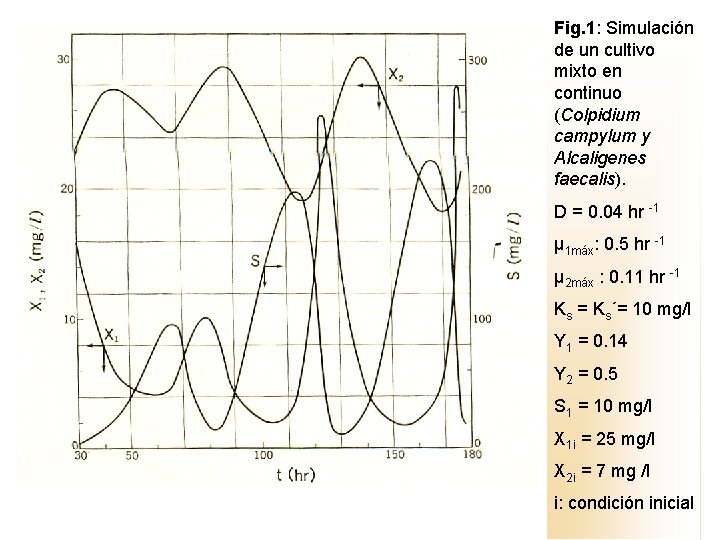
donde: Ks´: constante de saturación para el predador Por tratamiento en computadora de las ecuaciones (1, 2, 3 y con 7, 8) se obtuvo la figura 1. Dependiendo de estos valores, las oscilaciones de X 1 y X 2, y S son muy obvias como lo ilustra la figura. En particular se nota, una gran amplitud de oscilación en S.

Fig. 1: Simulación de un cultivo mixto en continuo (Colpidium campylum y Alcaligenes faecalis). D = 0. 04 hr -1 μ 1 máx: 0. 5 hr -1 μ 2 máx : 0. 11 hr -1 Ks = Ks´= 10 mg/l Y 1 = 0. 14 Y 2 = 0. 5 S 1 = 10 mg/l X 1 i = 25 mg/l X 2 i = 7 mg /l i: condición inicial

De acuerdo a Canale, el punto singular del primer cuadrante del plano X 2 – X 1 es inestable (el predijo la existencia de un ciclo límite). La oscilación marcada de s se ejemplifica en la Fig. 2, en un cultivo continuo de Alcalígenes faecalis (presa, X 1) y Colpidium campylum, (predador, X 2) a 20 ºC, p. H 6. 5 a 7, usando asparigina como sustrato limitante de la bacteria. En términos más generales y cualitativos, otro conjunto de ecuaciones para el crecimiento en un cultivo mezclado bajo condiciones de corrida continua involucra: (9) (10) (11) (12)
![puesto que Xn masa celular de la especie nth del organismo μn velocidad específica puesto que: Xn: [masa celular] de la especie n-th del organismo μn: velocidad específica](https://slidetodoc.com/presentation_image_h2/757bba0cae0c8dbb62457ed1fa3ec0de/image-30.jpg)
puesto que: Xn: [masa celular] de la especie n-th del organismo μn: velocidad específica de crecimiento de la especie n-th La velocidad específica de crecimiento μn, de cualquier especie n, puede ser aumentada, inhibida ó no ser afectada por cualquiera de las otras especies. Dependiendo del modelo particular usado para expresar la velocidad específica de crecimiento , uno puede observar el fenómeno de interés de competición, inhibición, mutualismo, comensalismo ó amensalismo.
 Estequiometra
Estequiometra Estequiometra
Estequiometra Estequiometra
Estequiometra Cintica
Cintica Qumica
Qumica Capacidade termica massica
Capacidade termica massica Inhibicion
Inhibicion Cintica
Cintica Cintica
Cintica Cintica
Cintica Cintica
Cintica Cintica
Cintica Cintica
Cintica Catlise
Catlise Equação de michaelis menten
Equação de michaelis menten Qumica
Qumica Cintica
Cintica Cintica
Cintica Cinética química
Cinética química Trabalho de energia
Trabalho de energia Cintica
Cintica Reflexiones de crecimiento espiritual
Reflexiones de crecimiento espiritual Objetivos especificos del desarrollo infantil
Objetivos especificos del desarrollo infantil Crecimiento, sostenimiento y cosecha.
Crecimiento, sostenimiento y cosecha. Cocos gram positivos en cadena
Cocos gram positivos en cadena Carls rogers teoria humanista
Carls rogers teoria humanista Crecimiento en cristo
Crecimiento en cristo Que significa asechar
Que significa asechar Qu es
Qu es Direccion de maximo crecimiento
Direccion de maximo crecimiento Creciendo en cristo
Creciendo en cristo